扩展功能
文章信息
- 宁梅红, 迟鸿, 陈毓, 杨波, 武正军, 黄华苑
- NING Meihong, CHI Hong, CHEN Yu, YANG Bo, WU Zhengjun, HUANG Huayuan
- 人工饲养猫儿山小鲵个体发育特征初探
- A Preliminary Study on the Ontogenetic Characteristics of Captive-Bred Hynobius maoershanensis
- 四川动物, 2021, 40(2): 196-202
- Sichuan Journal of Zoology, 2021, 40(2): 196-202
- 10.11984/j.issn.1000-7083.20200422
-
文章历史
- 收稿日期: 2020-11-01
- 接受日期: 2021-01-04
2. 广西师范大学, 广西珍稀濒危动物生态学重点实验室, 广西桂林 541004
2. Guangxi Key Laboratory of Rare and Endangered Animal Ecology, Guangxi Normal University, Guilin, Guangxi Autonomous Region 541004, China
猫儿山小鲵Hynobius maoershanensis属有尾目Caudata小鲵科Hynobiidae小鲵属Hynobius,为广西壮族自治区的特有种(陈伟才,2017)。2006年在广西猫儿山国家级自然保护区被发现,栖息于海拔2 000 m左右的高山沼泽地带周围,附近植被多为竹林、山顶矮林和南方铁杉Tsuga chinensis林(周放等,2006)。2019年11月—2020年8月野外调查仅在保护区的三江源、野人湖和山顶湖3个主要区域(110°24′~110°26′E,25°52′~25°53′N)发现成体、幼体和卵袋。由于种群数量极低,已被《中国脊椎动物红色名录》列为濒危(EN)物种(蒋志刚等,2016)。2021年2月, 被列为国家Ⅰ级重点保护野生动物(国家林业和草原局,农业农村部,2021)行动通常十分隐蔽,多藏在枯木落叶下或水体边的洞穴中,非繁殖期难以发现;繁殖期成体常在水体附近聚集交配(黄华苑等,2019)。宁梅红等:人工饲养猫儿山小鲵个体发育特征初探
由于难以观察,猫儿山小鲵相关研究不多,已有研究多集中于分子遗传学(卿立燕,2009;林冰洁,2015;Huang et al., 2016)、鼻间骨(Xiong et al., 2011)、眼睛形态学(吕云云,2015)、繁殖生境选择(卜荣平,2017;黄华苑等,2019)及肝的组织学(陈毓等,2020)等,少量幼体特征仅见卜荣平(2017)的研究。较为系统的发育特征及人工饲养条件下的幼体生长发育研究则未见报道。为了解猫儿山小鲵发育的特点,为该物种的保护管理积累基础数据资料,本研究通过人工饲养猫儿山小鲵蝌蚪,观察其生长发育特征,分析其发育情况;同时,对人工饲养过程中遇到的问题加以研究,讨论该物种未来人工养殖的可行性。
1 材料与方法2019年3月20日,从状元桥产卵场采集猫儿山小鲵卵袋2对,共192颗卵。参考泽陆蛙Fejervarya multistriata蝌蚪人工饲养(师杜娟等,2015)的方法人工养殖。使用纯净水进行饲养,换水频率为3天1次,每次更换盆中1/3的水量。投喂的食物为:熟鸡蛋黄粉末、油菜花菜叶碎末、观赏鱼饲料、冻干红虫饲料、丰年虾Artemia salina、冰鲜红虫、蚯蚓,依次单独投放,观察记录。每日记录室温、水温与湿度。后肢芽期,在饲养盆中加入落叶、碎石作为遮挡物以供蝌蚪生存。从3月24日蝌蚪完全孵化开始,到7月4日变态完毕,历时102 d。
参考东北小鲵H. leechii生长发育阶段(马连第等,1994)与挂榜山小鲵H. yunanicus胚后发育特点(米小其等,2007),结合实验中的发育特点将猫儿山小鲵蝌蚪孵化到变态完成分为4期。测量各个生长发育阶段的形态,包括头长、体长、尾长等,每次随机测量30只。
2 结果 2.1 孵化期孵化期以猫儿山小鲵蝌蚪破膜孵出为止,从采卵到完全孵化约历时4 d(图 1)。在孵化期,蝌蚪破膜而出,此阶段的蝌蚪角膜透明,眼球黑色,有明显窝状凹陷。整体呈黄黑色,体表半透明,具明显口窝。全身被黑色斑点,尤以尾部黑色斑点最为密集。前肢芽可见,为身体两侧的三角形凸起,长0.3 mm。蝌蚪体全长16.0~18.0 mm,头长3.0~3.5 mm,尾长4.0~6.0 mm,头宽1.5~2.0 mm,外鳃2.0~2.5 mm,平衡棒1.0~2.0 mm。可见明显的心脏跳动和血液循环。此阶段的个体可在水中平衡身体且短暂游动,一段时间后侧卧于盆底。

|
| 图 1 猫儿山小鲵孵化期 Fig. 1 Hynobius maoershanensis in hatching period 1. 整体形态, 2. 头部形态, 3. 尾部, 4. 孵化期蝌蚪外鳃及前肢肢芽; a. 平衡棒, b. 外鳃, c. 前肢肢芽 1. the overall shape, 2. head, 3. tail, 4. gills on the outside and forelimb bud; a. balance rod, b. gills on the outside, c. forelimb bud |
| |
前肢芽期分为前肢芽早期与前肢芽中期,历时约15 d(图 2)。前肢芽早期自蝌蚪孵出,到前肢肢芽末端形成二叉型为止;前肢芽中期,前肢芽由末端二叉型逐渐分出第三叉至形成三叉型为止。在前肢芽期,蝌蚪的体色开始变淡,尾部仍有黑色斑点,较之前不那么密集,但集中于尾端边缘,同时可见口部基本形成,后肢芽出现且呈锥状。此阶段个体全长19.0~24.0 mm,头长5.0~6.0 mm,尾长5.0~7.5 mm,头宽4.0~5.0 mm,外鳃发育完全,长3.0~3.5 mm,平衡棒长1.0~2.0 mm。在该阶段,蝌蚪的体型逐渐增大,行动能力也增强,同时有攻击甚至吞食同类的现象,有个体被攻击后出现平衡棒脱落、肢芽或外鳃残缺的状况。吞食同类的个体头部口部明显变宽变大,体型也较其他同类更大,但未见加速发育的情况。

|
| 图 2 猫儿山小鲵前肢芽期 Fig. 2 Hynobius maoershanensis in forelimb bud period 5. 头部放大形态, 6. 前肢与外鳃形态, 7、8. 后肢芽与尾部形态; d. 三叉型前肢芽末端, e、f. 后肢肢芽 5. enlarged part of the head, 6. foreleg and gills on the outside, 7, 8. posterior limb bud and tail; d. terminal bud of trigeminal forelimb, e, f. posterior limb bud |
| |
后肢芽期分为后肢芽早期、后肢芽中期与后肢芽完成期,历时约13 d(图 3)。后肢芽早期,前肢末端呈四叉型,后肢肢芽生长至末端出现二叉型;后肢芽中期,后肢芽末端逐渐发育形成四叉型,前肢肘关节形成;后肢芽完成期,后肢形成五趾且后肢关节形成。在后肢芽期,蝌蚪体色更透明,尤其是头部,清晰可见脑部及周围血管。腹面透明,可见肠管与其他脏器。体侧开始见肋沟,前后肢可见稀疏的褐色斑点。此阶段个体全长20.0~30.0 mm,头长6.0~7.0 mm,尾长8.0~12.0 mm,头宽4.5~6.0 mm;后肢芽早期外鳃长3.0~3.5 mm,此后开始萎缩;前肢在该期从三叉型变为四叉型,历时约2 d,早期平衡棒长2.0~2.5 mm,但可见萎缩、脱落的迹象,约于后肢芽中期到完成期完全脱落;四肢逐渐具有支撑能力,在后肢芽完成期基本能够支撑身体。该阶段,蝌蚪体型更大且更灵活。在此期间,蝌蚪中开始出现由水霉病导致的大量死亡现象。用0.000 4%高锰酸钾溶液分别浸泡生病的蝌蚪、其他健康蝌蚪和饲养器30 min,该浓度处理可以有效地抑制水霉病在猫儿山小鲵蝌蚪中的感染与传播。

|
| 图 3 猫儿山小鲵后肢芽期 Fig. 3 Hynobius maoershanensis in posterior limb bud period 9. 后肢芽形态, 10. 前肢与外鳃形态, 11. 整体形态, 12. 后肢芽完成期蝌蚪的后肢; g. 后肢五趾初步成型,h. 前肢四指初步成型,i. 萎缩的外鳃, j. 成型的后肢关节, k. 遭到攻击导致残缺的后肢 9. the posterior limb bud, 10. foreleg and gills on the outside, 11. the overall shape, 12. posterior limb in the completion stage of posterior limb bud period; g. 5 toes initially shaped, h. 4 fingers initially shaped, i. atrophic outer gills, j. dormed posterior limb joint, k. a posterior limb mutilated as a result of an attack |
| |
变态期以外鳃萎缩为始,外鳃完全消失为止,历时约72 d(图 4)。在变态期,体色加深,不再透明而是全身呈浅泥黄色,有白色斑点,背脊处至尾缘密布黑色斑点。体侧的肋沟更加明显,外鳃完全消失。此阶段个体全长39.5~42.0 mm,头长7.5~8.0 mm,尾长16.0~17.0 mm,头宽6.5~7.0 mm。变态完成并成为亚成体,开始用肺呼吸,主动寻找陆地,但生活仍离不开水。亚成体会主动将头部探出水面,四肢较后肢芽完成期更加粗壮有力,四肢的肘关节也可活动,有明显的支撑能力,能四处爬行。亚成体的活动性增加,出现了爬出盆外在途中缺水干燥而死的现象。
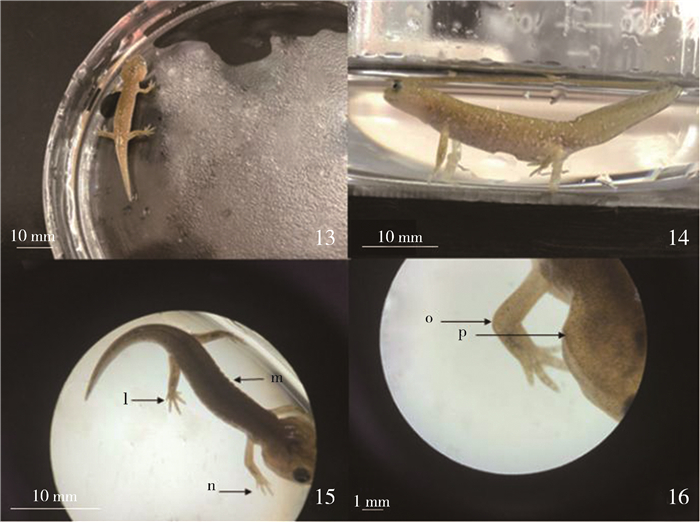
|
| 图 4 猫儿山小鲵变态期 Fig. 4 Hynobius maoershanensis in transformation period 13. 幼体形态, 14、15. 侧面形态, 16. 手部头部放大形态; l. 成型的五趾及脚掌, m. 肋沟, n. 成型的四指及手掌, s. 成型的肘关节, t. 外鳃完全消失 13. larval form, 14, 15. lateral morphology, 16. enlarged hand and head; l. molded 5 toes and soles of feet, m. costal groove, n. shaped 4 fingers and palm, o. molded elbow joint, p. the outer gill completely disappeared |
| |
在刚孵化出的前3 d内未见进食现象,第4天开始进食。广泛取食鲜活丰年虾、干红虫、冰鲜红虫,只有个别蝌蚪取食少量鱼饲料和蛋黄碎末,无蝌蚪取食油菜花菜叶碎末。在后肢芽期的喂食过程中,发现其对运动的物体特别是人为晃动冰鲜红虫有追逐行为。同时,对体型较小的蚯蚓以及切段的大蚯蚓也有取食趋势。
3 讨论刚孵化出的猫儿山小鲵蝌蚪前肢肢芽仅为1个三角状凸起,与挂榜山小鲵蝌蚪类似,但二者皆不同于中国小鲵H. chinensis蝌蚪,中国小鲵蝌蚪刚孵化时前肢肢芽就已经呈二叉型(张鸾笙,唐国起,1987)。与中国小鲵、大鲵Andrias davidianus刚孵出来时的侧卧水底状态相似(张鸾笙,唐国起,1987;杨焱清等,1994),刚孵出的猫儿山小鲵蝌蚪仅有前肢,尚无后肢,无法保持平衡,可能是其侧卧于盆底的原因。孵化期全身被黑色斑点的特征与大鲵(刘鉴毅等,1994)、东北小鲵(马连第等,1994)和挂榜山小鲵(米小其等,2007)等相似,由此可知有尾两栖动物在幼时具有很多相似之处。
在前肢芽期,猫儿山小鲵蝌蚪生长发育速度加快,出现互相捕食现象。吞食其他蝌蚪的优势蝌蚪会出现头部变大变宽、嘴部也变宽的现象,优势个体的体型明显比其他蝌蚪大,但其发育的速度并未因吞食其他同类而加快,此现象与Wakahara (1995)报道的滞育小鲵H. retardatus同种相食相似。同种相食是导致人工饲养的小鲵科蝌蚪出现较高死亡率的重要原因,而饵料投放量、大小等级和密度是影响同种相食的重要因素(Wakahara,1995;傅萃长等, 2003a, 2003b;Michaels,2015)。
野生猫儿山小鲵一般呈泥黄色到浅棕色(卜荣平,2017),而人工饲养亚成体的体色较野外同阶段个体体色淡,且具有相当数量的白色斑点。水生动物出现体色异常主要有2个原因:第一是饲养期较短,导致养殖水生动物体内色素积累不够,与野生个体体色存在明显差异(马晶晶等,2009);第二是物种内的变异可能导致体色异常,例如山女鳟Oncorhynchus masou masou在人工养殖的情况下出现银化个体,而这种银化个体的发育速度比正常个体慢,性成熟速度及身体生长状况都没有正常个体快(张玉勇等,2011)。实验室饲养的猫儿山小鲵出现体色变淡的情况,结合其他水生动物体色异常的原因来看,不排除有个体变异的可能,但推测主要原因应该还是饲料单一、营养来源单一。罗氏沼虾Macrobrachium rosenbergii经摄入添加虾青素的饲料才得以改善体色(吕玉华等,1999),牙鲆Paralichthys olivaceus白化率高的原因是饵料中缺乏n3-HUFA和A.V(黄瑞等,1997)。实验室提供的饲料主要成分为蛋白质,可能缺乏该物种所需的某种特定营养元素。尽管罗氏沼虾、鱼类与猫儿山小鲵存在差异,但在多种营养摄入方面的需求应当是类似的。没有摄取某种特定营养成分导致体色变淡,也能解释饲养个体体色为什么较淡。具体原因有待进一步研究。
人工饲养的猫儿山小鲵前、后肢发育完成时间约为17 d和30 d,人工饲养的东北小鲵前、后肢发育完成时间约为21 d和33 d(马连第等,1994),两者相差不大。野外猫儿山小鲵蝌蚪变态发育需65 d(卜荣平,2017)。此次人工饲养猫儿山小鲵蝌蚪,从3月24日完全孵化开始,到7月4日完全变态结束,历时102 d,比野生蝌蚪多37 d。挂榜山小鲵在野外变态发育需80~100 d(孙普选,2005b),东北小鲵在人工饲养下变态发育时间为80~94 d(马德滨等,2003),由此可知,人工饲养的猫儿山小鲵的发育速度慢于野生猫儿山小鲵、野生挂榜山小鲵和人工饲养东北小鲵。北鲵属Ranodon的新疆北鲵Ranodon sibiricus幼体外鳃需2年左右才消失(王秀玲等,1997),大鲵完成变态发育需360 d(杨焱清等,1994)。人工饲养、野生猫儿山小鲵的生长发育速度与小鲵属其他物种都有较大区别,与小鲵科其他属在变态发育时间的差异,具体的原因有待进一步研究。
猫儿山小鲵蝌蚪孵出后可用熟蛋黄辅助饲喂(卜荣平,2017)。本实验发现猫儿山小鲵蝌蚪不喜欢取食菜叶碎末,个别少量取食蛋黄碎末,该阶段个体可能依靠卵黄囊内的营养物质维持生存(张鸾笙,唐国起,1987)。在孵化期后期,人为晃动饲料有个别蝌蚪少量取食,而用人工孵化出的丰年虾、干红虫、冰鲜红虫进行投喂,所有蝌蚪都取食,说明丰年虾、干红虫、冰鲜红虫可作为人工饲养猫儿山小鲵的饲料。野生猫儿山小鲵产卵的水域通常有较多种类的中小型无脊椎水生生物,如蚯蚓和石蛾幼体,可以提供丰富的食物从而提高其成活率(黄华苑等,2019)。由此推断,人工饲养猫儿山小鲵的孵化期阶段,最好是投喂活食,如体型较小的蛙类蝌蚪、水生昆虫(如:蚊子幼虫、红虫)等。根据其他小鲵属幼体的杂食性(孙普选等, 2005a, 2005b;郭克疾等,2008;叶林骏,2012),推测猫儿山小鲵应该也属于杂食性,但仍需验证。
卜荣平. 2017. 猫儿山小鲵(Hynobius maoershanensis)繁殖行为和繁殖期生境选择研究[D]. 广西: 广西师范大学.
|
陈伟才. 2017. 广西两栖动物概况[J]. 广西林业, 36(8): 25-26. DOI:10.3969/j.issn.1004-0390.2017.08.011 |
陈毓, 许爱兰, 崔甄甄, 等. 2020. 猫儿山小鲵肝的组织结构[J]. 动物学杂志, 55(5): 593-598. |
傅萃长, 饶韧, 吴纪华, 等. 2003a. 密度和饵料投放量对安吉小鲵幼体生长与同种相残率的影响[J]. 动物学研究, 24(3): 186-190. |
傅萃长, 孙娴斐, 王心怡, 等. 2003b. 大小等级和大小组合差异对盆养安吉小鲵幼体同种相残率的影响[J]. 动物学研究, 24(6): 407-412. |
郭克疾, 米小其, 邓学建. 2008. 挂榜山小鲵的繁殖生态[J]. 生态学杂志, 27(1): 77-82. DOI:10.3969/j.issn.1005-376X.2008.01.030 |
国家林业和草原局, 农业农村部. 2021. 国家林业和草原局农业农村部公告(2021年第3号)(国家重点保护野生动物名录)[EB/OL]. [2021-03-10]. https: //www.forestry.gov.cn/main/5461/20210205/122418860831352.html.
|
黄华苑, 卜荣平, 谢海, 等. 2019. 猫儿山小鲵(Hynobius maoershanensis)繁殖期生境选择[J]. 生态学报, 39(17): 6443-6451. |
黄瑞, 北岛力, 柯才焕. 1997. 关于牙鲆Paralichthys olivaceus (Temminck et Schlegel)白化诱因的探讨[J]. 现代渔业信息, 12(9): 21-23. |
蒋志刚, 江建平, 王跃招, 等. 2016. 中国脊椎动物红色名录[J]. 生物多样性, 24(5): 500-551. |
林冰洁. 2015. 猫儿山小鯢(Hynobius maoershanensis)遗传多样性研究[D]. 广西: 广西师范大学.
|
刘鉴毅, 林锡芝, 杨焱清, 等. 1994. 大鲵早期胚胎发育观察[J]. 动物学杂志, 29(4): 42-46. |
吕玉华, 金征宇, 徐学明. 1999. 饲料中添加法夫酵母对罗氏沼虾的体色及生长状况的影响[J]. 水产养殖, 20(4): 15-18. |
吕云云. 2015. 小鲵科动物眼睛的形态学比较研究[D]. 河南: 河南科技大学.
|
马德滨, 韩媛媛, 吴伟峰, 等. 2003. 东北小鲵繁殖生态的研究[J]. 哈尔滨学院学报(教育), 24(6): 135-137. |
马晶晶, 张利民, 王际英. 2009. 饲料添加剂对水产动物体色的调控[J]. 养殖与饲料, 8(8): 48-51. |
马连第, 马德坤, 高薏. 1994. 千山产东北小鲵的早期发育[J]. 动物学杂志, 29(2): 46-51. |
米小其, 邓学建, 郭克疾, 等. 2007. 挂榜山小鲵早期胚胎发育初步观察[J]. 四川动物, 26(2): 377-378. DOI:10.3969/j.issn.1000-7083.2007.02.039 |
卿立燕. 2009. 中国小鲵属的核型研究[D]. 成都: 四川师范大学.
|
师杜娟, 麻友立, 袁朝晖. 2015. 泽陆蛙蝌蚪栖息地和人工饲养研究[J]. 现代农业科技, 44(8): 270, 276. |
孙普选, 郭石生, 张贵祁, 等. 2005b. 湖南中国小鲵的生物学特征及其资源保护措施[J]. 中国水产, 48(10): 70-71. |
孙普选, 蒋艾青, 郭石生, 等. 2005a. 湖南挂榜山中国小鲵——生物特征资源量及保护措施探讨[J]. 水产学杂志, 18(2): 70-73. |
王秀玲, 吴敏, 袁定国. 1997. 新疆北鲵人工繁殖初步研究[J]. 四川动物, 16(1): 22-24. |
杨焱清, 肖汉兵, 刘鉴毅. 1994. 大鲵胚后发育的初步观察[J]. 中国水产科学, 1(2): 26-31. |
叶林骏. 2012. 安吉小鲵生存现状及其繁殖期生境特征研究[D]. 浙江: 浙江师范大学.
|
张鸾笙, 唐国起. 1987. 中国小鲵的一些生物学资料[J]. 动物学杂志, 22(1): 23-25. |
张玉勇, 贾智英, 白庆利, 等. 2011. 养殖条件下山女鳟银化体色个体生产性状[J]. 动物学杂志, 46(4): 8-15. |
周放, 蒋爱伍, 蒋得斌. 2006. 中国两栖类一新种(有尾目, 小鲵科)[J]. 动物分类学报, 31(3): 670-674. |
Huang HY, Lin BJ, Guo C, et al. 2016. The complete mitochondrial genome of the Hynobius maoershanensis (Caudata: hynobiidae)[J]. Mitochondrial DNA Part A: DNA Mapping, Sequencing, and Analysis, 27(1): 173-174. |
Michaels C. 2015. Cannibalistic phenotype of the larvae of the Oita salamander Hynobius dunni[J]. Herpetological Bulletin, 134(134): 24-25. |
Wakahara M. 1995. Cannibalism and the resulting dimorphism in larvae of a salamander Hynobius retardatus, inhabited in Hokkaido, Japan[J]. Zoological Science, 12(4): 467-473. |
Xiong JL, Liu XY, Zeng XM. 2011. Discovery of an internasal bone in Hynobius maoershanensis (Urodela: Hynobiidae)[J]. Asian Herpetological Research, 2(2): 87-90. |
 2021, Vol. 40
2021, Vol. 40




