扩展功能
文章信息
- 王颖, 张富春
- WANG Ying, ZHANG Fuchun
- 犬卵透明带3 DNA疫苗在小鼠模型中的避孕效果评价
- Evaluation of Contraceptive Effects of Canine Zona Pellucida 3 DNA Vaccine in a Mouse Model
- 四川动物, 2020, 39(3): 266-273
- Sichuan Journal of Zoology, 2020, 39(3): 266-273
- 10.11984/j.issn.1000-7083.20190356
-
文章历史
- 收稿日期: 2019-10-16
- 接受日期: 2020-03-26
2. 新疆大学生命科学与技术学院, 乌鲁木齐 830046
2. College of Life Science and Technology, Xinjiang University, Urumqi 830046, China
随着经济的发展和人们生活水平的提高,犬Canis lupus familiaris作为宠物伴侣进入了千家万户,宠物犬数量不断增多的同时,越来越多的流浪犬出现在城市的大街小巷中。庞大数量的流浪犬不仅严重影响人们的日常生活、城市的环境卫生,还增加了人们罹患各种疾病的危险(王金霞,2016)。因为流浪犬不仅是狂犬病的宿主,还是诸多寄生虫的中间或终末宿主(李斌等,2016;汪天平,操治国,2018)。目前控制流浪犬数量主要是通过棒杀、毒杀、绝育等方法,这些方法都存在一些局限性,无法广泛并有效应用于控制流浪犬数量(庄心依等,2017)。避孕疫苗是利用在生殖过程中具有重要作用的蛋白或激素作为靶标抗原,免疫动物后控制其生育的一种方法,相比传统控制流浪犬数量的方法,其具有低成本、环保、符合动物福利等优点(樊姝彤等,2017)。但是目前还没有能高效控制流浪犬生育数量的避孕疫苗商品,因此开发一款能有效控制流浪犬数量的避孕疫苗具有良好的市场前景。
卵透明带(zona pellucida,ZP)是一种特殊的细胞外透明基质,围绕在排出的卵子和早期胚胎周围(Nixon et al., 2007),其形成对卵巢卵泡的发育、受精、囊胚形成、早期胚胎的运输必不可少(Talbot et al., 2003;Nixon et al., 2007)。ZP基质主要由ZP1、ZP2、ZP3糖蛋白构成(Spargo & Hope,2003),其中,ZP3作为精子的初级受体,在精子与卵子结合和激发精子顶体反应中发挥重要作用(Bagavant et al., 1997;Srivastave et al., 2002)。研究表明,用ZP3作为靶抗原的蛋白疫苗免疫犬(Srivastave et al., 2002)、兔Oryctolagus cuniculus(Mackenzie et al., 2006)、灰袋鼠Macropus giganteus(Kitchener et al., 2009a)、树袋熊Phascolarctos cinereus(Kitchener et al., 2009b)和小鼠Mus musculus(Gupta et al., 2013;Shrestha et al., 2014, 2015)等都取得了良好的避孕效果。但是纯化ZP3重组蛋白的生产成本高、工艺繁琐,且蛋白不易保存,因此很难在临床实践中广泛应用。DNA疫苗是一种将编码靶标抗原的重组真核表达载体通过肌肉、皮下或黏膜途径给人或动物免疫后,使外源基因在活体内表达,激活机体的免疫系统,从而诱导机体特异性体液免疫和细胞免疫应答的方法。与传统的蛋白疫苗相比,DNA疫苗更稳定(Sasaki et al., 2003;Sun et al., 2010)、更经济(Sasaki et al., 2003)、维持免疫原性时间长,且易于生产(Alarcon et al., 1999;Robinson & Pertmer,2000)。本研究以犬卵透明带3(CZP3)为靶蛋白制备了CZP3 DNA疫苗,在小鼠模型上注射后辅以电脉冲刺激以增强DNA疫苗的免疫效果,对其避孕效果进行了初步的评价,为CZP3 DNA避孕疫苗在流浪犬上的推广应用建立了基础。
1 材料方法 1.1 实验试剂及材料pcDNA3、pcDNA3-CZP3由本实验室保存及构建。6~8周龄12只BALB/c小鼠,生产许可证号:SCXK(京)2016-0011,购自北京维通利华,比格犬卵巢由新疆医学院科技楼惠赠。CZP3c重组蛋白为本实验室纯化并保存。HRP标记的山羊抗小鼠二抗、FICT标记的兔抗鼠二抗、BSA购自生工生物工程(上海)股份有限公司,孕马血清(PMSG)、人绒毛促性腺激素(hCG)购自宁波第二激素厂,透明质酸酶购自Sigma。其他化学试剂均为国产分析纯。
1.2 质粒的提取、纯化及定量按《分子生物学实验技术》(张富春等,2008)中的实验步骤,对pcDNA3、pcDNA3-CZP3进行质粒的提取及纯化。用紫外分光光度仪定量灭菌生理盐水溶解纯化后的质粒,使其终浓度为1 μg·μL-1。
1.3 小鼠免疫12只BALB/c雌性小鼠随机分为2组(n=6):实验组和阴性对照组,第0、2、4周分别向每只小鼠腿部肌肉注射50 μL pcDNA3-CZP3和pcDNA3质粒,然后迅速进行6次电脉冲(电压30 V)刺激。初免后,每周从小鼠眼眶静脉丛取血,分离血清,-80 ℃备用。
1.4 ELISA检测抗体水平用纯化后的CZP3c重组蛋白作为包被抗原,浓度为10 μg·mL-1。血清的稀释倍数为1: 100,山羊抗小鼠二抗的稀释倍数为1: 2 000,OD450检测抗体水平。
1.5 抗体滴度检测选择抗体水平最高的第6周血清进行倍比稀释,血清按照1: 50、1: 500、1: 1 000、1: 1 200、1: 4 000进行稀释,ELISA检测各组的抗体滴度。
1.6 小鼠卵子的间接免疫荧光取5只BALB/c雌性小鼠进行超数排卵实验。每只小鼠肌肉注射12 IU的PMSG,46 h后肌肉注射12 IU的hCG。13 h后处死小鼠,收集壶腹部卵子。用5 IU的透明质酸酶室温消化5 min后,将卵子转移至BMOC培养基制作的液滴中。磷酸盐缓冲液(PBS)冲洗卵子数次后,计数,将卵细胞平均分为2组放置于防脱载玻片上。无水乙醇固定后,5%BSA,37 ℃,5%CO2培养箱中封闭1 h。PBS冲洗3次后,加入一抗(稀释倍数为1: 50),37 ℃,5%CO2培养箱中孵育1 h。PBS冲洗3次后,加入FITC标记的兔抗鼠二抗(1: 200),37 ℃,5%CO2培养箱中孵育30 min。PBS充分清洗,甘油封片后于荧光显微镜下观察结果。
1.7 犬卵巢切片的间接免疫荧光比格犬卵巢固定后委托新疆医学院科技楼病理切片室制作成5 μm厚切片。56 ℃烤片1 h后,乙醇脱蜡,柠檬酸盐微波加热修复抗原10 min。切片温度降至室温后,用PBST清洗。用含有2%兔血清的PBS 37 ℃孵育封闭1 h。一抗(1: 50)4 ℃孵育过夜。PBST清洗切片后,加入FITC标记的兔抗鼠二抗(1: 200),37 ℃孵育30 min。充分清洗后用甘油封片于荧光显微镜下观察结果。
1.8 避孕效果检测初免后第6周,对每组小鼠进行分笼,每笼3只小鼠。同时每笼放入1只具有生殖能力的雄鼠进行合笼实验。雄鼠每天轮换1次,3周后取出,计算雌鼠的产仔数及生育率。
1.9 组织学分析第24周处死小鼠,取出卵巢用4%多聚甲醛固定24 h。卵巢经脱水、包埋后,制成2张5 μm厚的连续切片。切片经HE染色后于显微镜下观察结果。
1.10 统计学分析数据利用Prism 5进行分析,其中,抗体水平、抗体滴度用t检验、产仔数用χ2检验、抗体水平与产仔数关系用Spearman相关性分析。小鼠的抗体水平、抗体滴度和平均产仔数均用x ± s表示。当P<0.05时,差异具有统计学意义。
2 结果 2.1 小鼠抗CZP3抗体水平检测初免后第2周,实验组小鼠即产生了抗CZP3的抗体,抗体水平与阴性对照组之间的差异有统计学意义(P<0.05)。初免后第3周,实验组的抗体水平迅速上升,到初免后第6周达到峰值,随后开始下降,直到初免后第24周,一直维持在一定水平。t检验结果显示,从初免后第3周到第24周,实验组的抗体水平与阴性对照组之间的差异有高度统计学意义(P<0.01)(图 1)。
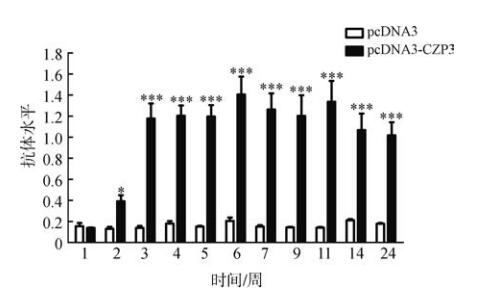
|
| 图 1 犬卵透明带3抗体水平检测 Fig. 1 Detection of antibody levels against canine zona pellucida 3 与阴性对照组相比Compared with the negative control group,*P<0.05,*** P<0.001;下同the same below |
| |
t检验结果显示,当血清稀释至1: 4 000倍时,实验组的抗体滴度与阴性对照组之间的差异有高度统计学意义(P < 0.001)(图 2)。
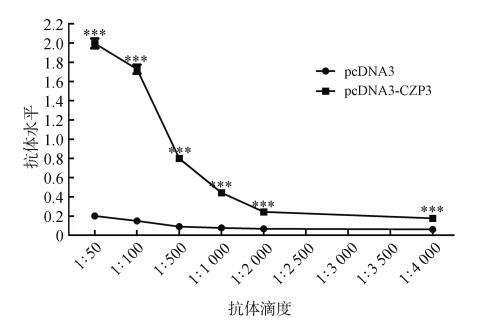
|
| 图 2 ELISA检测血清中的抗体效价 Fig. 2 Antibody titer of serum detected by ELISA |
| |
间接免疫荧光结果显示,实验组小鼠产生的血清抗体不仅可以识别小鼠卵子的透明带基质(图 3:A),也可与犬卵巢切片中的卵子外透明带基质结合(图 3:B),并且与犬的其他组织无交叉反应。
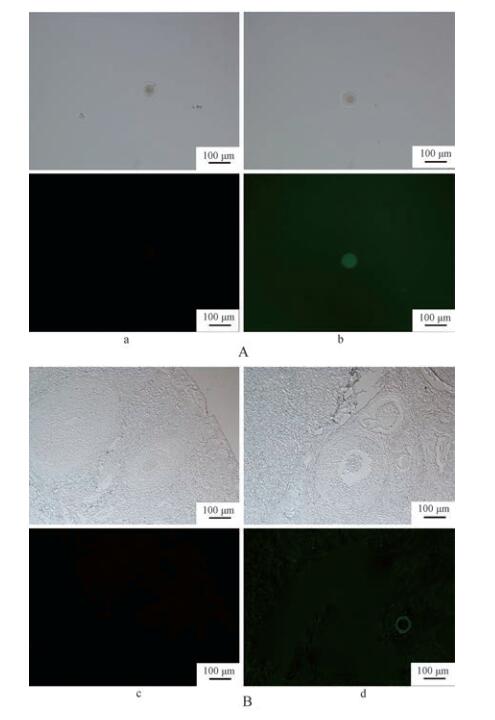
|
| 图 3 小鼠卵子(A)与犬卵巢切片(B)的间接免疫荧光实验 Fig. 3 Indirect immunofluorescence assay of mouse oocytes and dog ovarian sections a,c. pcDNA3,b,d. pcDNA-CZP3;上upper.明场bright filed,下lower.荧光场fluorescence field |
| |
实验结果显示,生育率由阴性对照组的100%下降至实验组的50%;产仔数由阴性对照组的40只降低到实验组的15只。χ2检验结果显示,实验组(2.500只±1.455只)与阴性对照组(6.667只±0.422只)的产仔数之间的差异有统计学意义(P<0.05)。Spearman相关性分析显示,实验组抗体水平与产仔数呈高度负相关(r=-0.941 1) (图 4)。
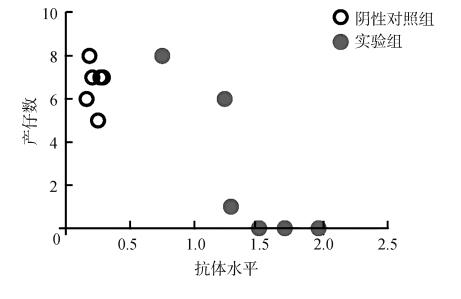
|
| 图 4 抗体水平与小鼠产仔数相关性分析 Fig. 4 Correlation between antibody levels and litter size of mouse |
| |
卵巢切片显示,与阴性对照组相比,实验组怀孕小鼠卵巢的卵泡发育正常,初级卵泡、次级卵泡以及成熟卵泡数量均正常;且实验组小鼠在不孕情况下的卵泡也发育正常(图 5)。
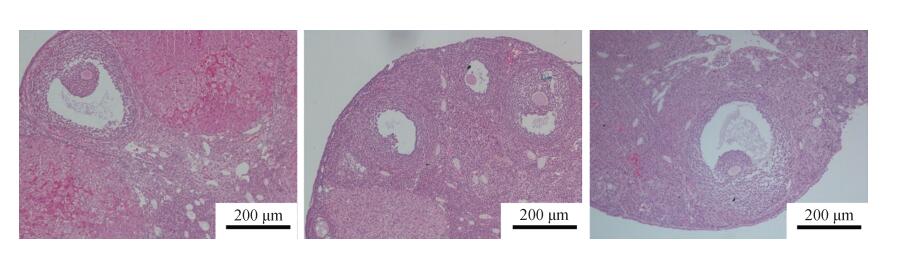
|
| 图 5 阴性对照组(左)和实验组(中,右)小鼠卵巢的组织胚胎学分析 Fig. 5 Histological analysis of the negative control group (left) and the experiment group (middle and right) mice ovary 左、中.怀孕小鼠,右.不孕小鼠 Left, middle. pregnant mouse, right. infertile mouse |
| |
与传统疫苗相比,DNA疫苗具有众多优点,如DNA疫苗能够在转染的细胞内表达,产生“内源性”抗原,从而激发CD4+和CD8+ T细胞免疫应答,但自Wolff发明DNA疫苗以来,近30年获得批准上市的DNA疫苗却很少(Kutzler & Weiner,2008)。制约DNA疫苗走向临床应用的瓶颈就是相对传统疫苗,DNA疫苗的免疫原性较差(Kim et al., 2010)。研究人员为此进行了一系列研究,如使用强有力的启动子(Luke et al., 2011)、免疫时使用传统佐剂或分子佐剂(Ma et al., 2014;Peng et al., 2014;Almeida et al., 2015;Bergamaschi et al., 2015)、使用靶向DNA疫苗技术(Fossum et al., 2015;Saiga et al., 2015;Ye et al., 2015)、采用先DNA疫苗免疫再蛋白加强免疫或先蛋白免疫再DNA疫苗加强免疫的免疫策略(Cervantes-Villagrana et al., 2013;Chuang et al., 2013;Fournillier et al., 2013),或使用基因枪或电脉冲注射质粒DNA(Broderick & Humeau,2015;Lee et al., 2015),以增强机体对DNA疫苗的免疫应答。电脉冲注射就是利用电流刺激注射部位的肌肉组织,使DNA质粒能够瞬时透过细胞膜进入胞内,从而提高质粒的转染效率。此外电脉冲还可以促进炎性细胞因子的产生,招募抗原递呈细胞及T细胞向免疫部位迁移(Lee et al., 2015)。研究显示,利用电脉冲免疫DNA疫苗在羊Ovis aries(Scheerlinck et al., 2004)、牛Bos taurus(Fowler et al., 2012)、犬(Shahbazi et al., 2015)、猪Sus scrofa(Sheng et al., 2016)等动物实验中都诱导产生了较强的免疫应答。为了增强CZP3 DNA疫苗的避孕效果,本研究采用电脉冲方式对小鼠进行DNA疫苗免疫,电脉冲增强了机体对于DNA疫苗的免疫应答,从初免后第2周起,实验组的抗体水平与阴性对照组之间的差异就有统计学意义,并且这种差异持续期近半年。此外,第6周实验组的抗体滴度为1: 4 000时,与阴性对照组之间的差异仍有统计学意义。
研究表明,以ZP3为靶抗原的避孕疫苗主要是通过2种机制介导不孕:一种机制认为动物免疫ZP3后产生充足的抗体结合于卵子外周的ZP上,阻断了精子与卵子的结合诱导不孕,因此ZP3的抗体水平对于诱导不孕至关重要,当ZP3的抗体水平达到某一临界值时即诱导不孕(Jackson et al., 1998;Hardy et al., 2002;Lloyd et al., 2003);另一种则认为ZP3在ZP的形成中发挥关键作用,抗ZP3的抗体与ZP3结合后会破坏ZP3的功能,导致形成ZP的厚度减小。此外,抗ZP3的抗体干扰颗粒细胞紧密附着于卵子,减少了颗粒细胞与卵子的联系,导致卵泡的异常发育,成熟卵泡的减少,诱发卵巢功能早衰。这些卵巢组织结构上的改变协同作用导致了免疫动物的不孕(Ma et al., 2012a, 2012b;Tu et al., 2013;Gupta et al., 2015)。间接免疫荧光实验显示,CZP3抗体可以结合于小鼠的ZP基质上,从而阻断精子与ZP的结合。此外,CZP3的抗体水平与产仔数呈负相关,即抗体水平越高,小鼠的产仔数越少,说明当抗CZP3的抗体水平达到某一特定值后可导致小鼠不孕。小鼠的卵巢组织学分析显示,免疫CZP3后抗CZP3的抗体并没有对不孕及怀孕小鼠的卵巢形态结构及发育产生影响,这进一步说明,导致小鼠不孕是抗CZP3的抗体所致。在间接免疫荧光实验中,抗CZP3的抗体不仅可以结合于犬的ZP上,还可以结合于小鼠的ZP上,这可能与CZP3与小鼠的ZP3氨基酸序列具有66.8%的相似性(王颖等,2016)相关。
本研究辅以电脉冲的方式对小鼠注射CZP3 DNA疫苗,增强了小鼠免疫应答的水平,同时显著降低了小鼠的产仔数,并且CZP3 DNA疫苗的接种免疫没有导致小鼠的卵巢发生病理学变化,使用安全且具有一定的免疫避孕效果,这为今后开发安全有效的CZP3 DNA避孕疫苗奠定了一定的基础。
樊姝彤, 尤新国, 满怡, 等. 2017. 免疫避孕疫苗的研究进展[J]. 中国男科学杂志, 31(3): 69-72. DOI:10.3969/j.issn.1008-0848.2017.03.016 |
李斌, 李莹莹, 王瑞, 等. 2016. 呼和浩特市流浪犬狂犬病病毒血清学调查[J]. 黑龙江畜牧兽医, (22): 208-210. |
汪天平, 操治国. 2018. 中国棘球蚴病防控进展及其存在的问题[J]. 中国寄生虫学与寄生虫病杂志, 36(3): 291-296. |
王金霞. 2016. 犬猫管理与流浪犬猫治理[J]. 中国畜牧业, (20): 64-65. DOI:10.3969/j.issn.2095-2473.2016.20.026 |
王颖, 张贝贝, 张冀, 等. 2016. 犬透明带3(CZP3)DNA疫苗免疫有效降低小鼠生育能力[J]. 细胞与分子免疫学杂志, 32(10): 1331-1335. |
张富春, 李江伟, 兰海燕, 等. 2008. 分子生物学实验技术[M]. 乌鲁木齐: 新疆大学出版社.
|
庄心依, 周双双, 王梦倩, 等. 2017. 多主体合作视角下的城市流浪犬管理研究——基于LA市的实证分析[J]. 畜牧与饲料科学, 38(9): 68-72. |
Alarcon JB, Waine GW, McManus DP. 1999. DNA vaccines: technology and application as anti-parasite and antimicrobial agents[J]. Advances in Parasitology, 42: 343-410. DOI:10.1016/S0065-308X(08)60152-9 |
Almeida RR, Raposo RA, Coirada FC, et al. 2015. Modulating APOBEC expression enhances DNA vaccine immunogenicity[J]. Immunology and Cell Biology, 93(10): 868-876. DOI:10.1038/icb.2015.53 |
Bagavant H, Fusi FM, Baisch J, et al. 1997. Immunogenicity and contraceptive potential of human zona pellucida 3 peptide vaccine[J]. Biology of Reproduction, 56(3): 764-770. DOI:10.1095/biolreprod56.3.764 |
Bergamaschi C, Kulkarni V, Rosati M, et al. 2015. Intramuscular delivery of heterodimeric IL-15 DNA in macaques produces systemic levels of bioactive cytokine inducing proliferation of NK and T cells[J]. Gene Therapy, 22(1): 76-86. DOI:10.1038/gt.2014.84 |
Broderick KE, Humeau LM. 2015. Electroporation-enhanced delivery of nucleic acid vaccines[J]. Expert Review of Vaccines, 14(2): 195-204. DOI:10.1586/14760584.2015.990890 |
Cervantes-Villagrana AR, Hernandez-Pando R, Biragyn A, et al. 2013. Prime-boost BCG vaccination with DNA vaccines based in bata-defensin-2 and mycobacterial antigens ESAT6 or AG85B improve protection in a tuberculosis experimental model[J]. Vaccine, 31(4): 676-684. DOI:10.1016/j.vaccine.2012.11.042 |
Chuang I, Sedegah M, Cicatelli S, et al. 2013. DNA prime/adenovirus boost malaria vaccine encoding P. falciparum CSP and AMA1 induces sterile protection associated with cell-mediated immunity[J/OL]. PLoS ONE, 8(2): e55571 [2019-07-31]. https://doi.org/10.1371/journal.pone.0055571.
|
Fossum E, Grodeland G, Terhorst D, et al. 2015. Vaccine molecules targeting Xcr1 on cross-presenting DCs induce protective CD8 T-cell responses against influenza virus[J]. European Journal of Immunology, 45(2): 624-635. DOI:10.1002/eji.201445080 |
Fournillier A, Frelin L, Jacquier E, et al. 2013. A heterologous prime/boost vaccination strategy enhances the immunogenicity of therapeutic vaccines for hepatitis C virus[J]. The Journal of Infectious Diseases, 208(6): 1008-1019. DOI:10.1093/infdis/jit267 |
Fowler V, Robinson L, Bankowski B, et al. 2012. A DNA vaccination regime including protein boost and electroporation protects cattle against foot-and-mouth disease[J]. Antiviral Research, 94(1): 25-34. DOI:10.1016/j.antiviral.2012.02.002 |
Gupta N, Chakrabarti K, Prakash K, et al. 2013. Immunogenicity and contraceptive efficacy of Escherichia coli-expressed recombinant porcine zona pellucida proteins[J]. American Journal of Reproductive Immunology, 70(2): 139-152. DOI:10.1111/aji.12095 |
Gupta SK, Malik A, Arukha AP, et al. 2015. Ovarian and oocyte targets for development of female contraceptives[J]. Expert Opinion on Therapeutic Targets, 19(11): 1433-1446. DOI:10.1517/14728222.2015.1051305 |
Hardy CM, ten Have JFM, Mobbs KJ, et al. 2002. Assessment of the immunocontraceptive effect of a zona pellucida 3 peptide antigen in wild mice[J]. Reproduction Fertility and Development, 14(3): 151-155. DOI:10.1071/RD01112 |
Jackson RJ, Maguire DJ, Hinds LA, et al. 1998. Infertility in mice induced by a recombinant ectromelia virus expressing mouse zona pellucida glycoprotein 3[J]. Biology of Reproduction, 58(1): 152-159. |
Kim D, Hung CF, Wu TC, et al. 2010. DNA vaccine with α-galactosyleceramide at prime phase enhances anti-tumor immunity after boosting with antigen-expressing dendritic cells[J]. Vaccine, 28(45): 7297-7305. DOI:10.1016/j.vaccine.2010.08.079 |
Kitchener AL, Harman A, Kay DJ, et al. 2009a. Immunocontraception of eastern grey kangaroos (Macropus giganteus) with recombinant brushtail possum (Trichosurus vulpecula) ZP3 protein[J]. Journal of Reproductive Immunology, 79(2): 156-162. DOI:10.1016/j.jri.2008.10.004 |
Kitchener AL, Kay DJ, Walters B, et al. 2009b. The immune response and fertility of koalas (Phascolarctos cinereus) immunised with porcine zonae pellucidae or recombinant brushtail possum ZP3 protein[J]. Journal of Reproductive Immunology, 82(1): 40-47. DOI:10.1016/j.jri.2009.07.001 |
Kutzler MA, Weiner DB. 2008. DNA vaccines: ready for prime time?[J]. Nature Reviews Genetics, 9(10): 776-788. DOI:10.1038/nrg2432 |
Lee SH, Danishmalik SN, Sin JI. 2015. DNA vaccines, electroporation and their applications in cancer treatment[J]. Human Vaccines & Immunotherapeutics, 11(8): 1889-1900. |
Lloyd ML, Shellam GR, Papadimitriou JM, et al. 2003. Immunocontraception is induced in BALB/c mice inoculated with murine cytomegalovirus expressing mouse zona pellucida 3[J]. Biology of Reproduction, 68(6): 2024-2032. DOI:10.1095/biolreprod.102.012880 |
Luke JM, Vincent JM, Du SX, et al. 2011. Improved antibiotic-free plasmid vector design by incorporation of transient expression enhancers[J]. Gene Therapy, 18(4): 334-343. DOI:10.1038/gt.2010.149 |
Ma JZ, Wang HL, Zheng XX, et al. 2014. CpG/Poly (I:C) mixed adjuvant priming enhances the immunogenicity of a DNA vaccine against eastern equine encephalitis virus in mice[J]. International Immunopharmacology, 19(1): 74-80. |
Ma XL, Kadir Z, Li JY, et al. 2012a. The effects of GM-CSF and IL-5 as molecular adjuvants on immune responses and contraception induced by mZP3 DNA vaccination[J]. American Journal of Reproductive Immunology, 68(6): 476-485. DOI:10.1111/aji.12007 |
Ma XL, Li JY, Zhang FC. 2012b. Intranasal co-delivery with the mouse zona pellucida 3 and GM-CSF expressing constructs enhances humoral immune responses and contraception in mice[J]. Scandinavian Journal of Immunology, 76(6): 521-527. DOI:10.1111/j.1365-3083.2012.02765.x |
Mackenzie SM, McLaughlin EA, Perkins HD, et al. 2006. Immunocontraceptive effects on female rabbits infected with recombinant myxoma virus expressing rabbit ZP2 or ZP3[J]. Biology of Reproduction, 74(3): 511-521. DOI:10.1095/biolreprod.105.046268 |
Nixon B, Aitken RJ, McLaughlin EA. 2007. New insights into the molecular mechanisms of sperm-egg interaction[J]. Cellular and Molecular Life Sciences, 64(14): 1805-1823. DOI:10.1007/s00018-007-6552-x |
Peng J, Shi S, Yang Z, et al. 2014. Short noncoding DNA fragments improve the immune potency of electroporation-mediated HBV DNA vaccination[J]. Gene Therapy, 21(7): 703-708. DOI:10.1038/gt.2014.44 |
Robinson HL, Pertmer TM. 2000. DNA vaccines for viral infections: basic studies and applications[J]. Advances in Virus Research, 55: 1-74. DOI:10.1016/S0065-3527(00)55001-5 |
Saiga H, Nieuwenhuizen N, Gengenbacher M, et al. 2015. The recombinant BCG ΔureC∷ hly vaccine targets the AIM2 inflammasome to induce autophagy and inflammation[J]. The Journal of Infectious Diseases, 211(11): 1831-1841. DOI:10.1093/infdis/jiu675 |
Sasaki S, Takeshita F, Xin KQ, et al. 2003. Adjuvant formulations and delivery systems for DNA vaccines[J]. Methods, 31(3): 243-254. DOI:10.1016/S1046-2023(03)00140-3 |
Scheerlinck JPY, Karlis J, Tjelle TE, et al. 2004. In vivo electroporation improves immune response to DNA vaccination in sheep[J]. Vaccine, 22(13-14): 1820-1825. DOI:10.1016/j.vaccine.2003.09.053 |
Shahbazi M, Zahedifard F, Saljoughian N, et al. 2015. Immunological comparison of DNA vaccineation using two delivery systems against canine leishmaniasis[J]. Veterinary Parasitology, 212(3-4): 130-139. DOI:10.1016/j.vetpar.2015.07.005 |
Sheng ZY, Gao N, Cui XY, et al. 2016. Electroporation enhances protective immune response of a DNA vaccine against Japanese encephalitis in mice and pigs[J]. Vaccine, 34(47): 5751-5757. DOI:10.1016/j.vaccine.2016.10.001 |
Shrestha A, Srithandan S, Minhas V, et al. 2015. Canine zona pellucida glycoprotein-3: up-scaled production, immunization strategy and its outcome on fertility[J]. Vaccine, 33(1): 133-140. |
Shrestha A, Wadhwa N, Gupta SK. 2014. Evaluation of recombinant fusion protein comprising dog zona pellucida glycoprotein-3 and izumo and individual fragments as immunogens for contraception[J]. Vaccine, 32(5): 564-571. DOI:10.1016/j.vaccine.2013.11.078 |
Spargo SC, Hope RM. 2003. Evolution and nomenclature of the zona pellucida gene family[J]. Biology of Reproduction, 68(2): 358-362. DOI:10.1095/biolreprod.102.008086 |
Srivastave N, Santhanam R, Sheela P, et al. 2002. Evaluation of the immunocontraceptive potential of Escherichia coli-expressed recombinant dog ZP2 and ZP3 in a homologous animal model[J]. Reproduction, 123(6): 847-857. DOI:10.1530/rep.0.1230847 |
Sun Y, Hu YH, Liu CS, et al. 2010. Construction and analysis of an experimental Streptococcus iniae DNA vaccine[J]. Vaccine, 28(23): 3905-3912. DOI:10.1016/j.vaccine.2010.03.071 |
Talbot P, Shur BD, Myles DG. 2003. Cell adhesion and fertilization: steps in oocyte transport, sperm-zona pellucida interactions, and sperm-egg fusion[J]. Biology of Reproduction, 68(1): 1-9. |
Tu YX, Li XP, Kadir Z, et al. 2013. Molecular adjuvant interleukin-33 enhances the antifertility effect of Lagurus lagurus zona pellucida 3 DNA vaccine administered by the mucosal route[J]. Brazilian Journal of Medical and Biological Research, 46(12): 1064-1073. DOI:10.1590/1414-431X20133126 |
Ye C, Choi JG, Abraham S, et al. 2015. Targeting DNA vaccines to myeloid cells using a small peptide[J]. European Journal of Immunology, 45(1): 82-88. |
 2020, Vol. 39
2020, Vol. 39




