扩展功能
文章信息
- 汪开宝, 游章强, 谢鸿鑫, 郑天才, 李忠秋
- WANG Kaibao, YOU Zhangqiang, XIE Hongxin, ZHENG Tiancai, LI Zhongqiu
- 四川察青松多白唇鹿国家级自然保护区白唇鹿繁殖期警戒行为
- Vigilance Behavior of Cervus albirostris During Breeding Season in Chaqingsongduo White-lipped Deer National Nature Reserve, Sichuan
- 四川动物, 2018, 37(3): 305-310, 330
- Sichuan Journal of Zoology, 2018, 37(3): 305-310, 330
- 10.11984/j.issn.1000-7083.20180016
-
文章历史
- 收稿日期: 2018-01-11
- 接受日期: 2018-04-08
2. 绵阳师范学院生命科学与技术学院, 四川绵阳 621000;
3. 四川察青松多白唇鹿国家级自然保护区管理局, 四川甘孜 626700
2. School of Life Sciences and Technology, Mianyang Normal University, Mianyang, Sichuan Province 621000, China;
3. Sichuan Chaqingsongduo White-lipped Deer National Nature Reserve Administration, Ganzi, Sichuan Province 626700, China
影响动物个体生存的最大威胁因素之一是捕食者,警戒行为作为反捕食策略的重要组成部分,发挥着侦查并发现外来风险,从而躲避敌害,进而提高自身以及后代生存率的作用(Treves,2000)。警戒行为通常表现为动物停止正在进行的诸如采食等一系列行为,抬头注视或扫视周围环境或探听某一方向(Lung & Childress,2007)。动物的警戒行为除了要面对外来捕食者或其他因素的潜在威胁,还要面对群体内部的挑战。因此,警戒行为还具有社会性监控的功能,在配偶争夺(Childress & Lung,2003)、食物资源竞争(Cameron & Toit,2005;Lung & Childress,2007;Pangle & Holekamp,2010)、领地捍卫(Pannozzo et al., 2007)以及抑制偷窃寄生(Gaynor & Cords,2012)等方面发挥着重要作用。
动物的警戒行为受到多种因素的影响,如性别、年龄、群体空间位置、捕食风险或人类干扰等(车烨,李忠秋,2014)。研究表明,雌雄个体和不同年龄个体在警戒水平上均有所差异。比如,雄性黑斑羚Aepyceros melampus的警戒水平高于雌性(Shorrocks & Cokayne,2005);相反,雌性美利奴绵羊Ovis aries的警戒水平比雄性高(Michelena et al., 2006)。雌雄个体间警戒行为的差异,可能是性二型所导致的捕食风险差异及繁殖行为策略差异所致。此外,成年个体的警戒水平一般高于幼年个体,这是因为幼体缺乏完善的采食和警戒能力,需要花费更多的时间在采食上(Avilés & Bednekoff,2007;Li et al., 2013;Li et al., 2015)。Shi等(2011)研究发现,普氏原羚Procapra przewalskii的警戒行为与个体所处群体内的空间位置相关,通常位于群体中心的个体比位于群体边缘的警戒水平低。这恰好印证了边缘效应,即相对于群体中心,群体边缘同种个体更少,面临更高的捕食风险,因此,群体边缘的动物需要更高的警戒水平并且向中心位置移动(Hamilton,1971)。此外,一些研究也发现了人类干扰对动物警戒行为的影响,即人类干扰越强,动物的警戒水平越高(Wang et al., 2011;Li et al., 2013)。
Pulliam于1973年提出了警戒行为的经典随机独立模型,此模型建立在3个假设的前提之上,即独立扫视原则(independent scanning)、瞬时随机性(instantaneous randomness)和顺序随机性(sequential randomness)(Pulliam,1973;Bednekoff & Lima,1998)。其中,顺序随机性指任意2次连续扫视行为的间隔时间(警戒间隔)是随机的,和前一次警戒间隔的时间无关。顺序随机性可以使捕食者无法预测猎物何时警戒、何时采食,从而充分发挥反捕食功能。
白唇鹿Cervus albirostris为中国特有物种,种群数量较小,栖息地环境特殊,研究难度较大。目前对白唇鹿的研究仅限于体形、繁殖以及食性等(郑生武等,1989;余玉群,1990),有关行为学的研究寥寥可数。研究白唇鹿的行为生态学对研究其行为规律,进而保护这一物种具有重要意义。本研究选取四川察青松多白唇鹿国家级自然保护区的白唇鹿作为研究对象,主要探究影响白唇鹿繁殖期警戒行为的主要因素,包括年龄性别、空间位置以及干扰程度;此外,为了验证Pulliam经典警戒模型的先提假设——顺序随机性,对白唇鹿警戒行为的顺序随机性进行验证,探究其警戒行为模式。
1 研究方法 1.1 研究地点和对象四川察青松多白唇鹿国家级自然保护区(99°11′~99°42′E,30°33′~31°06′N)位于四川省甘孜藏族自治州白玉县,区内最低海拔3 600 m,最高海拔5 725 m。地貌、植被类型丰富,由低到高依次分布有河谷旱生灌丛、针阔叶混交林、亚高山针叶林、高山灌丛、高山草甸以及流石滩。白唇鹿栖息地的植被类型主要有高山灌丛、高山草甸以及高山荒漠(游章强等,2014)。当地物候可简单地分为冷、暖两季(每年9月进入冷季,次年5月进入暖季)。
白唇鹿是我国分布于青藏高原及其周边地区的特有物种,属于国家Ⅰ级重点保护野生动物,被世界自然保护联盟(IUCN)濒危物种红色名录列为易危(VU)物种。成年雄鹿在非繁殖期形成单性集群,通常分布于海拔较高的生境,成年雌性则与未成年个体形成雌雄混合群,其分布生境以海拔相对较低的高山草甸为主。每年9月初,成年雌雄个体开始形成雌雄混合群,进入发情期后,成年雄鹿通过竞争建立相应的社会序位,在群内产生1只最强悍的雄鹿成为群主,然后形成一雄多雌的“后宫群”,这些雌鹿通常被群主控制在相对固定的区域,避免被其他雄鹿偷袭。此外还有其他类型的群体,例如,由1只普通成年雄鹿控制的1~5只雌鹿组成的普通配对群,一般远离群主群;由携带幼崽、不愿接受交配的雌鹿以及亚成体组成的混合群。
调查区内允许人类采药、放牧,但是由于当地居民的宗教信仰,不会猎杀白唇鹿。白唇鹿的主要捕食者为狼Canis lupus、豺Cuon alpinus、金雕Aqulia chrysaetos等。
1.2 行为观察2016年9月30日—10月14日,对保护区内的白唇鹿进行观察,此时正值白唇鹿的繁殖期。因地理位置特殊,无法跟随观察,在白唇鹿活动区域的麻绒乡四道桥附近设临时观测点,对四面山坡出现的白唇鹿集群进行观察记录。白唇鹿在夜间活动不积极(郑生武等,1989),故观察时间为每天的06: 00—20: 00。任意2只白唇鹿间的距离不超过50 m定义为同一群。采取焦点取样法对每个集群记录10~20 min。在使用双筒望远镜(Nikula 8×42)观察发现鹿群后,立即用相机(Nikon D7100)进行拍摄,拍摄距离一般为1~2 km,对鹿群基本没有干扰。共记录视频总时长约22 h。
将白唇鹿的行为分为5类:采食、警戒、休息、移动和其他。采食:站立进食草本或灌木,或者头低于脊柱,边行走边进食;警戒:站立或躺卧的姿势,望向四周或某一方向,时常伴随聆听;休息:俯卧在空地上,不进食、不观望,有时伴随反刍;移动:站立、走开或者跑开等一系列活动;其他:搔痒、哺乳等。
通过视频回放对视频中的个体进行焦点取样,记录每只焦点个体在各种行为上的时间分配,同时记录其他变量指标:
(1) 按年龄性别分为成年雄性、成年雌性、亚成体雄性、亚成体雌性和幼崽。判断依据为个体体型,雄鹿年龄根据鹿角分叉来判断(当年幼鹿不分叉,次年长出茸角,第三年开始分叉,此后依次叠加)。
(2) 干扰强度分为3个标准:高(距干扰源距离≤500 m)、中(距干扰源距离:500~1 000 m)、低(距干扰源距离≥1 000 m或没有干扰源)。其中,干扰源主要包括牧民放牧时骑行摩托发出的噪音和牧民放牧时的呐喊声。
(3) 空间位置。为了在白唇鹿中验证“边缘效应”,将观察个体的空间位置分为群体边缘和群体中心。记录时,如果某一个体的位置在观察期间发生了较大变化(如某只个体最初位于群体边缘,一段时间后进入群体中心),则不记录。
在对警戒行为顺序随机性的研究中,通过视频回放,记录每只个体的每次警戒行为,并计算相邻2次警戒行为之间的时间,从而得出该个体的警戒间隔序列。为了减少小样本带来的偶然性,研究排除间隔片段数目≤5的序列,共获得61个白唇鹿警戒间隔序列。
1.3 数据分析在影响警戒行为因素的研究中,所有的警戒时间占比数据通过反正弦开平方根处理后符合正态分布。通过建立一般线性模型,将年龄性别、干扰强度和空间位置作为解释变量加入模型当中,用方差分析事后检验(SNK法)对结果进行检验。群编号(编号1~18)作为随机变量进行处理。
在研究警戒间隔顺序随机性的研究中,因为对顺序随机性的参数检验需要至少50次采食/警戒的行为转换(Roberts,1996),而实际数据均未达到50次,因此,使用非参数检验中的游程检验(Run Test)对每个警戒序列的随机性进行检验(Beauchamp,2006)。使用游程检验时,需要形成一个二元数据,因此,将警戒间隔序列的间隔片段按照时间分为短间隔和长间隔,在检验过程中使用中位数作为长短间隔的分割点,对每个序列进行分组。最后的结果如果拒绝零假设(P<0.05),那么可以认为该序列代表的是一种有规律且不随机的警戒模式,即不符合经典模型中的顺序随机性。
在对警戒间隔序列进行游程检验后,使用卡方检验对这些序列的总体随机性进行检验,从而判断白唇鹿个体的警戒间隔序列是否存在对随机性或非随机性的显著倾向。
所有运算统计均在SPSS 22.0中进行,文中所有数值以平均值±标准误表示,显著性水平设为α=0.05。
2 研究结果本研究共收集了18个集群95只焦点样本(成年雄性19只,成年雌性50只,亚成体雄性9只,亚成体雌性12只,幼崽5只),其中,17个为混合群,1个为“单身汉群”,集群大小为1~45只不等。
2.1 不同年龄性别个体的警戒水平差异不同年龄性别白唇鹿的警戒水平之间的差异有统计学意义(F4,90=2.636,P=0.041)。SNK法检验结果显示,警戒水平边际平均值由高到低依次为:幼崽、成年雌性、亚成体雌性、亚成体雄性、成年雄性(图 1)。
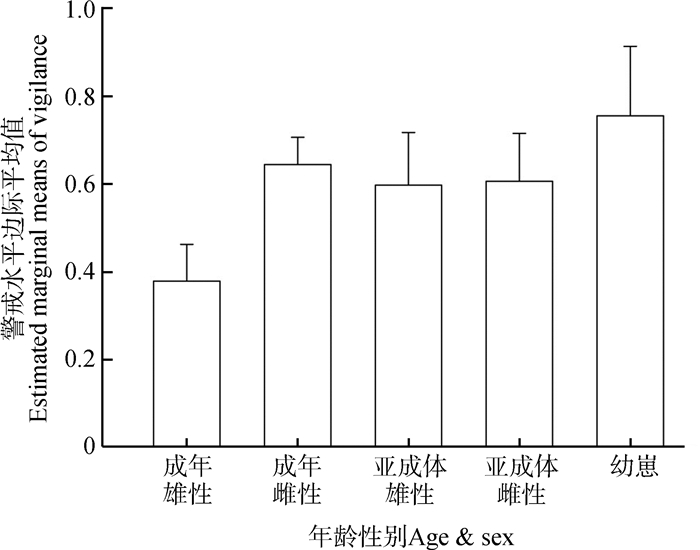
|
| 图 1 不同年龄性别白唇鹿的警戒水平边际平均值 Fig. 1 Estimated marginal means of vigilance levels of Cervus albirostris under different sexes and ages |
| |
人类干扰对白唇鹿警戒行为的影响为:干扰程度越大,个体警戒水平越高(图 2),但差异无统计学意义(F2,92=0.178,P=0.837)。SNK法检验结果表明,警戒水平边际平均值由小到大依次是:低干扰强度、中等干扰强度、高干扰强度。
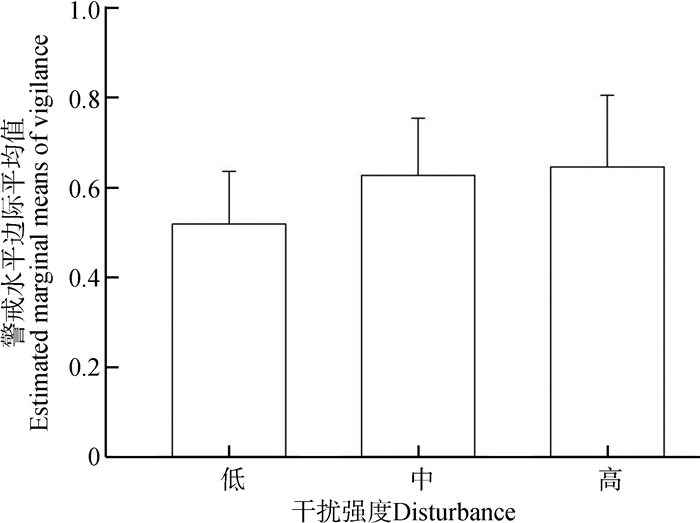
|
| 图 2 不同人类干扰强度下白唇鹿的警戒水平边际平均值 Fig. 2 Estimated marginal means of vigilance levels of Cervus albirostris under different human disturbances |
| |
个体在群体中的空间位置对白唇鹿警戒行为的影响为:越靠近群体中心,个体的警戒水平越低,即位于群体边缘个体的警戒水平高于群体中心(图 3),但差异无统计学意义(F1,93=0.445,P=0.507)。
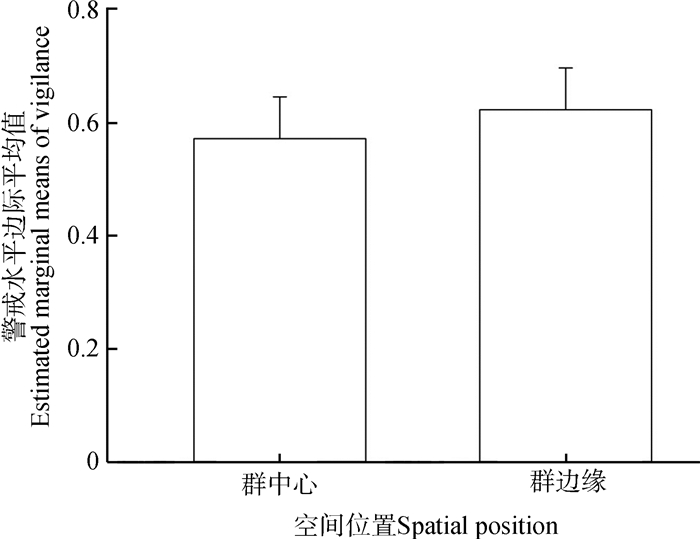
|
| 图 3 不同空间位置白唇鹿的警戒水平边际平均值 Fig. 3 Estimated marginal means of vigilance levels of Cervus albirostris with different within-group spatial positions |
| |
在选中的61个序列中,发现只有4个(6.6%)偏离了随机性(P<0.05),其余57个(93.4%)均符合随机性(P > 0.05,图 4)。另外,从卡方检验对全部61个序列的检验中发现,警戒间隔序列更倾向于随机性(χ2=46.049,df=1,n=61,P<0.01)。
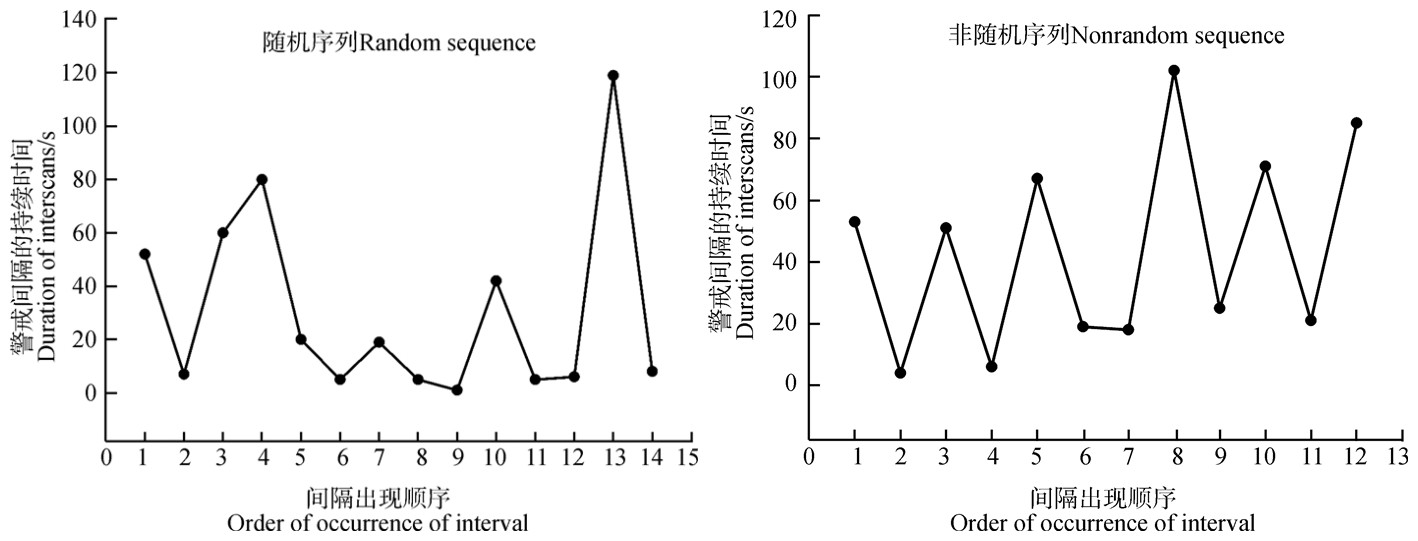
|
| 图 4 间隔序列举例 Fig. 4 Example of sequences of interscan durations |
| |
本研究表明,在影响白唇鹿警戒行为的因素中,仅年龄性别的差异有统计学意义。此外,白唇鹿的警戒模式也符合经典随机警戒模式中的顺序随机性假设。
3.1 影响白唇鹿警戒行为的因素 3.1.1 年龄性别动物的年龄、性别对有蹄类警戒水平的影响,结果并不一致。雄性藏原羚Procapra picticaudata警戒行为的时间显著高于雌性(Li & Jiang,2008),这是因为雄性藏原羚更具侵略性,1只成年雄性藏原羚除了对捕食者进行侦查,还要消耗一定时间用于防范其他雄性对配偶或者领地的侵犯。类似的情况还存在于黑斑羚(Shorrocks & Cokayne,2005)中。而马鹿Cervus elaphus(Lung & Childress,2007)以及美利奴绵羊(Michelena et al., 2006)雌性的警戒水平反而高于雄性,这是因为与强健有力的雄性相比,雌性更易被捕食,因此需要更高的警戒水平来实施反捕食策略,尤其是携带幼崽的雌性。在本研究中,白唇鹿幼崽的警戒水平最高,成年雄性最低。在野外考察中发现,对白唇鹿造成威胁的大型食肉动物主要是狼和豺,其在保护区内密度相对较低,对体型硕大且强壮的雄鹿威胁不大;而体型小、易受伤害的幼崽被捕食的风险相对更大。此外,幼崽处于生长期,需要模仿成体行为来适应外界环境,因此需要消耗更多的时间用于警戒。研究中还发现,成年雌性也具有较高的警戒水平。在对麋鹿Elaphurus davidianus警戒行为的研究中发现,混合群中的雌性比雌性群中的保持更高的警戒水平,因为在繁殖期间,雄性为了获得交配机会不断骚扰雌性(Zheng et al., 2013)。具体来说,雄性会通过驱逐来控制雌性,同时进行嗅阴等确定雌性是否正在发情,因此,雌性的部分警戒是针对群中的发情雄鹿。
3.1.2 干扰效应关于人类干扰对警戒水平的影响,Li等(2007)和Zheng等(2013)发现,麋鹿可以依据不同强度的人类干扰做出相应的反应,即随着人类干扰程度的加强,麋鹿的警戒水平会相应提高;Xia等(2011b)发现鹅喉羚Gazella subgutturosa在人类活动强度最高的冬季,警戒水平也为一年之中最高。而在对白唇鹿的研究中,这一现象却不显著,原因可能是当地人类活动如采药(虫草)具有明显的季节性,牧场与白唇鹿繁殖生境没有重叠,且由于宗教原因,当地牧民对野生动物保护均表现出一定的积极性;同时长期的人为活动也有可能使白唇鹿适应,因此,白唇鹿对人类活动并未表现出更高的警戒水平。
3.1.3 空间位置不同于以往对边缘效应和干扰效应的研究(Shi et al., 2011;Wang et al., 2011),本研究并未发现空间位置和人类干扰对白唇鹿个体警戒水平有显著影响。根据实际观察情况,白唇鹿集群数量不大,多数仅由十几只个体组成;同时空间分布较分散,个体间距较大,面临的捕食风险可能没有太大差异,因此,警戒水平也没有显著差别。
3.2 警戒间隔顺序随机性Pulliam于1973年提出独立警戒模型,但此模型建立在3个假设之上。顺序随机性意味着警戒间隔持续的时间是随机的,并且与前一次间隔的时间长短无关(Bednekoff & Lima,1998;Carro et al., 2011)。对顺序随机性这一假设的验证,结论并不统一。顺序随机性在一些研究中得到了支持(Roberts,1994;Suter & Forrest,1994),而另一些研究则发现了警戒间隔的可预测性,也就是非随机性(Ferrière et al., 1999;Beauchamp,2006;Carro et al., 2011)。本研究结果显示,白唇鹿长短警戒间隔片段出现的频率是随机的,并没有发生相似长短片段频繁出现的现象,说明白唇鹿的警戒行为模式符合警戒间隔顺序随机性的假设。尽管关于顺序随机性的研究结果有争议,但不可否认的是,顺序随机性的存在使捕食者无法预测猎物的行为,也无法准确地在非警戒期发动攻击,因此不失为一种有效的反捕食策略。
致谢: 野外工作得到四川省白玉县林业局和四川察青松多白唇鹿国家级自然保护区管理局领导和职工的大力支持,同时得到白玉县麻绒乡当村藏民扎西江措、格松吉的协助调查,在此一并致谢!| 车烨, 李忠秋. 2014. 动物的警戒行为——回顾及展望[J]. 四川动物, 33(1): 144–150. |
| 游章强, 唐中海, 杨远斌, 等. 2014. 察青松多白唇鹿国家级自然保护区白唇鹿对夏季生境的选择[J]. 兽类学报, 34(1): 46–53. |
| 余玉群. 1990. 白唇鹿性行为的观察[J]. 兽类学报, 10(1): 235–236. |
| 郑生武, 吴家炎, 韩亦平. 1989. 白唇鹿食性与繁殖的初步观察[J]. 兽类学报, 9(2): 123–120. |
| Avilés JM, Bednekoff PA. 2007. How do vigilance and feeding by common cranes Grus grus depend on age, habitat, and flock size?[J]. Journal of Avian Biology, 38(6): 690–697. DOI:10.1111/jav.2007.38.issue-6 |
| Beauchamp G. 2006. Nonrandom patterns of vigilance in flocks of the greater flamingo, Phoenicopterus ruber ruber[J]. Animal Behaviour, 71(3): 593–598. DOI:10.1016/j.anbehav.2005.06.008 |
| Bednekoff PA, Lima SL. 1998. Randomness, chaos and confusion in the study of antipredator vigilance[J]. Trends in Ecology & Evolution, 13(7): 284–287. |
| Cameron EZ, Toit JT. 2005. Social influences on vigilance behaviour in giraffes, Giraffa camelopardalis[J]. Animal Behaviour, 69(6): 1337–1344. DOI:10.1016/j.anbehav.2004.08.015 |
| Carro ME, Fernández GJ, Reboreda JC. 2011. Sequential predictability of the scanning behaviour of greater rheas, Rhea americana[J]. Ethology Ecology & Evolution, 23(1): 27–39. |
| Childress MJ, Lung MA. 2003. Predation risk, gender and the group size effect:does elk vigilance depend upon the behaviour of conspecifics?[J]. Animal Behaviour, 66(2): 389–398. DOI:10.1006/anbe.2003.2217 |
| Ferrière R, Cazelles B, Cézilly F, et al. 1999. Predictability, chaos and coordination in bird vigilant behaviour[J]. Animal Behaviour, 57(2): 497–500. DOI:10.1006/anbe.1998.0966 |
| Gaynor KM, Cords M. 2012. Antipredator and social monitoring functions of vigilance behaviour in blue monkeys[J]. Animal Behaviour, 84(3): 531–537. DOI:10.1016/j.anbehav.2012.06.003 |
| Hamilton WD. 1971. Geometry for the selfish herd[J]. Journal of Theoretical Biology, 31(2): 295–311. DOI:10.1016/0022-5193(71)90189-5 |
| Li CL, Zhou LZ, Xu L, et al. 2015. Vigilance and activity time-budget adjustments of wintering hooded cranes, Grus monacha, in human-dominated foraging habitats[J]. PLoS ONE, 10(3): e0118928. DOI:10.1371/journal.pone.0118928 |
| Li CQ, Jiang ZG, Tang S, et al. 2007. Evidence of effects of human disturbance on alert response in Père David's deer (Elaphurus davidianus)[J]. Zoo Biology, 26(6): 461–470. DOI:10.1002/zoo.20132 |
| Li ZQ, Jiang ZG. 2008. Group size effect on vigilance:evidence from Tibetan gazelle in upper Buha River, Qinghai-Tibet Plateau[J]. Behavioural Processes, 78(1): 25–28. DOI:10.1016/j.beproc.2007.11.011 |
| Li ZQ, Wang ZG, Ge C. 2013. Time budgets of wintering red-crowned cranes:effects of habitat, age and family size[J]. Wetlands, 33(2): 227–232. DOI:10.1007/s13157-012-0371-z |
| Lung MA, Childress MJ. 2007. The influence of conspecifics and predation risk on the vigilance of elk (Cervus elaphus) in Yellowstone National Park[J]. Behavioral Ecology, 18(1): 12–20. |
| Michelena P, Noël S, Gautrais J, et al. 2006. Sexual dimorphism, activity budget and synchrony in groups of sheep[J]. Oecologia, 148(1): 170–180. DOI:10.1007/s00442-005-0347-2 |
| Pangle WM, Holekamp KE. 2010. Functions of vigilance behaviour in a social carnivore, the spotted hyaena, Crocuta crocuta[J]. Animal Behaviour, 80(2): 257–267. DOI:10.1016/j.anbehav.2010.04.026 |
| Pannozzo PL, Phillips KA, Haas ME, et al. 2007. Social monitoring reflects dominance relationships in a small captive group of brown capuchin monkeys (Cebus apella)[J]. Ethology, 113(9): 881–888. DOI:10.1111/eth.2007.113.issue-9 |
| Pulliam HR. 1973. On the advantages of flocking[J]. Journal of Theoretical Biology, 38(2): 419–422. DOI:10.1016/0022-5193(73)90184-7 |
| Roberts G. 1994. When to scan:an analysis of predictability in vigilance sequences using autoregression models[J]. Animal Behaviour, 48(3): 579–585. DOI:10.1006/anbe.1994.1277 |
| Roberts G. 1996. Testing for patterns in sequences of vigilance behaviour[J]. Animal Behaviour, 51(5): 1179–1182. DOI:10.1006/anbe.1996.0120 |
| Shi JB, Li DQ, Xiao WF. 2011. Influences of sex, group size, and spatial position on vigilance behavior of Przewalski's gazelles[J]. Acta Theriologica, 56(1): 73–79. DOI:10.1007/s13364-010-0001-1 |
| Shorrocks B, Cokayne A. 2005. Vigilance and group size in impala (Aepyceros melampus Lichtenstein):a study in Nairobi National Park, Kenya[J]. African Journal of Ecology, 43(2): 91–96. DOI:10.1111/aje.2005.43.issue-2 |
| Suter RB, Forrest TG. 1994. Vigilance in the interpretation of spectral analyses[J]. Animal Behaviour, 48(1): 223–225. DOI:10.1006/anbe.1994.1228 |
| Treves A. 2000. Theory and method in studies of vigilance and aggregation[J]. Animal Behaviour, 60(6): 711–722. DOI:10.1006/anbe.2000.1528 |
| Wang Z, Li ZQ, Beauchamp G, et al. 2011. Flock size and human disturbance affect vigilance of endangered red-crowned cranes (Grus japonensis)[J]. Biological Conservation, 144(1): 101–105. DOI:10.1016/j.biocon.2010.06.025 |
| Xia CJ, Xu WX, Yang WK, et al. 2011. Seasonal and sexual variation in vigilance behavior of goitered gazelle (Gazella subgutturosa) in western China[J]. Journal of Ethology, 29(3): 443–451. DOI:10.1007/s10164-011-0279-8 |
| Zheng W, Beauchamp G, Jiang XL, et al. 2013. Determinants of vigilance in a reintroduced population of Père David's deer[J]. Current Zoology, 59(2): 265–270. DOI:10.1093/czoolo/59.2.265 |
 2018, Vol. 37
2018, Vol. 37




