扩展功能
文章信息
- 王志洁, 汪洋, 安志芳, 魏琳娜, 魏莲, 魏登邦
- WANG Zhijie, WANG Yang, AN Zhifang, WEI Linna, WEI Lian, WEI Dengbang
- 高原鼠兔组织中精子特异性乳酸脱氢酶的作用机理
- The Role of the Sperm-specific Lactate Dehydrogenase in Ochotona curzoniae Tissues
- 四川动物, 2017, 36(6): 624-631
- Sichuan Journal of Zoology, 2017, 36(6): 624-631
- 10.11984/j.issn.1000-7083.20170146
-
文章历史
- 收稿日期: 2017-05-08
- 接受日期: 2017-08-11
高原鼠兔Ochotona curzoniae隶属兔形目Lagomorpha鼠兔科Ochotonidae鼠兔属Ochotona(蒋志刚等,2015),是青藏高原特有的小型哺乳类世居动物,主要栖息在海拔3 000~5 000 m的高寒草甸及高寒荒漠草原地带(施银柱,樊乃昌,1980;丁晓涛等,1999),其生境的含氧量为139~203 g·m-3;高原鼠兔能有效地从低氧环境中摄取氧、转运氧和利用氧(饶鑫峰,2010),对高原低氧环境具有很强的适应性(Kilic et al., 2004;齐新章等,2008;王晓君等,2008;Zhu et al., 2009;Gonzales,2013)。
先前研究表明,精子特异性乳酸脱氢酶(Ldh-c)基因只在鸟类和哺乳类的精子中特异性表达(Goldberg,1975),而在体细胞中不表达(Wheat & Goldberg,1977;Goldberg,1985)。而我们的研究发现,精子特异性乳酸脱氢酶(sperm-specific lactate dehydrogenase,LDH-C4)不仅在高原鼠兔睾丸和精子中表达,在心肌、肝脏和脑等组织中也有表达(Wang et al., 2013)。LDH-C4是乳酸脱氢酶的一种同工酶(Gupta,2012),主要催化丙酮酸和乳酸(lactic acid,LD)相互转化(Smithies,1959;Everse & Kaplan,1973)。酶促动力学研究结果表明,LDH-C4对丙酮酸的亲和力高于对LD的亲和力,其酶促反应不易受高浓度LD的抑制(Hereng et al., 2011),有利于催化丙酮酸转化为LD,说明LDH-C4有利于无氧糖酵解。应用LDH-C4特异性抑制剂(N-isopropyl oxamate)能显著降低高原鼠兔骨骼肌中LDH比活力、减少LD和ATP的生成,并显著降低高原鼠兔的运动能力。为了进一步深入探讨Ldh-c基因在高原鼠兔心肌、肝脏和脑组织中的作用及机理,本文通过构建特异性沉默Ldh-c基因载体,用腺病毒包装,通过腹腔注射7 d后,检测3种组织中Ldh-c基因在mRNA和蛋白水平的表达,测定组织中LDH比活力、LD和ATP的含量,进一步探讨高原鼠兔适应低氧的生理机制。
1 材料与方法 1.1 实验动物高原鼠兔捕捉于青海省海南州贵德县拉脊山(101°28′E,36°72′N,海拔3 900 m)。采样点氧分压为62 kPa,含氧量为182 g·m-3。样本量27只,体质量150~200 g,随机分为3组,每组9只。第1组为干扰组(RNAi-LDHC),向高原鼠兔腹腔注射腺病毒pMultiRNAi-Ldhc,注射剂量为0.650 mL;第2组为空壳组(RNAi-HK),向腹腔注射等剂量腺病毒pMultiRNAi-NS;第3组为空白对照组(Control),不注射。高原鼠兔分组注射后饲养7 d,实验前静息30 min,5%戊巴比妥钠麻醉后,用EDTA2K2抗凝管从颈部采血2~3 mL,离心10 min(4 000 r·min-1),分离血浆,4 ℃保存;采集心肌、肝脏和脑组织样品立即保存于液氮。采样过程所涉及处理动物的措施均按照国家《实验动物管理条例(GB14923-2010)》执行。
1.2 RNA干扰在高原鼠兔体内抑制Ldh-c基因表达的研究 1.2.1 Ldh-c基因shRNA表达质粒干扰片段的设计根据GenBank报道的高原鼠兔Ldh-c基因的cDNA序列(HQ704678),选择2个靶位点(321-339,855-875),用Blast进行序列同源性分析,并用RNAstructure 4.2对其二级结构预测。siRNA干扰序列为LDHC321:TTAGTACTTCAAAGATTAC,LDHC855:GCTATTGGACTGTCTGTGA。
1.2.2 Ldh-c基因特异性shRNA表达载体构建及腺病毒包装根据高原鼠兔和人Ldh-c基因的编码区序列,设计并合成shRNA靶序列,用合成的单链shRNA寡核苷酸退火后得到双链产物,用低熔点的琼脂糖凝胶电泳回收,并验证所回收的DNA片段,构建Ldh-c基因特异性shRNA表达载体,转入感受态细胞,挑取阳性克隆在培养基中培养过夜,提取质粒,测序鉴定插入序列。根据DNA测序结果,将与所设计shRNA序列100%相同的重组质粒及空质粒分别进行腺病毒包装。
序列的合成及测序、质粒的链接与病毒包装由武汉晶赛生物有限公司完成。
1.3 荧光定量PCR测定心肌、肝脏和脑组织Ldh-c mRNA表达水平TRIzol(Invitrogen Life Technologies)法提取心肌、肝脏和脑组织总RNA,核酸蛋白含量检测仪测定A260/A280值(1.8<A260/A280<2.0)及浓度(≥0.4 μg·μL-1),取4 μg总RNA采用First Strand cDNA Synthesis Kit(Thermo Scientific,USA)试剂盒制备cDNA。根据高原鼠兔Ldh-a、Ldh-b和Ldh-c基因的cDNA序列,以Ldh-a、Ldh-b和Ldh-c基因同源性低的cDNA序列为模板设计特异性引物用于荧光定量PCR。引物序列如下所示(表 1),按照SYBR©Premix Ex Taq Ⅱ (Tli RNAaseH Plus)(TaKaRa)试剂盒说明配制反应体系:10 μL SYBR@Premix Ex Taq Ⅱ,0.8 μL PCR Forward Primer,0.8 μL PCR Reverse Primer,0.4 μL Rox Reference Dye Ⅱ,2 μL cDNA,加水至总体积20 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 34 s,40个循环;ABI 7500采集和分析数据。各样品目的基因和管家基因的浓度于机器直接生成。每个样品的目的基因浓度除以其管家基因浓度,即为该样品该基因校正后的相对含量。
| 基因 | 序列5'-3' | 序列长度/bp |
| Ldh-a | F:TTGGTCCAGCGGAATGTA | 220 |
| R:GGTGAACTCCCAGCCTTT | ||
| Ldh-b | F:TGTTGGACAAGTCGGAATG | 130 |
| R:CTGAAGAAACAGGCTCCC | ||
| Ldh-c | F:CAGCAGGAGGGAGAAGGT | 179 |
| R:ATGACACGAGAGGCAGGTAA | ||
| β-actin | F:CTCTTCCAGCCCTCCTTCTT | 98 |
| R:AGGTCCTTACGGATCTCCAC |
用总蛋白提取试剂盒提取心肌、肝脏和脑组织总蛋白,采用Piercetm BCA Protein Assay Kit (Thermo Fisher Scientific,USA)测定浓度。取40 μg蛋白进行SDS-聚丙烯酰胺凝胶电泳后,转到0.22 PVDF膜上。用5%脱脂奶粉稀释液常温封闭2 h;与一抗(抗LDH-C:abcam公司兔单克隆抗体,1: 10 000稀释;抗GAPDH:abcam公司单克隆抗体,1: 4 000稀释)4 ℃孵育过夜;TBST洗涤后,用羊抗兔IgG (山羊抗兔,abcam公司,1: 2 000稀释)常温孵育2 h后再用TBST洗涤。采用ECL荧光试剂盒(Thermo Fisher Scientific,USA)曝光、凝胶成像系统(Bio-Rad,USA)拍照。以LDH-C蛋白条带的灰度值与内参GAPDH的灰度值的比值表示该样品的相对蛋白表达水平。
1.5 组织中LDH比活力、LD含量和ATP含量的测定LD含量及LDH比活力测定:心肌、肝脏和脑组织用0.9%生理盐水冰浴匀浆,质量/体积为1: 9,4 ℃ 5 000 r·min-1离心10 min,取上清液。采用比色法检测组织LD含量及LDH比活力,按照试剂盒(南京建成生物技术有限公司,中国)说明操作(许利娜等,2015)。
ATP含量测定:采用萤光素-萤光素酶法检测组织中ATP含量,按照ATP试剂盒(江苏碧云天生物技术有限公司,中国)说明操作。组织用试剂盒中裂解液冰浴匀浆(质量/体积为1: 5)后,4 ℃ 12 000 r·min-1离心10 min,取上清。以ATP浓度与裂解液蛋白浓度的比值来表示组织中ATP的相对含量(单位:nmol·mg-1),参考许利娜等(2015)。
1.6 血清中LDH比活力、LD含量测定取高原鼠兔血清,生理盐水稀释后,采用LD含量和LDH比活力测试盒(南京建成生物工程有限公司)测定。
1.7 干扰效率计算腺病毒pMultiRNAi-Ldhc对各指标的干扰效率按照以下公式计算:干扰组干扰效率=(空白对照组平均值-干扰组平均值)/空白对照组平均值,空壳组干扰效率=(空白对照组平均值-空壳组平均值)/空白对照组平均值。
1.8 数据统计分析使用Excel 2007和SPSS整理数据并分析,采用Kolmogoroe-Simirnov和Levene检验数据的正态性和方差同质性。符合正态分布并具有同质性的数据采用单因素方差分析(One-Way ANOVA)。数据用Mean±SD表示,P<0.05为差异有统计学意义。
2 结果 2.1 高原鼠兔心肌组织中Ldh-c基因的表达荧光定量PCR结果表明,高原鼠兔心肌组织中Ldh-a、Ldh-b和Ldh-c基因在mRNA水平均有表达,注射腺病毒7 d后,Ldh-a和Ldh-b基因表达在干扰组、空壳组和空白对照组之间差异无统计学意义(P>0.05),但能特异性地沉默高原鼠兔Ldh-c基因表达;与空白对照组相比,干扰组中Ldh-c基因表达水平极显著降低(P<0.01),干扰效率为48.11%。干扰组、空壳组和空白对照组中LDH-A和LDH-B亚基均表达,且差异无统计学意义(P>0.05);与空白对照组相比,干扰组LDH-C亚基表达极显著减少(P<0.01),干扰效率为19.27%。同时LDH比活力、LD和ATP的含量也显著降低,与空白对照组相比,干扰组LDH比活力极显著减少(P<0.01),干扰效率为25.58%;干扰组LD含量极显著减少(P<0.01),干扰效率为41.94%;干扰组ATP含量极显著减少(P<0.01),干扰效率为21.23%(图 1)。
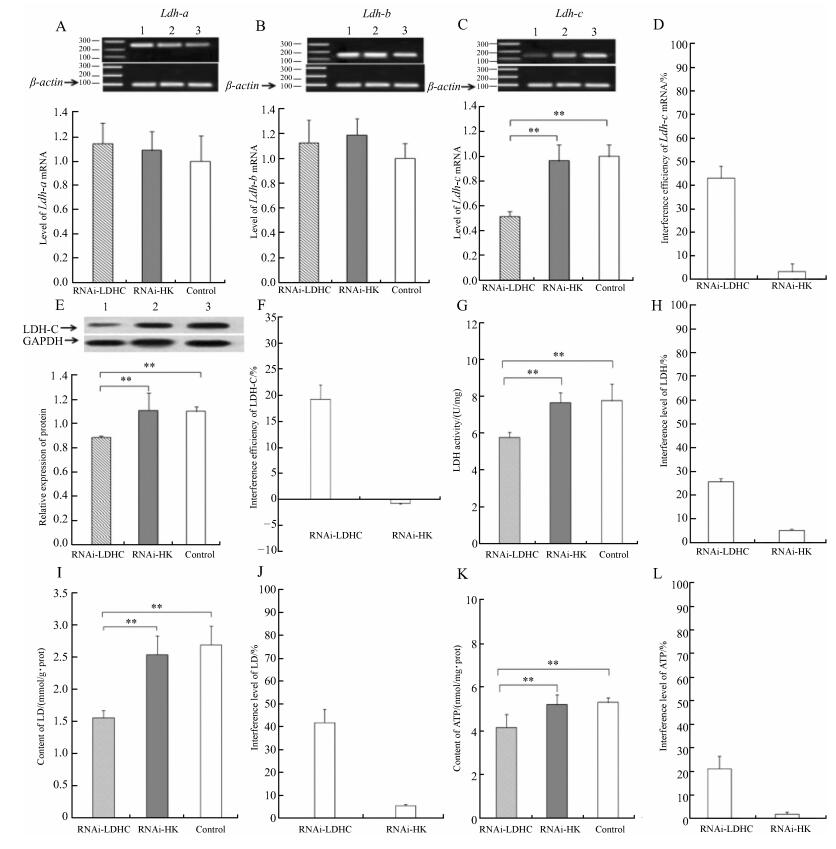
|
| 图 1 Ldh-c基因在高原鼠兔心肌组织的表达(n=9) Fig. 1 The expression of Ldh-c gene in the heart of Ochotona curzoniae (n=9) A. Ldh-a基因mRNA的表达水平,B. Ldh-b基因mRNA的表达水平,C. Ldh-c基因mRNA的表达水平,D.腺病毒pMultiRNAi-Ldhc对Ldh-c基因的干扰效率,E. LDH-C蛋白的表达水平,F.腺病毒pMultiRNAi-Ldhc对LDH-C蛋白的干扰效率,G.腺病毒pMultiRNAi-Ldhc对乳酸脱氢酶(LDH)比活力的影响,H.腺病毒pMultiRNAi-Ldhc对LDH的干扰效率,I.腺病毒pMultiRNAi-Ldhc对乳酸(LD)含量的影响,J.腺病毒pMultiRNAi-Ldhc对LD的干扰效率,K.腺病毒pMultiRNAi-Ldhc对ATP含量的影响,L.腺病毒pMultiRNAi-Ldhc对ATP的干扰效率;其中A、B、C和E图上侧电泳图和免疫印迹图分别表示Ldh-a、Ldh-b和Ldh-c基因mRNA以及LDH-C蛋白的表达模式;1、2和3分别表示干扰组、空壳组和空白组;*P<0.05,**P<0.01;图 2、图 3同。 A. expression level of Ldh-a mRNA, B. expression level of Ldh-b mRNA, C. expression level of Ldh-c mRNA, D. interference efficiency of pMultiRNAi-Ldhc on Ldh-c gene, E. expression level of LDH-C protein, F. interference efficiency of pMultiRNAi-Ldhc on LDH-C protein, G. effect of pMultiRNAi-Ldhc on the activity of lactate dehydrogenase (LDH), H. interference level of LDH, I. effect of pMultiRNAi-Ldhc on the content of lactic acid (LD), J. interference level of LD, K. effect of pMultiRNAi-Ldhc on the content of ATP, L. interference level of ATP; in figs. A, B, C and E, the electrophoresis and Western Blot results represent the expression pattern of Ldh-a, Ldh-b, Ldh-c mRNA and LDH-C protein, respectively; 1, 2 and 3 represent RNAi-LDHC, RNAi-HK and control, respectively; *P < 0.05, **P < 0.01; the same as fig. 2 and fig. 3. |
| |
荧光定量PCR结果表明,高原鼠兔肝脏组织中Ldh-a、Ldh-b和Ldh-c基因在mRNA水平均有表达,注射腺病毒7 d后,Ldh-a和Ldh-b基因表达在干扰组、空壳组和空白对照组之间差异无统计学意义(P>0.05),但能特异性地沉默高原鼠兔Ldh-c基因表达;与空白对照组相比,干扰组中Ldh-c基因表达水平的差异有高度统计学意义(P<0.01),干扰效率为70.16%。干扰组、空壳组和空白对照组中LDH-A和LDH-B亚基均有表达,且差异无统计学意义(P>0.05);与空白对照组相比,干扰组LDH-C亚基极显著减少(P<0.01),干扰效率为25.82%。同时LDH比活力、LD和ATP的含量也显著降低,与空白对照组相比,干扰组LDH比活力极显著减少(P<0.01),干扰效率为28.16%;干扰组LD含量显著减少(P<0.05),干扰效率为15.90%;干扰组ATP含量极显著减少(P<0.01),干扰效率为24.66%(图 2)。

|
| 图 2 Ldh-c基因在高原鼠兔肝脏组织的表达(n=9) Fig. 2 The expression of Ldh-c gene in the liver of Ochotona curzoniae (n=9) |
| |
荧光定量PCR结果表明,高原鼠兔脑组织中Ldh-a、Ldh-b和Ldh-c基因在mRNA水平均有表达。注射腺病毒7 d后,Ldh-a和Ldh-b基因表达在干扰组、空壳组和空白对照组之间差异无统计学意义(P>0.05),但能特异性地沉默高原鼠兔Ldh-c基因表达;与空白对照组相比,干扰组中Ldh-c基因表达水平极显著降低(P<0.01),干扰效率为49.08%。干扰组、空壳组和空白对照组中LDH-A和LDH-B亚基均有表达,且差异无统计学意义(P>0.05);与空白对照组相比,干扰组LDH-C亚基极显著减少(P<0.01),干扰效率为25.36%。同时LDH比活力、LD和ATP的含量也显著降低,与空白对照组相比,干扰组LDH比活力显著减少(P<0.05),干扰效率为16.65%;干扰组LD含量显著减少(P<0.05),干扰效率为12.78;干扰组ATP含量极显著减少(P<0.01),干扰效率为18.50%(图 3)。

|
| 图 3 Ldh-c基因在高原鼠兔脑组织的表达(n=9) Fig. 3 The expression of Ldh-c gene in the brain of Ochotona curzoniae (n=9) |
| |
结果表明,血清中LDH比活力和LD含量,空壳组和空白对照组之间差异无统计学意义(P>0.05);与空白对照组相比,干扰组的LDH比活力和LD含量显著减少(P<0.05),干扰效率分别为18.43%和18.90%(图 4)。

|
| 图 4 腺病毒pMultiRNAi-Ldhc对高原鼠兔血清中乳酸脱氢酶比活力和乳酸含量的影响(n=9) Fig. 4 Effects of pMultiRNAi-Ldhc on the activity of lactate dehydrogenase (LDH) and the content of lactic acid (LD) in the serum of Ochotona curzoniae (n=9) A.腺病毒pMultiRNAi-Ldhc对高原鼠兔血清中LDH比活力的影响,B.腺病毒pMultiRNAi-Ldhc对高原鼠兔血清中LD含量的影响,C.腺病毒pMultiRNAi-Ldhc对高原鼠兔血清中LDH和LD的干扰效率;*P<0.05。 A. effect of pMultiRNAi-Ldhc on the activity of LDH in plateau pika serum, B. effect of pMultiRNAi-Ldhc on the content of lactic acid in plateau pika serum, C. interference level of LDH and lactic acid in plateau pika serum; *P < 0.05. |
| |
RNA干扰是近年来发现的普遍存在于生物体内的一种古老的现象,在转录水平、转录后水平和翻译水平上阻断基因的表达(姜怀春,李宏,2004)。在研究基因功能上RNA干扰有以下优点,一是简单易行;二是周期短,成本低;三是沉默效率高,具有高度特异性(何正波等,2009)。本文通过构建特异性腺病毒结果表明,用RNA干扰技术干扰Ldh-c基因效果好。
腹腔注射法操作比较简单,注射时针头不宜刺入腹腔太深,太深则会刺入内脏,太浅不易穿过腹腔壁,最佳深度为3~5 cm,就可以很好进药(俞玉忠,穆斌,2011;祝春青等,2012;姜国良等,2013),其可行性强,能精准控制给药量(祝春青等,2012),且腹腔面积广并分布大量血管和淋巴管,具有很强的吸收能力(姜国良等,2013)。因此,腹腔注射的腺病毒能充分进入组织并有效地干扰Ldh-c基因。本研究构建了Ldh-c基因特异性载体包装的腺病毒,向高原鼠兔注射后饲养7 d,结果表明,腺病毒能够干扰Ldh-c基因的表达。本文结果显示,运用RNA干扰技术腹腔注射腺病毒pMultiRNAi-Ldhc后,在mRNA水平和蛋白水平均能降低组织中Ldh-c基因的表达,同时降低LDH比活力、LD和ATP含量以及血清中LDH比活力和LD含量,说明腹腔注射的腺病毒在心肌、肝脏和脑组织中发挥了作用,沉默了Ldh-c基因的表达,腺病毒pMultiRNAi-Ldhc对高原鼠兔心肌、肝脏和脑组织中LDH比活力、LD和ATP含量的干扰效率分别为25.58%、41.94%和21.23%;28.16%、15.90%和24.66%以及16.65%、12.78%和18.50%。Wong等(1997)表明N-isopropyl oxamate对LDH-C4具有较强的抑制作用,而对LDH-A4和LDH-B4的抑制作用较小,先前研究向高原鼠兔股二头肌注射N-isopropyl oxamate,研究心肌、肝脏和脑组织中LDH-C4的作用机理,结果表明,当高原鼠兔血液中N-isopropyl oxamate浓度为0.08 mmol·L-1时,其心肌、肝脏和脑组织中LDH比活力、LD和ATP含量显著下降,N-isopropyl oxamate对高原鼠兔心肌、肝脏和脑组织中LDH比活力、LD和ATP含量的抑制率分别为31.98%、20.90%和28.70%;30.19%、32.22%和24.94%;30.78%、46.47%和21.04%(李筱等,2015;许利娜等,2015;魏琳娜等,2015);前期研究表明用N-isopropyl oxamate注射骨骼肌后,高原鼠兔骨骼肌的LDH比活力、LD和ATP含量相应减少,其运动能力也显著降低(Wang et al., 2015),均与本文结果相近。这是由于LDH-C4沉默了C基因的表达从而减少了LDH-C4的合成,降低了无氧糖酵解水平。这些结果表明,LDH-C4通过催化无氧糖酵解过程,为高原鼠兔组织提供生命活动的部分ATP。
总之,Ldh-c基因在高原鼠兔组织中的表达是对高原低氧环境的适应机制。LDH-C4通过催化糖酵解过程降低高原鼠兔心肌、肝脏和脑组织中对有氧代谢氧的依赖性,为其生命活动提供部分ATP,以保证缺氧条件下高原鼠兔机体的供能,使其减小了在低氧环境中对氧的依赖,增强了高原鼠兔对低氧环境的适应。
| 丁晓涛, 何秀琼, 曹玉琼, 等. 1999. 高原鼠兔寄生虫感染调查报告[J]. 四川动物, 18(1): 34. |
| 何正波, 陈斌, 冯国忠. 2009. 昆虫RNAi技术及其应用[J]. 应用昆虫学报, 46(4): 525–532. DOI:10.7679/j.issn.2095-1353.2009.100 |
| 姜国良, 于晓, 徐恺, 等. 2013. 腹腔和皮下注射D-半乳糖衰老大鼠模型分析[J]. 中国老年学, 33(5): 1101–1103. |
| 姜怀春, 李宏. 2004. RNAi的研究进展[J]. 重庆工商大学学报(自然科学版), 21(6): 570–574. |
| 蒋志刚, 马勇, 吴毅, 等. 2015. 中国哺乳动物多样性及地理分布[M]. 北京: 科学出版社. |
| 李筱, 魏莲, 汪洋, 等. 2015. 高原鼠兔心脏中Ldh-c基因的表达及其对无氧糖酵解水平的影响[J]. 生理学报, 67(3): 312–318. |
| 齐新章, 王晓君, 朱世海, 等. 2008. 高原鼢鼠和高原鼠兔心脏对低氧环境的适应[J]. 生理学报, 60(3): 348–354. |
| 饶鑫峰. 2010. 高原鼠兔组织乳酸脱氢酶同工酶的特异性[D]. 西宁: 青海大学. http://cdmd.cnki.com.cn/Article/CDMD-10743-2010210018.htm |
| 施银柱, 樊乃昌. 1980. 草原害鼠及其防治[M]. 西宁: 青海人民出版社: 67-105. |
| 王晓君, 魏登邦, 魏莲, 等. 2008. 高原鼢鼠和高原鼠兔红细胞低氧适应特征[J]. 四川动物, 27(6): 1100–1103. |
| 魏琳娜, 魏莲, 汪洋, 等. 2015. 高原鼠兔肝中Ldh-c基因的表达及其对无氧糖酵解水平的影响[J]. 动物学杂志, 50(6): 846–854. |
| 许利娜, 魏莲, 汪洋, 等. 2015. 高原鼠兔脑组织中精子特异性乳酸脱氢酶的作用[J]. 兽类学报, 35(4): 431–437. |
| 俞玉忠, 穆斌. 2011. 浅谈小鼠腹腔注射的方法与技巧[J]. 中国实用医药, 6(22): 249. DOI:10.3969/j.issn.1673-7555.2011.22.212 |
| 祝春青, 陈冬波, 王苗, 等. 2012. 腹腔注射百草枯构建小鼠肺纤维化模型[J]. 生物技术通讯, 23(4): 563–566. |
| Everse J, Kaplan NO. 1973. Lactate dehydrogenases:structure and function[J]. Advances in Enzymology & Related Areas of Molecular Biology, 37(1): 61–133. |
| Goldberg E. 1975. Lactate dehydrogenase-X from mouse testes and spermatozoa[J]. Methods in Enzymology, 41(1): 318–323. |
| Goldberg E. 1985. Reproductive implications of LDH-C4 and other testis-specific isozymes[J]. Experimental Clinical Immunogenetics, 2(2): 120–124. |
| Gonzales GF. 2013. Serum testosterone levels and excessive erythrocytosis during the process of adaptation to high altitudes[J]. Asian Journal of Andrology, 15(3): 368–374. DOI:10.1038/aja.2012.170 |
| Gupta GS. 2012. LDH-C4:a target with therapeutic potential for cancer and contraception[J]. Molecular and Cellular Biochemistry, 371(1-2): 115–127. DOI:10.1007/s11010-012-1428-2 |
| Hereng TH, Elgstøen KBP, Cederkvist FH, et al. 2011. Exogenous pyruvate accelerates glycolysis and promotes capacitation in human spermatozoa[J]. Human Reproduction, 26(12): 3249–3263. DOI:10.1093/humrep/der317 |
| Kilic BA, Dingil O, Erkula G, et al. 2004. Evaluation of the muscles around the knee in rabbits whose anterior cruciate and/or medial collateral ligaments were dissected[J]. Archives of Orthopaedic and Trauma Surgery, 124(9): 626–630. DOI:10.1007/s00402-003-0633-6 |
| Smithies O. 1959. Zone electrophoresis in starch gels and its application to studies of serum proteins[J]. Advances in Protein Chemistry, 14(10): 65–114. |
| Wang DW, Wei L, Wei DB, et al. 2013. Testis-specific lactate dehydrogenase is expressed in so-matic tissues of plateau pikas[J]. FEBS Open Bio, 3: 118–123. DOI:10.1016/j.fob.2013.01.011 |
| Wang Y, Wei L, Wei D, et al. 2015. Testis-specific lactate dehydrogenase (LDH-C4) in skeletal muscle enhances a pika's sprint-running capacity in hypoxic environment[J]. International Journal of Environmental Research & Public Health, 12(8): 9218–9236. |
| Wheat TE, Goldberg E. 1977. An allelic variant of the sperm-specific lactate dehydrogenase C4 (LDH-X) isozyme in humans[J]. Journal of Experimental Zoology, 202(3): 425–430. DOI:10.1002/(ISSN)1097-010X |
| Wong C, Rodríguezpáez L, Nogueda B, et al. 1997. Selective inhibition of the sperm-specific lactate dehydrogenase isozyme-C4 by N-isopropyl oxamate[J]. Biochimica et Biophysica Acta-Biomembranes, 1343(1): 16–22. DOI:10.1016/S0167-4838(97)00090-3 |
| Zhu SH, Qi XZ, Wang XJ, et al. 2009. Difference in oxygen uptake in skeletal muscles between plateau zokor (Myospalax rufescens baileyi) and plateau pika (Ochotona curzoniac)[J]. Acta Physiologica Sinica, 61(4): 373–378. |
 2017, Vol. 36
2017, Vol. 36




