扩展功能
文章信息
- 陈海峰
- CHEN Haifeng
- 红脂大小蠹基于近交避免行为的雄性配偶选择研究
- Effects of Inbreeding Avoidance on Mate Choice of Male Dendroctonus valens
- 四川动物, 2017, 36(3): 271-276
- Sichuan Journal of Zoology, 2017, 36(3): 271-276
- 10.11984/j.issn.1000-7083.20160364
-
文章历史
- 收稿日期: 2016-12-22
- 接受日期: 2017-03-14
近交衰退是指有亲缘关系的亲本进行交配, 使原本杂交繁殖的生物增加纯合性, 同时伴随出现后代减少、后代弱小或后代不育的现象(Ralls et al., 1979;Pemberton et al., 2017)。如果一个物种确实存在近交衰退现象, 那么选择压力会促使该物种进化出避免近亲交配的机制(Duthie & Reid, 2016;Wikberg et al., 2017)。近交避免机制有几种:(1) 出生地扩散。个体在未达到性成熟前即离开出生地, 迁移至远方。这种方式在自然界普遍存在。鸟类通常是雌性离开出生地, 而哺乳类通常是雄性离开出生地(Huchard, 2017)。(2) 生殖抑制和延缓性成熟。一个亲本的后代, 一种性别的个体先性成熟, 而另一性别个体延后成熟, 使其后代雌雄间无法交配繁殖;或某一性别有某种形式的抑制性性行为(Hoogland, 2013)。(3) 配对外交配。雌雄配对后除了和配偶交配外, 还会与其他异性进行交配, 这样可以提高杂合性, 增加生殖成功。这种方式在鸟类中很常见, 例如, 雌鸟通常会避免与亲缘关系较近的雄鸟结合, 因为近亲繁殖会降低后代的存活率。但有时雌鸟已没有别的选择, 只好找近亲配对, 在这种情况下, 雌鸟就会寻求与亲缘关系较远的雄鸟进行配对外交配(Riehl & Stern, 2015)。(4) 配偶选择。相对于出生地扩散等其他近交避免机制, 配偶选择是最实用且廉价的方式(Wikberg et al., 2017), 因此自然选择在各种各样的环境下都可以通过进化出配偶选择的性选择方式来避免近交。在配偶选择理论中, 雌性往往是主动选择方, 因为雌性在生殖和后代抚育方面的付出远大于雄性。一个典型的例子就是交配场, 在交配场上雄性做出求偶展示以及领域的保卫争斗, 而雌性只是从中挑选出自己中意的配偶, 然后与之进行交配, 交配完后, 所有的亲本照料责任一般都由雌性承担(Höglund & Alatalo, 1995)。不过, 雌性并不总是选择方, 一些性角色转换的物种, 雄性也可能会对雌性进行谨慎选择, 避免近亲交配。发生雄性配偶选择的物种将为配偶选择理论的发展提供新的研究证据。
1 材料与方法 1.1 实验动物红脂大小蠹Dendroctonus valens LeConte隶属于鞘翅目Coleoptera象甲科Curculionidae(殷惠芬, 2000), 主要取食油松Pinus tabuliformis的韧皮部, 是国内重要的入侵害虫。红脂大小蠹野外诱捕方法、室内饲养方法和木段接种方法参见Chen等(2012)。本研究使用2个自然种群的杂交后代。2个自然种群分别诱捕于山西省古交市屯兰川林场和沁源县灵空山林场。为保证较远的亲缘关系, 2个自然种群各随机抽取1雌虫或者1雄虫配对接种至木段上(n=13)。3个月后剖开木桩, 获得不同家庭的子代成体, 分别鉴定雌雄并置于15 mL离心管饲养。离心管内提供新鲜油松韧皮为食物。
1.2 雄性配偶选择中的近交避免行为为了检验雄性在配偶选择过程中是否出现近交避免的行为, 及与之相关联的亲属识别的行为机制。本实验由3个子实验组成。实验一:当雄性同时面对2个远缘雌性或者2个近缘雌性时, 远缘交配是否比近缘交配更易完成?实验二:雄性同时面对1个远缘雌性(与雄性来自不同家庭)和1个近缘雌性(与雄性来自一个家庭), 是否偏向与远缘雌性交配。实验三:亲属识别机制及其对雄性交配动机的影响。因为化学信息在红脂大小蠹配偶选择中起重要作用, 在含有近缘雌性气味(粪屑)的培养皿中, 雄性是否不再与远缘雌性交配。
1.2.1 实验一:近缘或远缘雌性存在下雄性的交配动机实验容器是无色透明的无菌塑料培养皿(直径9 cm, 高1.5 cm), 培养皿底部放置一层滤纸。先将雄性置于培养皿内10 min, 然后将2雌性(远缘雌性或近缘雌性)引入培养皿。雌性的引入位置在与雌性相对的培养皿另一侧边缘, 且2雌性与雄性距离相等。引入后, 使用Sony DCR-HC40E数码摄像机录像30 min。记录并分析以下行为:1) 交配的潜伏期;2) 交配时间。交配的潜伏期定义为从雄性头部移动, 并朝向一雌性开始, 一般先是短暂静止, 静止时出现有规律的触角摆动动作, 并开始移向雌性, 一直到雄性爬上雌性背部, 将阳器插入雌性生殖孔为止。交配时间定义为雄性将阳器插入雌性生殖孔开始, 到雄性离开雌性背部, 双方分离为止。每个雌雄个体仅用于1次实验。
本实验分成2个子实验:
(1) 亲缘关系相同的2雌性实验, 又分2个处理:a)2个近缘雌性;b)2个远缘雌性。(2) 亲缘关系不同的2雌性实验。2雌性中, 1个是近缘雌性, 1个是远缘雌性。
1.2.2 实验二:雄性对近缘和远缘雌性的基于化学信息的配偶选择行为本实验旨在检验雄性在Y-型嗅觉仪中面对近缘和远缘雌性, 是否能够依据化学信息选择远缘雌性, 避免近交。雄性置于Y-型嗅觉仪的主茎, 2个雌性(1个近缘雌性, 1个远缘雌性)置于分支臂。Y-型嗅觉仪及其实验操作见Chen等(2012)。所有个体大小相近(体长6.76 mm±0.12 mm)。
1.2.3 实验三:亲属识别的机制及对雄性交配的影响交配实验同实验一的子实验(2), 但培养皿内1个为远缘雌性, 而近缘雌性是其粪屑(处理1), 或阳性对照(远缘雌性粪屑, 处理2), 以及阴性对照(未被蛀食的韧皮碎屑, 处理3)。雌性取食新鲜油松韧皮36 h后, 在饲养管内留下粪屑, 每个雌性的粪屑用分析天平(0.000 1 g)称取100 mg±5 mg用于实验。粪屑称取后, 1 h内完成雄性交配实验。分析在近缘雌性粪屑、远缘雌性粪屑和韧皮碎屑存在下, 是否显著影响雄性交配成功率。
1.3 统计分析数据分析使用SPSS 20.0和R。用Shapiro-Wilk检验和Levene's检验分别检验数据的正态性和方差齐性。雄性对雌性的选择实验使用卡方拟合优度检验。雄性与近缘、远缘雌性交配潜伏期的不同使用log-rank检验。Y-型嗅觉仪中雄性对近缘和远缘雌性选择的一致性比较使用二项分布检验。每组近缘、远缘雌性体长的比较用配对样本t检验。使用Wald检验分析雄性在近缘雌性粪屑(或韧皮碎屑)存在下, 对交配成功率的影响。显著性水平α=0.05。文中的描述性统计值用平均值±标准误表示。统计图由GraphPad Prism 5.0绘制。
2 结果与分析 2.1 实验一:近缘或远缘雌性存在下雄性的交配动机亲缘关系相同的2雌性实验中, 78.6%的雄性(22/28) 与远缘雌性进行交配, 只有44.8%的雄性(13/29) 与近缘雌性进行交配;雄性更愿意与远缘雌性交配(卡方检验:χ2=6.844, df=1, P=0.009)。观察期内, 交配的潜伏期明显受亲缘关系的影响。远缘雌性交配的潜伏期远短于近缘雌性(log-rank检验:χ2=6.844, df=1, P=0.004)。大部分的交配在前10 min完成(中位数329 s;四分位数25%:86 s, 75%:882 s)。雄性和远缘雌性的交配时间显著长于与近缘雌性(远缘雌性:3.37 min±0.19 min, n=22;近缘雌性:2.38 min±0.21 min, n=13;配对样本t检验:t33=2.657, P=0.015)。
亲缘关系不同的2雌性实验中, 在45组实验中有23组未交配, 22组交配成功(48.9%)。远缘雌性交配的比例(12/22) 与近缘雌性交配的比例差异并无统计学意义(10/22;卡方检验:χ2=2.316, df=1, P=0.128;图 1)。雄性交配的比例与子实验(1) 的近缘雌性的交配比例相比, 差异没有统计学意义(卡方检验:χ2=0.370, df=1, P=0.543)。
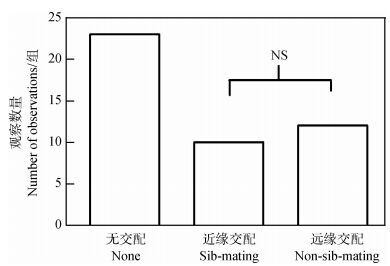
|
| 图 1 雄性与远缘雌性、近缘雌性的交配数量以及未交配的数量 Fig. 1 Number of matings between sibs, non-sibs or no mating when male faced a sister and an unrelated female NS.无统计学意义;下图同。 NS. there is no significant difference; the same below. |
| |
57组Y-型嗅觉仪实验中有41组的雄性做出了选择(二项分布检验:P<0.001)。16组未成功实验中, 有2例停留在原地, 未移动;5例进入其中一个分支臂, 但未超过5 cm;9例停留在主茎, 未进入分支臂。雄性明显偏向选择远缘雌性(远缘雌性:n=37;近缘雌性:n=4;二项分布检验:P<0.001)。每组实验中, 远缘雌性体长(6.75 mm± 0.07 mm, n=57) 和近缘雌性体长(6.78 mm±0.09 mm, n=57) 差异无统计学意义(配对样本t检验:t56=-1.022, P=0.112)。
2.3 实验三:亲属识别的机制及对雄性交配的影响雄性在近缘雌性粪屑存在下, 交配成功率明显降低(卡方检验:χ2=2.316, df=2, P=0.041;“远缘雌性化学信息” vs.“近缘雌性化学信息”, Wald检验:Z=2.332, P=0.020;图 2)。在对照试验中(远缘雌性粪屑, 未被蛀食的韧皮碎屑), 雄性都有较高的交配成功率, 对照间差异无统计学意义(Wald检验:Z=0.656, P=0.421;图 2)。
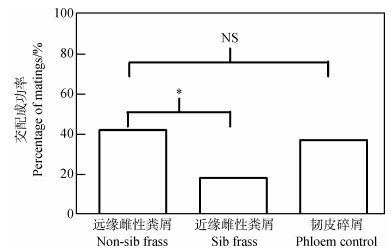
|
| 图 2 雄性在3种处理下(近缘雌性粪屑、远缘雌性粪屑和韧皮碎屑)与远缘雌性的交配成功率(n=32/处理) Fig. 2 Success rate of male Dendroctonus valens mate with a non-sib female in the presence of frass from different relatedness (n=32/treatment) * P<0.05. |
| |
本研究首次表明红脂大小蠹雄性对不同亲缘关系的雌性有显著不同的交配期望。雄性对亲缘关系近的同家庭雌性有明显的近交避免行为, 避免近交衰退, 是雄性主导的“遗传不亲和性假说(genetic incompatibility hypothesis)”的直接证据。本研究同时也显示红脂大小蠹亲属识别的机制是基于个体的化学信息。
雄性面对2个远缘雌性时交配的成功率是近缘雌性的2倍, 表明红脂大小蠹雄性在配偶选择的过程中具有基于化学信息的亲属识别能力。亲属识别能力在小蠹类尚未有系统的研究, 只有零散的研究提示过(Choe & Crespi, 1997;Yan et al., 2005)。由于小蠹类飞翔能力普遍较弱, 扩散能力较差(Turchin & Theony, 1993), 因此扬飞后, 同家庭的个体很可能在附近的油松伐桩上聚集生活, 有了亲属识别能力就可以避免近亲交配。亲属识别在社会性昆虫中普遍存在(Zweden et al., 2010), 但在非社会性昆虫中比较少见(Fellowes, 2008)。红脂大小蠹是少有的通过配偶选择避免近亲交配的非社会性昆虫, 出现这类行为的还有蟋蟀Gryllus bimaculatus(Simmons, 1989), 蟑螂Blattella germanica(Lihoreau et al., 2007);以及社会性昆虫蜜蜂(Smith & Ayasse, 2007), 蚂蚁Iridomyrmex humilis和Plagiolepis pygmaea(Keller & Passera, 1993;Thurin & Aron, 2009)及白蚁Zootemopsis nevadensis(Shellman-Reeve, 2011)。欧洲熊蜂Bombus terrestris配偶的亲缘关系也显著影响了求偶和交配行为(Whitehorn et al., 2009b)。
红脂大小蠹的近交避免行为暗合了遗传互补性的模型, 该模型假定在配偶选择中, 选择方并不总是选择有优良基因的配偶, 而是有可能选择遗传互补的配偶(即子代的适合度取决于雌雄基因型的相互作用)(Duthie & Reid, 2015)。很多遗传互补性的研究集中在一雄多雌制, 因为交配后的性选择(如精子竞争)在这种婚配制度中比较常见(Birkhead & Pizzari, 2002)。在单配制中, 遗传互补性主要体现在交配前基于亲缘关系的配偶选择上。
研究结果显示红脂大小蠹亲属识别的依据是化学信号。在实验一中, 雄性在子实验(2) 中面对1近缘雌性和1远缘雌性时, 雄性并没有表现出明显的与远缘雌性交配的意愿, 只有48.9%的雄性与远缘雌性交配, 这与子实验(1) 雄性与远缘雌性的较高交配成功率显著不同, 而与子实验(1) 近缘雌性交配的比例相比差异无统计学意义。这2个子实验相悖的结果可能是由于近缘雌性挥发性的化学信息很容易充满整个实验平台腔体(培养皿), 干扰了雄性对远缘雌性的交配期望。这个假设被实验三所证实:雄性在远缘雌性化学信息(粪屑)和阴性对照(未被蛀食的韧皮碎屑)下, 与远缘雌性的交配成功率相差无几, 都保持较高的成功率。但有近缘雌性化学信息(粪屑)存在下, 与远缘雌性的交配成功率显著下降。这就证实了亲属识别是依据雌性释放的化学信息, 这些化学信息抑制了雄性的交配意愿。通常, 配偶选择实验只是获得选择或被选择的结果, 但结果常常并不相同, 如子实验(1)、子实验(2), 一些研究的类似实验也产生过这样的矛盾结果(Murray et al., 2009), 本实验设计很好地解决了这个问题, 实验结果也得到了圆满解释。
本研究主要针对雄性的配偶选择, 但雌性也可能会存在配偶选择, 也可能具有亲属识别能力, 这就为实验一相互矛盾的子实验的结果提供另外一种解释。在子实验(1) 中, 2雌性是近缘雌性, 而且不与雄性一个家庭, 在亲属选择理论中, 2雌性因为亲缘关系很近会降低对配偶的竞争。在子实验(2) 中, 2雌性没有亲缘关系, 就会增加对配偶的竞争能力, 理论上甚至会阻止对方与雄性交配。不过, 交配实验表明, 近缘雌性和远缘雌性(相对于雄性而言)存在下, 雄性的交配动机是不一样的, 前者应尽力避免与雄性交配, 而后者应尽力与雄性进行交配, 不论雌性是否存在选择, 近交避免行为是真实发生的。Y-型嗅觉仪实验则进一步证实了近交避免行为可以由雄性通过配偶选择主导完成。同时, 野外观测表明, 雄性的选择基本在侵入孔外即完成, 进入孔后, 很少再出来, 而且雄性进入后会马上把侵入孔和一部分主坑道用粪屑堵实, 暗示雌性对雄性的选择效应较弱, 这种现象同时也出现在Ips pini上(Reid & Roitberg, 1994;Reid & Stamps, 1997)。因此, 在前期工作的基础上, 雄性配偶选择和雄性对近缘雌性化学信息的识别是对本结果的最好解释。
近交避免行为对红脂大小蠹这种单配制和扩散能力相对较弱的入侵昆虫来说, 有利于种群的建立和繁衍。Zayed和Packer(2005)用模型模拟了有近交衰退的物种, 如果无法避免近亲交配, 遗传负荷(genetic load)将高到使随机交配种群萎缩, 乃至灭绝的境地(Hedrick, 2006)。近交的雌性欧洲熊蜂产卵量降低, 后代的存活率也下降(Whitehorn et al., 2009a), 这样的结果对只有一个配偶的种类将会更加严重, 例如红脂大小蠹。在20世纪80—90年代, 山西省很多煤矿从北美地区多次进口了大量的、未经任何加工的松木材, 其中一些松属种类就是红脂大小蠹在北美地区的寄主(Yan et al., 2005)。据此可以推测, 这样的木材进口方式使红脂大小蠹多次从原产地被带入中国成为可能。而且, 来自红脂大小蠹的线粒体细胞色素氧化酶Ⅰ基因(mtDNA CO Ⅰ)显示, 中国红脂大小蠹种群从北美传入;根据单倍型变异的分析认为, 红脂大小蠹侵入中国是短时间内发生的, 即该虫传入中国的时间并不长(Cognato et al., 2005)。同时, 红脂大小蠹的中国种群存在较高的单倍型多样性, 这与外来入侵种因奠基者效应而经常表现的遗传多样性下降恰好相反。这一结果说明, 我国的红脂大小蠹可能是多次、多途径传入(Cognato et al., 2005)。如果同一时间多次入侵同一地区, 那么红脂大小蠹通过基于配偶选择的近交避免机制完全可以减小近交衰退现象, 这对入侵初期小种群建立尤其重要, 避免了几乎所有入侵物种入侵初期都会出现的瓶颈现象(Golani et al., 2007)。在入侵生物学理论中, 一直有一个自相矛盾的问题很难解释, 就是生物入侵刚开始进入新生境时是小种群, 会出现近交衰退现象, 但入侵物种又是如何快速进化、适应、蔓延并大规模繁殖和扩散呢?红脂大小蠹的研究给我们提供一个新的视野, 对于可能同时多途径入侵同一地区的动物, 如果存在基于配偶选择的近交避免行为, 可以避免小种群的瓶颈效应, 促进成功入侵。
| 殷惠芬. 2000. 强大小蠧的简要形态学特征和生物学特征[J]. 动物分类学报, 25(1): 120–121. |
| Birkhead TR, Pizzari T. 2002. Postcopulatory sexual selection[J]. Nature Reviews Genetics, 3(4): 262–273. DOI:10.1038/nrg774 |
| Chen HF, Salcedo C, Sun JH. 2012. Male mate choice by chemical cues leads to higher reproductive success in a bark beetle[J]. Animal Behaviour, 83(2): 421–427. DOI:10.1016/j.anbehav.2011.11.012 |
| Choe JC, Crespi BJ. 1997. The evolution of social behavior in insects and arachnids[M]. Cambridge: Cambridge University Press. |
| Cognato AI, Sun JH, Anducho-Reyes MA, et al. 2005. Genetic variation and origin of red turpentine beetle (Dendroctonus valens LeConte) introduced to the People's Republic of China[J]. Agricultural and Forest Entomology, 7(1): 87–94. DOI:10.1111/afe.2005.7.issue-1 |
| Duthie AB, Reid JM. 2015. What happens after inbreeding avoidance? Inbreeding by rejected relatives and the inclusive fitness benefit of inbreeding avoidance[J]. PLoS ONE, 10(4): e0125140. DOI:10.1371/journal.pone.0125140 |
| Duthie AB, Reid JM. 2016. Evolution of inbreeding avoidance and inbreeding preference through mate choice among interacting relatives[J]. The American Naturalist, 188(6): 651–667. DOI:10.1086/688919 |
| Fellowes MDE. 2008. Do non-social insects get the (kin) recognition they deserve[J]. Ecological Entomology, 23(2): 223–227. |
| Golani D, Azzurro E, Corsini-Foka M, et al. 2007. Genetic bottlenecks and successful biological invasions:the case of a recent Lessepsian migrant[J]. Biology Letters, 3(5): 541–545. DOI:10.1098/rsbl.2007.0308 |
| Hedrick PW, Gadau J, Page JRE. 2006. Genetic sex determination and extinction[J]. Trends in Ecology & Evolution, 21(2): 55–57. |
| Höglund J, Alatalo RV. 1995. Leks[M]. Princeton: Princeton University Press. |
| Hoogland JL. 2013. Prairie dogs disperse when all close kin have disappeared[J]. Science, 339(6124): 1205–1207. DOI:10.1126/science.1231689 |
| Huchard E, Schliehe-Diecks S, Kappeler PM, et al. 2017. The inbreeding strategy of a solitary primate, Microcebus murinus[J]. Journal of Evolutionary Biology, 30(1): 128–140. DOI:10.1111/jeb.2017.30.issue-1 |
| Keller L, Passera L. 1993. Incest avoidance, fluctuating asymmetry, and the consequences of inbreeding in Iridomyrmex humilis, an ant with multiple queen colonies[J]. Behavioral Ecology and Sociobiology, 33(3): 191–199. DOI:10.1007/BF00216600 |
| Lihoreau M, Zimmer C, Rivault C. 2007. Kin recognition and incest avoidance in a group-living insect[J]. Behavioral Ecology, 18(5): 880–887. DOI:10.1093/beheco/arm046 |
| Murray TJ, Withers TM, Mansfield S. 2009. Choice versus no-choice test interpretation and the role of biology and behavior in parasitoid host specificity tests[J]. Biological Control, 52(2): 153–159. |
| Pemberton JM, Ellis PE, Pilkington JG, et al. 2017. Inbreeding depression by environment interactions in a free-living mammal population[J]. Heredity, 118(1): 64–77. DOI:10.1038/hdy.2016.100 |
| Ralls K, Brugger K, Ballou J. 1979. Inbreeding and juvenile mortality in small populations of ungulates[J]. Science, 206(4422): 1101–1103. DOI:10.1126/science.493997 |
| Reid ML, Roitberg BD. 1994. Benefits of prolonged male residence with mates and brood in pine engravers (Coleoptera:Scolytidae)[J]. Oikos, 70(1): 140–148. DOI:10.2307/3545709 |
| Reid ML, Stamps JA. 1997. Female mate choice tactics in a resource-based mating system:field tests of alternative models[J]. The American Naturalist, 150(1): 98–121. DOI:10.1086/286058 |
| Riehl C, Stern CA. 2015. How cooperatively breeding birds identify relatives and avoid incest:new insights into dispersal and kin recognition[J]. BioEssays, 37(12): 1303–1308. DOI:10.1002/bies.201500120 |
| Shellman-Reeve JS. 2011. Genetic relatedness and partner preference in a monogamous, wood-dwelling termite[J]. Animal Behaviour, 61(5): 869–876. |
| Simmons LW. 1989. Kin-recognition and its influence on mating preferences of the field cricket, Gryllus bimaculatus (de Geer)[J]. Animal Behaviour, 38(1): 68–77. DOI:10.1016/S0003-3472(89)80066-1 |
| Smith BH, Ayasse M. 2007. Kin-based male mating preferences in two species of halictine bee[J]. Behavioral Ecology and Sociobiology, 20(5): 313–318. |
| Thurin N, Aron S. 2009. Sib-mating in the ant Plagiolepis pygmaea:adaptative inbreeding?[J]. Journal of Evolutionary Biology, 22(12): 2481–2487. DOI:10.1111/jeb.2009.22.issue-12 |
| Turchin P, Theony WT. 1993. Quantifying dispersal of southern pine beetles with mark-recapture experiments and a diffusion model[J]. Ecological Applications, 3(1): 187–198. DOI:10.2307/1941801 |
| Whitehorn PR, Tinsley MC, Brown MJF, et al. 2009a. Impacts of inbreeding on bumblebee colony fitness under field conditions[J]. BMC Evolutionary Biology, 9(1): 152. DOI:10.1186/1471-2148-9-152 |
| Whitehorn PR, Tinsley MC, Goulson D. 2009b. Kin recognition and inbreeding reluctance in bumblebees[J]. Apidologie, 40(6): 627–633. DOI:10.1051/apido/2009050 |
| Wikberg EC, Jack KM, Fedigan LM, et al. 2017. Inbreeding avoidance and female mate choice shape reproductive skew in capuchin monkeys (Cebus capucinus imitator)[J]. Molecular Ecology, 26(2): 653–667. DOI:10.1111/mec.2017.26.issue-2 |
| Yan ZL, Sun JH, Owen DR, et al. 2005. The red turpentine beetle, Dendroctonus valens LeConte (Scolytidae):an exotic invasive pest of pine in China[J]. Biodiversity and Conservation, 14(7): 1735–1760. DOI:10.1007/s10531-004-0697-9 |
| Zayed A, Packer L. 2005. Complementary sex determination substantially increases extinction proneness of haplodiploid populations[J]. Proceedings of the National Academy of Sciences of the USA, 102(30): 10742–10746. DOI:10.1073/pnas.0502271102 |
| Zweden JS, Brask JB, Christensen JH, et al. 2010. Blending of heritable recognition cues among ant nestmates creates distinct colony gestalt odours but prevents within-colony nepotism[J]. Journal of Evolutionary Biology, 23(7): 1498–1508. DOI:10.1111/j.1420-9101.2010.02020.x |
 2017, Vol. 36
2017, Vol. 36



