扩展功能
文章信息
- 段清星, 李湘, 王本君, 刘春红, 高霞, 敬凯
- DUAN Qingxing, LI Xiang, WANG Benjun, LIU Chunhong, GAO Xia, JING Kai
- 福寿螺密度变化的环境影响因素研究
- Effects of Environment Factors on Density Variation of Pomacea canaliculata
- 四川动物, 2016, 35(4): 503-510
- Sichuan Journal of Zoology, 2016, 35(4): 503-510
- 10.11984/j.issn.1000-7083.20160090
-
文章历史
- 收稿日期: 2016-04-18
- 接受日期: 2016-06-14
生物入侵的出现往往与入侵地的环境条件、资源水平和物种组成有关(Shea & Chesson,2002;Moles et al.,2008)。环境因子对种群具有调节作用,环境条件发生改变会使种群相应地扩大或缩小(Thompson,1929),其中栖息地环境因子,如物理因子和种间关系对水生生物种群的分布和数量具有重要的影响(何明海等,1988;Moles et al.,2008)。
福寿螺Pomacea canaliculata为原产于南美洲淡水湿地的热带物种,现已扩散到全球,尤以中国台湾、菲律宾、日本、马来西亚、泰国等东南亚和东亚国家和地区为重(Mochida,1988)。由于食性广、食量大、繁殖快、适应性强、缺乏天敌等原因,福寿螺可迅速在野外建立庞大的种群,对当地农业和湿地生态系统造成严重的危害(Robert,2002;Salleh et al.,2012),已成为我国长江以南大部分地区的主要农业害虫(俞晓平等,2001)。同时,福寿螺还是广州管圆线虫Angiostrongylus cantonensis、卷棘口吸虫Echinostoma revolutum等寄生虫的中间宿主,严重威胁人类健康(潘长旺等,1998;郭靖等,2014)。
福寿螺在全球广泛的入侵带来了严重的生态学和经济学问题,研究者对其开展了大量的研究,内容涉及生物学特性(Estoy et al.,2002;Teo,2004;Yusa et al.,2006b)、入侵地种群的遗传多样性(Vega et al.,2005;Yusa,2006;Accorsi et al.,2014)、生态危害(Sin,2003;Carlsson et al.,2006;Fang et al.,2010)、防控技术(Yusa et al.,2006a;Wong et al.,2009;Dong et al.,2012)等。中国的研究也经历了从最早的开发养殖技术到认识遗弃后成为入侵种所造成的危害,以及再后来的防控技术研究(邓智心等,2013)。目前的研究重点仍然是种群扩散造成的危害以及防控技术的开发。全面分析入侵地环境因子与福寿螺的关系,对了解影响福寿螺密度变化的主要环境因素,揭示其入侵机制和相应的生态学过程(Burlakova et al.,2010)具有重要意义,也能为预测福寿螺对本地生态系统的影响和进一步开发防控技术提供新的科学依据。本文对景观池塘中福寿螺的密度和环境因子进行了调查研究,以了解栖息地植被、水体物理化学因子和种间关系对福寿螺密度的影响。
1 研究方法 1.1 研究地概况研究地点为云南省昆明市呈贡区(102°51′7′′E,24° 51′56′′N),海拔1 890 m,处于云贵高原中部的滇池盆地以东,属于典型的温带季风气候。干、湿季分明,5—10月为雨季,全年降水量约800 mm,年均温14.7 ℃,最热月平均气温19.7 ℃,最冷月平均气温6.5 ℃。研究地点为农田区的自然湿地经过一系列改造和人工绿化形成的景观池塘,水域面积约43 000 m2。整个研究区域分为3个部分,包括南湖、清溪和北潭,由2座石桥隔开,但水体彼此相连,南湖为自然泉水的出水口。除原本的自然植被外,研究区域还引入了大量的水生生物,如菖蒲Acorus calamus、纸莎草Cyperus papyrus、睡莲Nymphaea tetragona、铁线蕨Adiantum capillus-veneris、芦苇Phragmites communis、风车草Cyperus alternifolius、姜花Hedychium coronarium、莲Nelumbo nucifera和鸢尾Iris tectorum等,沿岸还种植有垂柳Salix babylonica以及其他杂草。福寿螺是在水生景观植物移栽时被带入而定殖形成的种群,水体在引入养殖鱼苗时也带入了一些外来野杂鱼,如食蚊鱼 Gambusia affinis、中华鳑鲏Rhodeus sinensis等。这些养殖鱼类和野杂鱼通常捕食水底的螺类,特别是幼螺。
1.2 研究方法 1.2.1 福寿螺密度调查2015年1—12月,在北潭、清溪、南湖3个区域各随机选取8个样方,对样方进行标记(图 1)。样方大小为1 m2(1 m×1 m),样方间的距离大于50 m。每月对样方中福寿螺的密度进行2次调查,共计24次。调查时,使用捞网捞取样方内的福寿螺,计数并称重。福寿螺的大小根据傅先元和王洪全(2000)的标准进行分级,体质量<1.5 g为幼螺,1.5 g≤中螺≤6.5 g,>6.5 g为成螺。
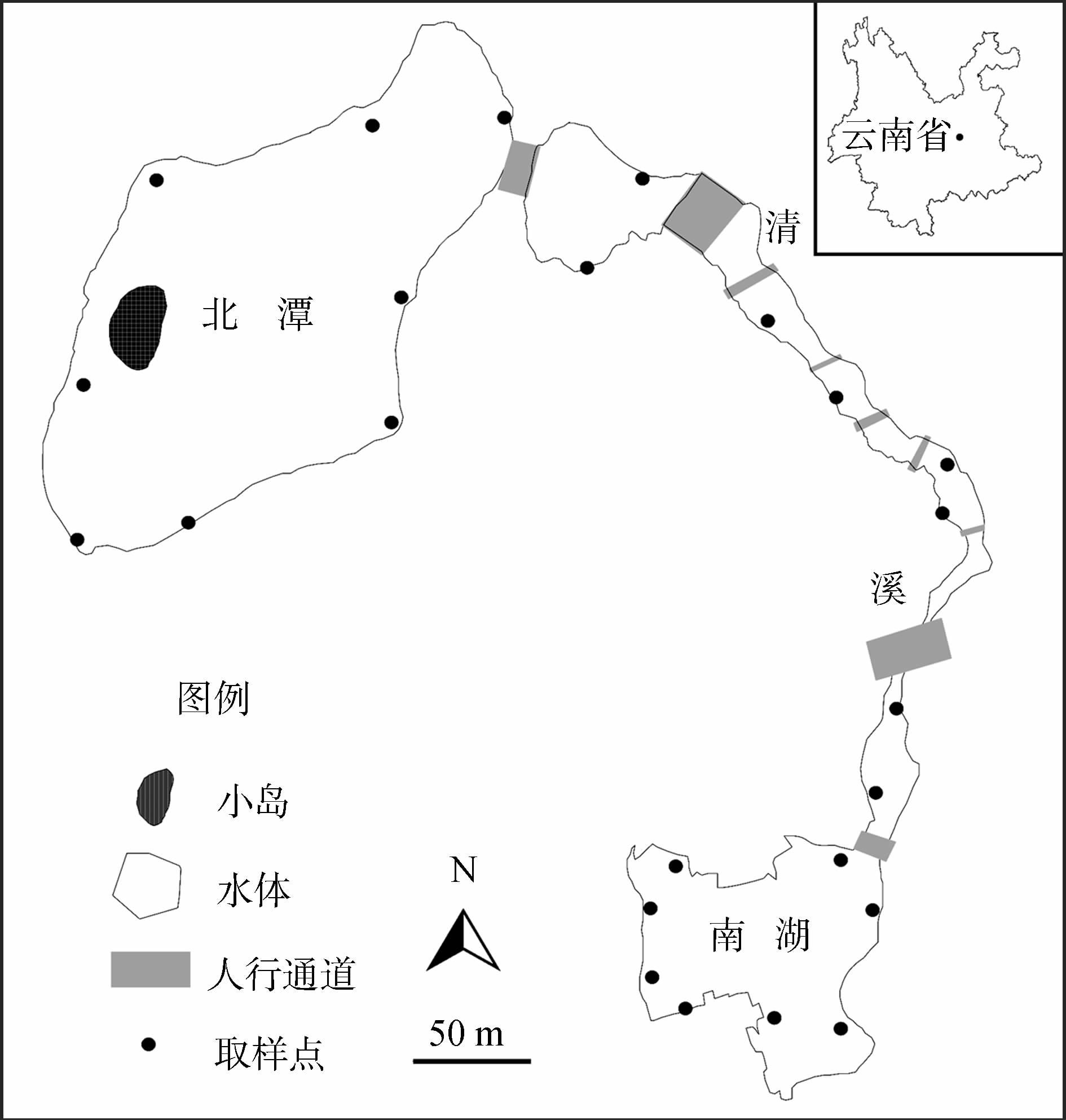
|
| 图 1 研究地点示意图 Fig. 1 Sketch map of the study sites |
| |
为了解环境因子对福寿螺密度的影响,2015年1—12月对福寿螺栖息地水体的植被、水体物理化学因子以及其他水生生物等环境变量进行了调查和测定,包括:(1)栖息地水体中的植被:实测样方中的植被高度、样方附近水面边缘的植被宽度,估测植被盖度。(2)水深:使用最小刻度为1 mm的卷尺进行测量。(3)水体透明度:以黑白相间的铁皮中间穿一根细绳,垂直沉入水中,直到看不见黑白色时水面以下细绳的长度来测量。(4)水体物理化学因子:使用DZB-712型便捷式多参数水质分析仪(上海仪电科学仪器股份有限公司)测量水温、pH值、溶解氧、电导率、氨氮(NH3-N)浓度、硝酸根离子(NO3-)浓度和钙离子(Ca2+)浓度7个参数。(5)田螺Cipangopaludina cahayensis密度:采用计数法直接统计并计算。(6)鱼类出现频次:样方内遇到鱼类的次数。环境因子中的鱼类出现频次调查每月进行2次,共计24次,其余环境因子每月调查1次,共计12次。
1.3 数据处理与分析对各区域福寿螺的密度和环境因子数据先用SPSS 15.0非参数检验中的Kolmogorov-Smirnov进行正态分布检验,根据检验结果进行单因素方差分析(One-Way ANOVA),对差异有统计学意义的因子采用Duncan法进行多重比较。环境因子与福寿螺密度的关系采用Pearson相关分析,对有显著相关的因子进行多元回归分析,求出最优回归模型。结果采用平均值±标准误(Mean±SE)表示。数据采用Excel 2010作图,P<0.05表示差异有统计学意义,P<0.01表示差异有高度统计学意义。
2 结果与分析 2.1 不同区域之间福寿螺密度和环境因子的差异福寿螺的密度在3个区域之间的差异有高度统计学意义(F=21.069,df=2,P<0.001),北潭密度最高,清溪次之,南湖最低,分别为94.31只/m2±11.84只/m2、58.47只/m2±7.19只/m2、18.14只/m2± 3.87只/m2。环境因子中,植被高度、植 被盖度、水面边缘植被宽度、田螺密度、鱼类出现频次在3个区域之间的差异有高度统计学意义,水深、水温、pH值和NH3-N浓度的差异有统计学意义,而水体透明度、电导率、溶解氧、NO3-浓度和Ca2+浓度等环境因子的差异无统计学意义(表 1)。
| 环境因子 | 北潭 | 清溪 | 南湖 | F值 | P值 |
| 平均值±标准误 | 平均值±标准误 | 平均值±标准误 | |||
| 植被高度/cm | 59.37±4.32a | 47.91±5.34a | 34.60±3.11b | 8.107 | 0.002 |
| 植被盖度/% | 48.05±1.46a | 37.08±2.48b | 12.00±2.76c | 64.408 | <0.001 |
| 水面边缘植被宽度/cm | 15.92±1.79a | 12.76±1.10a | 8.02±1.02b | 8.699 | 0.002 |
| 水深/cm | 26.32±2.15 b | 32.36±1.19 a | 39.40±3.18 a | 7.955 | 0.003 |
| 水体透明度/cm | 14.19±0.52 | 14.53±0.18 | 13.62±0.50 | 1.149 | 0.336 |
| 水温/℃ | 21.51±0.19a | 21.11±0.15ab | 20.71±0.24b | 4.123 | 0.031 |
| pH值 | 7.90±0.12a | 7.58±0.14ab | 7.35±0.13b | 4.662 | 0.021 |
| 溶解氧/mg·L-1 | 7.35±0.23 | 7.16±0.06 | 6.98±0.24 | 0.882 | 0.429 |
| 电导率/μs·cm-1 | 366.43±14.61 | 395.23±4.25 | 375.29±7.15 | 2.310 | 0.124 |
| 氨氮(NH3-N)浓度/mg·L-1 | 1.69±0.11b | 2.11±0.10a | 2.27±0.16a | 5.320 | 0.014 |
| 硝酸根离子(NO3-)浓度/mg·L-1 | 0.47±0.04 | 0.57±0.04 | 0.57±0.06 | 1.537 | 0.238 |
| 钙离子(Ca2+)浓度/mg·L-1 | 18.51±0.94 | 16.43±1.09 | 16.79±1.13 | 1.107 | 0.349 |
| 田螺密度/只 | 19.84±1.39a | 16.57±1.29a | 8.76±1.56b | 16.203 | <0.001 |
| 鱼类出现频次/次 | 7.88±2.22 b | 11.75±1.25b | 16.88±0.48a | 9.124 | 0.001 |
| 注:a、b、c依次表示数值由大到小排列; 不同字母代表区域间的数值差异有统计学意义,相同字母代表区域间的数值差异无统计学意义。 | |||||
| Notes: a,b and c indicated the ordinary value from small to large; Different letters between the columns indicated there was a significant difference,and the same letters indicated there was no significant difference. | |||||
植被对福寿螺的密度有重要的影响。Pearson相关分析结果表明,福寿螺密度与植被高度(r=0.794,P<0.001,n=24)、植被盖度(r=0.903,P<0.001,n=24)、水面边缘植被宽度(r=0.802,P<0.001,n=24)呈极显著正相关关系(图 2)。表明栖息地中植被越丰富,福寿螺的密度越大。
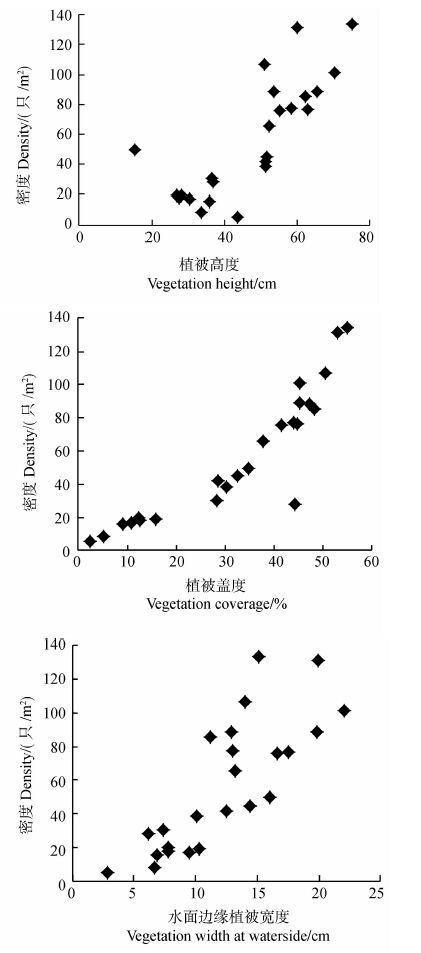
|
| 图 2 栖息地植被对福寿螺密度的影响 Fig. 2 The influence of vegetation on the density of Pomacea canaliculata |
| |
水体的部分物理化学因子与福寿螺密度关系密切(图 3)。Pearson相关分析显示,福寿螺密度与水体深度(r=-0.720,P<0.001,n=24)、NH3-N浓度(r=-0.752,P<0.001,n=24)呈极显著的负相关关系;而与水温(r=0.699,P<0.001,n=24)、pH值(r=0.839,P<0.001,n=24)呈极显著正相关关系。水体较浅、NH3-N浓度低、水温及pH值较高环境中的福寿螺密度高。
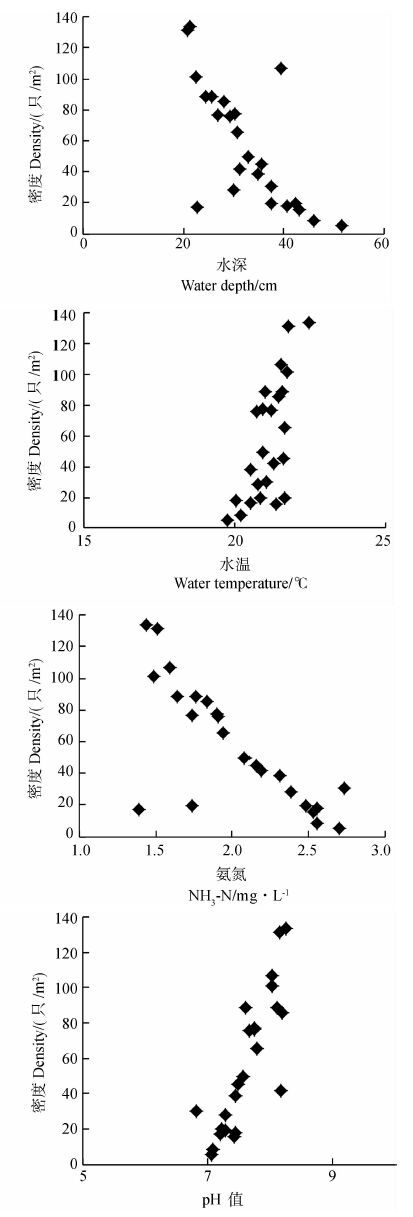
|
| 图 3 水体物理化学因子与福寿螺密度的关系 Fig. 3 The relationships between the physical and chemical environment factors of water body and the density of Pomacea canaliculata |
| |
水体中的鱼类对福寿螺密度也有重要的影响。样方内的鱼类出现频次在0~18次 之间,相关分析显示鱼类出现频次与福寿螺密度之间呈极显著负相关(Pearson,r=-0.753,P=0.001,n=24)关系(图 4)。表明水体中作为福寿螺捕食者的鱼类出现越频繁,福寿螺的密度就越低。
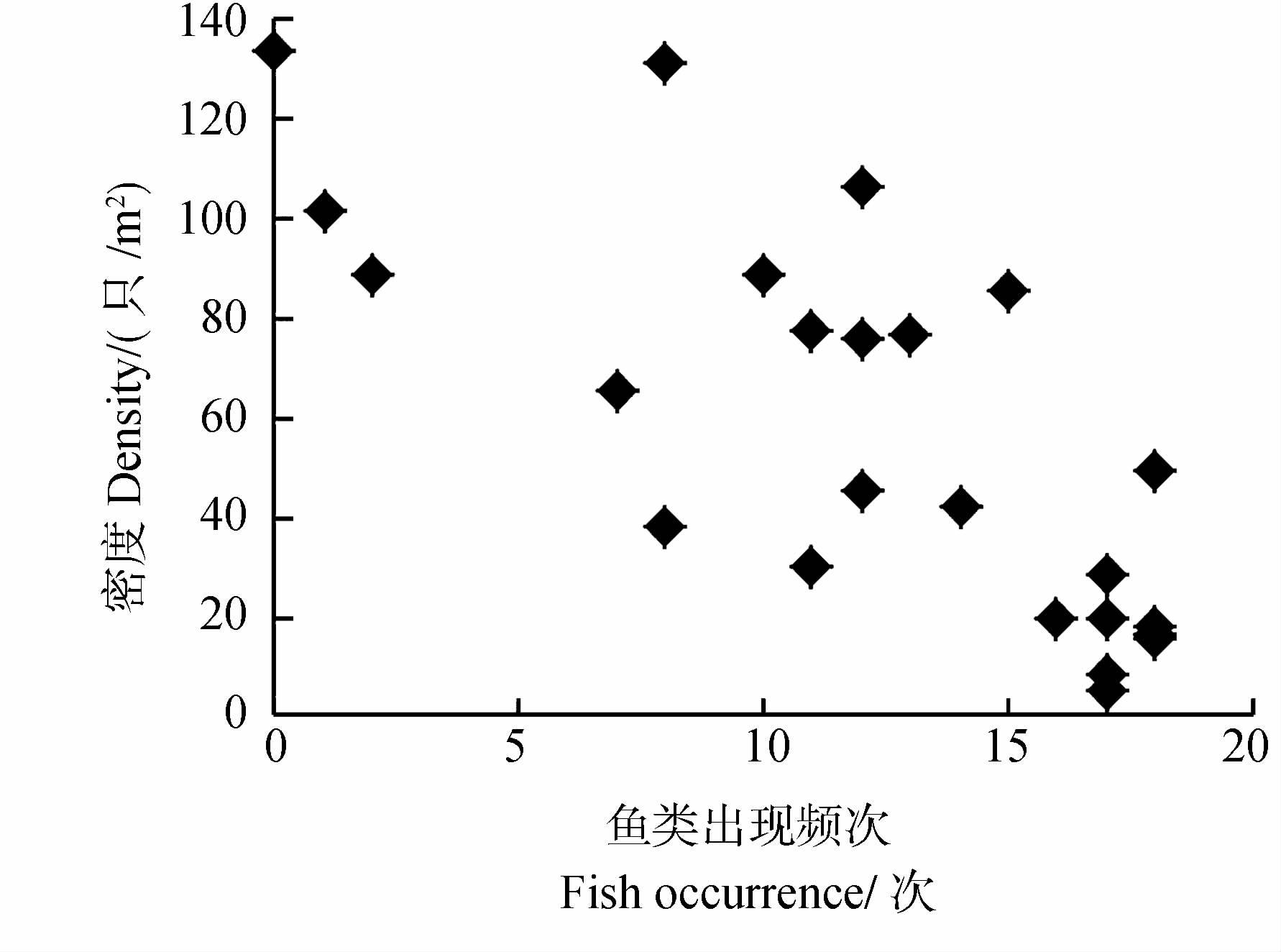
|
| 图 4 鱼类的出现频次与福寿螺密度的关系 Fig. 4 The relationship between fish occurrence and the density of Pomacea canaliculata |
| |
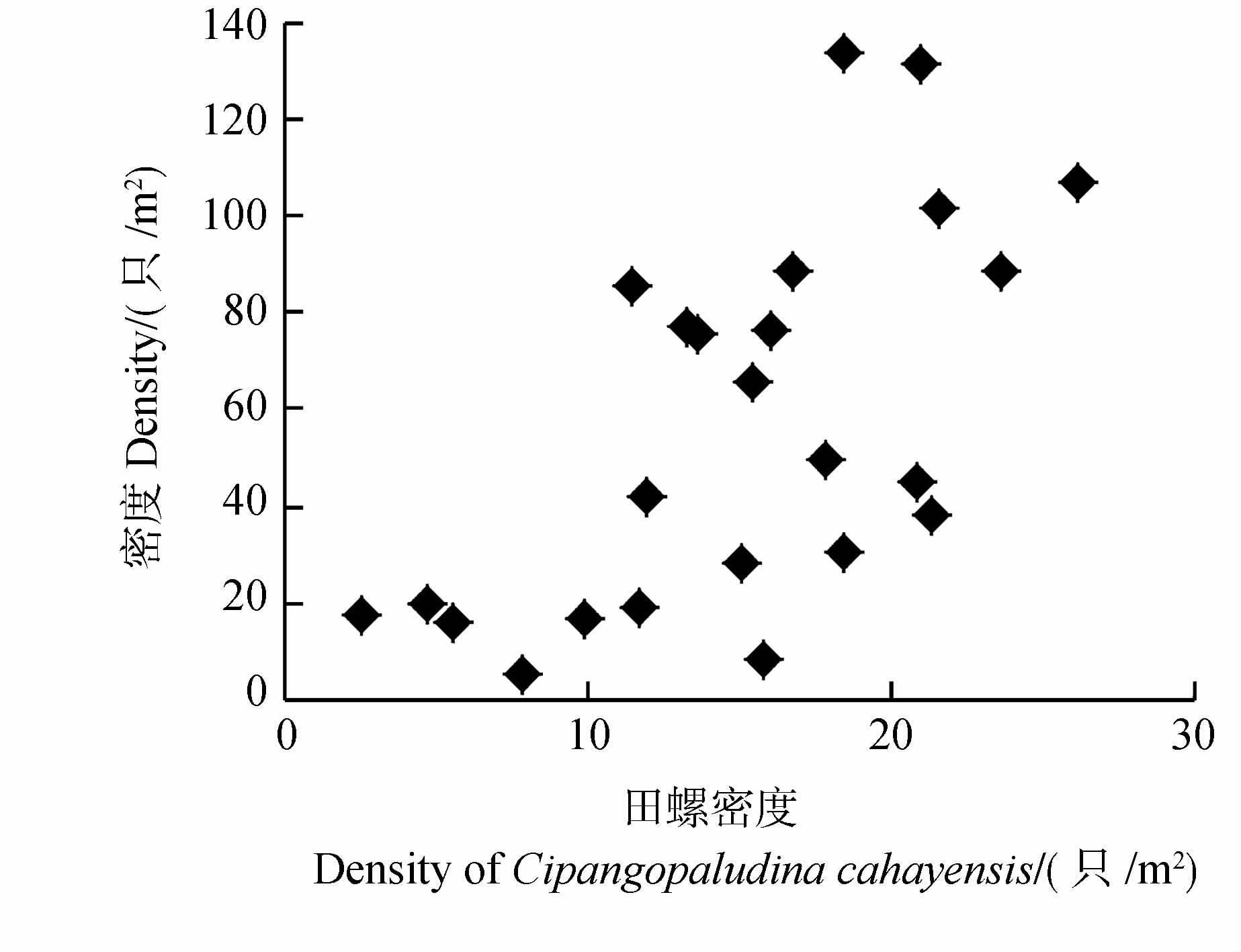
样方内本地田螺密度在3~26只/m2之间,田螺密度与福寿螺密度呈极显著正相关(Pearson,r=0.625,P<0.001,n=24)关系(图 5),显示水域中田螺密度越大区域中的福寿螺密度也越大。
|
| 图 5 田螺密度与福寿螺密度的关系 Fig. 5 The relationship between the density of Cipangopaludina cahayensisand the density of Pomacea canaliculata |
| |
对与福寿螺密度具有相关关系的9个环境因子(植被高度、植被盖度、水面边缘植被宽度、水温、pH值、水深、NH3-N浓度、田螺密度、鱼类出现频次)进行多元回归分析得到3个模型(表 2)。3个回归模型中,当植被盖度、pH值和鱼类出现频次进入回归方程时,回归方程的拟合程度最高(表 3),为最优回归模型。其方程为:
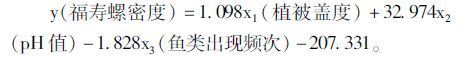
|
| 模型 | 回归系数B | t值 | P值 | |
| 1 | 常数(Constant) | -11.459 | -1.476 | 0.154 |
| x1(植被盖度) | 2.113 | 9.865 | <0.001 | |
| 2 | 常数(Constant) | -254.156 | -3.247 | 0.004 |
| x1(植被盖度) | 1.468 | 5.327 | <0.001 | |
| x2(pH值) | 34.631 | 3.112 | 0.005 | |
| 3 | 常数(Constant) | -207.331 | -3.005 | 0.007 |
| x1(植被盖度) | 1.098 | 4.097 | 0.001 | |
| x2(pH值) | 32.974 | 3.449 | 0.003 | |
| x3(鱼类出现频次) | -1.828 | -2.926 | 0.008 |
| 模型 | 复相关系数R | 判别系数R2 | 调整系数 | 估计标准误差 | F值 | P值 |
| 1 | 0.903 | 0.816 | 0.807 | 17.080 | 97.323 | <0.001 |
| 2 | 0.935 | 0.874 | 0.862 | 14.463 | 72.708 | <0.001 |
| 3 | 0.955 | 0.912 | 0.898 | 12.401 | 68.782 | <0.001 |
模型显示,植被盖度、pH值和鱼类出现频次是影响福寿螺密度最重要的3个环境因子。福寿螺密度随植被盖度和水体pH值的增加而增加,随鱼类出现频次的增加而降低。
3 讨论栖息地的不同是影响淡水螺类分布的主要因素之一(Crowl & Schnell,1990)。福寿螺的种群增长受到多种环境因子的影响,如水文周期、食物、温度等,其种群的丰度与环境因子(如水深、水流、水温、溶解氧等)密切相关(Teo,2004;Yamanishi et al.,2012)。在研究地,景观池塘的北潭、清溪和南湖3个不同区域里,福寿螺密度表现出明显的差异(密度大小依次为北潭>清溪>南湖),同样,不同区域福寿螺栖息地的14个环境因子中有9个也表现出了显著的不同。这显示多种环境因子对福寿螺密度具有影响,北潭的植被高度、植被盖度和水面边缘植被宽度都较大,而水体的水深较浅,NH3-N浓度较低,水温较高,pH值较大,鱼类出现频次较低,因此福寿螺密度相对较高。
3.1 植被的影响水生植物是影响淡水螺类分布的重要因素之一(Giorgi et al.,2005;Tietze & De Francesco,2010)。本研究发现植被高度、植被盖度、水面边缘植被宽度等对福寿螺密度具有重要影响。丰富的植被为福寿螺提供了充足的食物资源。福寿螺为广食性种类,对水生和陆生植物没有偏爱性(叶建人等,2011),主要栖息于水草茂盛的水域,可摄食大量水生植物,其生长速率与倾向摄食的植物丰富度有关(徐汝梅,叶万辉,2003)。池塘中有大量的湿地植被和枯枝落叶等有机质,杂草丛生,是福寿螺主要的食物来源(Estebenet,1995)。水体植被除了为福寿螺提供了食物外,还为其提供了产卵场所。福寿螺虽然是水生动物,但只在水面上方产卵(Wang et al.,2012),且所产的卵只能在空气中孵化(王彝豪,1988)。福寿螺吸附于水生植物的茎叶上,较高的植被有利于福寿螺进行产卵,避免所产的卵块接近水面,也可保证卵块不受其他物种的干扰,增加卵块的存活率(Seuffert & Martín,2010)。丰富的植被还可能为福寿螺提供躲避敌害的场所(Werner et al.,1983;Hara et al.,2015)。大型植物一方面为福寿螺提供了丰富的食物,有利于福寿螺进行产卵活动和直接进行空气呼吸,另一方面为福寿螺提供了躲避 不良环境的场所(Seuffert & Martín,2010)。当大型植物减少或消失时,福寿螺密度会急剧下降(Tietze & De Francesco,2010)。
3.2 水体的影响水深是福寿螺栖息地的重要限制因子之一。研究表明福寿螺的死亡率与水深有密切关系,水体太深或太浅都不利于福寿螺的生存(Teo,2004)。福寿螺主要栖息于水深不超过50 cm的浅水区(Burlakova et al.,2010)。在日本,当水深超过50 cm时,福寿 螺密度快速下降(Ichinose et al.,2000)。夏威夷的福寿螺倾向于生活在水深不超过30 cm的水体中,当水深超过90 cm时很少有福寿螺的分布,而在原产地巴西的福寿螺主要集中生活在水深30~168 cm 的水域中(Levin et al.,2006)。本研究表明,福寿螺偏爱生活在较浅的水体中,其原因可能是较浅水域中有大量泥土基质,当遇到天敌或极端环境时,福寿螺能较快躲避。浅水区的挺水植物、浮游植物和有机质都较丰富,不仅为福寿螺提供了丰富的食物,还有利于其在植被上进行产卵和直接爬出水面进行呼吸(Turner,1996;Darby et al.,2002)。福寿螺营两栖生活,浅水区更有利于其进行水生和陆生的交替生活。
水温不仅影响福寿螺的生长、发育,还影响其生存(Costil & Bailey,1998;Albrecht et al.,2005)。研究表明水温与福寿螺的死亡密切相关(Teo,2004)。福寿螺的正常生活水温为10 ℃~35 ℃(刘中丽,1989),当水温在10 ℃~30 ℃时,随着温度的升高,福寿螺的活动和摄食行为明显增强(Seuffert et al.,2010)。福寿螺原产于南美洲热带地区,适宜在水温较高的水域中生活(Robert,2002),23 ℃~27 ℃ 是其生长发育的最佳温度,当水温低于15 ℃时,福寿螺的活动和摄食能力明显受到抑制(刘中丽,1989)。然而高于40 ℃或低于0 ℃(周卫川等,2003)的水温常会导致福寿螺的死亡。本研究区域的水温处于福寿螺生存的安全生理温度之间,有利于其入侵和种群的扩散。
淡水螺类对环境中的酸碱度适应范围较广,在pH值4.5~9.4范围内均可存活(Hunter,1990)。朱丽霞等(2015)对福寿螺的研究发现,pH值6.5~8.5有利于福寿螺的生长发育和繁殖,当pH≤3.5或pH≥10.5,福寿螺的生长受到抑制。本研究区域中的pH值变化不大,处于福寿螺安全生理pH值之间,随着pH值的升高,福寿螺种群增加,表明中性和弱碱性的水体有利于福寿螺的生存。这与其他研究(Kwong et al.,2008;Seuffert & Martín,2013;朱丽霞等,2015)的结论一致。一般认为,pH值偏低时会影响囊胚或早期的发育,导致淡水螺生长缓慢、产卵量下降(Hunter,1990)。
NH3-N浓度对福寿螺的生长具有一定的影响。在一定条件下,福寿螺正常生存的NH3-N安全浓度为2.684 mg·L-1,随着NH3-N浓度的增加,福寿螺的死亡率增加(尹绍武,许芳,2000)。本研究表明,福寿螺远离NH3-N浓度高的环境,可能是因为在NH3-N浓度高的水体中,藻类和某些细菌过度繁殖会破坏水体的生态平衡,严重时可致福寿螺中毒甚至窒息死亡(夏新建等,2012)。
3.3 捕食者的影响捕食是影响被捕食者种群动态和群落结构的重要因素之一(Sih,1987),而福寿螺的密度与其捕食者的捕食活动有关(Yamanishi et al.,2012)。本研究区域中福寿螺的捕食者主要是各种大型鱼类,如青鱼Mylopharyn godonpiceus、鲤鱼Cyprinus carpio、鲫鱼Carassius auratus、鲶鱼Silurus asotus、草鱼Ctenopharyn godonidellus等。鲫鱼、青鱼、鲶鱼和鲤鱼主要捕食福寿螺幼螺,体型大的鱼还可捕食中大型螺类(Sin,2006;Yusa et al.,2006a)。本研究发现福寿螺的数量与鱼类出现频次呈极显著负相关关系,鱼类出现频次较多的区域中福寿螺密度较小,可能是捕食者(鱼类)对福寿螺的捕食所致。这与其他相关研究(Ichinose et al.,2002;Hara et al.,2015)的结果一致。
本研究还发现,在昆明地区的景观池塘中,福寿螺密度受多种环境因子共同的影响。在逐步回归分析中仅有植被盖度、pH值和鱼类出现频次进入最后的最优回归模型,这表明福寿螺密度受植被、水体及捕食者压力等环境因子的共同作用。
 2016, Vol. 35
2016, Vol. 35




