扩展功能
文章信息
- 戴金妹, 张玲玲, 耿宝荣
- DAI Jinmei, ZHANG Lingling, GENG Baorong
- 二硫氰基甲烷对斑腿泛树蛙蝌蚪抗氧化系统及丙二醛含量的影响
- Effects of Methylene Dithiocyanate on Antioxidant System Activity and Malondialdehyd Content in Polypedates megacephalus Tadpoles
- 四川动物, 2016, 35(2): 283-287
- Sichuan Journal of Zoology, 2016, 35(2): 283-287
- 10.11984/j.issn.1000-7083.20150408
-
文章历史
- 收稿日期: 2015-12-22
- 接受日期: 2016-01-15
二硫氰基甲烷 是一种具有强烈杀菌、降低线虫活性的有机硫氰化合物(祁之秋等,2007),对 20 多种植物病原真菌、细菌和线虫均具有很高的生物学活性,可用于防治水稻恶苗病和干尖线虫病、大麦条纹病、网斑病、坚黑穗病等,同时也适用于其他病害的防治,还能够降低病原菌对苯并咪唑类药剂的抗药性(陈长军等,2003;马承铸等,2011)。作为一种高效、广谱、安全的杀菌剂,MBT在作物病虫害防治方面得到了广泛的应用,但对农田生态环境和水生生物的影响则少有研究(王李宝等,2008)。
两栖动物生活于水陆环境,是农田生态系统的重要组成部分,在控制害虫和发展无公害农业中起到重要的作用(薛清清等,2005)。然而,近年来全球性的两栖类种群下降已引起人们的高度关注(Stuart et al.,2004; Xie et al.,2007)。研究表明,环境污染对两栖动物的生存与繁殖造成了巨大威胁(Sharpe & Skakkebaek,1993; Geng et al.,2005),有关环境污染物对两栖动物的影响已成为当前生态毒理学研究的热点(Blaustein et al.,2003; 李贞等,2010)。实际上,两栖动物具有特殊的生活周期和生理特征,与其他脊椎动物相比,其对环境变化更为敏感,在作为灵敏的生物学标志物或早期预警系统检测环境毒物方面具有重要的意义(徐士霞等,2003;周景明等,2006)。本试验以斑腿泛树蛙Polypedates megacephalus蝌蚪为实验材料,在急性毒性研究基础上,开展MBT对其总抗氧化能力(total antioxidative capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力以及脂质过氧化产物丙二醛(malondialdehyd,MDA)含量等影响的生理毒性研究,探讨MBT的生态毒理学效应,旨在探明MBT对两栖动物抗氧化性的损伤程度,为农田生态系统保护和保护两栖动物水质标准的制定提供参考,也为MBT的合理使用提供科学依据。
1 材料与方法 1.1 仪器与试剂DT11A型电子天平由江苏常熟长青仪器仪表厂生产,CR2II型高速冷冻离心机由日本日立有限公司生产,台式离心机、752型紫外可见分光光度计由上海精密科学仪器有限公司生产,HH4数显恒温水浴锅为国华电器有限公司生产。
MBT(有效成分98%)由成都艾科达化学试剂有限公司生产,试验前先用二甲基亚砜(DMSO)作为助溶剂,将其配成质量浓度为1 g·L-1的母液,正式试验时再稀释为试验所需要的浓度。考马斯亮蓝蛋白试剂盒、T-AOC试剂盒、GSH-Px试剂盒和MDA试剂盒均购自南京建成生物工程研究所。
1.2 试验动物将采自福建师范大学仓山校区生态池塘的斑腿泛树蛙卵泡带回,置于实验室的水族箱内,用充分曝气48 h以上的自来水进行孵化和培养,定期换水;开食后的蝌蚪用蛋黄和粉状鳗鱼饲料喂养。选择处于28~30期(Gosner,1960)、体质健康、活动正常、大小一致(体长22.06 mm±2.25 mm,体质量0.18 g±0.03 g)的蝌蚪进行实验。
1.3 试验方法 1.3.1 急性毒性在实验室条件下(水温15 ℃~17 ℃)采用静态换水法进行急性毒性试验(周永欣,章宗涉,1989)。在预试验所得到的最大无致死浓度(LC0)和最小全致死浓度(LC100)范围内,按0.9等对数间距,设置5个MBT浓度处理组(4.0 μg·L-1、4.9 μg·L-1、6.0 μg·L-1、7.4 μg·L-1和9.1 μg·L-1),另设1个DMSO对照组(3.0 μg·L-1)和1个空白对照组,试验设置3个平行组。每组随机放置8尾蝌蚪,染毒持续96 h;试验期间不喂食,每24 h更换1次试液,记录蝌蚪死亡数并清除死亡个体。
1.3.2 生理毒性染毒:根据急性毒性试验的结果,以96 h半致死浓度(96 h-LC50)的50 %值为最高浓度,设置5个MBT浓度处理组(0.6 μg·L-1、1.2 μg·L-1、1.8 μg·L-1、2.4 μg·L-1和3.0 μg·L-1)、1个DMSO对照组(3.0 μg·L-1)和1个空白对照组。每组放置20尾蝌蚪,染毒期间不喂食,每24 h更换一次试液。
样品制备:分别于暴露后48 h和96 h,从各处理组及对照组中随机取出6尾蝌蚪,冲洗后用滤纸吸干体表的水,按质量体积比(1: 9)加入生理盐水,在冰浴条件下迅速将蝌蚪研磨,制成10%的匀浆液,在2 500 r下离心10 min,取上清液测定。
测定方法:采用考马斯亮兰法测定蝌蚪体内的蛋白质含量,T-AOC、GSH-Px活力及MDA含量的测定严格按照试剂盒中的说明书步骤进行操作。T-AOC单位定义为:在37 ℃时,每分钟每毫克蛋白质使反应体系的吸光度(OD)值每增加0.01时为1个总抗氧化能力单位;GSH-Px活力单位定义为:每毫克蛋白质每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1 μmol·L-1为1个酶活力单位;MDA含量以nmol·mg-1表示。
1.4 数据处理急性毒性试验中,利用Excel计算LC50。将MBT浓度转化为浓度对数,与蝌蚪累积死亡百分率进行回归分析,得到毒性回归方程,当死亡率为50%时,通过回归方程计算出48 h-LC50和96 h-LC50,安全浓度(SC)采用公式SC=0.1×96 h-LC50(Ezemonye & Tongo,2009)。在生理毒性试验中,数据以平均值±标准误表示;在同一暴露时间内,各处理组间及各处理组与对照组间的比较用SPSS 19.0软件包进行LSD多重比较分析,显著性水平设置为α=0.05。
2 结果与分析 2.1 急性毒性在急性毒性试验的96 h内,DMSO对照组和空白对照组的蝌蚪未出现死亡,且活动正常、游动活跃、反应灵敏,表明低剂量的助溶剂DMSO对蝌蚪无影响。各处理组中的蝌蚪则出现一定的中毒症状,主要表现为:蝌蚪游动的频率和能力下降,出现呆滞、行动缓慢的症状,躯体呈现不同程度的僵硬状态,尾部出现不同程度的弯曲;随着处理时间的延长,蝌蚪出现死亡现象;蝌蚪死亡时,身体发黑腐烂。
96 h 的急性毒性试验表明,MBT浓度对数和蝌蚪累积死亡百分率呈显著线性关系(图 1)。经计算得知,MBT对斑腿泛树蛙蝌蚪48 h和96 h 的LC50分别为8.024 μg·L-1和6.095 μg·L-1,安全浓度为0.610 μg·L-1。
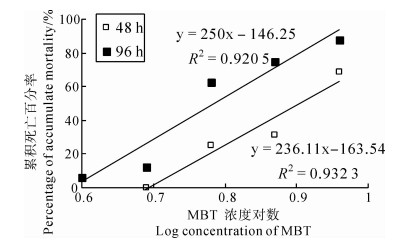
|
| 图 1 暴露于不同浓度的二硫氰基甲烷溶液48 h和96 h的 斑腿泛树蛙蝌蚪累积死亡百分率与二硫氰基甲烷浓度对数关系曲线 Fig. 1 Accumulate mortality-MBT log concentration curve of Polypedates megacephalus tadpoles exposed to methylene dithiocyanate for 48 h and 96 h |
经MBT处理48 h和96 h后,蝌蚪的T-AOC、GSH-Px活力变化及MDA含量变化见图 2。由于DMSO对照组和空白对照组的所有数据均无统计学差异,故合并为单一的对照组数据进行分析。
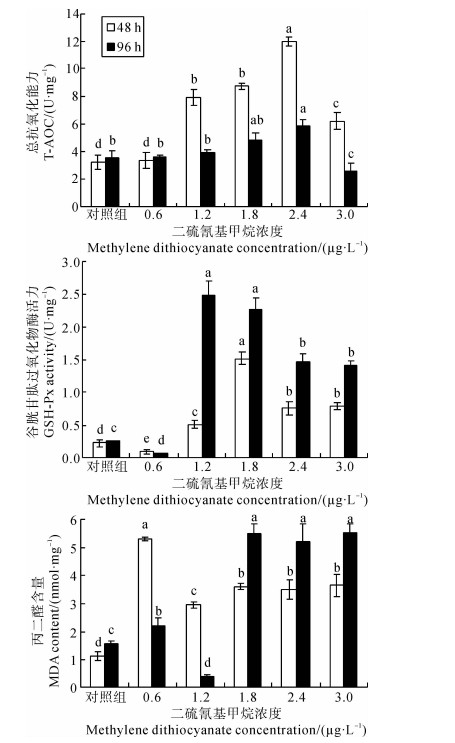
|
|
图 2 二硫氰基甲烷溶液中斑腿泛树蛙蝌蚪的 T-AOC、GSH-Px活力及MDA含量变化
Fig. 2 The T-AOC, GSH-Px activity and MDA content
changes of Polypedates megacephalus tadpoles
exposed to methylene dithiocyanate medium
注:同一暴露时间中,标注字母不同表示差异有统计学意义,P < 0.05或P < 0.01。 Note: Different letters indicate significant difference in the same exposed time, P < 0.05 or P < 0.01. |
由图 2可以看出,在MBT溶液中暴露48 h后,0.6 μg·L-1浓度处理组蝌蚪的T-AOC和对照组相比无统计学差异(P>0.05),而中、高浓度处理组的T-AOC则被诱导而呈上升趋势,峰值出现在2.4 μg·L-1浓度处理组;而最高浓度处理组(3.0 μg·L-1)的T-AOC则受到显著抑制而下降。
暴露96 h后,0.6 μg·L-1浓度处理组仍与对照组无统计学差异,说明该浓度不会影响蝌蚪的T-AOC;中、高浓度处理组的T-AOC被诱导呈缓慢上升之势,峰值仍出现在2.4 μg·L-1浓度处理组,而最高浓度处理组的T-AOC则下降至极显著低于对照组的水平(P < 0.01),表明T-AOC受到较大抑制。
2.2.2 MBT对斑腿泛树蛙蝌蚪GSH-Px活力的影响斑腿泛树蛙蝌蚪在MBT溶液中暴露48 h和96 h后,其GSH-Px活力变化趋势大致与T-AOC的相同(图 2)。在最低浓度处理组(0.6 μg·L-1),蝌蚪的GSH-Px活力受毒物的胁迫先显著下降(P<0.05);从1.2 μg·L-1浓度处理组开始,其活力出现“毒物兴奋效应”而显著升高,染毒48 h后的GSH-Px活力峰值出现在1.8 μg·L-1浓度处理组,而96 h后则出现在1.2 μg·L-1浓度处理组。表明在较高的浓度中,只需相对较短的时间即可 被诱导而引起“毒物兴奋效应”,高浓度处理组(2.4 μg·L-1和3.0 μg·L-1)的GSH-Px活力则比中浓度处理组的显著下降,说明其活力受到了一定程度的抑制。
2.2.3 MBT对斑腿泛树蛙蝌蚪MDA含量的影响由图 2可以看出,斑腿泛树蛙蝌蚪在MBT溶液中暴露48 h后,在0.6 μg·L-1浓度处理组中,MDA含量显著上升(P < 0.01),而在1.2 μg·L-1浓度处理组中则开始下降,1.8 μg·L-1浓度处理组中又出现极显著提高,并保持高值状态。暴露96 h后,0.6 μg·L-1浓度处理组的MDA含量与对照组相比无统计学差异,在1.2 μg·L-1处理组也出现显著的下降;与处理48 h情况一致,在1.8 μg·L-1浓度处理组中显著上升(P < 0.01)后趋于稳定,保持高值状态。
3 讨论急性毒性是大剂量的环境污染物一次性或短时间内多次对生物的毒性作用(周启星等,2004),由于该试验操作简便、耗时短,并能够反映污染物的相对毒性强度以及剂量效应关系,故被广泛应用,是最常用的一种毒性试验方法(黄修平等,2013)。有关环境污染物对水生动物毒性的评价,目前一般以测得的LC50值作为评价依据,根据48 h LC50值的大小,将农药对水生生物的毒性划分为3个等级(张克杰,张维平,1991)。本试验的研究结果表明,MBT对斑腿泛树蛙蝌蚪的毒性属于中等毒性。
T-AOC是一项衡量机体抗氧化系统功能状况的综合性指标,反映了机体清除自由基的能力(李安娜等,2008)。有研究表明,受到环境化学污染物及环境应激因子胁迫的动植物机体组织能够产生大量自由基,使抗氧化酶活性发生相应的改变。由于抗氧化酶对低浓度的环境化学污染物非常敏感,很多环境毒理实验均将其作为研究、检测及评价污染物引起的机体生化效应的一种重要生物标志物(Almeida et al.,2002;王重刚等,2002)。本研究结果表明,在低浓度(0.6 μg·L-1)的MBT溶液中,无论是48 h还是96 h,斑腿泛树蛙蝌蚪的T-AOC均不受影响;但随着MBT浓度的上升,刺激了蝌蚪体内抗氧化系统,出现了T-AOC增高呈兴奋效应,但高浓度长时间的暴露则会严重抑制机体的T-AOC,从而产生一定的毒性效应。
GSH-Px是机体内最重要的抗氧化酶之一,能特异催化对H2O2的还原反应,有效清除新陈代谢产生的活性氧(ROS),保护脂膜和其他细胞组分的结构及功能,维持组织内的氧代谢平衡(Kosower & Kosower,1978; 谭树华等,2012)。许多研究表明,酶活力在低浓度污染物胁迫时先下降后因“毒物兴奋效应”而升高,随着污染物浓度不断提高或暴露时间的延长,则形成了毒害而再次下降(王重刚等,2002;朱友芳,洪万树,2011)。本实验结果表明,蝌蚪的GSH-Px活力在低浓度(0.6 μg·L-1)的MBT胁迫时显著下降,随着毒物浓度的上升而逐渐被诱导,出现激活状态,但随着毒物浓度的继续上升,其活性则被抑制。T-AOC和GSH-Px活力在暴露情况下的诱导与抑制在毒物浓度上没有同步性,T-AOC峰值出现在2.4 μg·L-1浓度处理组,而GSH-P峰值则出现在1.8 μg·L-1浓度处理组(48 h)和1.2 μg·L-1浓度处理组(96 h)。由此说明环境污染物对蝌蚪抗氧化酶活性的影响模式比较复杂,还需要进一步的 深入研究(Stephensen et al.,2000; 王重刚等,2002)。
MDA是体内氧自由基引发的生物膜不饱和脂肪酸过氧化反应的代谢产物,是目前反映机体氧化损伤最具代表性的指标之一,其在机体中的浓度水平反映了脂质过氧化的程度,即机体细胞受自由基攻击的程度(贾秀英,施蔡雷,2008),可作为环境污染评价的有力指标(钟碧瑾等,2009)。研究表明,在有毒性作用的外界化学物质影响下,生物机体内的MDA含量会上升(Catalgol et al.,2007)。本研究 结果表明,在较低浓度(0.6 μg·L-1和1.2 μg·L-1)的 MBT下染毒48 h,或最低浓度(0.6 μg·L-1)MBT下染毒96 h,蝌蚪机体尚未对MBT的胁迫做出及时反应,不能及时清除氧自由基,MDA含量上升。随后机体内抗氧化系统被激活,清除部分氧自由基,MDA含量显著下降;但随着药物浓度的增高和染毒时间延长,机体抗氧化系统遭到破坏,MDA含量再次上升,并保持高值状态。这与T-AOC和GSH-Px活力的变化是相符合的。
总之,农药的使用在对防治农业病虫害发挥作用的同时,也对两栖动物和其他水生动物产生了较大的负面影响。因此,科学规范地使用农药,对有效地控制水环境污染,保障生态安全,以及保护两栖动物正常的生长与繁殖,具有重要的意义。
| 陈长军, 周明国, 叶钟音. 2003. 二硫氰基甲烷对水稻恶苗病菌菌体作用机理研究[J]. 植物病理学报, 33(1): 48-51. |
| 黄修平, 江沄, 耿宝荣. 2013. 高效氯氰菊酯对中华蟾蜍蝌蚪的毒性影响[J]. 四川动物, 32(4): 555-559. |
| 贾秀英, 施蔡雷. 2008. 水体二价铜离子致蟾蜍蝌蚪DNA损伤和氧化损伤[J]. 环境科学学报, 28(10): 2095-2100. |
| 李安娜, 张迎梅, 李瑗伶, 等. 2008. 十二烷基硫酸钠对斑马鱼抗氧化能力的影响[J]. 四川动物, 27(6): 993-996. |
| 李贞, 李丕鹏, 徐齐艳, 等. 2010. 农药和化肥对无尾两栖类蝌蚪的毒性效应研究进展[J]. 生态毒理学报, 5(2): 287-294. |
| 马承铸, 李世东, 缪作清, 等. 2011. 在蔬菜作物生长期中二硫氰基甲烷和四硫代碳酸钠处理根围土壤的安全性和效果研究[J]. 上海农业学报, 27(1): 28-32. |
| 祁之秋, 王建新, 陈长军, 等. 2007. 二硫氰基甲烷对番茄苗安全性及其对根结线虫的防效[J]. 农药, 46(7): 489-490, 493. |
| 谭树华, 袁志栋, 刘雨芳, 等. 2012. 镉对克氏原螯虾肝胰腺抗氧化系统的影响[J]. 应用生态学报, 23(9): 2595-2601. |
| 王重刚, 郑微云, 余群, 等. 2002. 苯并(a)芘和芘的混合物暴露对梭鱼肝脏抗氧化酶活性的影响[J]. 环境科学学报, 22(4): 529-533. |
| 王李宝, 万夕和, 朱彬, 等. 2008. 二硫氰基甲烷对脊尾白虾的急性致毒实验[J]. 海洋水产研究, 29(5): 120-123. |
| 徐士霞, 李旭东, 王跃招. 2003. 两栖动物在水体污染生物监测中作为指示生物的研究概况[J]. 动物学杂志, 38(6): 110-114. |
| 薛清清, 姚丹, 黄泽宇, 等. 2005. 杀虫剂敌敌畏和除草剂丁草胺对饰纹姬蛙蝌蚪的急性毒性实验[J]. 四川动物, 24(2): 209-212. |
| 张克杰, 张维平. 1991. 环境污染生物监测与评价[M]. 北京: 中国环境科学出版社. |
| 钟碧瑾, 姚丹, 刘娟娟, 等. 2009. 两种有机磷农药对沼水蛙蝌蚪抗氧化系统及MDA浓度的影响[J]. 福建师范大学学报, 25(2): 91-96. |
| 周景明, 秦占芬, 徐晓白. 2006. 两栖类动物在环境毒理学研究中的应用[J]. 环境与踺康杂志, 23(4): 369-371. |
| 周启星, 孔繁翔, 朱琳. 2004. 生态毒理学[M]. 北京: 科学出版社. |
| 周永欣, 章宗涉. 1989. 水生生物毒性试验方法[M]. 北京: 农业出版社. |
| 朱友芳, 洪万树. 2011. 敌百虫对中国花鲈的毒性效应[J]. 生态学杂志, 30(7): 1484-1490. |
| Almeida JA, Diniz YS, Marques SFG, et al. 2002. The use of the oxidative stress responses as biomarkers in Nile tilapia (Oreochromis niloticus) exposed to in vivo cadmium contamination[J]. Environment International, 27: 673-679. |
| Blaustein AR, Romansic JM, Kiesecker JM, et al. 2003. Ultraviolet radiation, toxic chemicals and amphibian population declines[J]. Diversity and Distributions, 9: 123-140. |
| Catalgol BK, Ozden S, Alpertunga B. 2007. Effects of trichlorfon on malondialdehyde and antioxidant system in human erythrocytes[J]. Toxicology in Vitro, 21: 1538-1544. |
| Ezemonye LIN, Tongo I. 2009. Lethal and sublethal effects of atrazine to amphibian larvae[J]. Jordan Journal of Biological Sciences, 2: 29-36. |
| Geng BR, Yao D, Xue QQ. 2005. Acute toxicity of the pesticide dichlorvos and the herbicide butachlor to tadpoles of four anuran species[J].Bulletin of Environmental Contamination and Toxicology, 75: 343-349. |
| Gosner KL. 1960. A simplified table for stating anuran embryos and larvae with notes in identification[J]. Herpetologica, 16: 183-190. |
| Kosower NS, Kosower EM. 1978. The glutathione status of cells[J]. International Review of Cytology, 54: 109-160. |
| Sharpe RM, Skakkebaek NE. 1993. Are oestrogens involved in falling sperm counts and disorders of the male reproductive tract? [J]. The Lancet, 341: 1392-1396. |
| Stephensen E, Svavarsson J, Sturve J, et al. 2000. Biochemical indicators of pollution exposure in shorthorn sculpin (Myoxocephalus scorpius), caught in four harbours on the southwest coast of Iceland[J].Aquatic Toxicology, 48: 431-442. |
| Stuart SN, Chanson JS, Cox NA, et al. 2004. Status and trends of amphibian declines and extinctions worldwide[J]. Science, 306: 1783-1786. |
| Xie F, Lau MWN, Stuart SN, et al. 2007. Conservation needs of amphibians in China: a review[J]. Science in China Series C: Life Sciences, 50: 265-276. |
 2016, Vol. 35
2016, Vol. 35




