扩展功能
文章信息
- 赵英政, 郭萍, 石超凡, 易宪文, 徐光翠
- ZHAO Yingzheng, GUO Ping, SHI Chaofan, YI Xianwen, XU Guangcui
- 高脂饮食联合链脲佐菌素对小鼠糖脂代谢及炎症的影响
- Effect of High-fat Diet and Streptozotocin on the Glucose Lipid Metabolism and the Inflammatory in Mice
- 四川动物, 2016, 35(1): 109-112
- Sichuan Journal of Zoology, 2016, 35(1): 109-112
- 10.11984/j.issn.1000-7083.20150206
-
文章历史
- 收稿日期: 2015-06-10
- 接受日期: 2015-10-29
随着我国社会经济水平的提高,人们的生活方式及饮食结构发生了极大的变化。高糖、高胆固醇饮食已成为动脉粥样硬化、冠心病、糖尿病等慢性疾病的潜在致病因素(Flynn et al.,2006; Lobstein,2006)。据报道我国2型糖尿病发病率逐年增加,目前糖尿病患病率高达9.7%,前期糖尿病患病率约15.5%,患病人群以2型糖尿病为主,比例达90%以上(燕娟等,2009)。高脂饮食可诱发氧化应激和炎症反应,而炎症与2 型糖尿病发生密切相关。
迄今为止,已建立了多种高胆固醇或高脂诱导的胰岛素抵抗的动物模型,但物种选择、高脂配方、喂养时间等因素仍需进一步探索。C57BL/6J小鼠被认为是“标准”的近交系动物,为许多突变基因提供遗传背景,同时对高脂诱导的肥胖敏感(van der Heijden et al.,2015)。本研究通过给予C57BL/6J小鼠高脂饮食,监测高脂饮食过程中小鼠体质量、糖脂代谢指标和炎症状态,旨在明确高脂饮食及注射链脲佐菌素(Streptozotocin,STZ)对C57BL/6J小鼠糖脂代谢及系统炎症的影响,为2型糖尿病的预防、疾病发生、发展过程中的影响因素及机制的探究提供理论基础。
1 材料与方法 1.1 材料 1.1.1 试剂和器材STZ(Sigma);甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(TCHO)等生化检测试剂盒(北京,北化康泰);TNF-α、IL-1β ELISA试剂盒(武汉,博士德);60%的高脂纯化饲料及10%的对照纯化饲料(江苏,特洛菲);电子血糖仪(美国,强生);低温离心机(德国,eppendorf);酶标仪(美国,Thermo)。
1.1.2 实验动物SPF级雄性C57BL/6J小鼠40只,体质量18~20 g,购于北京维通利华实验动物技术有限公司,于IVC动 物房饲养,明暗周期12 h/12 h;相对湿度60%~70%。
1.2 方法 1.2.1 动物分组及处理适应7 d后,将40只C57BL/6J小鼠随机分为对照组和模型组,每组20只。对照组小鼠饲喂10%的对照纯化饲料,模型组小鼠饲喂60%的高脂纯化饲料。自由摄食、饮水,每天定时更换饲料,观察小鼠状态。1周后,禁食16 h,测量小鼠体质量;经尾静脉采血后,分离血清并置于-20 ℃冰箱保存,每周1次,连续4周。4周后,对照组腹腔注射柠檬酸缓冲液,模型组腹腔注射STZ,剂量为40 mg·kg-1,每天1次,连续3 d。继续饲养2周后,测量随机血糖,以血糖值≥16.7 mmol·L-1者为2型糖尿病小鼠。对照组及模型组成模小鼠分别通过腹腔注射葡萄糖以进行糖耐量试验,葡萄糖浓度为10%,注射容积为0.2 mL·10 g-1,分别测定和记录30 min、60 min、90 min、120 min、240 min时的血糖值。最后,经股动脉采血后,处死小鼠,分离血清。
1.2.2 指标测定采用电子血糖仪测血糖。严格按照试剂盒的说明书检测血清中甘油三酯、高密度脂蛋白、低密度脂蛋白等含量;严格按照ELISA试剂盒方法检测血清中的TNF-α、IL-1β。
1.2.3 数据处理采用SPSS 18.0统计软件,数据以x±s表示,样本间比较采用独立样本t检验;重复测量数据采用重复测量方差分析,检验水平为0.05。
2 结果 2.1 高脂饲料喂养对C57BL/6J小鼠体质量及血糖值的影响与同一时间对照组比较,除第1周空腹血糖及第6周体质量外,模型组体质量、空腹血糖均升高,差异有统计学意义(P<0.05)。对前4周数据采用重复测量方差分析,发现喂养时间对体质量(F=200.831)和空腹血糖(F=7.025)的影响有统计学意义(P<0.05),即高脂饲料及喂养时间导致了小鼠体质量、空腹血糖的增加。不同喂养时间与不同饲料对体质量的影响存在交互作用(F=7.951,P<0.05)。未发现不同饲料喂养与不同喂养时间对空腹血糖存在交互作用(F=1.449)。在第6周STZ注射后模型组体质量降低,但与注射前的体质量差异无统计学意义(t=0.386),空腹血糖升高(t=8.177,P<0.05)(表 1)。
| 时间 | 体质量/g | 空腹血糖/(mmol·L-1) | ||
| 对照组 | 模型组 | 对照组 | 模型组 | |
| 第1周 | 20.39±1.13 | 23.53±1.72* | 4.17±0.96 | 4.55±1.18 |
| 第2周 | 20.03±0.89 | 24.34±2.18* | 3.90±0.52 | 6.76±3.75* |
| 第3周 | 21.84±1.69 | 25.49±2.44* | 4.16±1.24 | 5.67±2.15* |
| 第4周 | 24.18±1.89 | 29.80±3.08* | 5.06±0.96 | 7.81±2.06* |
| 第5周 | 25.95±1.90 | 30.46±3.51* | 4.75±1.06 | 12.86±3.65* |
| 第6周 | 28.23±3.51 | 28.62±2.84 | 5.46±0.72 | 14.90±4.10* |
| 注: * 与同一时间对照组比较, P<0.05; 喂养时间对体质量(F=200.831, P<0.05)和空腹血糖(F=7.025, P<0.05)的影响有统计学意义, 不同喂养时间与不同饲料对体质量的影响存在交互作用(F=7.951, P<0.05);在第6周STZ注射后模型组空腹血糖值升高(t=8.177, P<0.05)。 Notes: * compared with the control group at the same time, P<0.05; Feeding time had an effect on body weights (F=200.831, P<0.05) and fasting blood glucose (F=7.025, P<0.05); There was an interaction between different feeding time and different diets on body weights (F=7.951, P<0.05); Fasting blood glucose increased after STZ injection at 6th week (t=8.177, P<0.05). | ||||
与同一时间对照组比较,除第1周低密度脂蛋白外,模型组血脂各项指标差异均无统计学意义。小鼠连续摄入高脂饲料4周,对前4周数据采用重复测量方差分析,发现喂养时间对低密度脂蛋白(F=30.793)、甘油三酯(F=34.027)和高密度脂蛋白(F=30.793)的影响均有统计学意义(P<0.05),即高脂饲料及喂养时间导致了小鼠低密度脂蛋白、甘油三酯和和高密度脂蛋白的增加。不同饲料喂养与不同喂养时间对甘油三酯的影响存在交互作用(F=7.828,P<0.05)。未发现不同饲料喂养与不同喂养时间对低密度脂蛋白和高密度脂蛋白存在交互作用。未发现注射STZ前后血脂各项指标的差异具有统计学意义(表 2)。
| 时间 | 低密度脂蛋白 LDL | 甘油三酯 TG | 高密度脂蛋白 HDL | |||
| 对照组 | 模型组 | 对照组 | 模型组 | 对照组 | 模型组 | |
| 第1周 | 2.15±0.65 | 3.36±1.00* | 1.35±0.66 | 1.91±0.73 | 6.09±2.45 | 6.82±1.83 |
| 第2周 | 3.23±1.42 | 3.42±1.17 | 1.03±0.82 | 1.07±0.57 | 5.43±1.06 | 5.66±1.29 |
| 第3周 | 3.71±0.88 | 3.78±0.68 | 2.26±0.91 | 2.99±0.58 | 4.17±0.72 | 4.38±0.91 |
| 第4周 | 3.54±0.92 | 4.18±0.96 | 2.10±0.42 | 2.71±0.34 | 5.24±1.86 | 5.54±0.78 |
| 第5周 | 3.62±0.68 | 4.28±1.06 | 2.13±0.79 | 2.89±0.58 | 4.37±1.28 | 4.63±0.98 |
| 第6周 | 3.71±0.95 | 4.38±1.12 | 2.25±0.94 | 2.97±0.62 | 4.24±1.86 | 4.12±0.81 |
| 注: * 与同一时间对照组比较, P<0.05; 喂养时间对低密度脂蛋白(F=30.793, P<0.05), 甘油三酯(F=34.027, P<0.05)和高密度脂蛋白(F=30.793, P<0.05)的影响均有统计学意义; 不同饲料喂养与不同喂养时间对甘油三酯的影响存在交互作用(F=7.828, P<0.05)。 Notes: * compared with the control group at the same time, P<0.05; Feeding time had an effect on low density lipoprotein (F=30.793, P<0.05), triglycerides (F=34.027, P<0.05) and high density lipoprotein (F=30.793, P<0.05); There was an interaction between different feeding times and different diets on triglycerides (F=7.828, P<0.05). | ||||||
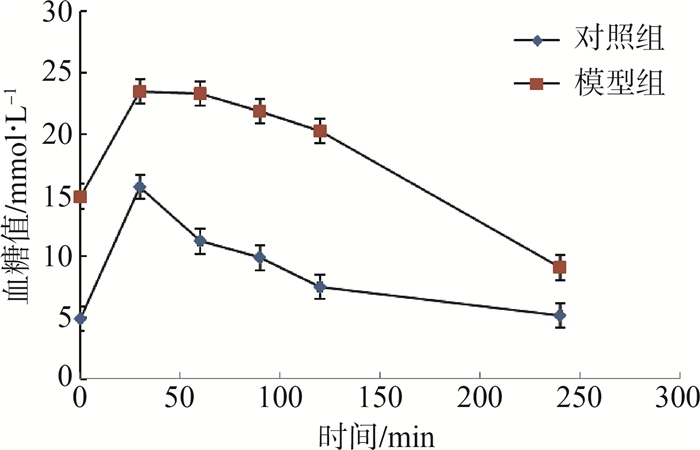
注射STZ 2周后,对20只C57BL/6J小鼠进行随机血糖的测定,以血糖值≥16.7 mmol·L-1者为2型糖尿病小鼠。有15只成模,成模率为75%。且随着体质量的增加,糖尿病小鼠成模率提高(表 3)。注射STZ 2周后,对照组与模型组小鼠分别经腹腔注射葡萄糖的240 min的糖耐量曲线比较见图 1。
| 体质量/g | 数量/只 | 成模率/% |
| <28 | 5 | 60.0 |
| 28~30 | 6 | 66.7 |
| >30 | 9 | 88.9 |
|
| 图 1 2组小鼠糖耐量曲线比较 Fig. 1 Comparison of glucose tolerance curves in two mice groups |
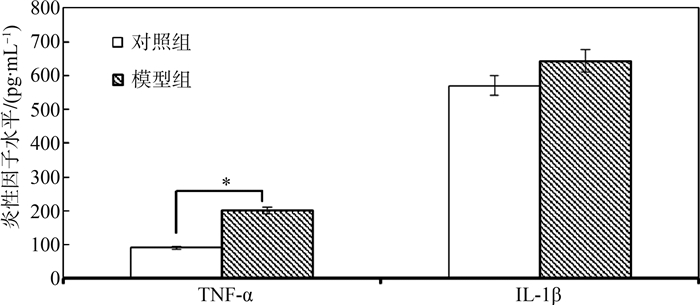
在注射STZ 2周后模型组小鼠血清中TNF-α含量大于对照组,差异有统计学意义(P<0.05),而IL-1β差异无统计学意义(图 2)。
|
|
图 2 2组小鼠血清中炎性因子水平的比较
Fig. 2 Comparison of serum inflammatory factors levels in two mice groups*与对照组比较, P<0.05。
* compared with the control group, P<0.05. |
以对胰岛素敏感性和反应性降低为特征的胰岛素抵抗是2型糖尿病发病的重要环节和基本特征。许多研究表明,高热量饲料喂养和STZ注射是形成2型糖尿病模型的2个重要条件(杜娟等,2001;周敏,柴可夫,2001)。单纯喂养高热量饲料,仅能增加动物体质量及脂肪组织质量,但糖耐量正常;而一次大剂量注射STZ,则易导致动物死亡。本研究在对大鼠等动物造模的经验基础上,采用高脂饲料饲喂C57BL/6J小鼠诱导胰岛素抵抗,然后分次小剂量注射STZ,造成胰岛轻度损伤,胰岛β细胞对糖反应性下降,从而出现空腹血糖升高及脂质代谢紊乱等一系列糖尿病的表现。
研究结果显示摄入高脂饲料的小鼠体质量、空腹血糖均明显大于对照组(P<0.05),这是由于摄入的过多热能而引起体质量升高、脂肪堆积,以及高脂饮食可诱发氧化应激和炎症反应,从而产生胰岛素抵抗,靶组织对胰岛素的敏感性和(或)反应性降低(D and ona et al.2005;郑素玲等,2010)。对于体质量和空腹血糖,不同喂养时间的差异有统计学意义,表明高脂饲料及喂养时间导致了小鼠体质量、空腹血糖的增加。不同喂养时间与不同饲料对体质量的影响存在交互作用。饮食与环境等因子通过调节机体的免疫状态,引起促炎细胞因子水平升高,使机体处于慢性炎症状态,本研究结果也显示模型组小鼠炎性因子TNF-α升高。
糖耐量试验结果显示,小鼠空腹一次性腹腔注射葡萄糖,小鼠的血糖在短时间内迅速升高,于30~60 min达到最高浓度,对照组180 min后降至空腹水平;而模型组小鼠由于胰岛素抵抗及胰岛功能受损,外周血糖不能及时降至正常水平,但在240 min后血糖水平仍然可以恢复至空腹水平,表明小鼠胰岛细胞未完全受损,为2型糖尿病模型而非1型糖尿病模型。在第6周STZ注射后模型组体质量未见增加,而血糖升高,也表明了STZ注射后引发了小鼠糖尿病的症状和表现。并且随着小鼠体质量的增加,2型糖尿病的成模率提高。
本研究通过高脂饮食诱导易发肥胖的C57BL/6J 小鼠系统炎症及胰岛素抵抗,再分次注射小剂量STZ,成功复制了小鼠2型糖尿病模型,其过程模拟了人类2型糖尿病的发病过程(杨架林等,2003;赵维刚,朱惠娟,2010)。
| 杜娟, 柯亭羽, 彭嘉睿, 等. 2014. 大鼠2型糖尿病模型制备方法探讨[J]. 昆明医科大学学报, 35(9): 13-16. |
| 燕娟, 郭巍伟, 梁执群, 等. 2009. 2型糖尿病大鼠模型的建立及其验证[J]. 临床和实验医学杂志, 8(4): 5-6. |
| 杨架林, 李果, 刘优萍, 等. 2003. 长期高脂饮食加小剂量链脲佐霉素建立人类普通2型糖尿病大鼠模型的研究[J]. 中国实验动物学报, 11(3): 138-141. |
| 赵维刚, 朱惠娟. 2010. 肥胖致胰岛素抵抗和高血糖的机制、治疗及测评[J]. 中国医学科学院学报, 32(1): 7-12. |
| 郑素玲, 陈超, 武炜, 等. 2010. 链脲佐菌素诱导小鼠Ⅱ型糖尿病模型的研究[J]. 动物医学进展, 31(7): 60-63. |
| 周敏, 柴可夫. 2001. 实验性2型糖尿病动物模型研究及其进展[J]. 浙江中医学院学报, 25(5): 79-81. |
| Dandona P, Aljada A, Chaudhuri A, et al. 2005. Metabolic syndrome: a comprehensive perspective based on interactions between obesity, diabetes, and inflammation[J]. Circulation, 111(11): 1448-1454. |
| Flynn MA, McNeil DA, Maloff B, et al. 2006. Reducing obesity and related chronic disease risk in children and youth: a synthesis of evidence with 'best practice' recommendations[J]. Obes Rev, 7: 57-66. |
| Lobstein T. 2006. Preventing child obesity-an art and a science[J]. Obes Rev, 7: 1-5. |
| van der Heijden RA, Sheedfar F, Morrison MC, et al. 2015. High-fat diet induced obesity primes inflammation in adipose tissue prior to liver in C57BL/6j mice[J]. Aging (Albany NY), 7(4): 256-268. |
 2016, Vol. 35
2016, Vol. 35




