扩展功能
文章信息
- 郭阳阳, 谢敏, 钟小婷, 张卫红
- GUO Yangyang, XIE Min, ZHONG Xiaoting, ZHANG Weihong
- 陆生贝类齿舌、颚片电镜样品的制备方法
- Radula and Jaw Preparation of Terrestrial Molluscan for Scaning Electron Microscopy
- 四川动物, 2015, 34(5): 725-728
- Sichuan Journal of Zoology, 2015, 34(5): 725-728
- 10.11984/j.issn.1000-7083.20150096
-
文章历史
- 收稿日期:2015-03-17
- 接受日期:2015-05-08
齿舌、颚片位于陆生贝类口球内,是陆生贝类的取食器官。不同种陆生贝类齿舌带上齿的数目、大小、形态和排列方式有较大差异,同一种类则比较稳定,因而齿舌常作为软体动物重要的分类依据之一(张玺,齐钟彦,1961;蔡英亚等,1995;欧阳珊等,2001)。陆生贝类颚片为几丁质,是由外皮厚化而成,通常平滑或呈鳞状,边缘锐利,有时具齿,不同种间有差异,也是分类的特征之一。目前研究齿舌、颚片多用扫描电镜的方法,克服了光学显微镜放大倍数有限,难以观察清楚各类齿的细微结构的不足,扫描电镜能得到清晰的立体照片。正确掌握陆生贝类齿舌、颚片电镜样品制备方法,是研究贝类科属种之间系统演化过程中亲缘关系(李进寿等,2004),揭示种内、种间一定差异关系及地理分化规律的重要手段。笔者参考相关文献,结合自己的实验经验,以采自新疆乌鲁木齐南山伞形琥珀螺Succinea daucina为例,介绍了陆生贝类齿舌、颚片电镜样品的制备方法。 1 材料 1.1 标本(图 1:A)
伞形琥珀螺Succinea daucina Pfeiffer,1854,采自乌鲁木齐南山西白杨沟山体岩石壁上,43°24.674′N,87°08.620′E,2012年8月26日,采集人,张卫红。标本处理参考陈德牛和高家祥(1981)的方法,保存于75%乙醇溶液中。标本贝壳壳高10~12 mm,壳宽6~8 mm,壳质薄而透明,易碎,壳面淡黄色或黄褐色,光滑,有光泽,并有细致的生长线,有314个螺层。 1.2 试剂、材料及用品
剪刀,尖头镊,解剖针,小刷,蜡盘,毛细滴管,烧杯,培养皿,盖玻片,载玻片,滤纸,NaOH,75%乙醇,蒸馏水,显微镜(Olympus BHC),解剖镜(Olympus SZ2-1LST),扫描电镜(LEO 1430VP),KQ-250DE型数控超声波清洗器。 2 扫描电镜样品制备过程 2.1 去壳
根据陆生贝类大小及陆生贝类软体与贝壳连接紧密程度的不同,去壳方法可分为2种。 2.1.1 中等及大型陆生贝类的去壳方法
贝壳大小在3 mm以上,可以手持操作的蜗牛根据软体和贝壳连接紧密程度不同,分2种情况:软体和贝壳之间连接紧密的陆生贝类去壳方法参见张卫红等(2010)。软体和贝壳之间连接不紧密的种类,如琥珀螺,可使蜗牛壳口朝着自己,右手持尖头镊伸进壳口,夹紧软体腹足部,逆着陆生贝类螺旋的方向轻轻地往外转着拉,边拉边转,并使镊子更多地往壳里伸,夹住更多的软体,防止螺旋部两性腺断在壳顶,小心将软体取出,保留贝壳的完整性以作贝壳形态学的研究。 2.1.2 微小陆生贝类的去壳方法
贝壳大小在3 mm以下、无法手持操作的陆生贝类,可采用酸溶解贝壳的方法,将蜗牛整体放入装有2%~5%HCl溶液的小培养皿中,控制好酸的浓度和溶解时间,融掉贝壳的钙质部分(Daniel et al., 2007),用镊子将存留贝壳的角质膜撕开,取出软体。 郭阳阳等:陆生贝类齿舌、颚片电镜样品的制备方法 2.2 取口球
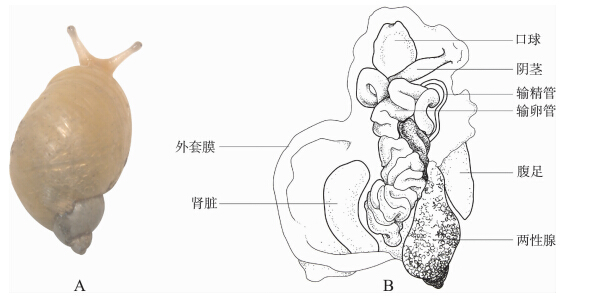
将陆生贝类软体背部朝上置于蜡盘中,加水浸没,在体视显微镜下解剖,解剖方法见张卫红等(2010)。沿头部正中从后向前用剪刀小心剪开头部体壁或两手持尖头镊小心撕开头部体壁,分离两侧体壁,暴露口球。口球位于陆生贝类头部,紧接口后,膨大呈球状,后接食道(图 1:B)。用镊子或剪刀取下口球放入装有适量水的小培养皿中。软体其余部分可放入有对应编号的装有75%或95%乙醇溶液的EP管中保存,以便做其他研究。
|
|
图 1 伞形琥珀螺
Fig. 1 Succinea daucina Pfeiffer,1854
A. 活体,B. 解剖图示口球。 A. Live specimen,B. Anatomy drawing showing buccal. |
将装有口球的培养皿放在体视显微镜下操作。颚片在口球的前方近腹面,有时部分漏出口外,几丁质,一般颜色较深,略微撕开口球,用镊子轻轻地取下。齿舌位于口腔底部,呈带状,角质,透明,不易分辨,尤其是微小陆生贝类,需要仔细辨认。在解剖镜下操作,用尖头镊子将口球轻轻地撕开,注意观察,尽量去掉齿舌周围肌肉纤维组织,保留齿舌的完整性。将附有残留肌肉及结缔组织的齿舌、颚片放入装有5%~40%NaOH或KOH溶液的小培养皿中,消化掉齿舌、颚片上粘连的肌肉组织(Daniel et al., 2007)。NaOH的具体用量和消化时间根据陆生贝类大小不同灵活掌握。可用加温的方式(30℃~50 ℃)加快消化速度。在消化的过程中,随时在体视解剖镜下观察,避免消化过度。待组织腐蚀后,用镊子或解剖针小心将齿舌、颚片转入装有蒸馏水的洁净的小培养皿中。 2.4 齿舌、颚片的清洗
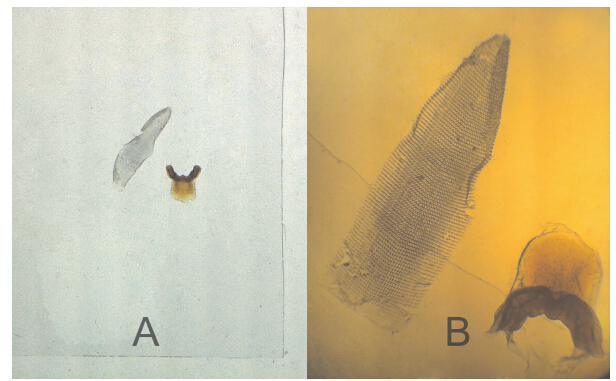
在解剖镜下用镊子、解剖针或小刷小心去掉消化后残留在齿舌颚片上的肌肉组织、膜及粘连的杂质。一遍清洗完成后将齿舌、颚片转入另外洁净小培养皿中进行第二次清洗。一般清洗多遍,直到洗干净为止。注意齿舌外覆盖有一层薄膜,一定要小心去掉。对于小型陆生贝类在齿舌清洗转移的过程中一定要在解剖镜下仔细操作,避免齿舌破坏或丢失。如果清洗结果不理想,且齿舌卷曲程度较大,不利于后续实验操作,可利用超声波清洗器进行进一步的清洗。清洗的时间、功率及温度可根据实际情况灵活掌握。 2.5 齿舌、颚片样品的制片(图 2)
取一洁净的盖玻片夹在4片载玻片中间,将盖玻片掰为2片,用同样的方法,分别再把掰开的2片盖玻片掰为2个小片。取一小片盖玻片放在一小的培养皿中(或放在一载玻片上)置于解剖镜下,用毛细滴管滴一滴蒸馏水于盖玻片上,用尖头镊或解剖针将清洗干净的齿舌移到盖玻片上的水滴中,用尖头镊或解剖针整理齿舌,使其齿面向上,展平于盖玻片上水滴中,用镊子或解剖针压住齿舌一端将齿舌拖出水滴,拖出水滴的齿舌很快干燥并紧贴于盖玻片上。分辨齿舌的齿面很重要,需要在解剖镜下认真辨认,对于微小贝类的齿舌,可以在显微镜下操作。齿舌一般会向反齿面有不同程度的弯曲,对于弯曲程度较大不易展平的齿舌,可以用镊尖轻轻地将齿舌边缘划破,或将齿舌分为两至多片,这样不仅能使齿舌更好地贴于盖玻片上,还能更好地显示齿舌的细微结构。
|
|
图 2 盖玻片上的齿舌、颚片样品
Fig. 2 Radula and jaw samples on a piece of coverslip
A. 解剖镜下齿舌、颚片样品,B. 显微镜下齿舌、颚片样品。 A. Radula and jaw under stereomicroscope,B. Radula and jaw under light microscope. |
质地较薄的颚片,清洗干净后可直接移到盖玻片上,自然干燥后会紧贴于盖玻片上。质地较厚用上述方法不易贴牢在盖玻片上的颚片,待其自然干燥后,可用一小片导电双面胶将其贴在盖玻片上。有厣陆生贝类,厣的电镜样品的制备方法与颚片电镜样品的制备方法相同。 2.6 样品的镀金及扫描
将制备好载有齿舌、颚片的盖玻片自然充分干燥,然后用导电胶将盖玻片贴在样品台上。放在镀膜机的真空罩内,喷镀一层金属膜,镀膜后,即可放在扫描电镜下观察,拍照。镀膜后的齿舌、颚片样品可长期保存。 3 实验结果(图 3)
齿舌角质,长形带状。共有齿88~95列,齿式为:16-21:10-13:1:10-13:16-21。中央齿3锥型,中锥两侧各有一个小的外锥;侧齿双锥型;缘齿双锥型,靠近齿舌带边缘外锥分裂为2~3个小齿。

|
|
图 3 齿舌、颚片扫描电镜照片
Fig. 3 SEM images of radula and jaw
A. 部分齿舌带外形,B. 中央齿和侧齿,C. 侧齿,D. 侧齿和边缘齿,E. 颚片; CT. 中央齿,LT. 侧齿,MT. 缘齿。 A. Part of a radula,B. Central teeth and lateral teeth,C. Lateral teeth,D. Lateral teeth and marginal teeth,E. Jaw; CT. Central teeth,LT. Lateral teeth,MT. Marginal teeth. |
颚片琥珀色,宽略稍大于高。切片末端方形;前缘深凹,具3个突起,中央突起明显;后缘圆形。基板圆形。
| 蔡英亚, 张英, 魏若飞. 1995. 贝类学概论(第二版)[M]. 上海:上海科学技术出版社:68-72. |
| 陈德牛, 高家祥. 1981. 陆生贝类标本的采集、保存及外生殖器、齿舌、颚片的制作方法[J]. 生物学通报, (6):58-59. |
| 李进寿, 周时强, 柯才焕. 2004. 福建沿海多板类齿舌形态的比较研究[J]. 厦门大学学报, 43(4):581-583. |
| 欧阳珊, 吴小平, 舒风月. 2001. 小型腹足类齿舌的扫描电镜观察[J]. 动物学杂志, 36(5):2-4. |
| 张卫红, 刘爱玲, 陈少丹, 等. 2010. 蜗牛的解剖[J]. 生物学通报, 45(3):45-46. |
| 张玺, 齐钟彦. 1961. 贝类学纲要[M]. 北京:科学出版社:56-57. |
| Daniel LG, Bruce AM, Winston FP, et al. 2007. Techniques for collecting, handling, preparing, storing and examining small molluscan specimens[J]. Molluscan Research, 27(1):1-50." |
 2015, Vol. 34(5)
2015, Vol. 34(5)




