扩展功能
文章信息
- 孙晓煜, 唐业忠, 陈勤
- SUN Xiaoyu, TANG Yezhong, CHEN Qin
- 短尾蝮蛇异氟烷气体麻醉方法介绍
- Description of Inhalant Anesthesia in Gloydius brevicaudus
- 四川动物, 2015, 34(5): 701-706
- Sichuan Journal of Zoology, 2015, 34(5): 701-706
- 10.11984/j.issn.1000-7083.20150112
-
文章历史
- 收稿日期:2015-03-25
- 接受日期:2015-05-08
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
蛇类作为爬行纲动物的重要组成部分,一直以来便是广大学者关注的对象,从系统学到生态学,从行为学到生理学,已有的研究涉及到了动物学研究的大多数领域(Ding et al., 2011;Geng et al., 2011;Chen et al., 2012)。动物学研究中的某些环节,如外科手术,常常需要对研究对象进行麻醉。但是,目前在实践中尚未有关于蛇类的标准麻醉方案。
作为一种技术手段,麻醉本身并不提供任何的治疗作用,而是让其他医学干预得以实施。两栖爬行动物通常采用的方法有浸泡鱼安定溶液(MS-222)或注射戊巴比妥钠溶液(Zhang et al., 2012;Fang et al., 2014)等方法。但蛇类由于体表被鳞片和蜡质结构,并不适用于上述第一种麻醉方式。注射戊巴比妥钠溶液的方法对于标准实验动物(如大鼠)有较稳定的麻醉效果,麻醉时间和深度易于控制,成功率高且死亡率低。但长期的实践证明,对蛇类这样的非标准实验动物,其注射量、注射部位都难以把握,容易导致过度麻醉致死,通常多用于不需要被麻醉的动物苏醒恢复的实验操作中,如免疫组织化学中的灌流处理以及安乐死(Zwart et al., 1989;de Moraisa et al., 2013)。
吸入麻醉是指气态或挥发性液态的麻醉药物经呼吸道吸入,在肺泡中被吸收入血液循环,到达神经中枢,使中枢神经系统产生麻醉效应(熊惠军,2005)。吸入式麻醉易于控制麻醉程度,维持麻醉相对容易,切断气体药物的摄入实验动物苏醒所需要的时间短(Tshukamato et al., 2015)。不管是人类临床治疗还是动物实验研究,吸入式麻醉都有广泛应用(左明章等,2005;Richardson & Flecknell,2005;Tshukamato et al., 2015)。基于吸入式气体麻醉的特点,本文介绍一种适用于蛇类的异氟烷麻醉方法,为其他研究工作提供参考。 孙晓煜等:短尾蝮蛇异氟烷气体麻醉方法介绍 1 材料与方法 1.1 实验动物
蝰科蝮亚科蛇类Crotalinae具有自然界特有的红外感知成像能力,它们能够在夜晚或洞穴等无光条件下对温血动物进行识别、定位以完成捕食行为(de Cock Buning,1983;Chen et al., 2012)。其红外感知系统的工作原理,是目前神经科学与仿生学研究的热点(Bakken & Kcochmal,2007;Bakken et al., 2012;Kohl et al., 2014)。本实验选用蝮亚科蛇类作为麻醉方法实验对象,可以为生物红外感知的相关研究起到直接的技术支持。
短尾蝮Gloydius brevicaudus (Stejneger,1907)是我国分布较为广泛的蝮亚科蛇类,目前对该类群已有较为全面的系统学研究(Ding et al., 2011)。相较于其他蝮亚科蛇类(如原矛头蝮、尖吻蝮),短尾蝮个体小且对人攻击性弱,在研究中的可操作性较好。但同时,短尾蝮蛇也是毒蛇,在饲养和整个实验过程中务必小心谨慎,有条件的情况下购买蝮蛇毒血清备用。本实验选取20号健康短尾蝮蛇样本,其中雌性14号,雄性6号。实验动物均为实验室12 h光照、12 h黑暗环境下长期饲养,每周投喂1只小鼠,水自由取食,饲养方式和环境按照《中国科学院成都生物研究所动物管理规程》执行。 1.2 麻醉药剂和器材
麻醉剂:本实验选用异氟烷(深圳市瑞沃德生命科技有限公司)为麻醉剂,本品具有血液溶解度低,诱导快,可准确调节和控制麻醉深度,麻醉后恢复快,且很少造成心律紊乱,有效抑制大脑血流量,利于颅部手术(李泉等,2002;Niedermeyer et al., 2005)等优点。
医用氧气瓶:成都昕源化工有限公司提供。
麻醉挥发罐:MIDMARK CORPERATION生产的异氟烷专用挥发罐VIP 3000。
预麻醉箱:透明的玻璃密闭箱。
实验温度维持在20 ℃。随机取一条蛇放置在密闭箱内,盖上盖子。蒙上黑布,在暗环境中蛇相对安静。任其自由呼吸,直至蛇出现窒息昏迷,记下该过程经历的时间。为确保蛇是由于麻醉效果而不是缺氧窒息出现昏迷,窒息发生需要的时间必须远远长于预麻醉时间。
小动物呼吸机:上海奥尔科特生物有限公司提供,型号ALC-V8S。
氧气瓶通过导管与麻醉挥发罐的进气孔相连,呼吸机与挥发罐的出气孔连接,呼吸机导出的细的塑料呼吸软管与动物呼吸道联通(图 1)。

|
| 图 1 实验装置连接示意图 Fig. 1 The connection order of experimental device |
预麻醉:取短尾蝮蛇样本No.1置于密闭箱内,注入0.2 mL异氟烷后密闭计时。每隔3 min掀开黑布观察一次,当蛇不再出现翻正反射,翻动密闭箱,直至蛇不再出现任何形式的自主活动,记录预麻醉时间T1,在此过程中蛇可能出现张大嘴的麻醉先兆。
诱导麻醉:预麻醉后期依次打开氧气瓶、麻醉挥发罐,通过调节氧气瓶减压阀与麻醉挥发罐的流量计的维持压力球处于刻度200处,打开异氟烷挥发罐,调至刻度5(即5%的异氟烷挥发等级);打开小动物呼吸机,设置呼吸频率为10次/min,吸呼比为1∶3,潮气量为8.0 mL,并将呼吸管末端放置入水中检测通气是否良好。待预麻醉充分后,做好防护措施,打开密闭箱,取出实验蛇放在实验台上,生理胶布控制蛇头和蛇颈后用镊子撬开蛇口,下颚处的中央管状突起即为气管,插进呼吸管,注意不要使用镊子尖端而用尖端后部操作,以防刺伤蛇的口腔。开始计时用一块黑布盖住蛇头。将密闭箱放在通风处。如果蛇挣扎,注意控制蛇颈部平直,以防塑料呼吸管扎伤蛇的气管。采用夹尾反射检查蛇是否麻醉完全,当不再出现夹尾反射时,计时T2并关闭异氟烷。
苏醒:待诱导麻醉稳定后,关闭麻醉挥发罐,保持氧气瓶和呼吸机开启,直至蛇自主活动或者出现夹尾反射,计时T3。拔出呼吸管,放回养殖箱。
更换实验样本No.2,重复上述操作,直至全部样本完成测试实验。 1.4 数据统计分析
记录数据包括:样本的性别(M/F),体质量(weight),预麻醉时间(T1),诱导麻醉时间(T2),苏醒时间(T3)。
用Excel 2007绘制每个样本的麻醉时间示意图,利用Sigmaplot 12.0(Systat Software,Inc.)检验各组数据的正态分布情况,符合正态分布的数据用Pearson相关性分析,不符合正态分布的数据用Spearman相关性分析。 2 结果
本实验共采用20号短尾蝮样本(雌性14号,雄性6号),体质量在43.1~143.1 g之间。实验中未发生无效麻醉或过度麻醉致死情况,且实验后观察2周均未发现异常状况。
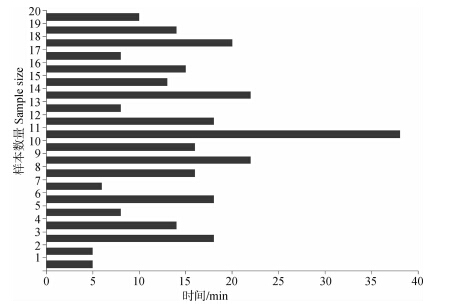
预麻醉时间:所有实验样本中,最短预麻醉T1时间为5 min,最长时间为38 min,平均14.70 min(图 2)。
|
| 图 2 各样本的预麻醉消耗时间T1 Fig. 2 Precursor anesthesia time(T1)of all samples |
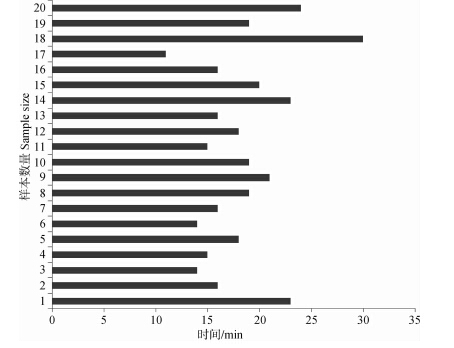
诱导麻醉时间:诱导麻醉时间T2最短为11 min,最长为30 min,平均值18.35 min,长于预麻醉所用时间(图 3)。
|
| 图 3 各样本的诱导麻醉消耗时间T2 Fig. 3 Induction anesthetesia time(T2)of all samples |
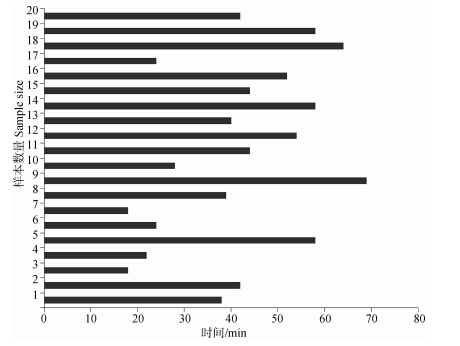
苏醒时间:实验样本用于苏醒的时间T3明显长于T1、T2,最短为18 min,最长为69 min,平均值41.80 min(图 4)。
|
| 图 4 各样本的苏醒消耗时间T3 Fig. 4 Recovery time(T3)of all samples |
相关性分析:进行统计相关分析时,雌性以数字1表示,雄性用数字2表示。经Sigmaplot软件正态性检验,该组数据中体质量、预麻醉时间不符合正态分布。同时使用Pearson相关性检验和Spearman相关性检验(表 1)。
| 相关性/P值 | |||||
| 体质量 | T1 | T2 | T3 | T1+T2 | |
| M/F | -/0.0055** | -/0.1742 | +/0.1522 | +/0.3772 | +/0.0254 |
| 体质量 | +/0.5812 | -/0.5772 | -/0.1192 | -/0.0754 | |
| T1 | +/0.7002 | +/0.1082 | +/0.4642 | ||
| T2 | +/0.0042** | +/0.1632 | |||
| T3 | +/0.0100** | ||||
| 注:M/F.样本的性别,T1.预麻醉时间,T2.诱导麻醉时间,T3.苏醒时间,T1+T2.麻醉需要的总时间;**P≤0.01,相关性极显著。
Notes: M/F. gender,T1. time of preanesthesia,T2. time of anesthesia induction,T3. time of recovery,T1+T2. total time of anethesia; **P≤0.01,indicated extremely significant correlation | |||||
样本的性别与体质量呈负相关。这与雄性个体体积小于雌性个体的自然界普遍现象相符。样本的性别与预麻醉时间T1、诱导麻醉时间T2和苏醒时间T3无显著相关性(P>0.05),但是性别与麻醉需要的总时间(T1+T2)显著正相关(P=0.0254),雄性个体麻醉需要的整体时间长于雌性。虽然苏醒时间T3和预麻醉时间T1没有显著相关性,但是与诱导麻醉时间T2和麻醉整体的时间T1+T2都呈显著正相关,P值分别是0.0042和0.0100,也就是说麻醉需要的时间越长,那么苏醒需要的时间也越长。
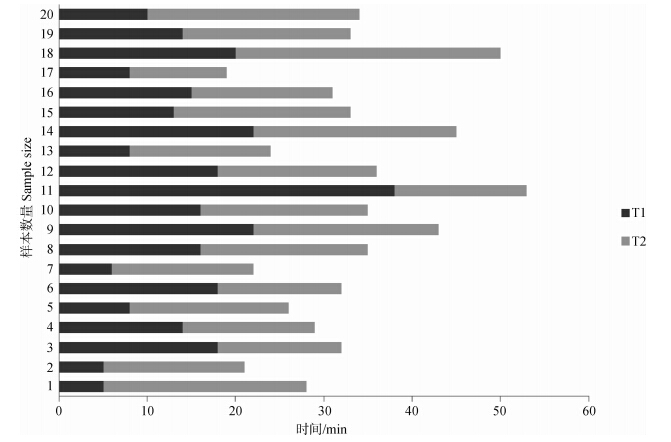
20号样本麻醉所需要的整体时间均在1 h内,平均33.05 min。从图 5可以看出,大多数短尾蝮蛇麻醉的整体时间需要30 min左右就可以达到期望的麻醉状态,从麻醉开始至苏醒,2 h内能够完成。
|
| 图 5 预麻醉T1,诱导麻醉T2时间分布图 Fig. 5 Time distribution of precursor anesthetesia(T1), and induction anesthetesia(T2) |
在进行蛇,尤其是毒蛇的麻醉实验中,经常以翻正反射的有无作为蛇是否进入麻醉状态的表征(Wang et al., 1993;Mader,2006)。作者在实际操作中发现,记录T1的时间段内,翻正反射很快消失,然而此时的蛇取出时发现蛇的肌肉紧绷,放到实验台上几乎立即开始活动,给实验人员的人身安全带来威胁,若强行插管诱导麻醉则会导致剧烈挣扎,容易引起蛇的气管损伤。由此,本实验采取翻动密闭箱,蛇不再出现任何形式的自主活动的时候由密闭箱内取出蛇插管。值得注意的是,即使动物在密闭箱内不再活动,取出后还是可能会出现轻微动作。
同一麻醉药剂对于不同物种的效果是有差异的,在相关蛇生理学研究中,作者对原矛头蝮Protobothrops mucrosquamatus Cantor,1839和双斑锦蛇Elaphe bimaculata Schmidt,1925进行类似麻醉,结果 表明异氟烷对原矛头蝮麻醉效果明显,但对双斑锦蛇的麻醉效果远不如对短尾蝮和原矛头蝮的作用效果,具体表现为预麻醉的时间过长(超过30 min),插管进行诱导麻醉的1 h过后,肌肉依然处于紧绷状态。由此推测,异氟烷对亲缘关系近的物种的麻醉效果类似,而对亲缘疏远的物种麻醉效果差异较大。
由于个体差异、具体操作等因素,在密闭箱中加入异氟烷对蛇类进行预麻醉的时间差异性较大。同一物种对于同一麻醉药剂的反应也存在个体间差异(Blouin-Demers et al., 2000),预麻醉结束时短尾蝮蛇的麻醉程度不同,直接影响诱导麻醉的时间T2。T1+T2更能说明短尾蝮蛇达到可以进行后续手术等操作的麻醉状态所需要的时间(图 5)。实验样本麻醉的整体时间平均需要30 min,对异氟烷耐受性强的个体在1 h内也能麻醉完全,而从麻醉到苏醒需要的时间在2 h内。在进行相关实验操作时,时间安排上不能忽视预留麻醉及苏醒的时间。
使用异氟烷容易引起呼吸抑制(李泉等,2002),机械辅助呼吸必不可少,而机械通气易引发气管及肺部炎症(刘春峰,2010)。因此,在实验过程中需使用消炎药物,如庆大霉素,地塞米松等。同时,呼吸机塑料呼吸管在蛇的气管内会引起异物感,增加气管分泌物,导致阻塞,需要使用阿托品等抑制腺体分泌的药物。利用本文介绍的异氟烷吸入式麻醉方法,在实际工作中,短尾蝮蛇麻醉完全后,可通入3%的异氟烷维持麻醉效果进行其他实验操作。此外,研究者可以类比本实验摸索探究其他蛇类或爬行动物的麻醉方法。
| "李泉, 李大勇, 冉大强, 等. 2002. 异氟烷综述[J]. 山东医药工业, 21(1):31-32. |
| 刘春峰. 2010. 机械通气并发症及处理[J]. 中国实用儿科杂志, 25(2):104-106. |
| 熊惠军. 2005. 中国畜牧兽医学会小动物医学分会成立大会暨学术报告会论文集[C]. |
| 左明章, 李晓琳, 王忠, 等. 2005. 脑电双频指数指导吸入异氟烷对腹部手术老年病人麻醉恢复的影响[J]. 中华麻醉杂志, 25(7):490-492. |
| Bakken GS, Colayori SE, Duong TH. 2012. Analytical methods for the geometric optics of thermal vision illustrated with four species of pitvipers[J]. Journal of Experimental Biology, 215:2621-2629. |
| Bakken GS, Krochmal AR. 2007. The imaging properties and sensitivity of the facial pits of pit vipers as determined by optical and heat-transfer analysis[J]. Journal of Experimental Biology, 210:2801-2810. |
| Blouin-Demers G, Weatherhead PJ, Shilton CM, et al. 2000. Use of inhalant anesthetics in three snake species[J].Contemporary Herpetology, 4:1094-2246. |
| Cantor TE. 1839. Spicilegium serpentium indicorum (part 1)[J]. Proc Zool Soc London, 1839:31-33. |
| Chen Q, Deng HH, Steven E, et al. 2012. Reduced performance of prey targeting in pit vipers with contralaterally occluded infrared and visual sensesc[J]. PLoS ONE, 7(5):e34989. |
| de Cock Buning T. 1983. Thermal sensitivity as a specialization for prey capture and feeding in snakes[J]. Integrative and Comparative Biology, 23(2):363-375. |
| de Moraisa ICO, Torresb AFC, da Silva Pereirac GJ, et al. 2013. Bothrops leucurus venom induces nephrotoxicity in the isolated perfused kidney and cultured renal tubular epithelia[J]. Toxicon, 61:38-46. |
| Ding L, Gan XN, He SP, et al. 2011. A phylogeographic, demographic and historical analysis of the short-tailed pit viper (Gloydius brevicaudus):evidence for early divergence and late expansion during the Pleistocene[J]. Molecular Ecology, 20:1905-1922. |
| Fang GZ, Xue F, Yang P, et al. 2014. Right ear advantage for vocal communication in frogs results from both structural asymmetry and attention modulation[J]. Behavioural Brain Research, 266:77-84. |
| Geng J, Liang D, Jiang K, et al. 2011. Molecular evolution of the infrared sensory gene TRPA1 in snakes and implications for functional studies[J]. PLoS ONE, 6(12):e28644. |
| Kohl T, Bothe MS, Luksch H, et al. 2014.Organotopic organization of the primary Infrared Sensitive Nucleus (LTTD) in the western diamondback rattlesnake (Crotalus atrox)[J]. Journal of Comparative Neurology, 522(18):23685. |
| Mader DR. 2006. Reptile Medicine and Surgery (2nd edition)[M]. Canada:Elsevier Inc. |
| Niedermeyer E, Silva FH, Lopes da. 2005. Electroencephalography:Basic Principles, Clinical Applications, and Related Fields (5th edition)[M]. Philadelphia:Lippincott Williams & Wilkins:1156 |
| Richardson CA, Flecknell PA. 2005. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents:are we making progress?[J]. Altern Lab Animals, 33:119-127. |
| Schmidt KP. 1925. New Chinese amphibians and reptiles[J]. American Museum Novitates, 175:1-3. |
| Stejneger LH. 1907. Herpetology of Japan and adjacent territory[J]. Bull US Natl Mus, 58:1-577. |
| Tsukamoto A, Iimuro M, Sato R, et al. 2015. Effect of midazolam and butorphanol premedication on inhalant isoflurane anesthesia in mice[J]. Experimental Animals, 64(2):139-145. |
| Wang T, Fernandes W, Abe AS. 1993. Blood pH and O2 homeostasis upon CO2 anesthesia in the rattlesnake (Crotalus durissus)[J]. Snake, 25:21-26. |
| Zhang D, Cui J, Tang YZ. 2012. Plasticity of peripheral auditory frequency sensitivity in Emei music frog[J]. PLoS ONE, 7(9):e45792. |
| Zwart P, de Vries HR, Cooper JE. 1989. The humane killing of fishes, amphibia, reptiles and birds[J]. Tijdschr Diergeneeskd, 114(10):557-565." |
 2015, Vol. 34(5)
2015, Vol. 34(5)




