扩展功能
文章信息
- 龚声辉, 傅丽容, 张海会, 张瑞红, 刘明娜, 史海涛
- GONG Shenghui, FU Lirong, ZHANG Haihui, ZHANG Ruihong, LIU Mingna, SHI Haitao
- 磷氧氮丙啶不育剂对雄性红耳龟生殖毒性研究
- Reproductive Toxicity Research of MAPO on Male Trachemys scripta elegans
- 四川动物, 2015, 34(5): 677-682
- Sichuan Journal of Zoology, 2015, 34(5): 677-682
- 10.11984/j.issn.1000-7083.20150072
-
文章历史
- 收稿日期:2015-03-04
- 接受日期:2015-05-08
2. 中国科学院成都生物研究所, 成都 610041
2. Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China
红耳龟Trachemys scripta elegans,又名巴西龟、红耳彩龟等,隶属龟科Emydidae纹龟属Trachemys,为纹龟T. scripta一亚种,原产于密西西比河流域,分布在美国的伊利诺斯州至墨西哥海湾(Semenov,2010),被世界自然保护联盟(IUCN)列为全球100种最危险的外来物种之一(ISSG/SSC,2001),现已成功入侵欧洲、非洲、大洋洲、亚洲、南美洲及美国原产地以外的美洲(Newberry,1984;O’Keeffe,2005)。1987年经中国香港引入中国内陆(谢忠明,1999;Shi et al., 2008)。2005年海南、江苏、浙江、湖南和广东5省红耳龟的繁殖量约有2500万只(徐婧等,2006),并销售到国内外各市场。如此庞大的养殖规模,运输和管理过程中疏漏导致的逃逸现象在所难免,而更为严重的是红耳龟成为大多数人选择放生的对象。由于宠物丢弃、宗教放生、养殖逃逸,甚至执法人员误把红耳龟当成保护物种放生等各种因素,导致红耳龟在我国野外广泛存在(史海涛等,2009)。已在我国22个省市的104个地点发现有野外分布,覆盖面积约300万km2(刘丹等,2011),并发现红耳龟在我国野外成功繁殖(李闯,2013;周鹏,2013),对我国自然生态系统将产生严重的影响。令人担忧的是到目前为止这种状况不但没有改观,还有发展的趋势。
国内外十分重视红耳龟的危害与防治,但缺乏有效的办法。目前更多的是专家们的呼吁,建议政府相关部门制定针对外来物种红耳龟的进口、养殖和放生活动管理的相关法规、政策及提高公众意识(Cadi et al., 2004;史海涛等,2009;刘丹等,2011)。目前,对该物种有效防治方法的研究未见报道,因此,对其防治方法的探究十分必要。
不育防治即利用某种方法或技术使雌性或(和)雄性不能繁殖,甚至使幼体生长发育障碍,从而降低种群出生率,控制其种群数量和密度,其实质是生育率控制(birth control)(张知彬,1995),纠正了“不育处理不如一次毒杀效果显著”的错误认识。目前对有害生物不育控制涉及到的不育剂有:雄性不育剂、雌性不育剂和两性不育剂,其中Epibloc和Glyzophro已经商品化,在美国、澳大利亚等国家广泛用于野鼠的控制(朱靖,张知彬,1988)。通过查阅不育剂相关资料,依据其作用机理及效果,我们初步筛选出2种可直接损坏小鼠睾丸生殖细胞,引起永久性不育的雄性不育剂:磷氧氮丙啶[Tris(2-methyl-1-aziridinyl)phosphine oxide,MAPO]和更昔洛韦(GCV)。采用这2种药物对雄性红耳龟进行的预实验表明,MAPO可造成雄性红耳龟不育。MAPO是一种烷化剂,具有直接和间接致突变作用,可造成雄鼠睾丸萎缩,精子发生障碍,引起不育(Epstein et al., 1970;王治乔等,1983),染毒剂量≥10 mg·L-1的成年雄性小鼠经口染毒60 d,与正常雌鼠交配后,其生育率为0%(王爱平等,1992),进一步研究表明MAPO对小鼠的精子发生和释放产生显著而不可逆的影响(刘巍,2006)。
为此,我们提出将不育技术应用于外来物种红耳龟的防治,通过对养殖场出售的红耳龟个体进行售前的不育处理,将有效阻止逃逸、放生个体参与野外种群的繁殖,并可能干预野外可育个体的繁殖,从而起到有效控制该物种在野外迅速蔓延的态势,以期能降低红耳龟对入侵地生态环境的危害。本实验采用MAPO不育剂腹腔注射雄性红耳龟的方法,研究MAPO影响其生殖功能的有效性,探寻红耳龟的防治新途径,为红耳龟的防治提供科学依据。 龚声辉等:磷氧氮丙啶不育剂对雄性红耳龟生殖毒性研究 1 材料与方法 1.1 材料
MAPO(生产批号SY201309)购自广州市齐云生物技术有限公司。实验雄性红耳龟购自海口市东山养殖场,置于长160 cm、宽105 cm、高65 cm的塑料水缸中露天饲养(24只/m2),采用逐步投喂法,饲喂浮性甲鱼配合饲料(文昌琼文歌颂饲料厂),每周喂食2次。试验处理前检疫15 d,及时剔除背、腹甲有缺损、四肢及头部有咬伤或病弱呆滞个体,保留体征完整、取食正常、行为活泼及躲避惊吓敏捷的健康个体进行实验。 1.2 方法 1.2.1 平均摄食量
选取健康的雄性红耳龟成体(BW: 738.9 g±101.2 g,n=160),采用Excel随机分为4个组,每组40只。采用腹腔注射法,每隔2 d注射一次,低、中、高剂量组每次分别注射2 mL浓度为0.1 g·L-1、3 g·L-1、10 g·L-1的MAPO,对照组则注射同等剂量的0.65%生理盐水,处理15 d。期间,每组称取400 g颗粒饲料,采用逐步投喂法,渐食渐投,投喂时程1.5 h,确保满足每只个体摄食,记录每组剩余饲料量,计算平均摄食量。
平均摄食量=(食物总量-剩余量)/n。 1.2.2 睾丸脏器系数及体积
第16天,每组随机选取6只个体,称重,经海南省生态环境教育中心动物伦理委员会批准,-20 ℃冷冻麻醉60~80 min后,解剖摘取两侧睾丸,剔除附着的结缔组织,用4 ℃预冷生理盐水冲洗后,用滤纸吸干睾丸表面水分,称重,测量睾丸的前后宽、左右宽及厚度,计算睾丸脏器系数及体积。
脏器系数=100×脏器质量/体质量,
睾丸体积V=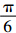 abc(a:前后宽,b:左右宽,c:厚度)。
1.2.3 睾丸组织病理学观察
abc(a:前后宽,b:左右宽,c:厚度)。
1.2.3 睾丸组织病理学观察
摘取红耳龟右侧睾丸,Bouin液固定,石蜡组织切片法,制备睾丸组织切片,镜检(MOTIC BA310-T),显微摄影。每颗睾丸采用Motic Images Advanced 3.2软件随机测量15个曲细精管管径、生精上皮厚度、曲细精管管腔直径,计算平均值(Mean±SE)。 1.2.4 血清睾酮及睾丸睾酮含量测定
血清制备:实验龟低温冷冻麻醉60~80 min,心脏取血10 mL,4 ℃ 3500 r/min离心10 min,取血清置于-80 ℃保存待检。
睾丸匀浆液:摘取左侧睾丸,剔除脂肪,4 ℃预冷生理盐水冲洗,吸干表面水分,-20 ℃冰箱保存。按磷酸盐缓冲液∶组织=9∶1比例组织匀浆,4 ℃ 3500 r/min离心10 min,所得上清液进行分装,-80 ℃保存待检。采用ELISA试剂盒(北京冬歌博业生物科技有限公司生产)检测血清及睾丸组织中睾酮含量。 2 数据处理
采用F检验或Bartletts检验各组方差齐性,ANOVA分析各组数据间有无显著差异,如果各组数据间存在显著差异,进一步采用Dunnett’s检验来进行比较,从而确定与对照组有统计学差异的实验组,上述数据分析应用Excel 2003和SPSS 16.0进行统计,设置差异有统计学意义的临界值α=0.05,差异有高度统计学意义临界值为α=0.01。 3 结果与分析 3.1 MAPO对红耳龟平均摄食量的影响
试验期间观察红耳龟行为特征,发现低、中剂量组红耳龟均行动自如,躲避敏捷,摄食正常,平均摄食量统计与对照组基本一致,差异无统计学意义(P>0.05)(图 1),高剂量组从注射药物第7天起,平均摄食量开始下降,显著低于对照组(P<0.01)。表明10 g/L MAPO对红耳龟有伤害,直接影响其摄食量。在15 d的染毒期,各处理组未发现个体死亡,第16天~第31天高剂量组实验龟表现行动缓慢,常浮于水面,反应迟钝,相继有个体死亡,第31天全部死亡。说明低、中剂量组红耳龟均能正常摄食,健康活泼,而高剂量MAPO不仅影响成体雄性红耳龟摄食,且具有致死效应。

|
| 图 1 MAPO对红耳龟平均摄食量的影响 Fig. 1 Influence of MAPO on the average food consumption |
经检测,同一个体两侧睾丸质量及大小相近,无明显差异。MAPO不同浓度处理,对红耳龟睾丸体积及脏器系数的影响不一(表 1),低剂量组睾丸体积及脏器系数变化不明显,与对照组的差异无统计学意义(P>0.05),中剂量组与高剂量组明显减小(P<0.05),约为对照的1/2。说明MAPO浓度为3 g·L-1及以上可影响红耳龟睾丸形态大小,即中剂量(3 g·L-1)、高剂量(10 g·L-1)引起红耳龟睾丸萎缩,体积、质量均减小。
|
对照组
Control group |
低剂量组
Low dose group |
中剂量组
Middle dose group |
高剂量组
High dose group | |
| 睾丸体积
Testicular volume/mL | 4.22±0.73 | 4.63±0.52 | 1.83±0.18* | 2.01±0.54* |
| 睾丸脏器系数
Testis coefficient/% | 0.15±0.07 | 0.17±0.07 | 0.06±0.02* | 0.08±0.03* |
| 注:同行数据间,*表示与对照组比较差异显著(P<0.05),**表示与对照组比较差异极显著(P<0.01);下表同。
Note: In the same row,* means significant difference compared with control group(P<0.05),** means extremely significant difference compared with control group(P<0.01); the same below. | ||||
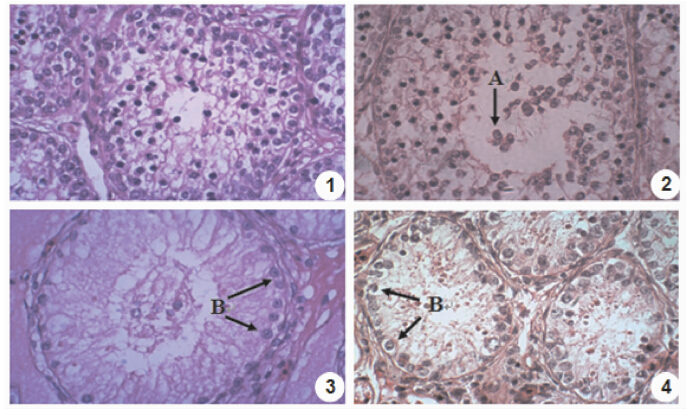
组织学观察睾丸结构(图版Ⅰ),并采用Motic Images Advanced 3.2软件测量各组曲细精管管径、生精上皮厚度、曲细精管管腔直径(表 2),结果显示:对照组曲细精管(图版Ⅰ:1)外观粗而饱满,管径为(151.77±9.97)μm,各级生精细胞充满曲细
精管,由外向内依次可见精原细胞、初级精母细胞、次级精母细胞,且排列规则整齐,发育良好,生精上皮高度为(80.46±6.87)μm,管腔较小,管腔直径为(18.52±3.39)μm;低剂量组曲细精管(图版Ⅰ:2),生精上皮排列松散,次级精母细胞及精子细胞脱落进入管腔,管腔直径增大为(56.98±7.75)μm,约为对照组的3倍,差异有统计学意义(P<0.05),精管间隙略增大,间质细胞发育良好;中剂量组与高剂量组(图版Ⅰ:3、4)生殖细胞层数减少变薄,几乎全部退化,生精上皮厚度分别为(9.67±8.67)μm和(4.30±2.29)μm,约为对照组的1/10和1/20,且差异有高度统计学意义(P<0.01),仅见支持细胞靠近基底膜(图版Ⅰ:B),偶见精原细胞,但已有脱落迹象,曲细精管间空隙增大,间质细胞发育良好,偶见集群增生。
| 对照组
Control group |
低剂量组
Low dose group |
中剂量组
Middle dose group |
高剂量组
High dose group | |
| 曲细精管管径
Pipe diameter/μm | 151.77±9.97 | 171.55±35.60 | 129.78±12.36 | 101.80±7.24 |
| 生精上皮厚度
Thickness/μm | 80.46±6.87 | 71.60±21.61 | 9.67±8.67** | 4.30±2.29** |
| 精细管管腔直径
Limen diameter/μm | 18.52±3.39 | 56.98±7.75* | 55.35±9.50 | 35.94±2.20 |
|
| 图版Ⅰ MAPO对红耳龟睾丸组织结构的影响(HE,×400) Plate Ⅰ Effect of MAPO on red-eared slider of testis(HE,×400) 1. 对照组睾丸,示曲细精管饱满,充盈各级生殖细胞; 2. 低剂量组睾丸,管腔增大,部分次级精母细胞脱落(A); 3. 中剂量组曲细精管; 4. 高剂量组曲细精管,仅一层支持细胞贴近基底膜(B)。 1. Testis of control group,seminiferous tubules are satiation and full of germ cells at various levels; 2. Testis of low-dose group,lumen increase,a part of the secondary spermatocyte fall off(A); 3. Testis of middle dose group; 4. Testis of high dose group,only a layer of sustentacular cells close to the basement membrane(B). |
检测结果表明,红耳龟不同部位睾酮含量不同,睾丸睾酮含量均略高于血清睾酮。注射不同浓度MAPO,睾丸睾酮均略高于对照组,但无统计学意义,血清睾酮变化不明显,与对照组相比基本持平(表 3)。说明MAPO不育剂对睾丸间质细胞无毒害效应,相反,对睾丸间质细胞增生、睾酮的合成有一定的促进作用。
|
对照组
Control group |
低剂量组
Low dose group |
中剂量组
Middle dose group |
高剂量组
High dose group | |
| 睾丸睾酮
Testis testosterone/(pg·mL-1) | 178.30±10.46 | 186.84±8.055 | 185.69±14.17 | 182.61±8.86 |
| 血清睾酮
Serum testosterone/(pg·mL-1) | 151.06±13.26 | 150.29±14.22 | 145.48±14.97 | 157.98±12.06 |
动物摄食量是一个重要且比较敏感、客观的指标,反映了药物对于实验动物健康状况的影响。结 果表明,低、中剂量组红耳龟平均摄食量与对照组基本一致,经一般体征观察,低、中剂量组健康活泼、行为敏捷,表明在不高于中剂量组(3 g·L-1,15 d)处理剂量下,经腹腔注射未对雄性红耳龟的正常能量摄取及生长产生影响,而高剂量组平均摄食量有所降低,且相继有个体死亡。许小珊等(1984)研究MAPO对小鼠作用的病理观察中亦有死亡个体,可能与MAPO的累积毒性,肝脏的灶性坏死有关。此外,本实验高剂量组(10 g·L-1,15 d)药物浓度设置可能略高或处理时间略长,导致高剂量组个体均死亡,其最大耐受剂量(LD0)有待进一步研究。
动物脏器的质量及形态是衡量动物健康与否的重要指标(田永路等,2009),其脏器系数可近似反映该脏器的功能状态和病变情况(陈贤均,赵红刚,2005)。睾丸是合成雄激素的主要部位和精子发生的唯一器官,其大部分体积为曲细精管,因此通过睾丸容积大小的测定及脏器系数可推测睾丸的生精功能,可旁证病理组织学改变的可能性。MAPO对红耳龟睾丸体积及脏器系数的影响表明,MAPO对红耳龟睾丸具有毒理效应,且呈现剂量-效应关系。对睾丸进行组织病理学观察发现,MAPO对红耳龟睾丸具有明显的破坏作用,低剂量组部分次级精母细胞脱落进入管腔,管间间隙略增大;中、高剂量组曲细精管萎缩,管径变小,生精上皮退化,管腔增大,仅见一层支持细胞贴近基底膜,曲细精管间空隙增大,间质细胞集群增生,与王爱平等(1992)、刘巍(2006)关于MAPO对小鼠生殖毒性的研究结果一致。廖明阳等(1998)的研究表明,MAPO诱发HGPRT基因位点突变的分子机理主要是由于基因缺失或重排,生殖细胞对MAPO毒性作用比较敏感,推测MAPO能穿过血-睾屏障,对其生殖细胞具有诱变性,其诱变作用可以直接造成各级生精细胞数量减少甚至全部退化,导致不育。睾酮主要由睾丸间质细胞合成分泌,与精子发生、雄性生殖器官发育分化、性功能及性行为等有关。本实验结果显示MAPO处理组与对照组睾丸睾酮及血清睾酮含量基本相同,表明MAPO对睾丸间质细胞无毒害作用,推测不育个体仍表现正常性行为。
红耳龟作为一种经济物种引入我国,由于对该物种缺乏科学、严格的风险-效益评价管理与监控,红耳龟已在我国自然环境广泛分布,并能在野外成功繁殖。探寻一种有效、可持续的防控手段迫在眉睫。本实验在室内通过腹腔注射的方法初步研究了MAPO对雄性红耳龟生殖功能的影响,据实验结果,表明浓度为3 g·L-1 MAPO,染毒15 d,可使雄性红耳龟睾丸萎缩,生精细胞退化,引起不育,而生长状况与对照组无异,反应敏捷,行动快速,健康活泼,几乎无毒副作用,该浓度可作为防治红耳龟的参考浓度。刘巍(2006)以雄性不育剂MAPO为主要成分配制出灭鼠剂M001,在农田、农户实地应用后,其适口性良好,效果明显,投药区繁殖率达到0%,应用7个月未发生人畜、鸡鸭、猫狗等动物中毒,是一种安全的不育剂。若能配制出以雄性不育剂MAPO为主要成分的红耳龟不育饵料,用于养殖场,则出售红耳龟为不育个体,那么人为有意或无意放生及逃逸的红耳龟即使进入野外环境也不能参与繁殖,只能自生自灭,况且不育个体可能竞争异性干扰野外正常个体的繁殖,将大大降低野外种群的出生率,能可持续、有效防治野外红耳龟数量和密度。本实验仅就MAPO不育剂对成体雄性红耳龟生殖功能的影响进行初步探究,对其幼体、雌性的生殖影响及红耳龟不育饵料配置尚需进一步研究。
| "陈贤均, 赵红刚. 2005. 盐制杜仲对小鼠生长发育与脏器系数的影响[J]. 四川中医, 23(11):29-31. |
| 李闯. 2013. 海南万泉河红耳龟(Trachemys scripta elegans)野外繁殖研究[D]. 海南:海南师范大学. |
| 廖明阳, 马华智, 王治乔, 等. 1998. 磷氧氮丙啶诱发CHO细胞HGPRT基因位点正向突变的分子特征[J]. 中国公共卫生学报, 17(3):137-138. |
| 刘丹, 史海涛, 刘宇翔, 等. 2011. 红耳龟在我国分布现状的调查[J]. 生物学通报, 46(6):18-21. |
| 刘巍. 2006. M001雄性不育灭鼠剂的生殖毒性研究及其在农业鼠害防治方面的应用[D]. 北京:中国协和医科大学. |
| 史海涛, 龚世平, 梁伟, 等. 2009. 控制外来物种红耳龟在中国野生环境蔓延的态势[J]. 生物学通报, 44(4):1-4. |
| 田永路, 于洪江, 张希牧, 等. 2009. 5-7周龄SD和Wistar大鼠主要脏器系数及体尺的测定[J]. 实验动物科学, 26(6):21-25. |
| 王爱平, 张清林, 黄春倩, 等. 1992. 膦氧氮丙啶对雄性小鼠的生殖毒性研究[J]. 中国公共卫生学报, 11(5):302. |
| 王治乔, 李秀英, 王耀忠, 等. 1983. 用多种方法检测化学物质诱变性的比较研究[J]. 中国环境科学, 3(2):31. |
| 谢忠明. 1999. 观赏龟[M]. 北京:中国农业出版社:87. |
| 徐婧, 周婷, 叶存奇, 等. 2006. 龟类外来种的生物入侵隐患及其防治措施[J]. 四川动物, 25(2):420-422. |
| 许小珊, 余寿忠, 黄春倩, 等. 1984. UDMH和MAPO对LACA种小鼠致癌作用的病理观察[J]. 军事医学科学院院刊, 18(2):108-112. |
| 张知彬. 1995. 鼠类不育控制的生态学基础[J]. 兽类学报, 15(3):229-234. |
| 周鹏. 2013. 广东古田外来物种红耳龟的家域及野外繁殖研究[D]. 海口:海南师范大学. |
| 朱靖, 张知彬. 1988. 农牧业鼠害综合治理的研究现状及对策[J]. 农牧情报研究, (7):1-10. |
| Cadi A, Delmas V, Prévot-Julliard AC, et al. 2004. Successful reproduction of the introduced slider turtle (Trachemys scripta elegans) in the south of France[J]. Aquatic Conservation:Marine and Freshwater Ecosystems, 14(3):237-246. |
| Epstein SS, Arnold E, Steinberg K, et al. 1970. Mutagenic and antifertility effects of TEPA and METEPA in mice[J]. Toxicology and Applied Pharmacology, 17(1):23-40. |
| ISSG/SSC. 2001.100 of the worlds worst invasive specises[J]. Specises, 35:5. |
| Newberry R. 1984. The American red-eared terrapin in south Africa[J]. African Wildlife, 38:186-189. |
| O'Keeffe S. 2005. Investing in conjecture:eradicating the red-eared slider in Queensland[C].//Proceedings of 13th Australasian Vertebrate Pest Conference 4, Te Papa Wellington, New Zealand. Landcare Research, Lincoln, New Zealand:169-176. |
| Semenov DV. 2010. Slider turtle, Trachemys scripta elegans, as invasion threat (Reptilia;Testudines)[J]. Russian Journal of Biological Invasion, 1(4):296-300. |
| Shi HT, Parham JF, Fan ZY, et al. 2008. Evidence for the massive scale of turtle farming in China[J]. Oryx, 42(1):147-150." |
 2015, Vol. 34(5)
2015, Vol. 34(5)




