扩展功能
文章信息
- 杨婵娟, 安瑞娣, 杨俊卿, 罗映, 齐云, 张云美
- YANG Chanjuan, AN Ruidi, YANG Junqing, LUO Ying, QI Yun, ZHANG Yunmei
- 造模时间对慢性不可预见性刺激致大鼠抑郁模型的影响
- Effects of Modeling Time on Rat Depression Model Induced by Chronic Unpredicted Mild Stress
- 四川动物, 2015, 34: 383-388
- Sichuan Journal of Zoology, 2015, 34: 383-388
- 10.3969/j.issn.1000-7083.2015.03.010
-
文章历史
- 收稿日期:2014-10-29
- 接受日期:2015-01-22
2. 重庆医科大学药学院, 重庆400016;
3. 西南药业股份有限公司, 重庆400038
2. Pharmacy School, Chongqing Medical University, Chongqing 400016, China;
3. Southwest Pharmaceutical Co., Ltd., Chongqing 400038, China
抑郁症(depression)是一种以持续情绪低落为主要症状,以情感低落、思维迟缓和言语动作减少、迟缓为典型症状的精神情志障碍性疾病,具有患病率高、复发率高、自杀率高的特点,是全球性公共卫生问题之一,受到国际社会和世界各国的广泛重视(汤球等,2011)。世界卫生组织、世界银行和哈佛大学的一项联合研究表明,该病已经成为我国疾病经济负担的第二大疾病(王亚军等,2008),已成为严重危害人们身心健康的常见临床精神疾患。随着社会竞争的日益激烈,抑郁症等情感性疾病的发病率逐年升高,然而其发病机制至今仍不清楚。在治疗方面,虽然抗抑郁药物的研发有了很大发展,但现有抗抑郁药物大都存在临床效应滞后、有效率不高、毒副反应大等缺点(陈红霞等,2011)。因此对抑郁症发病机制和治疗药物的研究都具有重要意义,而这些研究内容都依赖于稳定可靠的抑郁动物模型的建立,因而成功地建立抑郁动物模型显得十分重要。
慢性温和不可预见性刺激(chronic unpredicted mild stress,CUMS)方法对抑郁模型的建立具有较高的有效性,并可持续几个月,基本符合抑郁模型的要求,是目前国外文献中广泛使用的建立抑郁模型方法(李晓秋,许晶,2002)。但是,不同文献中造模时间的长短不统一,因而大多数实验的造模成功率仅30%左右,给后来的研究带来困惑,因此需要进一步优化动物模型的建立方法,以提高造模成功率,降低造模时间成本和经济成本。
本实验研究采用CUMS建模方法,将旷场试验、高架十字迷宫实验、糖水偏爱实验、强迫游泳实验指标作为判定应激抑郁模型建立成功的依据,观察给予不同时间长短的CUMS刺激(21 d、35 d、49 d、63 d)后抑郁模型建立的成功率,初步探讨造模时间长短对大鼠抑郁症模型成功率的影响。 1 材料和方法 1.1 实验动物
为避免实验动物的个体差异性,实验采用雄性成年同龄SD大鼠,体质量180~220 g,由重庆医科大学实验动物中心提供,动物生产许可证号:SCXK(渝)2012-0001,动物质量合格证号:0001750;动物使用许可证号:SYXK(渝)2012-0001。首先用旷场试验(Open-field法)作行为学评分,取得分相近的240只大鼠进行实验,以降低大鼠的个体差异对实验结果的干扰。 1.2 实验方法 1.2.1 分组
将240只大鼠随机分为CUMS1(造模21 d),CUMS2(造模35 d),CUMS3(造模49 d),CUMS4(造模63 d),每组各60只。置于室温22 ℃±2 ℃、湿度50%±10%、12 h黑-白循环光照条件下,孤立饲养,采用标准颗粒饲料,自由进食、进水,饲养7 d以适应环境,每日触摸动物以适应实验人员的操作。 1.2.2 造模方法
按Zhao等(2008)的造模方法并稍加修改,12种应激方案按随机方法在造模过程中连续应用:1.潮湿垫料(24 h);2.倾斜45°;3.禁食(24 h)和禁水(24 h);4.夹尾(距尾根1 cm,1 min);5.冰水游泳(4 ℃,5 min);6.闪光照射3 h;7.噪音3 h;8.电击足底(电压为50~100 mV,每隔1 s刺激1次,每次持续1 s,5 min);9.水平震荡(10 min);10.热水浴(45 ℃,5 min);11.昼夜颠倒;12.空笼(24 h)和禁食(24 h)。每日给予1种刺激方案,相同刺激2 d内不重复,顺序随机,使动物不能预料刺激的发生。大鼠适应7 d后开始造模。 1.3 行为学评估 1.3.1 旷场试验(Open-field法)
参照王建影等(2006)、董海影等(2011)的方法,将大鼠放入由不透明材料制成的长宽高为100 cm×100 cm×50 cm,周壁、箱底为黑色的敞箱内,且其底面用白线划分成20 cm×20 cm的25个方格。08∶00—12∶00之间在安静的房间内进行此项试验观察。将大鼠放入正中央格后,记录大鼠5 min内动作行为表现,包括在中央格停留时间(潜伏期)、水平穿越格数(4只脚在同一格子内为1格)、直立次数(两前腿离地或攀附墙壁)、理毛次数及粪便粒数。每只动物只进行1次行为测定,测定完毕清除干净动物粪便,然后用75%的酒精棉球清洗敞箱周壁及底板,彻底清洁敞箱后再进行下只动物的得分测定。
计分方法:将大鼠置于敞箱中央格,以穿越底面方格数为其水平活动得分,大鼠4只脚均在同一格子内为1格,穿越1格为1分;大鼠两前腿离地或爬墙壁为垂直运动,垂直1次记1分;中央格停留时间:即动物开始置于中央格停留的时间,以秒(s)计。以粪便粒数和有无尿记为排泄得分,1粒记1分,有尿记1分,无尿记0分。4项之和为旷场试验总得分。 1.3.2 糖水消耗实验(Sucrose preference test)
参照Benelli等(1999)的方法,实验前,在隔噪音、安静的房间内。第一个24 h,训练动物适应含糖饮水。每笼同时放置2个水瓶,均装1%蔗糖水;适应时间为24 h;1瓶仍装1%蔗糖水,1瓶装自来水,再适应24 h,适应期间禁食。适应完毕后,禁食禁水24 h,而后进行动物的基础糖水/纯水消耗实验。同时给予每只大鼠事先定量好的2瓶水:1瓶1%蔗糖水,1瓶纯水,于1 h后取走2瓶并称重。计算动物的总液体消耗、糖水消耗、纯水消耗、糖水偏爱(糖水偏爱=糖水消耗/总液体消耗×100%)。每9~10 d进行1次糖水消耗实验。 1.3.3 高架十字迷宫实验(High plus maze test)
参照李宁等(2010)的方法,高架十字迷宫由2个相对的开放臂(50 cm×10 cm),2个相对的封闭臂(50 cm×10 cm×40 cm)和1个联结四臂的开阔平台(10 cm×10 cm)组成,2条开放臂与2条封闭臂呈十字交叉型,封闭臂顶部敞开。进行实验时,将迷宫置于与地面距离为50 cm的高度。迷宫的地板和封闭臂的墙由黑色塑胶构成(王建醒等,2006)。
将大鼠置于迷宫中央,头朝封闭臂,放置后立即开始测试观察,分别记录5 min内大鼠进入开放臂次数(OE)、进入封闭臂的次数(CE)、进入开放臂的时间(OT)、进入封闭臂的时间(CT)。计算开放臂和封闭臂总的进入次数(OE+CE),表示大鼠的运动能力;开放臂进入次数比(OE%),即OE/(OE+CE)×100%;开放臂停留时间比(OT%),即OT/(OT+CT)×100%。每只大鼠观测结束后,清除干净动物粪便,用75%的酒精棉球擦拭迷宫,待酒精挥发完全后,可进行下一只大鼠的观察测试。
高架十字迷宫检测操作在室内光线昏暗(以1.5 m距离处能区分大鼠细微活动的最低亮度为准),室温20 ℃,08∶00—12∶00之间在安静的房间内进行。 1.3.4 强迫游泳实验(Forced swimming test)
参照马妮等(2010)的方法,测定指标为不动时间,即在水面漂浮、只有轻微的活动或是身体垂直于水面只有鼻露出水面的时间记录为不动时间。首先向圆柱形(高40 cm,直径30 cm)玻璃容器内注入温度为(23±2)℃,深约20 cm的水,使大鼠在水中不能以后爪支撑身体、前爪攀附于缸壁。每只大鼠单独测试。测试时将大鼠轻放入水中,首先让其适应游泳2 min,从第3分钟开始记录后续 5 min内大鼠在水中停止挣扎、呈漂浮状态的时间的总和。每次强迫游泳实验的总时间为 7 min。 1.4 统计方法
根据记录的详细数据资料,用SPSS 16.0软件进行统计学处理,计量资料以造模前与造模后各项指标平均得分的绝对差值表示,用单因素方差分析进行多组间比较。以α=0.01为差异有统计学意义标准。 2 结果 2.1 大鼠旷场实验结果
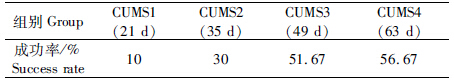
对造模后与造模前大鼠旷场试验各项指标的绝对差值进行组间单因素方差分析发现,与造模前相比,CUMS1~CUMS4组大鼠的垂直运动次数、水平穿越格数、理毛次数均减少,潜伏期、粪便粒数均增加。与CUMS1比较,随着造模时间延长,大鼠的垂直运动次数、水平穿越格数、理毛次数减少,前2项差异具有统计学意义(P<0.01);潜伏期延长,粪便粒数增加,差异具有统计学意义(P<0.01),这表明动物在造模时间延长后,抑郁程度加重。CUMS3和CUMS4大鼠比较,大鼠的垂直运动次数、水平穿越格数减少,差异均无统计学意义(P>0.01)(图 1)。
|
|
图 1 慢性应激对大鼠旷场实验各项指标的影响
Fig. 1 Effects of chronic unpredicted mild stress on indices of open-field test
注: 与CUMS 1相比,*P<0.01; 下图同。 Notes: compared to CUMS 1,*P<0.01; the same below. |
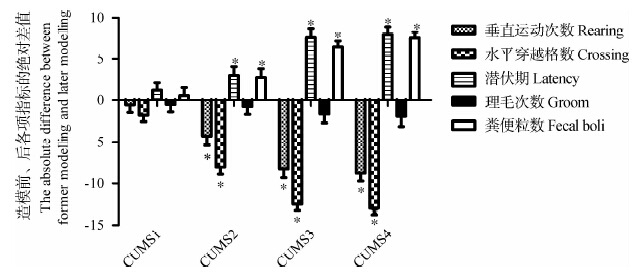
CUMS模型组的基线总液体消耗、糖水消耗、纯水消耗、糖水偏爱百分比的差异均无统计学意义(P>0.01)。对造模后与造模前大鼠糖水消耗试验各项指标的绝对差值进行组间单因素方差分析发现,CUMS1~CUMS4组大鼠的糖水消耗和糖水偏爱百分比均低于造模前,而纯水消耗量则高于造模前,总液体消耗在整个造模过程中无明显变化。CUMS2、CUMS3、CUMS4与CUMS1相比,大鼠糖水消耗、糖水偏爱百分比均减少(P<0.01),纯水消耗量增加(P<0.01),说明造模时间延长,抑郁程度加重;CUMS3和CUMS4大鼠比较,糖水消耗、糖水偏爱百分比、纯水消耗量无统计学意义(P>0.01)(图 2)。
|
| 图 2 慢性应激对大鼠糖水消耗实验各项指标的影响 Fig. 2 Effects of chronic unpredicted mild stress on indices of sucrose preference test |
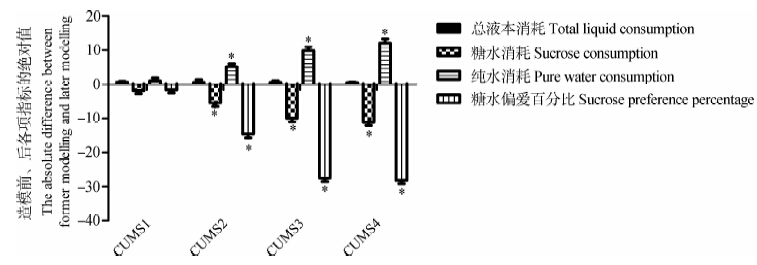
对造模后与造模前大鼠高架十字迷宫实验各项指标的绝对差值进行组间单因素方差分析发现,CUMS模型组大鼠造模前后的总次数、进入开放臂次数、进入开放臂次数比例、进入开放臂时间、进入开放臂时间比例均减少。CUMS2、CUMS3、CUMS4与CUMS1相比,大鼠的进入开放臂次数及次数比例、进入开放臂时间、进入开放臂时间比例及总次数均减少,有统计学意义(P<0.01),说明造模时间延长,抑郁程度加重。CUMS3与CUMS4相比,总次数、进入开放臂次数、进入开放臂次数比例、进入开放臂时间、进入开放臂时间比例无统计学意义(P>0.01)(图 3)。
|
| 图 3 大鼠高架十字迷宫趋近-规避冲突行为比较 Fig. 3 Comparison of approach-avoid conflict behavior of rat high plus maze test |
对造模后与造模前大鼠强迫游泳静止时间的绝对差值进行组间单因素方差分析发现,CUMS1~CUMS4组大鼠在造模后强迫游泳静止时间均延长。CUMS2、CUMS3、CUMS4与CUMS1相比,大鼠强迫游泳静止时间延长,差异有统计学意义(P<0.01),说明造模时间延长,抑郁程度加重。CUMS3与CUMS4相比,强迫游泳静止时间的差异无统计学意义(P>0.01)。 2.5 造模时间长短和成功率
根据行为学各项指标的变化得出,在CUMS1中有抑郁鼠6只;在CUMS2中有抑郁鼠18只;在CUMS3中有抑郁鼠31只,在CUMS4中有抑郁鼠34只。由此可见,随着造模时间的适当延长,成功率增加,同时基于行为学的各项指标发现,随着造模时间的延长,抑郁程度也加重,在一定程度上可看作抑郁程度与成功率之间呈正相关,相关系数为0.986(表 1)。
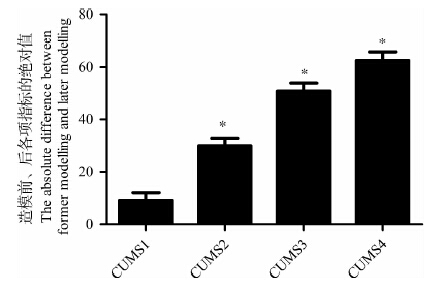
|
| 图 4 CUMS对大鼠强迫游泳静止时间的影响 Fig. 4 Effects of chronic unpredicted mild stress on the duration of immobility |
有调查资料显示,长期的不良环境和不良事件与抑郁症的发生之间存在正相关关系,紧张性生活事件尤其是慢性长期的压力与抑郁症是一种剂量-反应关系,且不良的生活事件越多,程度越严重,抑郁症的发病率就越高,症状也越重(Willner,1986)。抑郁模型建立的理论依据在于:不管是人类还是其他生物,在面临其不适合生存的刺激时,必然会引起紧张、焦虑、抑郁等情绪,而长期慢性的不可预见性刺激可导致抑郁的发生并加速抑郁的发展。在此模型的建立过程中,刺激的多变性和不可预见性是建立模型成功的关键,且建立模型时没有一种刺激单独应用就可产生理想效应,也没有一种刺激因子是抑郁模型成功必不可少的(Rasenick et al.,1996)。本试验采用慢性轻度不可预见刺激和孤养2种经典模型相结合的方式,慢性轻度不可预见刺激模拟抑郁症发病的压力源,造成孤养大鼠的抑郁状态,孤养模拟人类失去社会和家庭支持的孤独状态。且该模型所致的行为学改变可持续较长的时间,可为研究抑郁症的发病机制和抗抑郁药物的药理作用提供较为理想的抑郁症动物模型。
此模型模拟出了抑郁症的症状表现,如运动能力及探索行为能力的下降,在行为上表现为在规定时间内的水平运动和垂直运动次数均减少。旷场实验可以反映大鼠在新异环境中的启动行为、探究行为、紧张恐惧状态、对新环境的警觉性及情绪。水平运动减少表明活动程度下降,垂直运动减少表明对新异环境的好奇程度降低,理毛次数显著下降,表明对自身的关注度降低,而自身的紧张程度增加,中央格停留时间表示启动活动的潜伏,排便量反映了紧张恐惧状态(王海涛等,2010)。由此可见大鼠抑郁模型表现出的抑郁状态、活动能力下降、兴趣丧失与抑郁症临床表现中的精神运动迟滞症状极为相似。
人类抑郁症的核心症状是快感缺乏(Washington,1994),CUMS模型也模拟了这一点,糖水消耗和糖水偏爱百分比作为衡量快感缺乏的有效客观指标。大鼠糖水饮用量的下降不能单纯地理解为动物的渴觉下降,因为本试验采用双瓶实验来衡量液体消耗实验中的各项指标,结果表明CUMS过程中动物的总液体消耗量无显著的改变,表示CUMS模型基本可以反映动物对奖赏的反应性也下降(夏军等,2005)。
高架十字迷宫是利用动物对新环境的探究和对高悬开放臂的恐惧而形成的矛盾冲突状态,从而反映出动物的焦虑情绪。目前,高架十字迷宫已成为国际上公认的动物焦虑表现行为测评的首要装置(Foreman et al.,2009)。据宗绍波等(2011)报道,状态焦虑和特质焦虑是动物的2种焦虑行为,在高架迷宫实验中,动物进入高架迷宫开放臂的次数比和开放臂停留时间比复测性较高,所表现的是实验动物趋近-规避冲突的行为结果,为评价动物焦虑表现的主要指标,与动物焦虑的程度直接相关,一般这2个指标之间也具有高度相关性,如果动物在开放臂探索时间和次数的比例减少,则说明动物的焦虑程度高。
强迫游泳实验是Porsolt等人于1977年创建的一种抑郁症动物模型(Porsolt et al.,1977)。实验中,大鼠被迫在一个有限的空间内游泳,起初它们试图逃跑,随后处于一种漂浮不动状态,放弃逃离这一恶劣环境的希望,即"行为绝望"。目前普遍认为,这种行为绝望(大鼠在强迫游泳期间的不动时间)类似于人类抑郁症的成分。作为判断指标,静止时间反映了大鼠的一种低落情绪,一种绝望状态。静止时间的长短可作为大鼠抑郁程度的指标。
通过行为学测试、指标检测,模型组大鼠表现出类似于快感缺失、兴趣减退以及精神运动性抑制等人类抑郁症患者常见的一些行为特征,且这些行为可持续一定时间,说明抑郁症模型造模成功。 3.2 造模时间长短与成功率
2组模型成功率比较:造模时间与成功率呈正相关,随着造模时间的适当延长,成功率也增加,根据行为学的各项指标,随着造模时间的延长,抑郁程度也加重,抑郁程度与成功率变化一致。比较CUMS模型组49 d与63 d发现各项指标无统计学意义(P>0.01),因此要想为研究抑郁症的发病机制和抗抑郁药物的药理作用提供较为理想的抑郁症动物模型,可以适当延长建立抑郁模型的时间,建议造模时间选取49 d有较大的造模成功率,同时可避免资源浪费。
| 陈红霞, 张黎明, 薛摇瑞, 等. 2011. 大鼠嗅球切除抑郁症动物模型的改进与评价[J]. 中国药理学通报, 27(3): 436-439. |
| 董海影, 兴桂华, 张晓杰. 2011. 不同年龄组大鼠抑郁症模型评价[J]. 中国老年学杂志, 31(10): 1796-1797. |
| 李宁, 唐启盛, 赵瑞珍, 等. 2010. 慢性焦虑应激大鼠行为学的变化及高架十字迷宫的测评[J]. 中华中医药学刊, 28(4): 711-712. |
| 李晓秋, 许晶. 2002. 抑郁动物模型的研究进展[J]. 中华精神科杂志, 35(3): 184-186. |
| 马妮, 陈林庆, 蔺兴遥, 等. 2010. 慢性应激抑郁症大鼠模型的复制与评价[J]. 甘肃中医学院学报, 27(8): 7-8. |
| 汤球, 刘志学, 崔淑芳, 等. 2011. 大鼠抑郁症模型的建立与评价[J]. 实验动物科学杂志, 28(1): 6-9. |
| 王海涛, 薛黎明, 秦雪梅, 等. 2010. 慢性不可预知和慢性束缚应激抑郁模型大鼠行为学研究[J]. 山西大学学报: 自然科学版, 33(1): 157-160. |
| 王建醒, 周丽, 徐华锋. 2006. 慢性应激大鼠抑郁模型的建立及其评价[J]. 齐齐哈尔医学院学报, 27(6): 644-646. |
| 王亚军, 张瑜, 田永萍. 2008. 针药结合治疗对慢性应激抑郁模型大鼠行为学的影响[J]. 中医研究, 21(11): 12-15. |
| 夏军, 叶慧, 周义成. 2005. 慢性应激大鼠抑郁模型的建立及其有效性的探讨[J]. 华中科技大学学报: 医学版, 34(4): 493-495. |
| 宗绍波, 魏盛, 苏云祥. 2011. 焦虑大鼠模型高架十字迷宫实验的复测信度检验及参数相关性分析[J]. 中国医药导报, 8(30): 5-7. |
| Benelli A, Filaferro M, Bertolini A, et al. 1999. Influence of S-adenosyll-methionine on chronic mild stress-induced anhedonia in cast rated rats[J]. British Journal of Pharmacology, 127: 645-654. |
| Foreman MM, Hanania T, Eller M. 2009. Anxiolytic effects of lamotrigine and JZP-4 in the elevated plus maze and in the four plate conflict test[J]. Eur J Pharmacol, 602(2-3): 316-320. |
| Porsolt RD, Bertin A, Jalfre M. 1977. Behavioural despair in mice: a primary screening test for antidepressants[J]. Arch Int Pharmacodyn, 229(21): 327-336. |
| Rasenick MM, Chaney KA, Chen JG. 1996. Protein-mediated signal transduction as atarget of antidepressant and an tibipolar drug action: Evidence from model systems[J]. J Clin Psychiatry, 57(suppl 13): 49-55. |
| Washington DC. 1994. American Psychiatric Association. DSM - Ⅲ Diagnostic and statistical manual of psychiatric disorders, 4th ed[M]. American Psychiatric Association. |
| Willner P. 1986. Validation criteria for animal models of human mental disorders: learned helplessness as a paradigm case[J]. Prog Neuropsy chopharmalol Biol Psychiatry, 10(6): 677-690. |
| Zhao Z, Wang W, Guo H, et al. 2008. Antidepressant-like effect of liquiritin from Glycyrrhiza uralensis in chronic variable stress induced depression model rats[J]. Behavior Brain Res, 194(1): 108-113. |
 2015, Vol. 34
2015, Vol. 34