扩展功能
文章信息
- 许静, 宋晶, 唐业忠
- XU Jing, SONG Jing, TANG Yezhong
- 钙结合蛋白在龟类听觉核团的表达
- Expression of Calcium-binding Proteins on the Auditory Nuclei in Turtles
- 四川动物, 2015, 34: 321-329
- Sichuan Journal of Zoology, 2015, 34: 321-329
- 10.3969/j.issn.1000-7083.2015.03.001
-
文章历史
- 收稿日期:2014-04-01
- 接受日期:2014-05-28
2. 中国科学院大学, 北京100049;
3. 山西农业大学, 山西太谷030801
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Shanxi Agricultural University, Taigu, Shanxi Province 030801, China
听觉是动物获取实时动态信息的重要感官之一。许多动物根据声音信号发现环境中的食物、配偶或天敌,判断目标的方向,更有一些物种,如鸮类、蝙蝠等可以利用声音信号对目标进行精确定位(Payne,1962;Schnitzler & Flieger,1983)。目前,学界广泛认为神经系统判别声源方位的基础主要是基于声音传递至左右听觉器官的时间差异(interaural time difference,ITD)(Knudsen & Konishi,1979;Carr & Konishi,1990;Fitzpatrick et al,1997;Gelfand ,2004)。
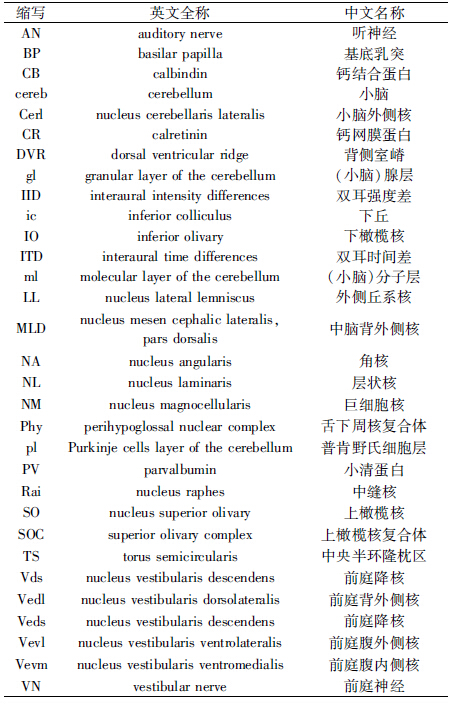
夜行性食肉鸟类仓鸮Tyto alba发达的听觉感受器可以收集猎物发出的微弱声音,再通过下丘脑分布的高度灵敏的听觉神经元,对两耳传入声音时间差进行精确编码,将声音信号转换为空间信息(Moiseff & Konishi,1981)。这一过程的具体实现主要依赖2个重要的听觉核团——巨细胞核(nucleus magnocellularis,NM,又称前庭神经外核)和层状核(nucleus laminaris,NL)。从神经传导通路上看,一侧NM核团分别投射至同侧和对侧的NL核团;同理,NL核团也同时接收来自两侧NM核团的声音时间信号(图 1)。基于目标声源相对两耳的位置差异,NM核团将时间差异信号放大投射到NL核团。NL核团由双极细胞型神经元构成,此类神经元两端树突分别接收同侧和对侧NM核团细胞送出的神经信号。一旦某一神经元两端同时接收到前级信号,则激活其胞体产生动作电位,其胞体的排布位置与空间信息有着拓扑结构相关性,这样的神经系统编码特征与著名的Jeffress模型所阐述的声源定位理论密切吻合(Jeffress,1948;Carr & Konishi,1990)。
|
| 图 1 参与ITD编码的2种听觉核团(Jeffress,1948; Carr & Konishi,1990) Fig. 1 Two auditory neuclei coding ITD(Jeffress,1948; Carr & Konishi,1990) |
物种间的听觉能力和特征差异较大,这种差异反映到了听觉系统各部分的形态结构方面,其中也表现到NL核团的细胞构成上。家鸡Gallus domestics NL核团的双极细胞形成单层排布,上下两层树突分别接收同侧和对侧NM核团的信号输入,这样的结构符合经典的Jeffress模型(Grau-Serrat et al,2003)。对于仓鸮而言,却找不到这样明确的双极细胞层状排列的结构,取而代之的是神经元的重排使其听觉更为灵敏。上述两类神经元排布结构反映了一定的鸟类种间差异,而重排的现象是在胚胎发育后期发生的(Kubke & Carr,2006)。根据声音信号的特质,频率越高的声音越不易表现出双耳时差(Feddersen et al,1957)。2003年,Grau-Serrat等分别构建了家鸡与仓鸮的NL编码ITD模型,并认为正是由于在NL核团的经典编码模式下,家鸡能分辨频率在2 kHz以内声音的双耳时差;而仓鸮的NL核团通过更多神经元数量和多梯度的树突关系等要素构成了"强化型"编码模式,使其对ITD分辨能力提高到6 kHz。
由于传播媒介的密度差异,声音在空气中与水中的传播速度有较大差异:空气中音速约为340 m·s-1,而水中音速为1500 m·s-1。水生动物和陆生动物由于适应性进化,各自的听觉系统是否存在较大差异?是否在NL核团表现出不同的结构特点以有效编码空气或水中的双耳时差?基于这一科学问题,我们选取了龟鳖目中底栖性较强的中华鳖Pelodiscus sinensis和在浅水和沿岸生活的红耳龟Trachemys scripta elegans为研究对象,比较二者的听觉系统(特别是NL核团)的结构差异。提出如下假说:由于传播介质直接影响音速,NL核团对水中的ITD编码压力则更大,对近缘物种而言(如同属一目),水生物种的NL核团可能与经典的单层神经元结构(Jeffress模型)有差异,应趋于特化的结构模型。 1 材料与方法 1.1 实验动物
以往的研究表明,爬行类和鸟类在系统演化上有着密切的亲缘关系,二者的听觉系统,从第Ⅷ神经(听神经)到间脑的整个通路有很大的相似性(Foster & Hall,1978)。 哺乳类和鸟类听觉系统已有大量研究,爬行动物的相关研究还有待完善(Braun et al,1985;Takahashi et al,1987;Rogers,1989;Braun,1990;Celio,1990;Braun et al,1991;Zettel et al,1991;Braun & Piepenstock,1993;Vater & Braun,1994;Kubke et al,1999)。已有研究表明,爬行动物不同类群的听觉系统结构也存在较大差异(Miller & Kasahara,1979;Dávila et al,2000;Yan et al,2010;Belekhova et al,2004,2008,2010)。
本研究中,选取了同属一目的中华鳖和红耳龟,检测其听觉核团是否能表现出针对环境声音特征的结构差异。本研究采用上述2种动物成年个体各5号样本(不作性别区分),并以爬行纲有鳞目的赤链蛇Lycodon rufozonatus rufozonatus作为对照研究。遵循《中国科学院成都生物研究所实验动物保护与使用规范》,暂养和实验过程中不得对实验动物造成非必要性的伤害。 1.2 手术和灌流
首先,经腹腔分3次共注射1.5 mL浓度为3%的戊巴比妥钠溶液,等待约10 min,采用观察夹指反射检验麻醉程度,直至动物进入深度麻醉后,打开其腹板以暴露心脏,用生理盐水(0.9%NaCl)进行心脏灌流血管,将脑部血液冲洗干净,以动物舌面颜色为参考,之后用0.1 M的磷酸盐缓冲液(PBS)配制的4%多聚甲醛溶液固定脑组织2 h。 1.3 冰冻切片
灌流完毕后按照以下步骤进行操作:1)小心取出动物脑部,用4%多聚甲醛保存并放置于4 ℃冰箱12 h~24 h;2)然后将脑组织转入30%蔗糖溶液12 h~24 h;3)用冷冻包埋剂(Jung,Heidelberg,Germany)将脑组织进行包埋处理,放入-80 ℃超低温冰箱冷冻;4)用冰冻切片机(Leica-910,Germany)将脑组织进行厚度为40 μm的横切面切片;5)脑片按序浸渍在0.01 M的PBS中备用。 1.4 免疫组织化学
由于不同的免疫组化指示剂对物种和听觉核团具有一定的选择性,因此选择了3种指示剂进行实验,实验流程按以下步骤进行:1)将普通血清用0.1 M的PBS稀释至10%,再加0.3%曲拉通100(Triton X-100)配置为封闭液;2)将切好的脑片放入封闭液中孵育1 h;3)加入第一抗体后,放置于4 ℃冰箱过夜,先后选用了3种一抗试剂,分别为:钙网膜蛋白(calretinin,CR)1∶5000(CR,7699/66;Swant,Belinzona,Switzerl and ),钙结合蛋白(calbindin,CB)1∶3000(CB,300;Swant),以及小清蛋白(parvalbumin,PV)1∶2000(PV,PA-235;Sigma,St.Louis,MO);4)用0.01 M的PBS清洗残余一抗(摇床慢速10 min,重复3遍),加入3种一抗对应的二抗试剂(均用0.1 M的PBS稀释至0.2%后使用);5)清洗二抗后,用卵白素-生物素-过氧化物酶复合物(SABC,Vector Laboratories,USA)孵育1.5 h;6)清洗脑片后,用SG试剂盒(SG,Vector Laboratories,Burlingame,CA)进行显色反应;7)制片(贴片-晾干-脱水-封片)。 1.5 观察和数据获取
将制作好的免疫组化切片用荧光显微镜(Nikon Eclips 55i)明场进行观察,并用其自带的图像软件(NIS-Elements F3.0)保存观察结果。依据观察需要,图片用ImageJ(1.44,NIH,USA)进行亮度和对比度的调节。 2 结果
选用的3种标记蛋白中,CR与CB均不能对听觉核团进行良好标记,但PV清晰标记了2种龟类的耳蜗核团及周边神经纤维。中华鳖和红耳龟的种内个体间听觉核团结构上未见明显差异,但物种间听觉核团独立性较为明显,初级核团NM与角核(nucleaus angularis,NA),以及次级核团上橄榄核(nucleus superior olivary,SO)与NL都被有效着色,结果显示出不同核团间的结构分化。
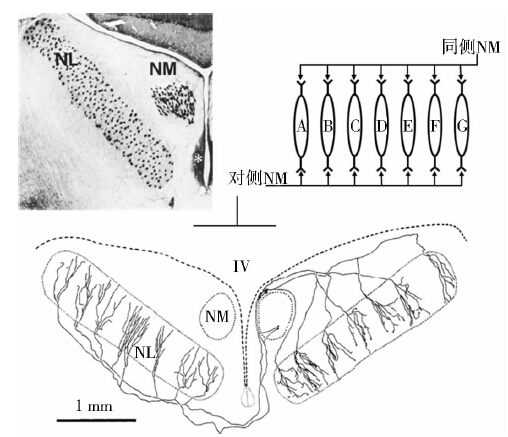
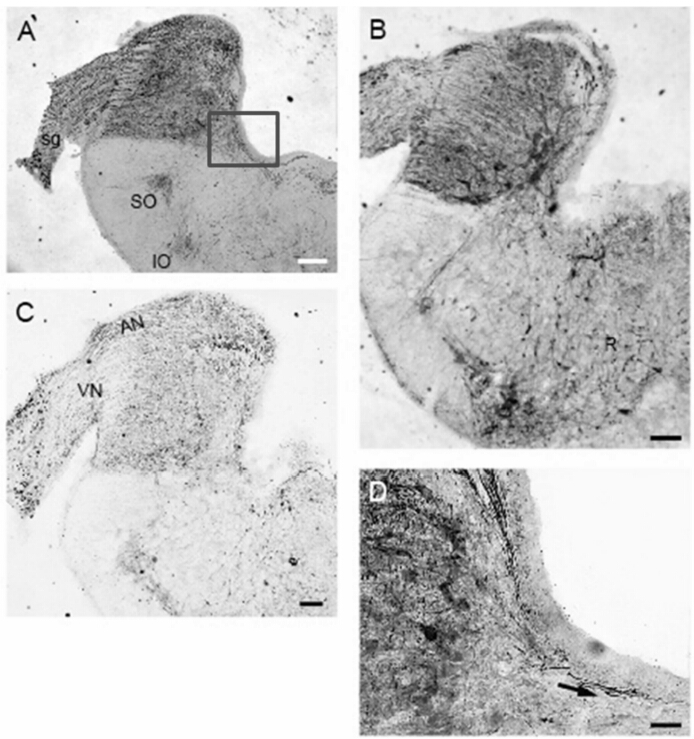
2个物种听觉系统均观察到2个橄榄核(图 2:A,B)。在脑干的冠状切面上,可以清晰地看到第Ⅷ神经的听神经分支在前庭神经分支之上(图 2:C),在中华鳖NL核团的腹侧接受对侧NM核团投射,神经沿着脑室底部投射到对侧(图 2:D)。SO核团作为一个次级核团,直接接受对侧NA核团的信号,向前投射到外侧丘系核(nucleus lateral lemniscus,LL),再经LL到前脑的中央半环隆枕区(torus semicircularis,TS),整个投射通路可能与解析双耳强度差(interaural intensity differences,IID)相关。中华鳖的2个橄榄核均位于脑干下部,同侧两核团之间有投射联系(图 3:B~D)。从NM核团、NA核团传来的神经纤维,在第四脑室底部外侧,前庭腹内侧核(nucleus vestibularis ventromedialis,Vevm)内侧的区域分支,一支通过中线投射到对侧脑干,另一支投射到同侧的SO核团(图 3:E)。外侧丘系核(LL)接受SO核团投射,再投射到更前部的TS,直至丘脑背内侧核和端脑的背侧室嵴(dorsal ventricular ridge,DVR)的重要中转站,如红耳龟的LL(图 3:F)。
|
|
图 2 红耳龟和中华鳖的脑干结构
Fig. 2 The structures of brainstem in the red-eared turtle Trachemys scripta elegans and the soft-shelled turtle Pelodiscus sinensis
A为中华鳖的脑干结构,红色方框部分放大至子图D; B、C分别为红耳龟脑干前部和中部的冠状截面; D箭头示中华鳖NL核团的腹侧接受对侧NM核团投射; A~C的标尺长度为200 μm,D的标尺长度均为50 μm。 (A)An overview of brainstem in the soft-shelled turtle;(B)An overview of brainstem in the red-eared turtle at rostral position;(C)The coronal section of auditory nuclei in the middle of brainstem;(D)The pathway to NL originate from NM in contralateral projection; Scale bars=200 μm in A,B and C; Scale bar=50 μm in D. |
|
|
图 3 爬行动物橄榄核的位置及细胞结构
Fig. 3 The position and cytoarchitecture of nucleus olivary in reptiles
A赤链蛇的SO核团; B中华鳖的2个橄榄核(2个红色方框部分,放大至C、D); C、D是B的局部放大; E左上方箭头显示NM核团接受与对侧NL核团投射的神经纤维; 下方箭头显示中华鳖SO核团接受对侧NA核团的神经纤维; F为红耳龟的LL;B的标尺长度为200 μm,其余各图标尺长度均为50 μm。 (A)SO in the red-b and ed snakes brainstem;(B)Two nuclei olivry in the soft-shelled tuetle,the boxed area in B is further enlarged in(C) and (D);(E)The fibers that were project to SO original from contralateral NA and project to contralateral NM original from ispilateral NL;(F)Lateral lemniscus in the red-eared turtle; Scale bars=50 μm in A,C,D,E and F; Scale bar=200 μm in B. |
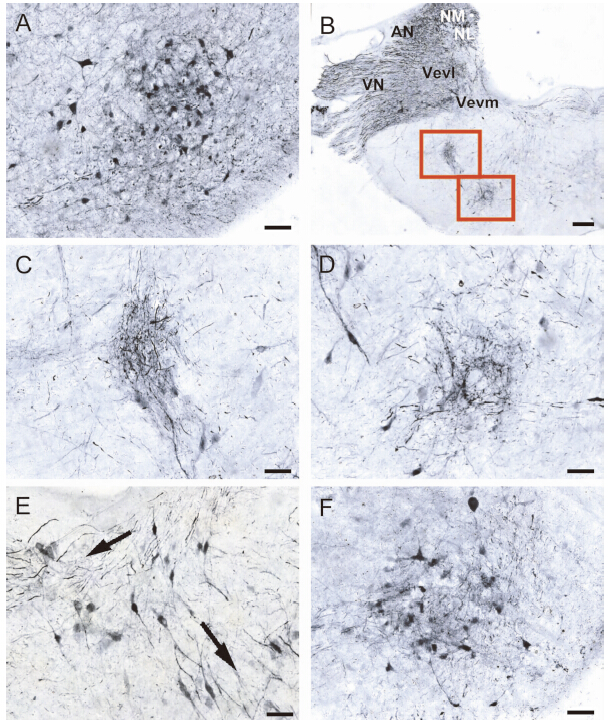
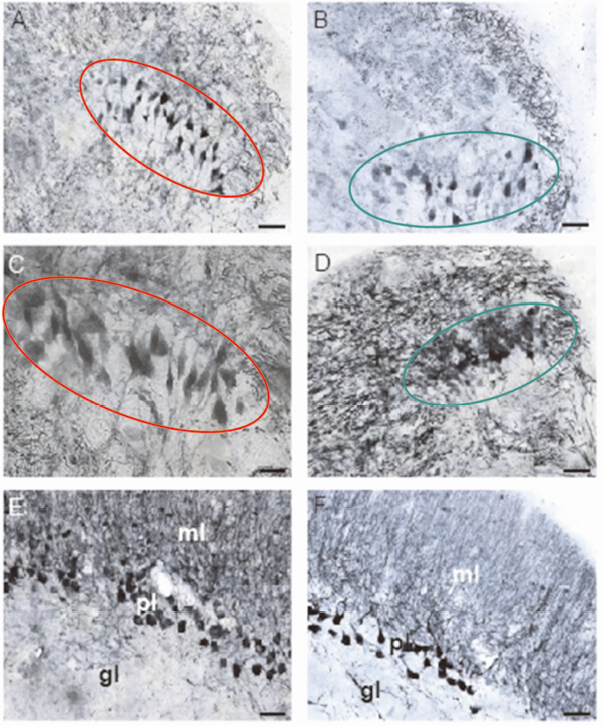
NM核团位于NA核团后方,与NL核团平行(图 4:A,B),红耳龟的NL核团容易观察到双极细胞构成的层状结构,属典型的Jeffress模型分布结构(图 4:C);而中华鳖的NL核团,从切片可观察到2个分区结构:背侧致密分布区的深着色细胞与腹侧疏松分布区的浅着色细胞(图 4:D)。此外,可见小脑部分的分子层(molecular layer of the cerebellum,ml)、普肯野氏细胞层(Purkinje cells layer of the cerebellum,pl)、腺层(granular layer of the cerebellum,gl)3个由外到内的层状结构(图 4:E,F)。其中,ml并未被深染,分布其间的灰黑色丝状物实为普肯野氏细胞的庞大树突,比较2种小脑结构发现,红耳龟具有较厚的pl。
|
|
图 4 龟、鳖NL和小脑的细胞结构
Fig. 4 The cytoarchitecture of nucleus laminaris and cerebellum in Pelodiscus sinensis and Trachemys scripta elegans
A、C为红耳龟NL核团的细胞结构(红圈);B、D为中华鳖NL核团的细胞结构(绿圈);E、F分别为红耳龟和中华鳖小脑各层的结构;各图标尺长度均为50 μm。 (A),(C)NL of the red-eared turtle;(B),(D)NL of the soft-shelled turtle;(E),(F)The different layers at cerebellum in the red-eared turtle and the soft-shelled turtle,respectively; Scale bars=50 μm. |
不同的钙结合蛋白具有不同的化学专一性,这在之前的免疫组化研究中就有相关报道。如采用PV和CB 2种标记物对四爪陆龟Testudo horsfieldi和欧洲泽龟Emys orbicularis的听觉系统研究中,PV主要标记了NA和NM核团,而CB则对刺激听觉核团NL、上橄榄复合体(superior olivary complex,SOC)、LL等有良好的染色反应(Chudinova et al,2012)。这种差异性标记的原因可能是由于组织结构、功能或是种间差异所致(Parvizi & Damasio,2003)。
另一方面,有报道认为与哺乳动物相比,爬行动物的丘脑感觉传导核团被CB标记较少,而PV的特异性标记非常明显(Belekhova et al,2003)。因此,对于不同种类抗体标记脑干结果的差异比较,其不适合作为羊膜动物脑干进化的一个标准,仅仅能用于判断其特异性结合的程度。这与我们的实验结果一致,同时也得到了Core-Matrix模型的支持(Jones,1998)。在两栖动物的相同区域则不具备如此典型的核-壳结构(Huang et al,2011)。因此在我们的实验当中也出现了3种标记物中,只有PV对研究区域有良好标记的情况,虽然其余两种标记物没有表现出特异性标记,但单从PV染色的结果上,已经可以发现2种龟类听觉系统的明显差异。
NL核团位于听结节中部的三分之一处,这也正是联接耳蜗神经主干前后部分的枢纽,是目前公认的处理双耳时差的核心位置。红耳龟的NL核团由1~2列不同列分布的双极细胞列阵构成,而中华鳖的NL核团则呈现出较为杂乱的双极细胞,形成一个不太规则的细胞阵列(图 4:B,C)。该核团的种间差异,在蜥蜴类的研究中也有相似的结果,蜥蜴亚目不同种类的NL核团的形态差异很大(Glatt,1975),一些种类(如G.gecko和L. sicula)的NL核团也很难被独立区分出来(Yan et al,2010)。Miller研究指出:NL核团在蜥蜴中发育的多样性,取决于其基底乳突(basilar papilla,BP)上单向听觉毛细胞和双向听觉毛细胞所占的比例,但是这种说法并未被比对统计证实(Miller,1975)。
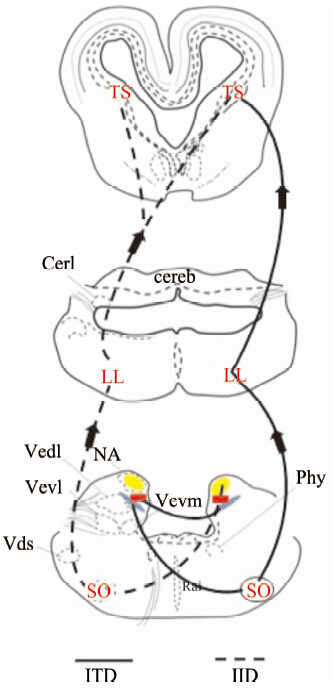
无论前人做的辣根过氧化物酶(horse radish peroxidase,HRP)标记,还是我们实验中观察到的神经纤维,都能证明NL核团、NM核团、NA核团都接受来自同侧听觉神经的传入投射(Boord & Rasmussen,1963;Parks & Boord,1968;Parks & Rubel,1978;Miller & Kasahara,1979)。NM核团、NA核团的传入神经有很多相关研究(Whitehead & Morest,1981;Carr & Boudreau,1991),NM核团的投射关系十分特殊,其能够同时分别投射到对侧的NL核团腹侧和同侧的NL核团背侧(Parks & Rubel,1978;Young & Rubel,1983)。NL核团和NA核团能够投射到SO核团,SO核团提供对NL核团、NM核团、NA核团的抑制性投射(Takahashi & Konishi,1988;Lachica et al,1994;Westerberg & Schwartz,1995)。NA核团、NL核团投射到TS,相当于鸟类的下丘(inferior colliculus,ic)和中脑背外侧核(nucleus mesen cephalic lateralis,pars dorsalis,MLD)区域(Kappers,1967;Knudsen,1983;Conlee & Parks,1986;Takahashi & Konishi,1988)(图 5)。
|
| 图 5 爬行类听觉核团投射关系示意图 Fig. 5 The schematic diagram of projections from auditory |
两栖类SO核团中神经元的放电形式也与哺乳动物SOC的及其相似(Condon et al,1994)。爬行动物的前庭核团NM、NA与鸟类的NM、NA形态、位置、细胞结构都极其相似,应属同源核团。之前的研究推测,这2个核团分别同哺乳动物的前腹侧耳蜗核和后腹侧耳蜗核具有一定的同源性(Kappers,1967;Carr & Code,2000),但这类论证资料较为零散,而且彼此矛盾。与爬行动物相同的是,NL核团的特殊细胞列阵结构,用于感知ITD来进行空间定位。我们实验结果中观察到的半水栖龟类和水栖龟类次级听觉核团NL的差异十分明显,红耳龟的由1~2列不同列分布的双极细胞列阵构成,而中华鳖的则呈现出较为无序的零星双极细胞,形成一个不太规则的细胞列阵。而这种差异也早在不同鸟类的听觉系统中发现类似的效应,比如仓鸮准确的声音定位能力得益于其大量的双极细胞并排布为更加复杂的核团结构,从而可以提高区分声源角度、距离的分辨率达到识别目标位置的目的(Kubke & Carr,2006)。众所周知,声波在水中的传播速度是空气中的4~5倍,水栖种类要感受ITD也就变得更为困难,其NL核团结构的作用机理还不完全清楚,双极细胞的散乱分布,是感知双耳时间差功能的退化,还是用更新的方法进行编码,仍有待研究。但可以肯定的是,生境、生理的差异对龟鳖类脑干听觉核团造成了重要的影响。
| Belekhova M, Chudinova T, Kenigfest N, et al. 2008. Distribution of metabolic activity (cytochrome oxidase) and immunoreactivity to calcium-binding proteins in the turtle brainstem auditory nuclei[J]. Journal of Evolutionary Biochemistry and Physiology, 44: 354-364. |
| Belekhova M, Chudinova T, Repéran J, et al. 2010. Core-and-belt organisation of the mesencephalic and forebrain auditory centres in turtles: Expression of calcium-binding proteins and metabolic activity[J]. Brain Research, 1345: 84-102. |
| Belekhova M, Kenigfest N, Minakova M, et al. 2003. Calcium-binding proteins in the turtle thalamus. analysis in the light of hypothesis of the "core-matrix" thalamic organization in relation to the problem of homology of thalamic nuclei among amniotes[J]. Journal of Evolutionary Biochemistry and Physiology, 39(6): 624-647. |
| Belekhova M, Kenigfest N, Karamian O, et al. 2004. Distribution of calcium-binding proteins in the central and peripheral regions of the turtle mesencephalic center torus semicircularis[J]. Doklady Biological Sciences, 399: 451-454. |
| Boord R, Rasmussen G. 1963. Projection of the cochlear and lagenar nerves on the cochlear nuclei of the pigeon[J]. Journal of Comparative Neurology, 120(3): 463-475. |
| Boord R. 1968. Ascending projections of the primary cochlear nuclei and nucleus laminaris in the pigeon[J]. Journal of Comparative Neurology, 133(4): 523-541. |
| Braun K. 1990. Calcium-binding proteins in avian and mammalian central nervous system: localization, development and possible functions[J]. Progress in Histochemistry and Cytochemistry, 21: 1-64. |
| Braun K, Scheich H, Hezmann C, et al. 1991. Parvalbumin and calbindin-D28k immunoreactivity as developmental markers of auditory and vocal motor nuclei of the zebra finch[J]. Neuroscience, 40(3): 853-869. |
| Braun K, Piepenstock A. 1993. Parvalbumin-immunoreactive neurons in the subcortical auditory pathway of the mongolian gerbil (Meriones unguiculatus)[J]. Acta Histochem Cytochem, 26(6): 543-554. |
| Braun K, Scheich H, Schachner M, et al. 1985. Distribution of parvalbumin, cytochrome oxidase activity and 14C-2-deoxyglucose uptake in the brain of the zebra finch[J]. Cell Tissue Research, 240(1): 101-115. |
| Carr C, Konishi M. 1990. A circuit for detection of interaural time differences in the brain stem of the barn owl[J]. Journal of Neuroscience, 10(10): 3227-3246. |
| Carr C, Boudreau R. 1991. Central projections of auditory nerve fibers in the barn owl[J]. Journal of Comparative Neurology, 314(2): 306-318. |
| Carr C, Code R. 2000. The central auditory system in reptiles and birds[M].// Dooling R, Fay R, Popper A. Comparative hearing: birds and reptiles. New York: Springe: 1-400. |
| Celio M. 1990. Calbindin D-28k and parvalbumin in the rat nervous system[J]. Neuroscience, 35: 375-475. |
| Condon C, White K, Feng A, et al. 1994. Processing of amplitude-modulated signals that mimic echoes from fluttering targets in the inferior colliculus of the little brown bat, Myotis lucifugus[J]. Journal of Neurophysiology, 71(2): 768-784. |
| Conlee J, Parks T. 1986. Origin of ascending auditory projections to the nucleus mesencephalicus lateralis pars dorsalis in the chicken[J]. Brain Research, 367(1): 96-113. |
| Dávila J, Guirado S, Puelles L. 2000. Expression of calcium-binding proteins in the diencephalon of the lizard Psammodromus algirus[J]. Journal of Comparative Neurology, 427(1): 67-92. |
| Feddersen W, Sandel T, Teas D, et al. 1957. Localization of high frequency tones[J]. Journal of the Acoustical Society of America, 5:82-108. |
| Fitzpatrick D, Batra R, Kuwada S. 1997. Neurons sensitive to interaural temporal disparities in the medial part of the ventral nucleus of the lateral lemniscus[J]. The Journal of Neurophysiology, 78: 511-515. |
| Foster R, Hall W. 1978. The organization of central auditory pathways in a reptile, Iguana iguana[J]. Journal of Comparative Neurology, 178: 783-831. |
| Gelfand S. 2004. Hearing: an introduction to psychological and physiological acoustics (4th Edition)[M]. New York: Marcel Dekker. |
| Glatt A. 1975. Vergleichend morphologische untersuchungen am akustischen system einiger ausgewahlter reptilien. B. Sauria, Testudines[J]. Revue Suisse de Zoologie, 82: 469-494. |
| Grau-Serrat V, Carr C, Simon J. 2003. Modeling coincidence detection in nucleus laminaris[J]. Biological Cybernetics, 89(5): 388-395. |
| Huang Y, Zhang J, Xi C, et al. 2011. Germinal sites and migrating routes of cells in the mesencephalic and diencephalic auditory areas in the African clawed frog Xenopus laevis[J]. Brain Res, 1373: 67-78. |
| Jeffress L. 1948. A place theory of sound localization[J]. Journal of Comparative Physiological Psychology, 41(1): 35-39. |
| Jones E. 1998. Viewpoint: the core and matrix of thalamic organization[J]. Neuroscience, 85(2): 331-345. |
| Kappers J. 1967. The sensory innervation of the pineal organ in the lizard, Lacerta viridis, with remarks on its position in the trend of pineal phylogenetic structural and functional evolution[J]. Cell and Tissue Research, 81(4): 581-618. |
| Knudsen E. 1983. Subdivisions of the inferior colliculus in the barn owl (Tyto alba)[J]. Journal of Comparative Neurology, 218(2): 174-186. |
| Knudsen E, Konishi M. 1979. Mechanisms of sound localization in the barn owl (Tyto alba)[J]. Journal of Comparative Physiology, 133(1): 13-21. |
| Kubke M, Carr C. 2006. Morphological variation in the nucleus laminaris of birds[J]. International Journal of Comparative Psychology, 19: 83-97. |
| Kubke M, Gauger B, Basu L, et al. 1999. Development of calretinin immunoreactivity in the brainstem auditory nuclei of the barn owl (Tyto alba)[J]. Journal of Comparative Neurology, 415(2): 189-203. |
| Lachica E, Rübsamen R, Rubel E. 1994. GABAergic terminals in nucleus magnocellularis and laminaris originate from the superior olivary nucleus[J]. Journal of Comparative Neurology, 348: 403-418. |
| Miller M. 1975. The cochlear nuclei of some turtles[J]. Journal of Comparative Neurology, 159(3): 375-406. |
| Miller M, Kasahara M. 1979. The cochlear nuclei of some turtles[J]. Journal of Comparative Neurology, 185(2): 221-235. |
| Moiseff A, Konishi M. 1981. Neuronal and behavioral sensitivity to binaural time differences in the owl[J]. Journal of Neuroscience, 1(1): 40-48. |
| Parks T, Rubel E. 1978. Organization and development of the brainstem auditory nuclei of the chicken: primary afferent projections[J]. Journal of Comparative Neurology, 180: 435-448. |
| Parvizi J, Damasio A. 2003. Differential distribution of calbindin D28K and parvalbumin among functionally distinctive sets of structures in the macaque brainstem[J]. Journal of Comparative Neurology, 462(2): 153-167. |
| Payne R. 1962. How the barn owl locates prey by hearing. the living bird. first annual of the Cornell Laboratory of Ornithology[M]. Ithaca: New York: Laboratory of Ornithology, Cornell University: 151-159. |
| Rogers J. 1989. Two calcium-binding proteins mark many chick sensory neurons[J]. Neuroscience, 31: 697-709. |
| Schnitzler HU, Flieger E. 1983. Detection of oscillating target movements by echolocation in the greater horseshoe bat[J]. Journal of Comparative Physiology, 153: 385-391. |
| Takahashi T, Carr C, Brecha N, et al. 1987. Calcium binding protein-like immunoreactivity labels the terminal field of nucleus laminaris of the barn owl[J]. Journal of Neuroscience, 7(6): 1843-1856. |
| Takahashi T, Konishi M. 1988. Projections of nucleus angularis and nucleus laminaris to the lateral lemniscal nuclear complex of the barn owl[J]. Journal of Comparative Neurology, 274(2): 212-238. |
| Vater M, Braun K. 1994. Parvalbumin, calbindin D-28k, and calretinin immunoreactivity in the ascending auditory pathway of horseshoe bats[J]. Journal of Comparative Neurology, 341(4): 534-558. |
| Westerberg B, Schwarz D. 1995. Connections of the superior olive in the chicken[J]. Journal of Otolaryngology, 24(1): 20-30. |
| Whitehead M, Morest D. 1981. Dual populations of efferent and afferent cochlear axons in the chicken[J]. Neuroscience, 6(11): 2351-2365. |
| Yan K, Tang Y, Carr C. 2010. Calcium-binding protein immunoreactivity characterizes the auditory system of Gekko gecko[J]. Journal of Comparative Neurology, 518: 3409-3426. |
| Young S, Rubel E. 1983. Frequency-specific projections of individual neurons in chick brainstem auditory nuclei[J]. Journal of Neuroscience, 3(7): 1373-1378. |
| Zettel M, Carr C, O'Neill W. 1991. Calbindin-like immunoreactivity in the central auditory system of the mustached bat, Pteronotus parnellii[J]. Journal of Comparative Neurology, 313(1): 1-16. |
 2015, Vol. 34
2015, Vol. 34