扩展功能
文章信息
- 张贵生
- ZHANG Guisheng
- 邻苯二甲酸二(2-乙基己基)酯长期暴露对鲤鱼毒理学指标的影响
- Effect of Di-(2-ethylhexyl) Phthalate on the Toxicology Parameter of Cyprinus carpio under a Long-term Exposure
- 四川动物, 2015, 34(2): 256-263
- Sichuan Journal of Zoology, 2015, 34(2): 256-263
- 10.3969/j.issn.1000-7083.2015.02.016
-
文章历史
- 收稿日期:2014-07-26
- 接受日期:2014-11-03
邻苯二甲酸二(2-乙基己基)酯[Di-(2-ethylhexyl)phthalate,DEHP]是人工合成的邻苯二甲酸酯类化合物(PAEs)中的一种,其产量每年超过200万吨,可被广泛用作增塑剂、软化剂,及服装、化妆品、地板、涂料、儿童玩具等的原料,由于DEHP的广泛应用,在水体(申艳艳等,2010)、大气(Fromme et al.,2013)、土壤(Sánchez-Avila et al.,2011;崔明明等,2013)、生物体内(Ikonomou et al.,2012)等均检出了该种物质。现已证实,DEHP是一种持久的有机污染物(POPs),由于其污染无处不在,因此DEHP对生物体的生物学效应及机理研究一直是一个热点问题。有研究表明,DEHP具有生殖毒性,能使斑马鱼胚胎孵化率降低、心脏发育畸形(何秀婷等,2010),幼鼠生精上皮受损(马洪等,2012)。此外,DEHP还具有神经毒性(Testa et al.,2012)、免疫毒性(Kitaoka et al.,2013),并诱发细胞凋亡(Aung et al.,2014)等。但目前DEHP对生物体的毒性效应及机理研究多集中于哺乳类,而对水生动物的影响研究较少。抗氧化防御系统是机体抵抗外界环境污染物胁迫的重要屏障,可清除因环境有毒物质胁迫而产生的多余自由基,以保护机体免受伤害,但组成抗氧化防御系统的活性成分或含量也会因污染物的影响而发生改变,因此可作为环境污染物胁迫的指标(王丽丽,2012)。7-乙氧基-3-异吩噁唑酮-脱乙基酶(EROD)和谷胱甘肽硫转移酶(GST)都是肝脏内重要的解毒酶。EROD是机体内参与外源有机污染物Ⅰ相反应代谢过程中的重要解毒酶,可催化外源有机污染物的代谢,增加其极性及亲水性,促进其排泄(Voskoboinik et al.,1997)。GST是机体内参与外源有机污染物Ⅱ相反应代谢过程中的重要解毒酶,可催化谷胱甘肽(GSH)与某些内源或外源性有害物质反应,生成更易溶解的、无毒的衍生物(Gadagbui & James,2000),因此,EROD和GST的酶活性变化在环境毒理学上已被作为评价环境有机污染物生物毒性的敏感指标。葡萄糖-6-磷酸脱氢酶(G-6-PD)是磷酸戊糖途径的限速酶,其活性决定了葡萄糖-6-磷酸进入此途径的流量。Na+K+-ATPase和Ca2+Mg2+-ATPase分别是维持细胞内外钠钾和钙镁离子平衡的重要酶类,其活性大小对维持细胞的正常功能起重要作用。单胺氧化酶(MAO)是参与体内单胺类物质代谢的主要功能酶类,可促进胶原分子内及分子间的交联,其活性的变化反映着肝组织的纤维化程度(唐望先等,2006)。γ-谷氨酰转肽酶(γ-GT)在肝内主要存在于肝细胞浆中,肝组织发生病变时,其酶活性就会发生变化(谢岚,2011;章海军,2014)。因此,MAO和γ-GT常被用来作为肝组织损伤的标志酶。同时,这些不同酶类的活性变化也反映着机体内不同物质的代谢状况,因而也能从物质代谢方面了解环境污染物的毒性机理。目前,DEHP对鱼类抗氧化性的研究有少量报道,但并不系统,对于鱼类肝解毒酶、能量代谢酶和肝损伤标志酶的影响尚未见报道。鲤鱼Cyprinus carpio Linnaeus是重要的水生经济动物,也是研究水环境毒理学的良好模式动物之一。本实验以鲤鱼为受试动物,研究了DEHP对鲤鱼肝脏抗氧化防御系统和肝解毒酶GST、EROD,能量代谢酶G-6-PD、Na+K+-ATPase、Ca2+Mg2+-ATPase,肝脏损伤标志酶γ-GT和MAO活力的影响,期望能为探讨DEHP对水生动物的致毒机理,筛选邻苯二甲酸酯类污染物的生物标志物提供科学依据。 1 材料与方法 1.1 实验材料 1.1.1 实验动物
鲤鱼由山东省菏泽市牡丹区鱼苗场提供,体质量67.46~76.32 g,实验前驯养15 d。 1.1.2 仪器及试剂
紫外可见分光光度计(TU-1810,北京普析);台式高速冷冻离心机(Eppendorf-5417R);自制玻璃缸(120 cm×80 cm×60 cm)等。吐温80、DEHP、三羟甲基氨基甲烷(Tris)、MgCl2、葡萄糖-6-磷酸、甲醇、磷酸二氢钠,磷酸氢二钠等均为国产分析纯;还原性辅酶Ⅱ四钠盐(NADPH)、7-羟基-3-异酚噁唑酮(RF)由Sigma公司生产。SOD、MDA、谷胱甘肽过氧化物酶(GSH-PX)、过氧化氢酶(CAT)、抗羟自由基能力、抗超氧阴离子自由基能力、GST、Na+K+-ATPase、Ca2+Mg2+-ATPase、MAO、γ-GT、组织蛋白测定试剂盒均购自南京建成生物科技有限公司。 1.2 实验方法 1.2.1 实验动物的处理
先以吐温80助溶,配制成含DEHP为120 g·L-1的母液,再以该母液分别配制成含DEHP分别为5 mg·L-1、20 mg·L-1、80 mg·L-1、160 mg·L-1的4个DEHP处理组(本实验浓度的设定是依据DEHP对鲤鱼苗的急性毒性实验结果及水体中DEHP的含量和其他相关文献资料确定),同时,设水空白对照组和吐温80对照组,共6个实验组[吐温80对照组和4个DEHP组中的吐温80含量均相同,质量分数小于0.01%,符合中国药典(CP2005)添加标准],每组设3个平行,每组放置鲤鱼30尾。实验在玻璃缸内进行,实验用水为曝气2 d的自来水,每缸处理液均为102 L,水温(18±2)℃,溶氧量大于6 mg·L-1,pH值6.5~7.0,水质符合中国渔业水质标准(GB11607-89),试验期间充氧机不间断充氧,每天早上08∶00饲喂饵料一次,2 d换水一次,每次换去1/3水量,每6 d全部更换处理液一次,将鲤鱼浸泡染毒20 d。 1.2.2 样品的采集和制备
浸泡染毒20 d时,从每组随机各取鲤鱼6尾,称重、解剖、取肝,并用0.68%的生理盐水将血渍冲洗干净,吸干水分,按质量(g)∶体积(mL)=1∶5的比例,加入0.68%的冰冷生理盐水,匀浆,离心(4 ℃,4000 r·min-1)15 min,取上清液进行相关指标的测定。 1.2.3 生化指标的测定
SOD、CAT、GSH-PX、MDA、MAO、GST、Na+K+-ATPase、Ca2+Mg2+-ATPase、γ-GT酶活性及抗羟自由基能力、抗超氧阴离子自由基能力和肝组织蛋白含量的测定均严格按试剂盒进行。
G-6-PD活力的的测定参考江泉观等(1994)的方法:酶活力单位定义为每mg组织蛋白每分钟产生1 μmoL NADPH为一个国际单位。
酶活力(U·mgprot-1)=8095×⊿A/(⊿t×mgprot)。
EROD的测定采用Pohl和Fouts(1980)的方法,EROD酶的活力单位为pmol·(min·mgprot)-1。1.3 统计分析
试验结果以平均值±标准差表示。对照组和吐温80组间,对照组、吐温80组和各DEHP处理组间使用SPSS软件进行单因素方差分析(One-Way ANOVA),两两比较采用最小显著差数法(LSD),P<0.05表示差异有统计学意义,P<0.01表示差异有高度统计学意义。 2 结果与分析 2.1 DEHP对鲤鱼肝脏抗氧化防御系统的影响
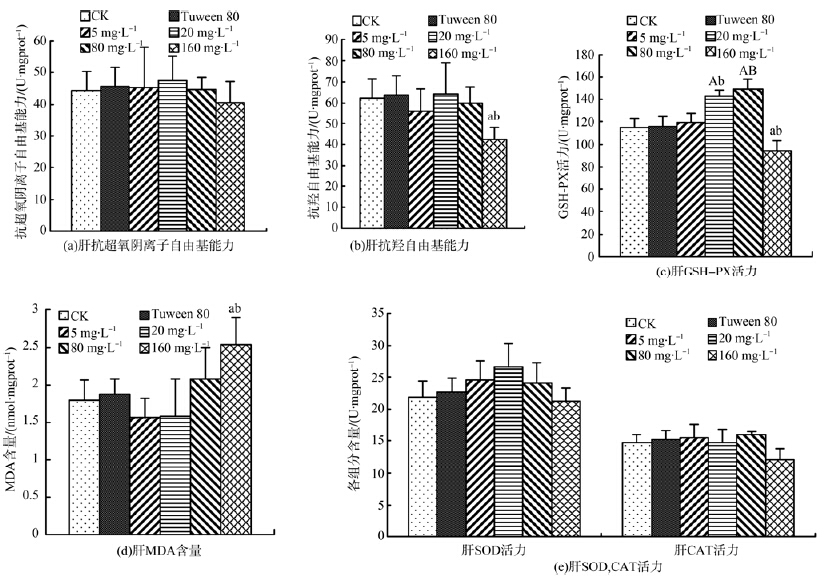
图 1显示吐温80组与水空白对照组相比,肝脏SOD、GSH-PX、CAT活力,MDA含量及抗羟自由基能力、抗超氧阴离子自由基能力的差异均无统计学意义,说明本实验助溶剂吐温80添加量对肝脏抗氧化防御系统的影响可不予考虑。DEHP暴露20 d时,与水空白对照组和吐温80组相比,图 1(a,e)显示肝脏SOD、CAT活力及抗超氧阴离子自由基能力均无显著性变化,而从图 1(c)可看出20 mg·L-1、80 mg·L-1组肝GSH-PX活力显著升高,160 mg·L-1组GSH-PX活力却显著降低,表现出了低浓度促进和高浓度抑制的特点。图 1(b,d)显示,与水空白对照组和吐温80组相比,5 mg·L-1、20 mg·L-1、80 mg·L-1组抗羟自由基能力和MDA含量均无显著性变化,而160 mg·L-1组抗羟自由基能力显著降低,MDA含量显著升高。这表明较高质量浓度的DEHP长期暴露能一定程度地影响鲤鱼肝脏抗氧化防御系统,并对肝细胞有损伤作用。
|
|
图 1 DEHP对鲤鱼肝脏组织抗氧化防御系统的影响
Fig. 1 Effect of DEHP on antioxidant defense system of liver in carp
注: 与水空白对照组相比,"a"表示差异有统计学意义(P<0.05),"A"表示差异有高度统计学意义(P<0.01); 与吐温80组相比,"b"表示差异有统计学意义(P<0.05),"B"表示差异有高度统计学意义(P<0.01); 下同。 Notes: Compared with the water control group,"a" represents significant difference(P<0.05),"A" represents extremely significant difference(P<0.01); Compared with tuween 80 group,"b" represents significant difference(P<0.05),"B" represents extremely significant difference(P<0.01); the same bellow. |
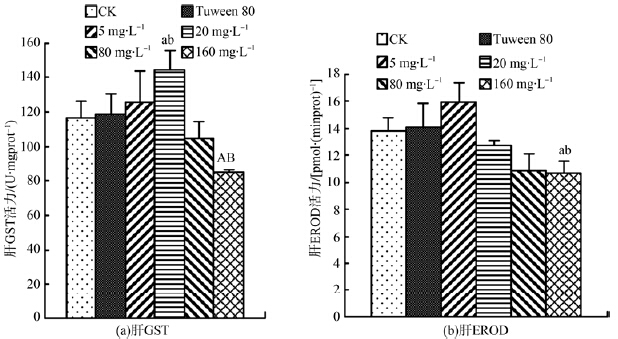
图 2显示吐温80组肝脏GST和EROD活力略高于水空白对照组,但差异均无统计学意义,说明本实验中吐温80的添加量对GST和EROD活力无明显影响。与水空白对照组和吐温80组相比,图 2(a)显示20 mg·L-1组明显促进了GST活力,160 mg·L-1组却受到明显抑制,图 2(b)显示,5 mg·L-1、20 mg·L-1、80 mg·L-1组肝EROD活力无明显变化,160 mg·L-1组却能显著抑制EROD的活力。这表明长期暴露,较低质量浓度的DEHP能促进肝脏GST的活力,较高质量浓度的DEHP则能明显抑制GST、EROD的活力。
|
| 图 2 DEHP对鲤鱼肝脏GST和EROD活力的影响 Fig. 2 Effect of DEHP on GST and EROD activities of liver in carp |
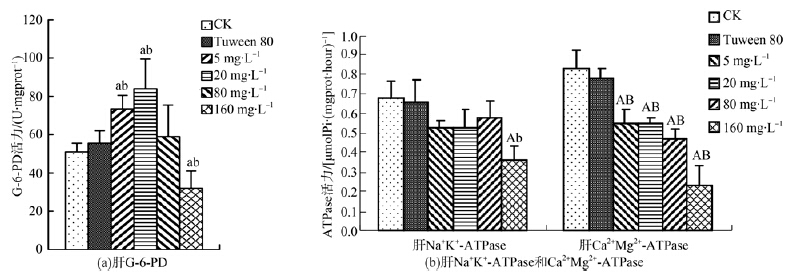
图 3显示,与水空白对照组相比,吐温80组肝G-6-PD活力略有升高,Na+K+-ATPase和Ca2+Mg2+-ATPase活力略有降低,但差异均无统计学意义,说明本实验中,吐温80的添加量对这3种酶活力无明显影响。图 3(a)显示DEHP暴露20 d时,与水空白对照组和吐温80组相比,5 mg·L-1、20 mg·L-1组G-6-PD活力显著升高,160 mg·L-1组显著降低,表现出了低浓度促进和高浓度抑制的特点。图 3(b)可看出,各DEHP组Ca2+Mg2+-ATPase活力均受到了极显著抑制,且显示出了剂量效应关系,而5 mg·L-1、20 mg·L-1、80 mg·L-1组Na+K+-ATPase活力与水空白对照组和吐温80组相比的差异均无统计学意义,160 mg·L-1组Na+K+-ATPase活力显著低于吐温80组,却极显著低于水空白对照组,说明DEHP对Na+K+-ATPase活力的影响,吐温80可能也起到了一定的协同作用。表明较高质量浓度的DEHP能明显抑制鲤鱼的能量代谢及细胞内外的离子平衡。
|
| 图 3 DEHP对鲤鱼肝脏G-6-PD、Na+K+-ATPase和Ca2+Mg2+-ATPase活力的影响 Fig. 3 Effect of DEHP on G-6-PD,Na+K+-ATPase and Ca2+Mg2+-ATPase activities of liver in carp |
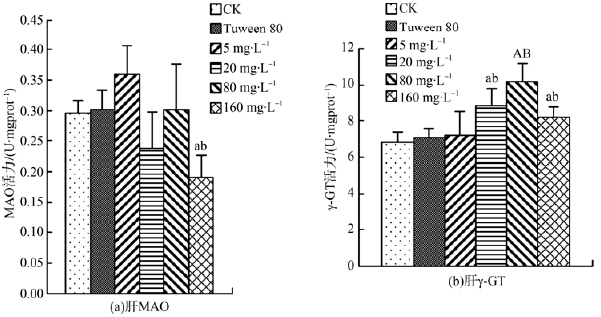
图 4显示吐温80组与水空白对照组相比,肝MAO和γ-GT活力的差异均无统计学意义。图 4(a)显示,与水空白对照组和吐温80组相比,5 mg·L-1、20 mg·L-1、80 mg·L-1组MAO活力无显著性变化,160 mg·L-1组MAO活力却显著降低。图 4(b)显示肝γ-GT活性随DEHP浓度的升高表现为先升高后降低,但20 mg·L-1、80 mg·L-1、160 mg·L-1组γ-GT活性均显著高于水空白对照组[KG(3x]和吐温80组。表明较高质量浓度的DEHP对肝脏具有一定的损伤。
|
| 图 4 DEHP对鲤鱼肝脏MAO和γ-GT活力的影响 Fig. 4 Effect of DEHP on MAO and γ-GT activities of liver in carp |
当机体受到外界环境污染物胁迫时,体内会产生超氧阴离子自由基(O-2)、羟自由基(·OH)等,自由基的累积会攻击细胞膜,引起膜脂质过氧化,进而诱发DNA损伤、基因突变、癌变等(张贵生,2008)。但机体内存在着抗氧化防御系统,可清除体内多余的自由基,使机体免受损伤。抗氧化防御系统主要由SOD、GSH-PX、CAT等酶系统和辅酶Q,维生素C等非酶系统组成,其中酶系统在清除自由基方面起着关键作用(丁为群等,2012)。SOD是专一清除多余的O-2,可将O-2歧化为H2O2和O2的酶。GSH-PX、CAT则可清除多余的H2O2、·OH等,同时,GSH-PX对自由基的清除作用须有解毒物质GSH的参与(李进寿等,2013)。当机体受到外界环境有毒物质胁迫时,SOD、GSH-PX、CAT酶活性就会发生不同程度的改变,进而影响机体的抗氧化防御能力,因此,SOD、GPH-PX、CAT的酶活性可作为外界环境污染物胁迫的指标(薛银刚等,2009),同时,也可作为机体抗氧化防御能力是否受影响的指标。MDA是机体细胞膜发生脂质过氧化的产物之一,MDA含量的变化可作为评价机体细胞及机体抗氧化防御能力是否受损伤的毒理学指标。抗O-2和抗·OH能力是反映机体抗氧化防御系统中酶系统和非酶系统总的清除O-2和·OH的能力,因此其变化可作为机体受外界污染物胁迫时抗氧化能力的综合指标。
本实验结果表明,DEHP暴露20 d时,鲤鱼肝SOD、CAT活性无显著性变化,GSH-PX活性表现为低促高抑的特点。说明DEHP对这3种酶的影响存在差异性。原因可能是DEHP能诱导ROS的产生(Wang et al.,2012)。由于肝的抗氧化功能强大,ROS的累积量较少,所以肝SOD、CAT活性无明显变化,而GSH-PX活力的变化可能与GSH含量的变化有关。一般认为,组织的抗超氧阴离子自由基能力主要与SOD的活性有关,抗羟自由基能力主要与CAT及GSH-PX的活性等有关,本实验结果表明,DEHP对抗超氧阴离子自由基能力无显著性影响,这与DEHP对SOD活性的影响结果基本一致。抗·OH能力在5 mg·L-1、20 mg·L-1、80 mg·L-1组无显著性变化,在160 mg·L-1组却显著降低。提示DEHP对抗·OH能力的影响,GSH-PX可能起着关键作用(黄宏妙等,2010),另外,非酶系统也可能起着一定的作用,具体原因有待进一步研究。MDA含量的测定结果表明,较高浓度的DEHP(160 mg·L-1)明显诱导了肝组织的脂质过氧化,这与对抗·OH能力的影响结果相一致,与对抗O-2能力的影响结果不同。说明,DEHP对肝组织的损伤,可能是由于·OH累积的结果。到目前为止,DEHP对动物抗氧化性的影响也有不少报道。Madkour(2012)用500 mg·kg-1和1000 mg·kg-1的DEHP饲喂大鼠4周,发现DEHP显著促进了肝脏SOD、CAT、GSH-PX的活性。而陈文婕等(2012)用1500 mg·kg-1、3000 mg·kg-1的DEHP饲喂大鼠4周,却发现肝脏SOD、GPX活性显著降低,MDA含量上升。秦洁芳等(2011)报道,用不同浓度的DEHP对红鳍笛鲷急性浸泡染毒,肝脏SOD主要表现为激活,MDA含量具有波动性。可看出,这些实验结果之间及与本实验结果之间并不完全一致。原因可能与DEHP的剂量、染毒时间、染毒方式及动物种类有关,具体机制有待进一步深入研究。
G-6-PD的酶活性决定了葡萄糖-6-磷酸进入磷酸戊糖途径的流量。该途径可产生ATP和NADPH等(Wood,1986)。GSH是维持细胞膜稳定性和完整性的重要解毒物质,NADPH对维持GSH的正常含量有重要的作用,而Na+K+-ATPase和Ca2+Mg2+-ATPase要维持细胞内Na+和Ca2+的稳态须有ATP提供能量。同时,Na+K+-ATPase和Ca2+Mg2+-ATPase活性降低,会引起细胞内Na+和Ca2+超载,从而导致物质代谢紊乱(刘云儒,汤乃军,2010)。本实验结果表明,DEHP对肝脏G-6-PD具有低促高抑的特点。说明DEHP质量浓度较低时,通过磷酸戊糖途径会产生更多的NADPH和ATP。而NADPH的增多可生成更多的GSH,以补充清除DEHP等所消耗的GSH。当DEHP质量浓度较高(160 mg·L-1)时,G-6-PD活性受到抑制,说明磷酸戊糖途径受阻,NADPH和ATP生成量减少,进而GSH的生成量减少,清除DEHP的能力减弱。DEHP引起G-6-PD活性变化的机制目前尚不清楚,有待进一步深入研究。本实验结果中,各DEHP组,Ca2+Mg2+-ATPase活性均受到了极显著抑制,且浓度越高,抑制作用越强,而Na+K+-ATPase活性在较高DEHP(160 mg·L-1)组才受到了显著抑制。说明Ca2+Mg2+-ATPase对DEHP较为敏感。DEHP能致Na+K+-ATPase和Ca2+Mg2+-ATPase活性降低,原因可能是DEHP能通过抑制葡萄糖调控蛋白(GRP58)基因的转录(Muhlenkamp & Gill,1998),影响葡萄糖的代谢,使ATP生成量发生变化所致,也可能是DEHP能使机体抗氧化能力降低,引起了肝细胞脂质过氧化所致。提示,DEHP可影响磷酸戊糖途径,引起细胞内Na+和Ca2+超载,使机体代谢紊乱。Dhanya等(2003)报道,用7.5 mg·kg-1的DEHP饲喂大鼠7 d,红细胞及肝组织Na+K+-ATPase活性受到了明显抑制,并引起了红细胞内Ca2+的蓄积和Mg2+的减少,这与本实验结果基本一致。但也有相反结果的报道,鲍利峰(2007)用400 mg·kg-1的DEHP饲喂小鼠14 d,结果发现,Na+K+-ATPase和Ca2+Mg2+-ATPase活性均显著高于对照组,其原因尚不清楚,可能是因为受试动物DEHP剂量或染毒时间不同所致。
DEHP暴露对鲤鱼肝EROD活性的影响结果表明,较低质量浓度的DEHP对EROD活性无明显影响,而160 mg·L-1组EROD活性却被显著抑制,原因可能是较高质量浓度的DEHP抑制了EROD(CYPA-1)的基因表达所致(Lu et al.,2013)。Voskoboinik等(1997)报道,用DEHP饲养大鼠,并未诱导EROD活性升高;王建书(2011)报道,DEHP短期染毒对张氏肝细胞EROD活力无明显影响,这与本实验较低浓度的DEHP的实验结果相一致,但与较高浓度的DEHP的影响结果不同,其原因可能与DEHP在机体内的蓄积量有关(聂湘平等,2008)。本实验结果还表明,DEHP暴露对肝GST活性具有低促高抑特点,原因可能是较低浓度的DEHP能诱导GSH和GST基因的表达,在GST催化作用下,DEHP与GSH结合,从而达到解毒的目的,但浓度较高时,GSH可能会大量消耗,从而导致GST基因表达量减少,GST活性降低。这与本实验中G-6-PD的变化规律相印证。同时也与Lu等(2013)报道的,对花蛤急性染毒,GST基因的表达与DEHP的剂量呈负相关的实验结果基本一致。提示较高浓度的DEHP能阻碍Ⅰ相和Ⅱ相反应的代谢过程,使机体的解毒能力减弱。同时还提示EROD、GST活性可作为DEHP环境污染的良好指标。
本实验结果中,DEHP暴露20 d时,160 mg·L-1组,MAO活性被显著抑制,而20 mg·L-1以上组γ-GT活性均显著高于水空白对照组和吐温80组,说明较高浓度的DEHP会对肝组织产生毒害作用,引起肝脏病变,但并不会诱发肝脏的纤维化。这与本实验DEHP引起MDA含量的升高,及陈文婕等(2012)报道的,用750~1500 mg·kg-1的DEHP饲喂小鼠,肝脏组织受到了明显损伤的实验结果相一致。至于DEHP对MAO和γ-GT活性的影响机理尚不清楚,有待进一步深入研究。4 结论
DEHP长期暴露能一定程度地影响肝脏的抗氧化防御能力。同时,DEHP暴露也能影响肝脏GST、EROD、G-6-PD、Na+K+-ATPase、Ca2+Mg2+-ATPase和肝脏γ-GT、MAO的酶活力,使肝细胞的能量代谢和物质代谢紊乱,并可导致肝组织损伤。同时,本实验结果也为筛选邻苯二甲酸酯类的生物标志物提供了参考依据。
致谢:课题组成员吴红松老师,朱道玉教授,张红梅、周长路副教授为本实验做了大量工作,谨表谢意!| 鲍利峰. 2007. 邻苯二甲酸二异辛酯对小鼠不同脏器ATPase活性的影响及其机制的研究[D]. 武汉: 华中师范大学. |
| 陈文婕, 戴红, 陈敏, 等. 2012. 邻苯二甲酸二乙基己酯(DEHP)对小白鼠肝脏毒性及脂质过氧化损伤[J]. 生态毒理学报, 7(1): 93-98. |
| 崔明明, 王凯荣, 王琳琳, 等. 2013. 山东省花生主产区土壤和花生籽粒中邻苯二甲酸酯的分布特征[J]. 应用生态学报, 24(12): 3523-3530. |
| 丁为群, 刘迪秋, 葛峰, 等. 2012. 鱼类对重金属胁迫的分子反应机理[J]. 生物学杂志, 29(2): 84-87. |
| 何秀婷, 李潇, 杨永涛, 等. 2010. 邻苯二甲酸酯对斑马鱼胚胎发育的联合毒性[J]. 中山大学学报: 自然科学版, 49(5): 101-112. |
| 黄宏妙, 李灵, 郭占京, 等. 2010. 板栗毛壳水提液对大鼠脑缺血再灌注损伤后羟自由基、NO和GSH-PX的影响[J]. 时珍国医国药, 21(11): 2917-2918. |
| 江泉观, 于永强. 1994. 雄(男)性生殖毒理学[M]. 北京: 北京医科大学, 中国协和医科大学联合出版社: 229-235. |
| 李进寿, 阮俊峰, 耿宏, 等. 2013. 多效唑暴露对褐菖鮋脾脏抗氧化防御系统的影响[J]. 厦门大学报: 自然科学版, 52(2): 267-272. |
| 刘云儒, 汤乃军. 2010. 2,3,7,8-四氯二苯并二嗯英急性染毒对小鼠脑组织中Na+K+-ATP酶和Ca2+-ATP酶活力的影响[J]. 中华劳动卫生职业病杂志, 28(6): 450-451. |
| 马洪, 杨俊杰, 李静, 等. 2012. 邻苯二甲酸二乙基己酯及代谢产物邻苯二酸-2-乙基己酯对幼鼠生精上皮的影响[J]. 中华小儿外科杂志, 33(3): 217-221. |
| 聂湘平, 李桂英, 吴志辉, 等. 2008. 4种酞酸酯在龙须菜-篮子鱼食物链中的积累放大研究[J]. 海洋科学, 32(1): 19-23. |
| 秦洁芳. 2011. 邻苯二甲酸酯类化合物对翡翠贻贝、红鳍笛鲷和紫红笛鲷的毒性效应[D]. 上海: 上海海洋大学. |
| 申艳艳, 吴淑燕, 殷雪琰, 等. 2010. 玄武湖中邻苯二甲酸酯的测定及分布特征[J]. 东南大学学报: 自然科学版, 40(6): 1337-1341. |
| 唐望先, 吴翠环, 金琦, 等. 2006. 肝炎平对日本血吸虫肝纤维化兔肝脏酶组织化学作用的研究[J]. 中国组织化学和细胞化学杂志, 15(1): 82-86. |
| 王建书. 2011. DEHP和BaP联合染毒对人张氏肝细胞EROD和ECOD 酶活性及凋亡的影响[D]. 武汉: 华中科技大学. |
| 王丽丽, 夏斌, 陈碧鹃, 等. 2012. 镉胁迫对虾夷扇贝抗氧化防御系统的影响[J]. 海洋环境科学, 31(1): 39-42. |
| 谢岚. 2011. 食用白酒对大鼠肝结构和功能的影响[D]. 遵义: 遵义医学院. |
| 薛银刚, 王晓蓉, 顾雪元, 等. 2009. 四溴双酚A对赤子爱胜蚓的急性毒性及抗氧化防御系统酶的影响[J]. 生态毒理学报, 4(1): 93-100. |
| 张贵生. 2008. 镧对鲤鱼肾和鳃抗氧化性和酯酶同工酶的影响[J]. 生态学杂志, 27(8): 1337-1342. |
| 章海军. 2014. ALT、AST、ALP、γ-GT组合实验室检验结果分析[J]. 医学信息, 27(4): 66. |
| Aung KH, Win-Shwe TT, Kanaya M, et al. 2014. Involvement of hemeoxygenase-1 in di-(2-ethylhexyl) phthalate (DEHP)-induced apoptosis of neuro-2a cells[J]. J Toxicol Sci, 39(2): 217-229. |
| Dhanya CR, Indu AR, Deepadevi KV, et al. 2003. Inhibition of membrane Na+K+-ATPase of the brain, liver and RBC in rats administered di(2-ethyl hexyl) phthalate (DEHP) a plasticizer used in polyvinyl chloride (PVC) blood storage bags[J]. Indian J Exp Biol, 41(8): 814-820. |
| Fromme H, Lahrz T, Kraft M, et al. 2013. Phthalates in German daycare centers: occurrence in air and dust and the excretion of their metabolites by children (LUPE 3)[J]. Environ Int, 61: 64-72. |
| Gadagbui BKM, James MO. 2000. Activities of affinity-isolated glutathione S-transferase (GST) from channel catfish whole intestine[J]. Aquat Toxicol, 49: 27-37. |
| Ikonomou MG, Kelly BC, Blair JD, et al. 2012. An interlaboratory comparison study for the determination of dialkylphthalate esters in environmental and biological samples[J]. Environ Toxicol Chem, 31(9): 1948-1956. |
| Kitaoka M, Hirai S, Terayama H, et al. 2013. Effects on the local immunity in the testis by exposure to di-(2-ethylhexyl) phthalate (DEHP) in mice[J]. J Reprod Dev, 59(5): 485-490. |
| Lu Y, Zhang P, Li C, et al. 2013. Characterisation of immune-related gene expression in clam (Venerupis philippinarum) under exposure to di-(2-ethylhexyl) phthalate[J]. Fish Shellfish Immunol, 34(1): 142-146. |
| Madkour NK. 2012. The beneficial role of celery oil in lowering of di-(2-ethylhexyl) phthalate-induced testicular damage[J]. Toxicol Ind Health, 30(9): 861-872. |
| Muhlenkamp CR, Gill SS. 1998. A glucose-2-regulated protein, GRP58, is down-2-regulated in C57B6 mouse liver after diethylhexyl phthalate exposure[J]. Toxicol Appl Pharmacol, 148(1): 101-108. |
| Pohl RJ, Fouts JR. 1980. A rapid method for assaying the metabolism of 7-ethoxyresorufin by micro-somal subcellular fraction[J]. Anal Biochem, 107: 150-155. |
| Sánchez-Avila J, Fernandez-Sanjuan M, Vicente J, et al. 2011. Development of a multi-residue method for the determination of organic micropollutants in water, sediment and mussels using gas chromatography-tandem mass spectrometry[J]. J Chromatogr A, 1218(38): 6799-6811. |
| Testa C, Nuti F, Hayek J, et al. 2012. Di-(2-ethylhexyl) phthalate and autism spectrum disorders[J]. ASN Neuro, 4(4): 223-229. |
| Voskoboinik I, Ooi SG, Drew R, et al. 1997. Peroxisome proliferators increase the formation of BPDE-DNA adducts in isolated rat hepatocytes[J]. Toxicology, 122(1-2): 81-91. |
| Wang W, Craig ZR, Basavarajappa MS, et al. 2012. Di-(2-ethylhexyl) phthalate inhibits growth of mouse ovarian antral follicles through an oxidative stress pathway[J]. Toxicol Appl Pharmacol, 258(2): 288-295. |
| Wood T. 1986. Distribution of the pentose phosphate pathway in living organisms[J]. Cell Biochem Funct, 4: 235-240. |
 2015, Vol. 34(2)
2015, Vol. 34(2)



