扩展功能
文章信息
- 赵柳兰, 蒲粟, 杨淞, 杨黎, 李胜杰, 王艳, 杜宗君
- ZHAO Liulan, PU Su, YANG Song, YANG Li, LI Shengjie, WANG Yan, DU Zongjun
- 大口黑鲈外周血细胞显微结构、细胞化学特征及吞噬作用的研究
- Microstructure and Cytochemical Characterisation and Phagocytosis of the Peripheral Blood Cells in Micropterus salmoides
- 四川动物, 2015, 34(1): 69-75
- Sichuan Journal of Zoology, 2015, 34(1): 69-75
- 10.3969/j.issn.1000-7083.2015.01.011
-
文章历史
- 收稿日期:2014-07-26
- 接受日期:2014-09-25
2. 四川农业大学动物科技学院水产养殖系, 四川雅安 625014
2. College of Animal Science and Technology, Sichuan Agricultural University, Ya'an, Sichuan Province 625014, China
大口黑鲈Micropterus salmoides为鲈亚目Porcoidei太阳鱼科Cehtrachidae黑鲈属Micropterus鱼类,原产北美。因其营养价值高,肉质鲜美,深受人们的喜爱,是我国引进的重要淡水名特优养殖品种之一。近几年由于集约化程度的提高,大口黑鲈疾病频发,如溃疡病(邓国成等,2009)、肝脾肿大病(马冬梅等,2011)、诺卡菌病(蒋依依等,2012)等,严重制约该养殖品种的发展。鱼类主要依靠免疫系统来抵御外来病原生物的侵害,通过免疫防御功能来维持体内环境稳定(张永安等,2000)。血细胞是免疫防御体系的重要成分,具有吞噬、分泌等功能,还参与机体的免疫应答及具有损伤修复等功能(Ellis,1977),在鱼类疾病防治中起着重要作用。目前对大口黑鲈的研究主要集中在选育(白俊杰,李胜杰,2013)、生长调节因子(韩林强等,2011)等方面,其免疫防御功能的研究鲜见报道。因此,本研究通过对大口黑鲈血细胞显微结构、细胞化学及吞噬作用的研究,旨在丰富大口黑鲈免疫机制方面的基础资料,为弄清其如何应对环境变化的挑战提供重要线索。 1 材料和方法 1.1 实验材料
大口黑鲈,2013年6月购自四川省雅安市苍坪路市场,塑料袋充氧后运回实验室,暂养于玻璃水族箱内。水体为曝气24 h以上的自来水,pH为6.8,水温为25 ℃±0.5 ℃,24 h充氧,暂养3 d后挑选健康活泼的12尾二龄鱼(雌雄比为1∶1;体长:263.5 mm±8.2 mm;体质量:475.3 g±25.2 g)进行实验,期间不投饵料。 1.2 显微观察及细胞化学染色 1.2.1 血涂片的制作
用1 mL无菌注射器从鱼尾椎静脉取血,以1∶10体积比加入抗凝剂(0.1 mmol·L-1葡萄糖,10 mmol·L-1乙二胺四乙酸(EDTA),0.45 mmol·L-1氯化钠,pH7.0)置于离心管中,混匀后滴在用盐酸酒精处理后的干净玻片上,用盖玻片呈30°角轻推,制备血细胞单层涂片,置4 ℃冰箱30 min后,室温干燥,备用。 1.2.2 细胞形态观察计数
制作好的血涂片用新鲜配制的固定剂(2.5%戊二醛)在室温下固定10 min,Wright's染液染色,每尾鱼染10张,中性树胶封片。Nikon显微镜油镜观察并拍照,统计5000个细胞,进行血细胞分类、计数及细胞大小测定,数据用平均值±标准差表示。 1.2.3 细胞化学染色
血涂片干燥后进参照Shigdar等(2009)和da Silva等(2011)进行细胞化学染色。过碘酸-希夫氏反应(PAS)显示糖类物质,阴性对照用唾液淀粉酶消化;苏丹黑B(SBB)染色显示脂类物质;萘酚AS-BI磷酸酯法显示酸性磷酸酶(ACP),阴性对照将孵育液中萘酚AS-BI换成等量蒸馏水;偶氮偶联法显示碱性磷酸酶(AKP),阴性对照将孵育液中萘酚AS-BI换成等量蒸馏水;二氨基联苯胺(DAB)法显示过氧化物酶(POX),阴性对照孵育前90 ℃加热10 min;酚氧化酶染液[5 mg·mL-1左旋多巴(L-DOPA)溶于0.1 mol·L-1磷酸盐缓冲液(PBS)]中37 ℃下染色2 h显示酚氧化酶(PO),阴性对照用PBS代替L-DOPA。 1.3 血细胞吞噬实验 1.3.1 酵母菌的制备
称取5 g蔗糖,加蒸馏水定容至75 mL作为酵母培养基。将培养基加入100 mL三角瓶当中,在高压锅内以120 ℃灭菌30 min。待培养基稍稍冷却,向三角瓶中加入1 g干酵母(购自安琪酵母股份有限公司),用玻璃棒搅拌均匀,再用灭菌后的棉塞塞紧瓶口。然后把三角瓶放在25~30 ℃的培养箱,培养1~2 d,之后转移至4 ℃冰箱中保存。使用酵母前,将酵母液用血球计数板调整浓度至1×108 cfu/mL,备用。 1.3.2 血细胞酵母菌混合吞噬
新鲜抽取的外周血,经血抗凝剂1∶1混合后用0.1 M PBS稀释,在血球计数板上调整浓度为1×107 cfu/mL,备用。
在灭菌后的离心管内同时加入1 mL上述经调整浓度后的血液与酵母液,上下轻轻翻倒离心管30 s,使其充分混合,后置于37 ℃水浴锅中孵育50 min。孵育完成后向离心管中加入0.1 mL 0.25%戊二醛,终止吞噬,置于4 ℃冰箱中固定10 min,后涂片。待涂片干燥后用2.5%戊二醛固定5 min,再用Wright's液染色,封片。每尾鱼制作3张吞噬涂片,每张涂片统计200个细胞中吞噬酵母菌的个数,最后再计算出红细胞吞噬酵母菌的吞噬百分率,吞噬标准参考具体如下:接触酵母甚至自身变形伸出伪足或胞浆内含有酵母者为吞噬红细胞;吞噬百分率公式=(吞噬酵母红细胞数/计数红细胞数总数)×100%(王旭东,饶家荣,1996)。 2 结果 2.1 外周血细胞的显微结构
大口黑鲈的外周血细胞经Wright's染色,光镜观察可分为5种细胞,分别为红细胞、淋巴细胞、单核细胞、血栓细胞和3种形态的粒细胞(图版Ⅰ)。大口黑鲈外周血细胞的大小及白细胞计数统计结果见表 1。
| 白细胞分类计数 Differential leucocyte counts(DLC)/% | 细胞长径 The long diameter of cells/μm | 细胞短径 The short diameter of cells/μm | 细胞核长径 Long diameter of neucleus/μm | 细胞核短径 Short diameter of neucleus/μm | ||
| 红细胞 Erythrocyte | 10.77±0.87 | 6.93±0.61 | 4.09±0.33 | 2.72±0.19 | ||
| 粒细胞 Granulocyte | Ⅰ型粒细胞 TypeⅠgranulocyte | 10.34 | 8.19±0.36 | 7.24±0.17 | 3.38±0.14 | 2.75±0.06 |
| Ⅱ型粒细胞 TypeⅡgranulocyte | 7.69±0.54 | 7.12±0.79 | 6.02±0.60 | 4.64±0.71 | ||
| Ⅲ型粒细胞 TypeⅢgranulocyte | 9.17±0.54 | 7.49±0.93 | 6.38±0.73 | 5.36±0.48 | ||
| 淋巴细胞 Lymphocyte | 大淋巴细胞 Large lymphocyte | 60.92 | 7.77±0.24 | 6.44±0.36 | 6.25±0.45 | 5.00±0.58 |
| 小淋巴细胞 Small lymphocyte | 3.88±0.46 | 3.48±0.40 | 3.02±0.21 | 2.84±0.14 | ||
| 血栓细胞 Thrombocyte | 22.99 | 4.58±0.68 | 3.48±0.69 | 3.21±0.59 | 2.62±0.80 | |
| 单核细胞 Monocyte | 5.75 | 9.89±0.70 | 8.72±0.68 | 7.79±0.34 | 5.87±0.16 |
红细胞 大口黑鲈成熟的红细胞占血细胞总数的绝大部分,为98.12%,细胞表面光滑,呈椭圆形,细胞大小为(10.77±0.87)μm×(6.93±0.61)μm(表 1),细胞核中位,卵圆形或圆形,蓝紫色,胞质淡蓝色(图版Ⅰ:1)。在大口黑鲈外周血中,偶见较幼稚的红细胞,呈圆形或椭圆形,细胞核较大,染色质疏松,染色较浅,胞质浅蓝至无色(图版Ⅰ:1)。在外周血中还可见少量核固缩和正在分裂的红细胞(图版Ⅰ:2,3)。固缩红细胞的细胞核较正常红细胞小,染色较深,呈深蓝色(图版Ⅰ:2)。另外,在血涂片观察过程中还可见到“核影”红细胞(图版Ⅰ:26,27),其细胞较正常红细胞大,细胞核膨胀呈不规则圆形。
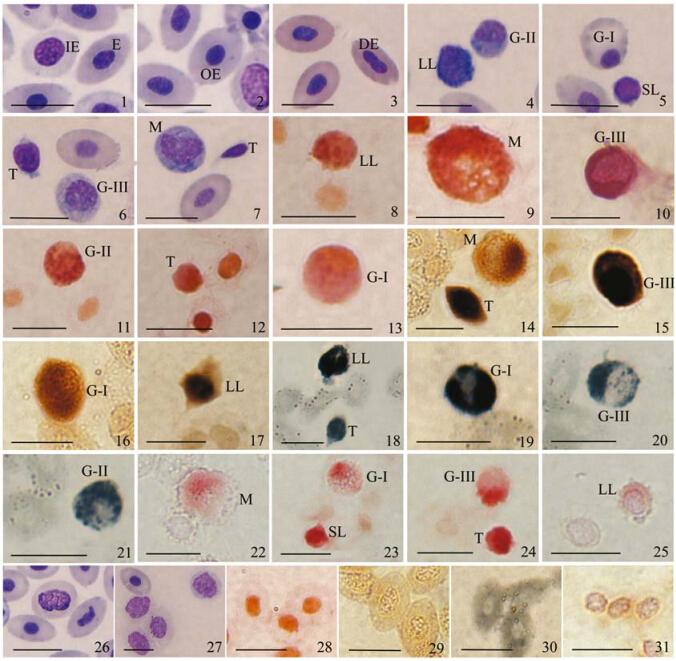
|
| 图版Ⅰ 大口黑鲈外周血细胞显微结构及细胞化学染色 Plate Ⅰ Microstructure and cytochemical characterisation of the peripheral blood cells in Micropterus salmoides 1~7. Wright's染色,8~13. 过碘酸希夫反应PAS,14~17. 酚氧化酶(PO)染色,18~21. 苏丹黑B(SBB)染色,22~25. 酸性磷酸酶(ACP)染色,26~27. Wright's染色核影细胞,28~31. 依次为PAS、PO、SBB、ACP的阴性对照; 比例尺为10 μm。 E. 成熟红细胞,IE. 幼稚红细胞,OE. 衰老红细胞,DE. 直接分裂的红细胞,SL. 小淋巴细胞,LL. 大淋巴细胞,T. 血栓细胞,M. 单核细胞,G-Ⅰ. Ⅰ型粒细胞,G-Ⅱ. Ⅱ型粒细胞,G-Ⅲ. Ⅲ型粒细胞。 1~7. Wright's staining,8~13. PAS staining,14~17. PO staining,18~21. SBB staining,22~25. ACP staining,26~27. the nuclear shadow cell,28~31. as negative control of PAS,PO,SBB and ACP,successively; Bar=10 μm. E. erythrocyte,IE. immature erythrocyte,OE. old erythrocyte,DE. dividing erythrocyte,SL. small lymphocyte,LL. large lymphocyte,T. thrombocyte,M. monocyte,G-Ⅰ. type Ⅰ granulocyte,G-Ⅱ. type Ⅱ granulocyte,G-Ⅲ. type Ⅲ granulocyte. |
粒细胞 粒细胞在白细胞中所占比例较低,为10.34%(表 1)。细胞呈圆形或近圆形,边缘光滑,无胞突。细胞核形状多样,多与细胞膜相切(图版Ⅰ:4~6)。根据细胞核形状、大小以及胞质中颗粒物质特征的差异,将粒细胞分为3种类型:Ⅰ 型粒细胞:细胞大小为(8.19±0.36)μm×(7.24±0.17)μm,细胞核圆形、卵圆形或分2~3叶,细胞核被染成蓝紫色,胞质淡蓝色或接近无色(图版Ⅰ:5);Ⅱ型粒细胞:细胞整体较Ⅰ型粒细胞小(表 1),细胞核呈卵圆形,未见分叶且与细胞膜相切,有突出感,胞质中可见淡蓝色颗粒物质(图版Ⅰ:4);Ⅲ型粒细胞是3种粒细胞中胞体最大的一类粒细胞,细胞大小为(9.17±0.54)μm×(7.49±0.93)μm,细胞核圆形、卵圆形,胞质淡蓝色(图版Ⅰ:6)。
淋巴细胞 淋巴细胞在白细胞中所占比例高达60.92%(表 1),同时也是细胞大小差异最大的一类。细胞呈圆形或不规则形,表面有指状伪足样突起,细胞核染色较深,紫红色或蓝紫色,核质比大,胞质被染成淡蓝色或天蓝色。根据细胞大小将淋巴细胞分为大淋巴细胞(图版Ⅰ:4)和小淋巴细胞(图版Ⅰ:5),其中大淋巴细胞大小为(7.77±0.24)μm×(6.44±0.36)μm,小淋巴细胞大小为(3.88±0.46)μm×(3.48±0.40)μm。
血栓细胞 血栓细胞是白细胞中数量仅次于淋巴细胞的一类,占22.99%。细胞体积较小,细胞形态多样,呈圆形、卵圆形或蝌蚪形,大小与淋巴细胞类似(表 1),核质比大,有时候几乎看不到细胞质,细胞核染色较深,呈紫红色,细胞质染色较浅,呈浅紫红色,细胞表面光滑,无突起,易与小淋巴细胞混淆(图版Ⅰ:6,7)。
单核细胞 单核细胞是白细胞中比例最少,仅占5.75%,但体积最大的一类细胞,细胞大小为(9.89±0.70)μm×(8.72±0.68)μm(表 1)。细胞呈圆形或卵圆形,细胞核呈卵圆形、圆形、不规则圆形或肾型,细胞核较大占细胞总体积1/3~1/2,细胞核被染成蓝紫色,胞质淡蓝色,其中可见细微紫红色颗粒以及大小不一的空泡,胞质向外伸出伪足样突起(图版Ⅰ:7)。 2.2 细胞化学特征
通过对大口黑鲈外周血细胞细胞化学染色,结果表明,红细胞的细胞化学染色均呈阴性,而不同种类白细胞的染色特征存在差异(图版Ⅰ,表 2)。
| 细胞类型 Cell types | 过碘酸希夫反应 PAS | 酸性磷酸酶 ACP | 碱性磷酸酶 AKP | 酚氧化酶 PO | 过氧化物酶 POX | 苏丹黑B染色 SBB |
| 红细胞Erythrocyte | - | - | - | - | - | - |
| 单核细胞Monocyte | + | + | - | + | - | - |
| 血栓细胞Thrombocyte | + | +++ | - | +++ | - | ++ |
| 淋巴细胞Lymphocyte | ++ | ++→(+) | - | ++ | - | +++ |
| Ⅰ型粒细胞TypeⅠgranulocyte | + | + | - | + | - | +++ |
| Ⅱ型粒细胞TypeⅡgranulocyte | +++ | - | - | - | - | + |
| Ⅲ型粒细胞TypeⅢgranulocyte | ++ | ++ | - | +++ | - | + |
| 注:“-”染色阴性,“+++”染色强烈阳性,“++”染色阳性较深,“+”染色阳性,“(+)”染色弱阳性,“→”变化范围 Note: “-” negative staining,“+++” positive staining intensively,“++” positive staining slightly,“+” positive staining,“(+)” positive staining weakly,“→” variation range | ||||||
所有白细胞的细胞质PAS反应均呈阳性,红色,但不同白细胞的PAS反应程度不一致(表 2)。Ⅱ型粒细胞(图版Ⅰ:11)呈强烈阳性,深红色,且颗粒物质突出,清晰易见;淋巴细胞(图版Ⅰ:8)和Ⅲ型粒细胞(图版Ⅰ:10)染色程度次之,而血栓细胞(图版Ⅰ:11)、单核细胞(图版Ⅰ:9)和Ⅰ型粒细胞(图版Ⅰ:13)染色均较弱。
除Ⅱ型粒细胞外所有白细胞细胞质PO染色均呈阳性(表 2),棕色。其中血栓细胞(图版Ⅰ:14)、Ⅲ型粒细胞(图版Ⅰ:15)呈强烈阳性,细胞质黑棕色;大淋巴细胞(图版Ⅰ:17)其次,细胞质浅棕色;单核细胞(图版Ⅰ:14)、Ⅰ型粒细胞(图版Ⅰ:16)最弱,细胞质浅棕黄色(表 2)。
除单核外所有白细胞的细胞质SBB染色呈阳性,黑色(表 2)。Ⅰ型粒细胞(图版Ⅰ:19)、淋巴细胞(图版Ⅰ:18)最为强烈,呈深黑色;其次为血栓细胞(图版Ⅰ:18);Ⅱ型粒细胞(图版Ⅰ:21)、Ⅲ型粒细胞(图版Ⅰ:20)染色最浅。
所有外周血细胞的AKP、POX染色均呈阴性。 2.3 血细胞吞噬酵母实验
通过吞噬实验,发现大口黑鲈红细胞(图版Ⅱ:1~6)、血栓细胞(图版Ⅱ,8)和粒细胞(图版Ⅱ:9,10)均能够吞噬酵母,且红细胞对酵母的吞噬率为(15.70±1.07)%。在吞噬过程中发现多种吞噬行为:红细胞能够在靠近酵母的部分伸出伪足(图版Ⅱ:1),通过伸出的伪足接触酵母(图版Ⅱ:2);有的红细胞能够粘附3个酵母(图版Ⅱ:3),且出现细胞膜向内凹陷(图版Ⅱ:4),被吞噬进胞浆中的中间过程,吞噬2个酵母的现象(图版Ⅱ:5);最终酵母被完全吞噬进细胞(图版Ⅱ:6),还可见到2个红细胞同时吞噬1个酵母的现象(图版Ⅱ:7)。另外血栓细胞也能同时粘附多个酵母(图版Ⅱ:8),粒细胞也出现变形及伸出伪足接触酵母的现象(图版Ⅱ:9,10)。

|
| 图版Ⅱ 大口黑鲈外周血吞噬酵母的现象 Plate Ⅱ Light micrographs of phagocytosis by the peripheral blood cells in Micropterus salmoides 1. 红细胞伸出伪足牵引较远的酵母,2. 红细胞伸出伪足使酵母与之接触,3. 红细胞刚接触到酵母,4. 红细胞膜向内凹陷,5. 酵母逐渐被吞噬进红细胞胞浆中,6. 酵母完全被吞噬进红细胞,7. 2个红细胞同时吞噬一个酵母,8. 血栓细胞同时粘附多个酵母,9. 粒细胞吞噬酵母,10. 粒细胞在吞噬酵母过程中变形; 比例尺为10 μm。 1. erythrocyte extending a pseudopodium around a yeast cell,2. erythrocyte extending a pseudopodium adhere to a yeast cell,3. erythrocyte adhere to three yeast cells,4. erythrocyte starting to hollow with three yeast cells,5. erythrocyte with one more engulfing yeast cell,6. combination erythrocyte with one engulfed yeast cell,7. two erythrocyte with one yeast cell,8. one thrombocyteis surrounded by some yeast cells,9. granulocyte engulfing one yeast cell,10. granulocyte deforming in the process of engulfing; Bar=10 μm. |
大口黑鲈外周血中红细胞占绝大部分,其中成熟的红细胞大量存在,还观察到少量正在分裂的红细胞和幼稚的红细胞,这与鲤形目鱼类如草鱼Ctenopharyngodon idellus、鲢鱼Hypophthalmichthys molitrix(赵宝生,沈成刚,1991)、齐口裂腹鱼Schizothorax prenanti(杨淞等,2011)、胭脂鱼Myxocyprinus asiaticus(Bleeker)(金丽等,2011b)等及鲈形目鱼类如条石鲷Oplegnathus fasciatus(胡玲玲等,2009)、红鳍笛鲷Lutjanus erythopterus(曹伏君,朱晓燕,2006)的结果相似,提示不同种类的鱼外周血中存在红细胞的成熟及增殖过程。此外,在本研究的外周血涂片中还能够观察到核固缩的红细胞(图版Ⅰ:2)及“核影”细胞(图版Ⅰ:26,27)。谢嘉华和陈朝阳(2003)认为“核影”细胞是衰老的表现,与自身的生理因子相关;Fijan(2002)则认为这种“核影”细胞是应对外界抗性的一种方式。可见红细胞核的形态变化与外界环境及自身的生理密切相关。目前已有研究通过红细胞的微核率及异常率来监测环境及生理状况(吴志昊等,2011;刘楠楠等,2012),因此鱼类红细胞的细胞核形态能够作为感应外界环境变化的指标。
以往研究认为,脊椎动物的红细胞只参与呼吸功能,进行O2和CO2的运输(Fijan,2002)。有研究表明红细胞有多种免疫功能,具有吞噬杀伤致病原的作用,且“红细胞免疫”系统的概念也适用于鱼类(蔡完其,轩兴荣,2003;张振冬等,2007)。在大口黑鲈血细胞的吞噬实验中,发现红细胞、粒细胞及血栓细胞具有吞噬酵母的能力,且发现1个红细胞粘附3个酵母及吞噬2个酵母现象,说明鱼类红细胞具有较强的吞噬能力,这种现象在草鱼、鳙鱼(王旭东,饶家荣,1996)、虹鳟Salmo gairdneri(Passantino et al., 2002)、牙鲆Paralichthys olivaceus(张振冬等,2007)、兴国红鲤C. carpio var. singguonensis(蔡完其,轩兴荣,2003)也有发现。本实验还发现大口黑鲈红细胞的吞噬率达到15%,仅高于兴国红鲤的13%,低于草鱼的18%,鳙鱼的39.5%,牙鲆的21%,这可能与不同种类红细胞膜表面的糖基磷脂酰肌醇(GPI)膜锚蛋白相关(王旭东,饶家荣,1996)。而鱼类红细胞与哺乳动物红细胞最大的区别是具有细胞核,大口黑鲈红细胞的细胞质PAS反应、SBB、AKP、ACP、POX、PO染色均呈阴性,说明红细胞的细胞质中缺乏这些免疫酶和能量物质,这与长薄鳅Leptobotia elongate(黄小铭等,2012)、短盖巨脂鲤Centropomus parallelus(da Silva et al., 2011)、鳕鱼Maccullochella peelii peelii(Shigdar et al., 2009)等的研究结果一致,因此红细胞在发挥吞噬作用过程中,细胞核也可能起着非常重要的作用,具体机制则需要进一步的研究。 3.2 血栓细胞的特点
大口黑鲈血栓细胞占白细胞中的比例为22.99%,是数量仅次于淋巴细胞的一类细胞,这与5种鲤科幼鱼(13.1%;赵宝生,沈成刚,1991)、二龄条石鲷O. fasciatus(25.14%;胡玲玲等,2009)结果相似,但与齐口裂腹鱼(69.33%;杨淞等,2011)、红鳍笛鲷(50%;曹伏君,朱晓燕,2006)、胭脂鱼(63.85%;金丽等,2011b)等有较大差异,提示血栓细胞在鱼类血液中所占比例与种类有关。
目前,许多学者做了不同鱼类外周血细胞显微结构的研究,发现鱼类外周血中的血栓细胞存在4种不同的形态,即圆形或椭圆形、蝌蚪形、纺锤形和长棒形。Ellis(1977)认为,上述4种形态的血栓细胞只有在不使用抗凝剂的情况下才会出现,是鱼类对取血所作出的一种应激反应。笔者在做血涂片时添加了抗凝剂,同时也观察到了上述4种形态的血栓细胞,与Ellis的观点不一致。笔者并不赞同卵圆形和纺锤形才是血栓细胞的正常形态,而更倾向于鱼类血栓细胞形态的不同显示其发育时期或功能状态不同的观点(Barber et al., 1981;袁仕取,张永安,1998)。 3.3 粒细胞的类型
鱼类的粒细胞根据细胞核形状、位置以及细胞质中颗粒物质等的不同,分为嗜中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞。鱼类外周血中最常见的是嗜中性粒细胞,嗜酸性粒细胞和嗜碱性粒细胞或有或无(杨淞等,2011;金丽等,2011a;黄小铭等,2012)。本研究中,Ⅰ型粒细胞是大口黑鲈中外周血中最常见的一类粒细胞,其形态、大小、比例及细胞核位置等描述与鳕鱼(Shigdar et al., 2009)、切尾拟鲿Pseudobagrus truncatus(邹远超等,2014)等鱼类中对嗜中性粒细胞的描述一致(金丽等,2011a),因此大口黑鲈Ⅰ型粒细胞可能对应嗜中性粒细胞。大口黑鲈的Ⅱ型粒细胞胞质淡蓝色,细胞核浅紫红色,占整个细胞的1/2~2/3,与切尾拟鲿(邹远超等,2014)中嗜酸性粒细胞的描述一致。此外,Wright's染色结果还发现,大口黑鲈外周血中存在Ⅲ型粒细胞,其形态特征类似尼罗罗非鱼Oreochromis niloticu和杂交罗非鱼外周血中嗜中性粒细胞特征(傅丽容等,2008)。本研究大口黑鲈的Ⅰ型粒细胞和Ⅲ型粒细胞的细胞化学染色结果相似。短盖巨脂鲤外周血研究也发现幼稚粒细胞和成熟粒细胞形态特征及细胞化学与本实验鱼的Ⅰ型粒细胞和Ⅲ型粒细胞类似(da Silva et al., 2011)的现象。因此推测本文中的Ⅲ型粒细胞可能是Ⅰ型粒细胞的某个阶段,这与胭脂鱼的研究结果类似(金丽等,2011b)。 3.4 细胞化学特征
糖原是真核生物最重要的短期存储物质,是ATP唯一能量来源,其合成和分解比脂类迅速,在抵御环境变化(如抗逆境)过程中尤为重要,且能为吞噬作用提供内生和外生的能量(Ueda et al., 2001)。在大口黑鲈外周血中PAS反应显示所有种类的白细胞都含有糖类物质,这与以往对鱼类血细胞的研究一致(金丽等,2011b;赵娜等,2011),而SBB染色显示除了单核细胞外,所有的白细胞均含有脂类,说明大口黑鲈白细胞中的脂类丰富。多种鱼类的白细胞缺乏脂类或脂类很少,5种鲤科鱼(赵宝生等,1991)、长吻鮠(金丽等,2011a)以及小锯盖鱼C. parallelus(da Silva et al., 2011)只在粒细胞当中出现脂类,鳕鱼(Shigdar et al., 2009)则在粒细胞以及淋巴细胞当中出现脂类,胭脂鱼(金丽等,2011a)和长薄鳅(黄小铭等,2012)所有的细胞染色呈阴性,说明不同鱼类白细胞中脂类的有无存在差异。
ACP是巨噬细胞溶酶体的标志酶,在体内细胞调节过程中起重要作用(Dusan et al., 2011)。大口黑鲈外周血中ACP分布广泛,除Ⅱ型粒细胞外所有的白细胞均含有ACP。鳕鱼(Shigdar et al., 2009)、胭脂鱼(金丽等,2011a)等鱼类大部分白细胞均含有ACP,说明不只大口黑鲈外周血中ACP分布广泛,在上述鱼类中也广泛存在。PO不仅参与伤口的愈合,而且具有免疫识别和免疫防御作用(Johansson et al., 1996),除Ⅱ型粒细胞外的所有白细胞均含有PO且阳性反应较强烈,说明PO也是大口黑鲈中分布广泛的一种酶。POX被认为是生物体的保护酶之一,能够分解体内产生的部分有毒物质且具有杀菌作用(Shigdar et al., 2009)。大口黑鲈的POX染色阴性,说明大口黑鲈不含有POX,这与胭脂鱼(金丽等,2011b)、长薄鳅(黄小铭等,2012)相同。大口黑鲈白细胞中缺乏AKP和POX,但ACP和PO含量丰富,在一定程度上弥补了这一欠缺。
| 白俊杰, 李胜杰. 2013. 大口黑鲈遗传育种[M]. 北京: 海洋出版社. |
| 蔡完其, 轩兴荣. 2003. 红鲤4群体间红细胞免疫功能及其差异[J]. 中国水产科学, 10(2): 133-136. |
| 曹伏君, 朱晓燕. 2006. 红鳍笛鲷外周血细胞的显微结构观察[J]. 海洋科学, 30(5): 32-35. |
| 邓国成, 谢骏, 李胜杰, 等. 2009. 大口黑鲈病毒性溃疡病病原的分离和鉴定[J]. 水产学报, 33(5): 871-877. |
| 傅丽容, 陈学光, 黎学春, 等. 2008. 两种罗非鱼外周血细胞显微结构比较观察[J]. 湖北农业科学, 47(9): 1065-1067. |
| 韩林强, 白俊杰, 李胜杰. 2011. 大口黑鲈GHRH-LP和GHRH基因序列同源性、基因结构和时序表达研究[J]. 水生生物学报, 35(3): 473-481. |
| 胡玲玲, 李加儿, 区又君, 等. 2009. 条石鲷外周血细胞的显微结构[J]. 福建农林大学学报: 自然科学版, 38(4): 384-387. |
| 黄小铭, 张耀光, 江星, 等. 2012. 长薄鳅外周血细胞的显微结构和细胞化学特征研究[J]. 四川动物, 31(1): 59-63. |
| 蒋依依, 李言伟, 周素明, 等. 2012. 加州鲈诺卡菌病病原的分离与鉴定[J]. 中山大学学报: 自然科学版, 51(1): 76-81. |
| 金丽, 杜长雷, 张耀光. 2011a. 长吻鮠血细胞的显微, 亚显微结构及细胞化学研究[J]. 西南大学学报: 自然科学版, (12): 79-85. |
| 金丽, 赵娜, 黄林, 等. 2011b. 胭脂鱼外周血细胞的显微, 超微结构与细胞化学观察[J]. 水生生物学报, 35(3): 550-556. |
| 刘楠楠, 吕碧平, 厉以强, 等. 2012. 稀有鮈鲫外周血红细胞微核试验方法研究[J]. 中国环境监测, 28(3): 121-126. |
| 马冬梅, 邓国成, 白俊杰, 等. 2011. 大口黑鲈肝脾肿大病病原的研究[J]. 中国水产科学, 18(3): 654-659. |
| 王旭东, 饶家荣. 1996. 红细胞广泛吞噬作用的发现和研究[J]. 水产学报, 20(1): 72-75. |
| 谢嘉华, 陈朝阳. 2003. 海鳗外周血细胞的显微结构[J]. 动物学杂志, 38(6): 14-18. |
| 杨淞, 杨世勇, 肖拉, 等. 2011. 养殖齐口裂腹鱼外周血细胞显微观察[J]. 四川动物, 30(2): 202-206. |
| 袁仕取, 张永安. 1998. 鳜鱼外周血细胞显微和亚显微结构的观察[J]. 水生生物学报, 22(1): 39-47. |
| 张永安, 孙宝剑, 聂品. 2000. 鱼类免疫组织和细胞的研究概况[J]. 水生生物学报, 24(6): 648-654. |
| 张振冬, 张培军, 莫照兰, 等. 2007. 鳗弧菌灭活疫苗对牙鲆外周血细胞吞噬活性的影响[J]. 海洋科学集刊, 48: 127-132. |
| 赵宝生, 沈成刚. 1991. 五种鲤科幼鱼外周血白细胞形态和细胞化学的研究[J]. 水生生物学报, 15(2): 184-186. |
| 赵娜, 杜长雷, 金丽, 等. 2011. 厚颌鲂外周血细胞形态及细胞化学特征研究[J]. 淡水渔业, 41(2): 36-42. |
| 邹远超, 岳静, 岳兴建, 等. 2014. 切尾拟鲿外周血细胞的显微结构[J]. 四川动物, 33(2): 234-238. |
| Barber DL, Mills Westermann JE, White MG. 1981. The blood cells of the Antarctic icefish Chaenocephalus aceratus Lönnberg: light and electron microscopic observations[J]. Journal of Fish Biology, 19(1): 11-28. |
| da Silva WF, Egami MI, Santos AA, et al. 2011. Cytochemical, immunocytochemical and ultrastructural observations on leukocytes and thrombocytes of fat snook (Centropomus parallelus)[J]. Fish & Shellfish Immunology, 31(4): 571-577. |
| Dusan Palic, Linda S, Beck B, et al. 2011. Use of rapid cytochemical staining to characterize fish blood granulocytes in species of special concern and determine potential for function testing[J]. Fish & Shellfish Immunology, 30: 646-652. |
| Ellis AE. 1977. The Leucocytes of fish: a review[J]. Journal of Fish Biolology, 11: 453-491. |
| Fijan N. 2002. Morphogenesis of blood cell lineages in channel catfish[J]. Journal of Fish Biology, 60(4): 999-1014. |
| Johansson MW, Soderhall K. 1996. The prophenoloxidase activating system and associated proteins in invertebrates[J]. Progress in Molecular and Subcellular Biology, 79(64): 46-66. |
| Passantino L, Altamura M, Cianciotta A, et al. 2002. Fish immunology. I. Binding and engulfment of Candida albicans by erythrocytes of rainbow trout (Salmo gairdneri Richardson)[J]. Immunopharmacology and Immunotoxicology, 24(4): 665-678. |
| Shigdar S, Harford A, Ward AC. 2009. Cytochemical characterisation of the leucocytes and thrombocytes from Murray cod (Maccullochella peelii peelii Mitchell)[J]. Fish & Shellfish Immunology, 26(5): 731-736. |
| Ueda IK, Egami MI, Sasso WS, et al. 2001. Cytochemical aspects of the peripheral blood cells of Oreochromis (Tilapia) niloticus.(Linnaeus, 1758)(Cichlidae, Teleostei): part II[J]. Brazilian Journal of Veterinary Research and Animal Science, 38(6): 273-277. |
 2015, Vol. 34(1)
2015, Vol. 34(1)




