扩展功能
文章信息
- 胡舒展, 路迪, 赵联军, 廖文波, 周材权
- HU Shuzhan, LU Di, ZHAO Lianjun, LIAO Wenbo, ZHOU Caiquan
- 华西蟾蜍年龄结构、体长和生长率的研究
- Research of Age Structure, Body Size and Growth Rate in Bufo andrewsi
- 四川动物, 2015, 34(1): 41-46
- Sichuan Journal of Zoology, 2015, 34(1): 41-46
- 10.3969/j.issn.1000-7083.2015.01.006
-
文章历史
- 收稿日期:2014-03-31
- 接受日期:2014-07-24
2. 四川王朗国家级自然保护区管理局, 四川绵阳 622550
2. Wanglang National Nature Reserve Administration Bureau, Mianyang, Sichuan Province 622550, China
种群的年龄结构和生长率是有机体重要的统计学参数,这些数据在帮助我们了解两栖动物的生活史和分类方面有重要意义(Morrison & Hero,2003)。另一方面,种群的年龄结构是几十年甚至上百年自然增长和迁移的综合作用结果,又是今后种群动态的基础和起点。生长率是了解一个种群生长模式的有效指标,也是反应不同生境下物种适应性的综合指标(孙儒泳,2006)。所以,研究种群的年龄结构和生长率对了解种群的基本资料和保护有重要意义。广义的动物两性异形(sexual dimorphism,SD)指两性间的所有差异,包括个体大小、形状以及体色等方面产生的差异(Fairbairn & Roff,2006)。狭义两性异形则是仅指身体大小的差异(sexual size dimorphism,SSD)(Darwin,1871; Andersson,1994)。两性异形在动物中很普遍,本文主要讨论华西蟾蜍在个体大小方面的两性差异。
华西蟾蜍Bufo and rewsi,隶属两栖纲Amphibia无尾目Anura蟾蜍科Bufonidae蟾蜍属Bufo,其栖居于中国西部海拔700~3000 m的亚热带山地地区(Liao & Lu,2009; Liao et al.,2014),是中国特有物种。每年产卵一次,主要集中于3—5月份,随海拔高度不同略有变化,繁殖期聚集于山溪流水或大河回水处、池塘、水坑等静水环境抱对产卵,卵在圆管状胶质卵带内多成双行交错排列。成体雌性大于雄性,雌性一般色较浅,后肢粗壮,无股后腺;雄性前肢粗壮,内侧3指基部有黑色刺状婚垫,无声囊(费梁,叶昌媛,2001)。华西蟾蜍种群数量丰富,易采集,并且其脚趾切片已有前人的研究(Liao & Lu,2012),可操作性强,所以将其作为试验材料。本文的研究目的是为了验证骨龄学方法对华西蟾蜍年龄鉴定的有效性,并且探讨用年龄结构、寿命和生长率来解释华西蟾蜍的性二型。胡舒展等: 华西蟾蜍年龄结构、体长和生长率的研究1 研究区域概况
本研究区域位于四川省绵阳市平武县王朗国家自然保护区(103°50′~104°58′E; 32°49′~33°02′N),面积32 297 hm2,建立于1965年,是以大熊猫Ailuropoda melanoleuca等珍稀野生动物及其生态环境为主要保护对象的国家级自然保护区(曾宗永等,2002)。保护区位于青藏高原东缘横断山脉区,海拔跨度2300~4980 m,植被以针阔混交林、暗针叶林为主,垂直带谱明显,动物资源十分丰富。华西蟾蜍广泛分布于海拔2300~2700 m的河道周围。保护区内年均气温2.9 ℃,7月份平均气温12.7 ℃,1月份平均气温-6.1 ℃,年降水量862.5 mm(杨宏伟等,2013)。本研究选择了保护区的牧羊场保护站(104°06′E,32°58′N,海拔2640 m)作为研究区域,位于山脚下,紧邻河道,保护站周围分布很多天然水塘和沼泽地,在繁殖期(3—5月份)华西蟾蜍会陆续聚集于此进行抱对和产卵。 2 材料和方法2.1 实验材料和取样
本研究于2013年3—5月(华西蟾蜍集中繁殖期)对保护区牧羊场保护站周围分布的华西蟾蜍种群进行了调查,晚上20∶00后使用手电筒到达水塘随机抓取华西蟾蜍,放在特定的透气口袋中带回;鉴定所有个体的性别,成体雄性前肢第1、2、3指基部有黑色刺状婚垫,通过怀卵状况和体长确定成体雌性;用电子游标卡尺测量所有个体的体长(snout-vent length,SVL),精确到0.01 mm;剪下每个个体后肢最长趾(至少前3节)储存在5%的福尔马林溶液中,贴好标签,回到实验室后进行骨龄切片确定年龄。有伤口的华西蟾蜍在干燥的纸箱中放置24 h,待创伤面止血后放回原捕捉点。由于放回的个体都已剪取后肢最长趾,故可以避免重复捕捉。本研究共捕捉到74只成体个体,其中雄性47只,雌性27只。2.2 骨龄学切片法
剪取福尔马林溶液固定的华西蟾蜍趾骨的第2或第3节,流水冲洗10 h;10%硝酸(稀释液为生理盐水)脱钙72 h;流水冲洗12 h,蒸馏水浸10 min,Ehrlich’s苏木精染色210 min;流水蓝化30 min;70%、80%乙醇分别脱水60 min,95%伊红酒精染5 min,95%乙醇60 min,无水乙醇30 min;二甲苯与酒精1∶1的混合液透明30 min,纯二甲苯30 min(中间换一次溶液);石蜡包埋;用切片机12 μm连续切片,然后封片;选择效果最好的用MOTIC-BA300光学显微镜观察并照相保存(Liao,2011)。2.3 年龄计算方法
两栖类的趾骨由内到外依次是骨髓腔、骨内膜、骨内板、骨外板和骨外膜,年轮分布在骨外板上(Li et al.,2010)。通过重吸收线(kastschenko line,KL),骨内膜骨和骨膜骨的相接处),确定受抑制生长线(lines of arrested growth,LAGs)的位置,依次向外计算数目(李文蓉等,2010)。在生长期呈现的是亮带(生长层,growth layers,GL),冬眠期表现的是暗带LAGs,一亮一暗表明生长期和受抑制生长期的交替,也就是活动和冬眠的交替,计算为1龄;2环LAGs表示2龄,以此类推;只出现暗带,没有亮带的为小于1龄个体。选取华西蟾蜍趾骨骨干中间部分的切片,拍得的照片每次由2位有经验的操作者(胡舒展和路迪)分别进行计数,直到得到相同的结果为止。两栖动物趾骨在生长过程中存在重吸收现象。通过比较亚成体骨膜外围的平均直径(R亚)和成体第1条可见生长线的直径(R1)来判断是否发生了骨内重吸收:若R亚≥R1,则判断个体没有发生骨内膜的重吸收或发生了但不影响个体真实年龄的估测;若R亚<R1,则判断个体发生了骨内重吸收,可能造成对个体真实年龄的低估(Castanet & Smirna,1990)。骨龄学中通常会出现假年龄线和双重线。假年龄线通常很模糊,条纹没有年轮线清楚,不能算作生长抑制线。双重线不能构成完整的1周只能算作1条,很容易进行区分(Lu et al.,2006)。 2.4 数据分析统计方法
使用SPSS 17.0分析数据,雌雄个体间的SVL和年龄差异用Student’s t-test检验;用Kolmogorov-Smirnov来检验两性之间的年龄分布。排除年龄的影响,SVL作因变量,年龄作协变量再次比较雌雄SVL的差异性。使用一般线性模型(GLMs)来分析年龄和性别的相互作用,SVL作为因变量,年龄和性别作为固定因子。使用线性回归来分析体长和年龄的关系。
采用von Bertalanffy模型SVLt=SVLmax(1-e-kt+b)来估算华西蟾蜍的生长模式,其中SVLt是t龄时的SVL,SVLmax是最大预测SVL,k是生长系数,b是常数(Hemelaar,1986)。变态后的个体生长率可以用这个方程计算;r=dSVL/dt=k(SVLmax-SVLmean),r是年生长率,SVLmean是一个种群成体的平均SVL(Lou et al.,2012),描述性统计值用平均值±标准差表示。所有的检验都是双尾检验,显著性水平为P<0.05。3 结果与分析 3.1 年龄结构
利用骨龄法测定了27只雌性个体和47只雄性个体的年龄,74只成年个体均能准确计算出年龄,划分为3~11龄9个年龄组(表 1);最小的成年雄性为3龄,最小的成年雌性为4龄,雌性和雄性的最长寿命皆为11龄。雌性和雄性的年龄分布差异有统计学意义(Kolmogorov-Smirnov test: Z=2.27,P<0.01),雄性的平均年龄为(6.2±1.8)龄,雌性的为(8.4±1.8)龄。两性的年龄差异有统计学意义(Mann-Whitney U-test,t=-4.59,df=74,P<0.01)。雌雄的年龄结构分布情况见图 1,其中雄性数量最多的年龄组为6龄,雌性为9龄。
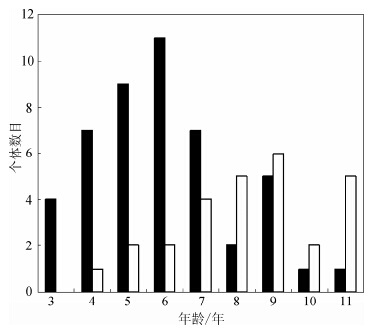 |
| 图 1 成体华西蟾蜍的年龄结构分布 (雄性为黑色条形,雌性为白色条形)Fig. 1 Adult age structure in Bufo and rewsi (male,close bars; female,open bars) |
 |
雌性体长显著大于雄性(Student’s t-test,t=2.348,P<0.01)。雄性平均体长为74.8 mm±5.5 mm(范围60.0~85.5 mm,n=47,表 1),雌性平均体长为91.9 mm±7.2 mm(范围80.0~108.3 mm,n=27,表 1)。
3.3 体长和年龄的关系
用协方差分析发现,当去除年龄的影响时,两性体长差异依然有统计学意义(F1,73=132.11,P<0.01)。各年龄阶段的雌性体长均大于雄性(图 2)。线性回归分析发现两性的SVL和年龄都成正相关关系(图 2; 雄性,SVL=0.846 age+69.68,F1,45=4.48,r=0.30,P=0.04; 雌性,SVL=1.47 age+79.75,F1,25=4.87,r=0.40,P=0.04)。一般线性模型(GLMs)分析发现性别和年龄的交互差异无统计学意义(F1,73=1.24,P>0.05);用von Bertalanffy模型分析发现华西蟾蜍雌性大于雄性,雄性的生长率为r=2.32,雌性为r=2.48。
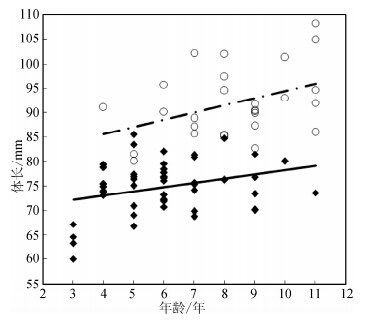 |
| 图 2 华西蟾蜍年龄和体长的关系 (雄性为黑色方块,实线;雌性为白色圆圈,虚线)Fig. 2 Relationship between SVL and age in Bufo and rewsi (male,close boxes; female,open circles) |
在过去的30年,骨龄学已经成为鉴定两栖类年龄广泛使用的手段,可信度很高(Hemelaar & Van Gelder,1980; Halliday & Verrell,1988; Lu et al.,2006; Liao & Lu,2011)。这种方法主要基于两栖类在季节交替时期,生长受到抑制,生长慢、骨质密,会记录在趾骨的横截面上,经过染色后会显示出疏密相间的轮纹(LAGs)每一轮代表一次季节交替,计为1龄(李文蓉等,2010; Liao & Lu,2012)。研究已证明周期性活动(包括冬眠和夏眠)广泛存在于温带、沙漠和热带地区的两栖类(Monnet & Cherry,2002)。使用趾骨切片鉴定两栖类种群的年龄,可以避免杀死个体,有利于野生动物资源的保护和可持续发展。但骨内膜的重吸收会影响年龄的准确计数(Hemelaar & Van Gelder,1980),本研究中发现仅有一个个体存在重吸收现象,年轮线并没有被完全吸收,可以对年龄进行准确计数(图 3,B)。具有冬眠或者夏眠习性的两栖类常会表现出双年轮线,但不影响年龄计数的可靠性(Lu et al.,2006)。年轮线有时候还会出现不完全、模糊和其他一些难以辨认的情况,给年龄计数带来困难。位于骨骼边缘的年轮线经常因为模糊不清或者被忽视而没有计数(Lu et al.,2006)。同时,骨龄学中有时会出现假年轮线,假年轮线通常是由于受伤、剧烈的气候变化或食物缺乏造成的;但是假年轮线与LAGs相比,通常很模糊或没有围绕骨髓腔形成一个同心圆,很容易进行区分(Lu et al.,2006)。在本研究中,骨龄学方法能够对华西蟾蜍的年龄进行很准确的鉴定(图 3,A),没有发现双重年轮线和假年轮线。
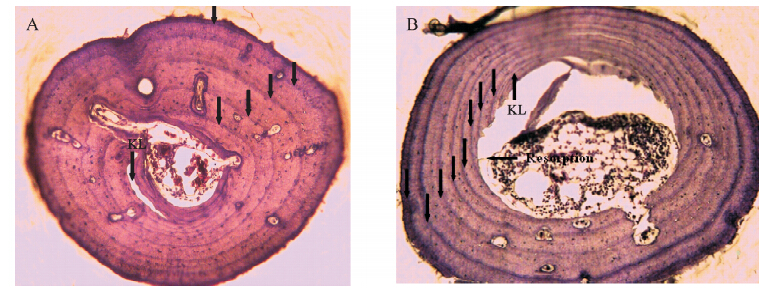 |
| 图 3 华西蟾蜍趾骨的横切面(A为一只5龄雄性,B为一只8龄雌性)Fig. 3 The phalangeal bone of Bufo and rewsi(A: a 5yrs old male; B: an 8yrs old female)KL表示骨内膜和骨膜的分界线,Resorption显示被重吸收部分 。 KL represents Kastschenko line,the division line between endosteal and periosteal zones. Resorption represents the endosteal |
本研究发现雄性华西蟾蜍比雌性提前1年性成熟,这种模式在以前的研究中也有发现(Miaud et al.,1999; Liao & Lu,2010a)。然而也有两栖类雌性和雄性同时性成熟,如黑斑蛙Rana nigromaculata(Mao et al.,2012)、泽蛙R. limnocharis(Liao et al.,2011)、华西雨蛙Hyla annectans chuanxiensis(Liao & Lu,2010b)、黑龙江林蛙R. amurensis(Liao,2011)等物种。多数两栖类物种中雌性平均年龄大于雄性,故雄性的性成熟年龄比雌性提前。在过去的研究中发现有相同的模式(Howard,1981;Hemelaar,1988; Reading,1991; Smirina,1994)。雄性和雌性对生殖的资源投入不同,雄性所面对的选择压力常导致其提早性成熟,以便减少在达到最小繁殖体长前死亡的可能性;而雌性繁殖需要更大的体长和储存更多的能量,性成熟较晚(Gasser,2000)。不过Reading(1991)研究大蟾蜍B. bufo的性成熟与体长、年龄的关系发现,决定性成熟的因素主要是体长而不是年龄。 4.3 华西蟾蜍的性二型
性二型在两栖类无尾目中是普遍存在的,一般是雌性大于雄性。关于动物的性二型,以前大量的研究提出了很多假说进行解释。第一,最多支持的是性选择假说,这个假说认为同性对配偶的竞争及异性的择偶偏好常作为性选择促使雌雄身体大小性二型的进化(Darwin,1906)。第二,生殖力选择假说,这个假说认为在多数产卵的动物中大的雌性比小的雌性会分配更多的资源到后代中,即可以产更多的卵或更快的繁殖,这可能导致雌性偏大(Andersson,1994),研究表明,生殖力选择在华西蟾蜍的性二型中有作用,Liao和Lu(2009)发现,雄性华西蟾蜍能够识别雌性的身体大小,并偏好于和具有更大生殖潜能的体型大的雌性抱对。第三,生态位差异假说,每个性别适合于不同的生态位,这可以减小两性之间的资源争夺,在食物贫乏期充分利用环境资源,而且繁殖期还可以分散被捕食的风险,使雌性更好地繁殖后代(Slatkin,1984; Shine,1989)。第四,生活史假说,本研究结果与以前的研究结果一致(Hemelaar,1986; Monnet & Cherry,2002; Liao & Lu,2011),各年龄段的华西蟾蜍雌性显著大于雄性,说明生活史假说明显作用于华西蟾蜍的性二型。由图 2可知华西蟾蜍雄性性成熟年龄为3龄,雌性为4龄。雄性平均年龄(6.2±1.8)龄,雌性平均年龄(8.4±1.8)龄,雌性大于雄性。雌性性成熟比雌性早了1年,这可能是因为雄性为了个体遗传物质的传递以尽早获得交配机会(Smirina,1994; Stamps & Krishnan,1997),较早的成熟期就会造成雄性个体生长期缩短,使雄性个体比雌性个体小。再加上雌性的平均年龄比雄性大,所以有更长的生长年限使得雌性个体大于雄性的个体。因此,性成熟年龄和平均年龄是造成华西蟾蜍性二型的主要原因。在生长率方面,由图 2可知华西蟾蜍在性成熟后雄性的生长率小于雌性,这可能是因为雄性性成熟之后需要投入一部分能量到繁殖中,生长变慢;另一方面雌性成熟后要增加繁殖输出需要更大的体型,生长变快。
两栖类两性异形的产生过程近年来在国内越来越受到重视,主要有吴鹏飞等(2005)对青海沙蜥Phrynocephalus vlangalii的研究,说明两性异形与生长率的关系。还有说明性成熟年龄和初次繁殖年龄对两性差异影响(Stamps & Krishnan,1997),有关高山倭蛙Nanorana parkeri(Ma & Lu,2009)和沼蛙Hylarana guentheri(Li et al.,2010)等物种的骨龄学研究,对此问题的研究还太少无法得出比较确切的结论。另外华西蟾蜍的生活环境变化多样,种群之间巨大的形态差异,国内对华西蟾蜍的研究较少,本文仅是对年龄结构和生长率与体形大小的基础研究,但是两性异形与雌雄两性间在食物选择、寿命、空间利用、食性及能量分配策略之间的关联性有待进一步研究。
| 费梁, 叶昌媛. 2001. 四川两栖类原色图鉴[M]. 北京: 中国林业出版社. |
| 李文蓉, 宋玉成, 时磊. 2010. 基于骨龄学方法鉴定吐鲁番沙虎的年龄[J]. 动物学杂志, 45(3): 79-86. |
| 孙儒泳. 2006. 动物生态学原理[M]. 北京: 北京师范大学出版社. |
| 吴鹏飞, 王跃招, 郭海燕, 等. 2005. 青海沙蜥的生长及两性生长差异[J]. 四川大学学报:自然科学版, 42(6): 1252-1257. |
| 杨宏伟, 康东伟, 李俊清, 等. 2013. 王朗小河沟自然保护区大熊猫越冬生境利用比较研究[J]. 生物学杂志, 30(3): 48-50. |
| 曾宗永, 岳碧松, 冉江洪, 等. 2002. 王朗自然保护区大熊猫对生境的利用[J]. 四川大学学报:自然科学版, 39(6): 1140-1144. |
| Andersson MB. 1994. Sexual Selection[M]. Princeton: Princeton University Press. |
| Castanet J, Smirina EM. 1990. Introduction to the skeletochronological method in amphibians and reptiles[J]. Annales des Sciences Naturalles. Zoologie et Biologie Animale, 11(4): 191-196. |
| Darwin CR. 1871. The descent of man, and selection in relation to sex[M]. Princeton: Princeton University Press. |
| Darwin C. 1906. The descent of man and selection in relation to sex[M]. London: John Murray. |
| Fairbairn DJ, Roff DA. 2006. The quantitative genetics of sexual dimorphism: assessing the importance of sex-linkage[J]. Heredity, 97(5): 319-328. |
| Gasser M, Kaiser M, Berrigan D, et al. 2000. Life history correlates of evolution under high and low adult mortality[J]. Evolution, 54(4): 1260-1272. |
| Halliday TR, Verrell PA. 1988. Body size and age in amphibians and reptiles[J]. Journal of Herpetology, 22: 253-265. |
| Hemelaar ASM, Van Gelder JJ. 1980. Annual growth rings in phalanges of Bufo bufo (Anura, Amphibia) from the Netherlands and their use for age determination[J]. Netherlands Journal of Zoology, 30(1): 129-135. |
| Hemelaar ASM. 1986. Demographic Study on Bufo Bufo (Anura, Amphibia) from Different Climates, by Means of Skeletochronology[D]. Nijmegen, Netherlands: University of Nijmegen. |
| Hemelaar A. 1988. Age, growth and other population characteristics of Bufo bufo from different latitudes and altitudes[J]. Journal of Herpetology, 22(4): 369-388. |
| Howard RD. 1981. Sexual dimorphism in bullfrogs[J]. Ecology, 62: 303-310. |
| Li C, Liao WB, Yang ZS, et al. 2010. A skeletochronological estimation of age structure in a population of the Guenther's frog, Hylarana guentheri, from western China[J]. Acta Herpetologica, 5(1): 1-11. |
| Liao WB, Lu X. 2009. Male mate choice in the Andrew's toad Bufo andrewsi: a preference for larger Females[J]. Journal of Ethology, 27(3): 413-417. |
| Liao WB, Lu X. 2010a. Age and growth of a subtropical high-elevation torrent frog, Amolops mantzorum, in western China[J]. Journal of Herpetology, 44(1): 172-176. |
| Liao WB, Lu X. 2010b. Age structure and body size of the Chuanxi tree toad Hyla annectans chuanxiensis from two different elevations (China)[J]. Zoologischer Anzeiger, 248(4): 255-263. |
| Liao WB. 2011. A skeletochronlogical estimate of age in a population of the Siberian Wood Frog, Rana amurensis, from northeastern China[J]. Acta Herpetologica, 6: 237-245. |
| Liao WB, Lu X. 2011. Variation in body size, age and growth in the Omei treefrog (Rhacophorus omeimontis) along an altitudinal gradient in western China[J]. Ethology Ecology and Evolution, 23(3): 248-261. |
| Liao WB, Lu X, Shen YW, et al. 2011. Age structure and body size of two populations of the rice frog Rana limnocharis from different altitudes[J]. Italian Journal of Zoology, 78(2): 215-221. |
| Liao WB, Lu X. 2012. Adult body size =f (initial size + growth rate×age): explaining the proximate cause of Bergman's cline in a toad along altitudinal gradients[J]. Evolutionary Ecology, 26(3): 579-590. |
| Liao WB, Lu X, Jehle R. 2014. Altitudinal variation in maternal investment and trade-offs between egg size and clutch size in the Andrew's toad[J]. Journal of Zoology, 293(2): 84-91. |
| Lou SL, Jin L, Liu YH, et al. 2012. Altitudinal variation in age and body size in Yunnan pond frog (Pelophylax pleuraden)[J]. Zoological Science, 29(18): 493-498. |
| Lu X, Li B, Liang JJ. 2006. Comparative demography of a temperate anuran, Rana chensinensis, along a relatively fine altitudinal gradient[J]. Canadian Journal of Zoology, 84(12): 1789-1795. |
| Ma XY, Lu X. 2009. Sexual size dimorphism in relation to age and growth based on skeletochronological analysis in a Tibetan frog[J]. Amphibia Reptilia, 30(3): 351-359. |
| Mao M, Huang Y, Mi ZP, et al. 2012. Skeletochronological study of age, longevity and growth in a population of Rana nigromaculata (Amphibia: Anura) in Sichuan, China[J]. Asian Herpetological Research, (3): 258-264. |
| Miaud C, Guyétant R, Elmberg J. 1999. Variations in life-history traits in the common frog Rana temporaria (Amphibia: Anura): a literature review and new data from the French Alps[J]. Journal of Zoology, 249: 61-73. |
| Monnet JM, Cherry MI. 2002. Sexual size dimorphism in anurans[J]. Proceedings of the Royal Society London B-Biology Science, 269: 2301-2307. |
| Morrison C, Hero JM. 2003. Geographic variation in life-history characteristics of amphibians: a review[J]. Journal of Animal Ecology, 72(2):270-279 |
| Reading CJ. 1991. The relationship between body length, age and sexual maturity in the common toad, Bufo bufo[J]. Ecography, 14(4): 245-249. |
| Shine R. 1989. Ecological causes for the evolution of sexual dimorphism: a review of the evidence[J]. The Quarterly Review of Biology, 64(4): 419-461. |
| Slatkin M. 1984. Ecological causes of sexual dimorphism[J]. Evolution, 38(3): 662-630. |
| Smirina EM. 1994. Age determination and longevity in amphibians[J]. Gerontology, 40(2-4): 133-146. |
| Stamps J, Krishnan VV. 1997. Sexual bimaturation and sexual size dimorphism in animals with asymptotic growth after maturity[J]. Evolutionary Ecology, 11(1): 21-39." |
 2015, Vol. 34(1)
2015, Vol. 34(1)




