2. 农业农村部环境保护科研监测所,天津 300191
2. Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Tianjin 300191, China
野艾蒿Artemisia lavandulaefolia DC.是菊科蒿属植物,在中国分布及其广泛[1]。有关野艾蒿中化学成分,如挥发油类、萜类、黄酮类、苯丙素类及木脂素类等的研究主要集中在其茎和叶部分[2-5],同时发现其许多化学成分具有一定的杀虫和抑菌活性[6-8]。鉴于木脂素类化合物具有广泛生物活性[9-10],同时考虑到野艾蒿资源丰富,易于采集,本研究从寻找植物源杀菌剂的角度出发,通过现代色谱及波谱等技术手段对野艾蒿中的木脂素类成分进行了细致的研究,以期发现其中具有抑菌活性的先导化合物。现将结果报道如下。
1 材料与方法 1.1 植物材料野艾蒿地上组织,2017年8月采集于内蒙古,经沈阳农业大学曲波教授鉴定为野艾蒿Artemisia lavandulaefolia DC.,植物标本现存于沈阳农业大学植物保护学院微生物次生代谢产物研究室。将植物材料自然晾晒风干,保存备用。
1.2 供试菌株番茄早疫病菌Alternaria solani、玉米纹枯病菌Rhizoctonia solani、禾谷镰刀病菌Fusarium graminearum、甜瓜枯萎病菌Fusarium oxysporum和水稻稻瘟病菌Pyricularia oryzaeCav.,均由沈阳农业大学植物保护学院微生物次生代谢产物研究室提供。
1.3 仪器及试剂FZ102型微型植物粉碎机 (天津市泰斯特仪器有限公司);R-1001-LN型旋转蒸发仪 (郑州长城科工贸有限公司);ZF-20A型暗箱四用紫外分析仪 (上海嘉鹏科技有限公司);Agilent 1260型液相分析色谱仪及半制备型C18色谱柱 (美国Agilent公司);Avance 600核磁共振仪 (Bruker公司);Agilent6500系列四极杆-飞行时间质谱仪 (美国Agilent公司);MultiskanTMFC型酶标仪 (芬兰Thermo Fisher Scientific公司)。ZCX-Ⅱ型柱层析硅胶 (青岛海洋化工厂);Sephadex LH-20 柱层析凝胶 (瑞典Pharmacia公司);甲醇和乙腈 (色谱纯,美国Sigma-Aldrich公司);其余试剂均为国产分析纯。75%百菌清 (chlorothaloni) 可湿性粉剂 (山东潍坊化工股份有限公司)。
1.4 野艾蒿地上部分木脂素成分的提取和分离称量5.5 kg植株样品,粉碎不过筛,用甲醇超声提取4次。抽滤,合并滤液,减压浓缩得到甲醇浸膏160 g。将全部浸膏用适量的水分散后用等体积的乙酸乙酯萃取,浓缩得到乙酸乙酯浸膏54 g。先取出10 g浸膏用二氯甲烷溶解,加入硅胶拌样,晾干研磨成粉。干法装柱,干法上样,硅胶柱色谱分离,依次用二氯甲烷与甲醇的体积比分别为100 : 0、100 : 2、100 : 4、100 : 8、100 : 16、100 : 32和0 : 100的混合溶剂进行梯度洗脱。经薄层层析法 (TLC) 检测,合并相同组分,分别得到10个不同的组分 (Fr1~Fr10)。将Fr4 (4.5 g) 再经硅胶柱梯度洗脱,溶剂石油醚 : 乙酸乙酯的体积比分别为10 : 1、10 : 2、10 : 4、10 : 8、10 : 16、0 : 10,共得到9个部分:Fr4-1 (90 mg)、Fr4-2 (176 mg)、Fr4-3 (250 mg)、Fr4-4 (159 mg)、Fr4-5 (438 mg)、Fr4-6 (276 mg)、Fr4-7 (774 mg)、Fr4-8 (1.3 g)、Fr4-9 (667 mg)。将Fr4-5经过凝胶柱层析[V (二氯甲烷) : V (甲醇)=1 : 1]、硅胶柱层析[V (石油醚) : V (乙酸乙酯) =85 : 15]及[V (二氯甲烷) : V (甲醇)=1 000 : 3]得到化合物1 (30 mg);将Fr4-6经过凝胶柱层析[V (二氯甲烷) : V (甲醇)=1 : 1]、硅胶柱层析 (石油醚 : 乙酸乙酯的体积比依次为85 : 15、80 : 20、75 : 25)、[V (二氯甲烷) : V (甲醇)=1 000 : 3.5]得到化合物2 (12 mg);将Fr4-7经过硅胶柱层析 (石油醚 : 乙酸乙酯的体积比依次为75 : 25、70 : 30、60 : 40、50 : 50)、凝胶柱层析[V (二氯甲烷) : V (甲醇)=1 : 1]、硅胶柱层析[V (石油醚) : V (丙酮)=100 : 17]得到化合物3 (20 mg);[V (二氯甲烷) : V (甲醇)=1 000 : 3.8]得到化合物4 (6 mg);将Fr-8经过硅胶柱层析 (二氯甲烷 : 甲醇的体积比依次为100 : 0.5、100 : 1、100 : 2、100 : 4),得到目标组分A (1.07 g), 将A组分经过凝胶柱层析[V (二氯甲烷) : V (甲醇)=1 : 1]、硅胶柱层析[V (二氯甲烷) : V (甲醇)=1 000 : 5]得到A1 (572 mg) 和A2 (217 mg) 两个部分,A1利用高效液相色谱进行半制备,得到目标化合物5 (100 mg);洗脱条件为体积分数58%的甲醇和42%的水, 保留时间为42 min。将A2经过硅胶柱层析[V(石油醚) : V (乙酸乙酯)=7 : 3]、[V (石油醚) : V (丙酮)=8 : 2]得到化合物6 (18 mg)。
1.5 抑菌活性测定 1.5.1 抑菌活性初筛采用微量肉汤稀释法[11]初步测定6个化合物对番茄早疫病菌、玉米纹枯病菌、禾谷镰刀病菌、甜瓜枯萎病菌及水稻稻瘟病菌的抑制活性。将每种植物病原真菌接种到RPMI Medium 1640 (RPMI是一类细胞培养基,1640是代号,其中含有10%胎牛血清) 培养基中制成菌悬液,用酶标仪调整浓度,使其在波长620 nm处OD值 (光密度,记为OD600) 为0.07~0.09。用少量二甲基亚砜 (DMSO) 溶解化合物,加液体培养基配制成初始质量浓度为100 μg/mL的母液 (DMSO的含量2%)。将母液加入到每孔含有100 μL菌悬液的96孔板中,使得每孔总体积为200 μL,化合物最终浓度为50 μg/mL。以百菌清为药剂对照,以相同含量的DMSO溶剂加培养基为空白对照,每处理重复3次。用酶标仪测定初始OD600值,在25 ℃培养72 h后再次测定OD600值。按式 (1) 计算抑制率 (I)。
| $ I/\% = \frac{{1 - \left( {{{ A}_{72}}{\rm{ - }}{{{A}}_0}} \right)}}{{{{ B}_{72}} - {{B}_0}}} \times 100 $ |
式中:A72和A0分别为处理组72 h和0 h的OD600值,B72和B0分别为对照组72 h和0 h的OD600值。
1.5.2 所筛选化合物对菌丝生长的抑制作用根据初筛结果,选定化合物1、3、5和6,采用菌丝生长速率法[12]进行抑菌活性测定。以V (丙酮):V (吐温-80)=1 : 1为溶剂,分别配制各化合物的质量浓度为5 mg/mL,再逐步稀释后,加入到PDA培养基中,使培养基中含药质量浓度分别为3.125、6.25、12.5、25和50 μg/mL。待培养基凝固后,接入生长一致的菌饼 (直径0.5 cm),菌丝面朝下,置于25 ℃的无菌培养箱中培养。待空白对照菌落长到培养皿直径的2/3~3/4时,采用十字交叉法测量菌落直径,计算菌丝生长抑制率。用SPSS 22.0软件的Probit回归分析进行数据处理,得到毒力回归方程,计算EC50值及95%置信限。以百菌清为药剂对照。
2 结果与分析 2.1 化合物结构鉴定采用 1H NMR、13C NMR和ESI-MS对化合物1~6的结构进行了鉴定,将谱图数据与相关文献的数据进行比对,确定这6个化合物的结构式如图式 1所示,均属于双四氢呋喃类木脂素。
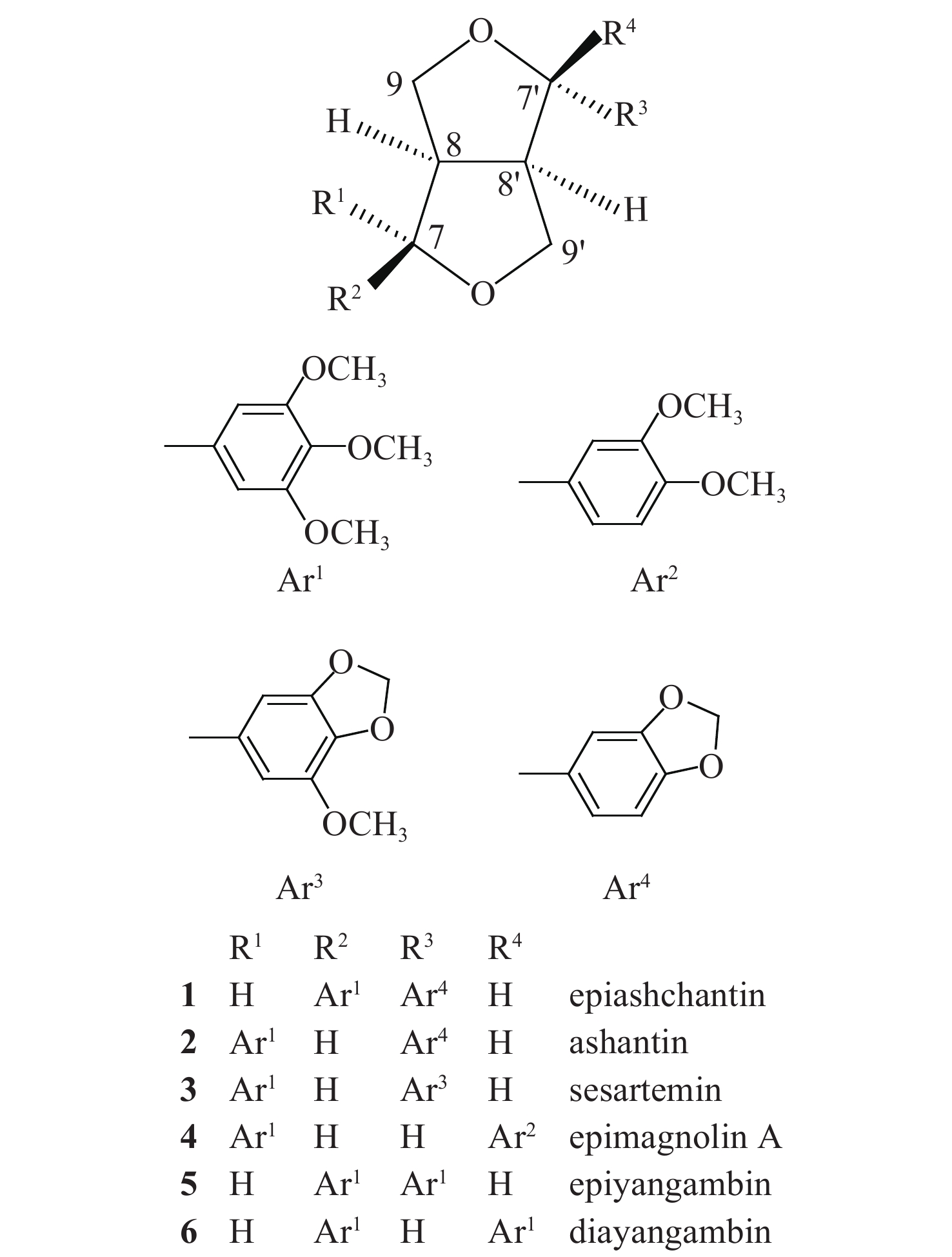
|
图式1 化合物1~6的结构式 Scheme1 The structural formula of compounds 1-6 |
化合物1:白色针状物,m.p. 120~122℃;ESI-MS:m/z 423 [M+Na]+;分子式为C22H24O7。1H NMR(600 MHz, CDCl3),δ:6.87(d, 1H, J = 1.2 Hz, H-6'), 6.82 (dd, 1H, J = 8.0, 1.3 Hz, H-5'), 6.78 (d, 1H, J = 7.9 Hz, H-2'), 6.58(s, 2H, H-2, 6), 5.94 (d, 2H, J = 0.7 Hz, OCH2O), 4.84 (d, 1H, J = 5.6 Hz, H-7), 4.42 (d, J = 7.0 Hz, H-7'), 4.12 (d, 1H, J= 9.5 Hz, Hβ-9'), 3.88 (s, 6H, 3, 5-OMe), 3.85 (s, 3H, 4-OMe), 3.87-3.82 (m, 2H, Hα-9, 9'), 3.39-3.28 (m, 2H, H-8, Hβ-9), 2.88 (dd, 1H, J = 14.5, 7.0 Hz, H-8');13C NMR (150 MHz, CDCl3),δ:153.1 (C-3, 5), 147.9 (C-3'), 147.1 (C-4'), 136.8 (C-4), 135.0 (C-1'), 134.0 (C-1), 119.5 (C-6'), 108.1 (C-5'), 106.4 (C-2'), 102.5 (C-2, 6), 101.0 (OCH2O), 87.6 (C-7'), 82.1 (C-7), 70.9 (C-9'), 69.6 (C-9), 60.8 (4-OMe), 56.1 (3, 5-OMe), 54.4 (C-8'), 50.0 (C-8)。其数据与文献[13]报道一致,故将该化合物鉴定为epiashchantin。
化合物2:无色油状物,ESI-MS:m/z 401[M+H]+;分子式为C22H24O7。1H NMR(600 MHz, CDCl3),δ:6.85 (s, 1H, H-2'), 6.80 (q, 2H, J = 8.1 Hz, H-5', 6'), 6.57 (s, 2H, H-2, 6), 5.95 (s, 2H, OCH2O), 4.73 (t, 2H, J = 4.9 Hz, H-7, 7'), 4.28 (ddd, 2H, J = 15.1, 10.8, 6.3 Hz, Hα-9, 9'), 3.90 (ddd, 2H, J = 11.8, 6.0, 2.9 Hz, Hβ-9, 9'), 3.87 (s, 6H, 3, 5-OMe), 3.84 (s, 3H, 4-OMe), 3.11-3.04 (m, 2H, H-8, 8');13C NMR (150 MHz, CDCl3),δ:153.4 (C-3, 5), 147.9 (C-3'), 147.1 (C-4'), 137.4 (C-4), 136.7 (C-1), 134.9 (C-1'), 119.3 (C-6'), 108.1 (C-5'), 106.4 (C-2'), 102.7 (C-2, 6), 101.0 (OCH2O), 85.9 (C-7), 85.7(C-7'), 71.9 (C-9), 71.6 (C-9'), 60.8 (4-OMe), 56.1 (3, 5-OMe), 54.3 (C-8), 54.2 (C-8')。其数据与文献[14]报道一致,故将该化合物鉴定为ashantin。
化合物3:淡黄色油状物,ESI-MS:m/z 453[M+Na]+;分子式为C23H26O8。1H NMR (600 MHz, CDCl3),δ:6.57 (s, 2H, H-2, 6), 6.55 (s, 1H, H-6'), 6.53 (d, 1H, J = 1.1 Hz, H-2'), 5.96 (q, 2H, J = 1.4 Hz, OCH2O), 4.72 (t, 2H, J = 4.2 Hz, H-7, 7'), 4.28 (ddd, 2H, J = 13.1, 9.1, 6.7 Hz, Hα-9, 9'), 3.92 (d, 1H, J = 4.5 Hz, Hβ-9), 3.91 (s, 3H, 5'-OMe), 3.91-3.89 (m, 1H, Hβ-9'), 3.87 (s, 6H, 3, 5-OMe), 3.84 (s, 3H, 4-OMe), 3.11-3.04 (m, 2H, H-8, 8');13C NMR (150MHz, CDCl3),δ:153.4 (C-3, 5), 149.0 (C-3'), 143.6 (C-5'), 137.4 (C-4), 136.7 (C-1), 135.7 (C-1'), 134.6 (C-4'), 105.5 (C-6'), 102.7 (C-2, 6), 101.4 (OCH2O), 100.0 (C-2'), 85.9 (C-7'), 85.7 (C-7), 71.9 (C-9), 71.7 (C-9'), 60.8 (4-OMe), 56.6 (5'-OMe), 56.1 (3, 5-OMe), 54.3 (C-8, 8')。其数据与文献[15]报道一致,故将该化合物鉴定为sesartemin。
化合物4:无色油状物,ESI-MS:m/z 417[M+H]+;分子式为C23H28O7。1H NMR (600 MHz, CDCl3),δ:6.94 (s, 1H, H-6'), 6.86 (s, 2H, H-2', 5'), 6.59 (s, 2H, H-2, 6), 4.88 (d, 1H, J = 5.5 Hz, H-7), 4.44 (d, 1H, J = 7.1 Hz, H-7'), 4.16 (d, 1H, J = 9.5 Hz, Hβ-9'), 3.91 (s, 3H, 3'-OMe), 3.89 (s, 3H, 4'-OMe), 3.88 (s, 6H, 3, 5-OMe), 3.87-3.84 (m, 2H, Hα-9, 9'), 3.84 (s, 3H, 4-OMe), 3.39-3.31 (m, 2H, H-8, Hβ-9), 2.93 (dd, 1H, J = 14.7, 6.9 Hz, H-8');13C NMR (150 MHz, CDCl3),δ:153.3 (C-3, 5), 148.8 (C-3'), 148.0 (C-4'), 137.5 (C-4), 136.8 (C-1'), 130.8 (C-1), 117.6 (C-6'), 111.0 (C-5'), 108.9 (C-2'), 102.9 (C-2, 6), 87.8 (C-7'), 82.0 (C-7), 71.0 (C-9'), 69.8 (C-9), 60.8 (4-OMe), 56.1 (3, 5-OMe), 55.9 (3'-OMe), 55.8 (4'-OMe), 54.5 (C-8'), 50.0 (C-8)。其数据与文献[16]报道一致,故将该化合物鉴定为epimagnolin A。
化合物5:白色针状物,m.p. 112~114℃;ESI-MS:m/z 485[M+K]+;分子式为C24H30O8。1H NMR (600 MHz, CDCl3),δ:6.59 (d, 4H, J = 5.3 Hz, H-2, 6, 2', 6'), 4.86 (d, 1H, J = 5.2 Hz, H-7), 4.44 (d, 1H, J = 6.9 Hz, H-7'), 4.16 (d, 1H, J = 9.4 Hz, Hβ-9'), 3.92-3.90 (m, 2H, Hα-9, 9'), 3.89-3.83 (m, 18H, 3, 4, 5, 3', 4', 5'-OMe), 3.39-3.32 (m, 2H, H-8, Hβ-9'), 2.93 (dd, 1H, J = 14.2, 6.9 Hz, H-8');13C NMR (150 MHz, CDCl3),δ:153.4 (C-3', 5'), 153.2 (C-3, 5), 137.5 (C-4'), 136.9 (C-4), 136.7 (C-1'), 133.9 (C-1), 102.9 (C-2', 6'), 102.5 (C-2, 6), 87.7 (C-7'), 82.1 (C-7), 71.0 (C-9'), 69.7 (C-9), 60.8 (4'-OMe), 60.7 (4-OMe), 56.1 (3, 5, 3', 5'-OMe), 54.5 (C-8'), 50.0 (C-8)。其数据与文献[17]报道一致,故将该化合物鉴定为epiyangambin。
化合物6:白色固体,m.p. 153~154℃;ESI-MS:m/z 469 [M+Na]+;分子式为C24H30O8。1H NMR (600 MHz, CDCl3),δ:6.62 (s, 4H, H-2, 6, 2', 6'), 4.92 (d, 2H, J = 4.5 Hz, H-7, 7'), 3.89 (s, 12H, 3, 5, 3', 5'-OMe), 3.86 (s, 6H, 4, 4'-OMe), 3.74 (d, 2H, J = 9.7 Hz, Hα-9, 9'), 3.59 (dd, 2H, J = 9.3, 6.8 Hz, Hβ-9, 9'), 3.21 (s, 2H, H-8, 8');13C NMR (150 MHz, CDCl3),δ:153.2 (C-3, 5, 3', 5'), 137.0 (C-1, 1'), 134.5 (C-4, 4'), 103.1 (C-2, 6, 2', 6'), 84.0 (C-7, 7'), 68.8 (C-9, 9'), 60.8 (4, 4'-OMe), 56.0 (3, 5, 3', 5'-OMe), 49.4 (C-8, 8')。其数据与文献[18]报道一致,故将该化合物鉴定为diayangambin。
2.2 活性初筛结果初筛试验结果 (表1) 表明:分离得到的6个化合物在50 μg/mL下对5种供试病原真菌的抑制作用存在明显差异,其中化合物1和3对番茄早疫病菌有较高的抑制效果,抑制率分别为72%和81%,化合物3、5和6对玉米纹枯病菌的抑制率分别为70%、68%和65%。
|
|
表 1 6个化合物对5种植物病原真菌抑制活性的初筛结果 (50 μg/mL) Table 1 Preliminary screening results of inhibitory effect of six compounds against five plant pathogenic fungi (50 μg/mL) |
2.3 化合物的抑菌活性
菌丝生长速率法测定结果 (表2) 表明:化合物1 (epiashchantin) 和3 (sesartemin) 对番茄早疫病菌菌丝生长表现出明显抑制作用,EC50值分别为14.3和11.0 μg/mL;化合物3 (sesartemin)、5 (epiyangambin) 和6 (diayangambin) 对玉米纹枯病菌菌丝生长也表现出抑制作用,EC50值分别为17.4、42.6和54.3 μg/mL。
|
|
表 2 所筛选化合物对番茄早疫病菌和玉米纹枯病菌菌丝生长的抑制作用 Table 2 Inhibitory effect of the screened compounds on the mycelia growth of Alternaria solani and Rhizoctonia solani |
3 结论与讨论
从野艾蒿地上组织中分离得到了6个化合物 (1~6),经鉴定,其均为双四氢呋喃类木脂素,其中化合物1、3、5、6,化合物2和3以及化合物6分别在Artemisia absinthium L.、Achillea holosericea以及Piper fimbriulatum等植物中分离得到过,但并未见有关其生物学方面的研究报道[13-14,18]。本研究将微量肉汤稀释法与菌丝生长速率法相结合首次测定了这6个化合物对番茄早疫病菌、玉米纹枯病菌、禾谷镰刀病菌、甜瓜枯萎病菌和水稻稻瘟病菌的抑制活性。值得注意的是,本研究并未分离得到野艾蒿中的全部木脂素类成分,其余木脂素类成分有待进一步分离纯化。
双四氢呋喃型木脂素在农业领域已表现出较高的使用价值和开发潜力。Akiyama等[19] 发现木脂素virgatusin(见图式 2) 对黄瓜炭疽病菌具有较强的抗菌活性,构效关系分析结果显示,C-9和C-9' 位甲氧基以及苯环上的亚甲二氧基对于抗菌活性是必需的。本研究分离到的含有亚甲二氧基结构的化合物1 (epiashchantin) 对番茄早疫病菌菌丝生长具有明显的抑制作用,化合物3 (sesartemin) 对番茄早疫病菌以及玉米纹枯病菌菌丝生长也具有明显抑制作用,说明苯环上连接亚甲二氧基结构的木脂素类化合物发展为具有农用杀菌活性先导化合物的可能性很大。
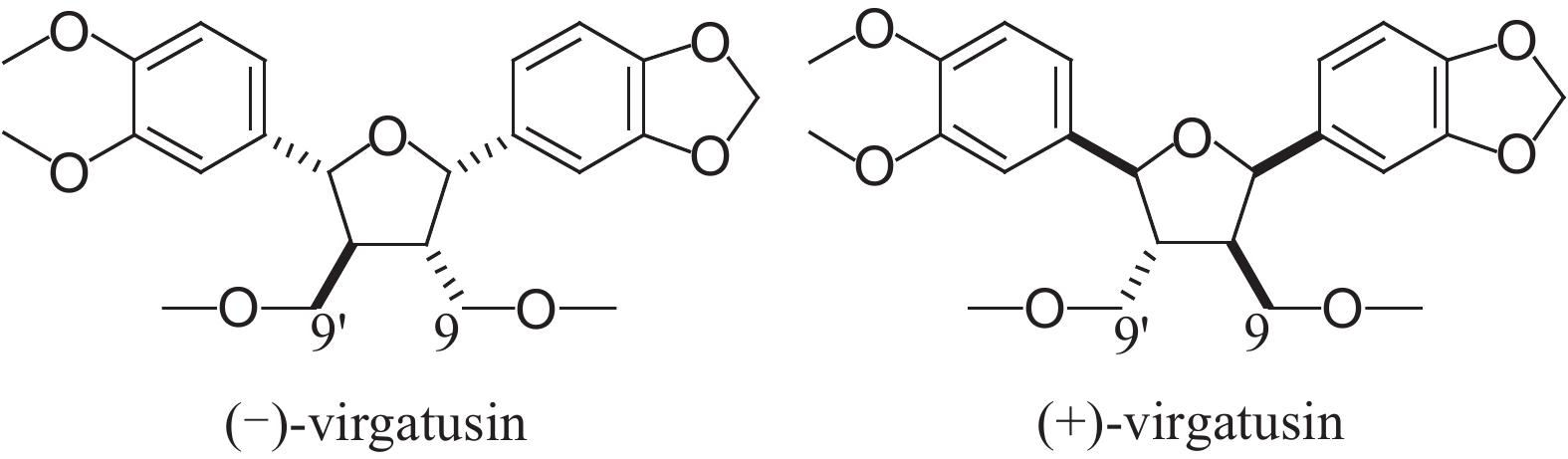
|
图式2 virgatusin的结构式 Scheme2 The structural formula of virgatusin |
天然产物的结构修饰是新农药开发的重要途径[20]。郭琪等[21]以双四氢呋喃木脂素prinsepiol为原料,对其进行酰化反应,设计合成了酰化衍生物,发现其衍生物对番茄灰霉菌孢子萌发抑制作用均有不同程度的提高。本研究仅对野艾蒿的甲醇提取物的乙酸乙酯萃取物进行了初步分离,下一步拟对分离得到的双四氢呋喃类木脂素类化合物进行结构修饰,以期发现具有更好杀菌活性的新化合物。
| [1] |
马麟, 韦炳华, 胡黎. 野艾蒿的化学成分研究[J]. 广州中医药大学学报, 2012, 29(4): 450-453. MA L, WEI B H, HU L. Analysis of chemical constituents of Artemisia lavandulaefolia DC [J]. J Guangzhou Univ Tradit Chin Med, 2012, 29(4): 450-453. |
| [2] |
胡林峰, 崔乘幸, 吴玉博, 等. 艾蒿化学成分及其生物活性研究进展[J]. 河南科技学院学报(自然科学版), 2010, 38(4): 75-78. HU L F, CUI C X, WU Y B, et al. Research advances on chemical constituents and bioactivities of Artemisia argyi [J]. J Henan Inst Sci Technol (Nat Sci Ed), 2010, 38(4): 75-78. DOI:10.3969/j.issn.1008-7516.2010.04.019 |
| [3] |
马麟, 周海玲, 龚又明, 等. 野艾蒿中黄酮类成分的研究[J]. 中药新药与临床药理, 2012, 23(5): 555-557. MA L, ZHOU H L, GONG Y M, et al. Analysis of flavonoids from aerial parts of Artemisia lavandulaefolia [J]. Tradit Chin Drug Res Clin Pharmacol, 2012, 23(5): 555-557. DOI:10.3969/j.issn.1003-9783.2012.05.017 |
| [4] |
HUANG X, GE S Y, LIU J H, et al. Chemical composition and bioactivity of the essential oil from Artemisia lavandulaefolia (Asteraceae) on Plutella xylostella (Lepidoptera: Plutellidae)
[J]. Flo Entomol, 2018, 101(1): 44-48. DOI:10.1653/024.101.0109 |
| [5] |
ZHOU J, ZOU K X, ZHANG W J, et al. Efficacy of compounds isolated from the essential oil of Artemisia lavandulaefolia in control of the cigarette beetle, Lasioderma serricorne
[J]. Molecules, 2018, 23(2): 343. DOI:10.3390/molecules23020343 |
| [6] |
江贵波, 曾任森, 陈少雄, 等. 中药野艾挥发性物质的抗菌活性与成分鉴定[J]. 沈阳农业大学学报, 2008, 39(4): 495-498. JIANG G B, ZENG R S, CHEN S X, et al. Identification and antimicrobial effects of volatiles in traditional Chinese medicine herb Artemisia lavandulaefolia DC.Prodr [J]. J Shenyang Agric Univ, 2008, 39(4): 495-498. DOI:10.3969/j.issn.1000-1700.2008.04.027 |
| [7] |
莫茂军, 吴洪基, 韩诗畴, 等. 16种植物乙醇提取物对桔全爪螨的生物活性测定[J]. 环境昆虫学报, 2008, 30(1): 44-49. MO M J, WU H J, HAN S C, et al. Bio-activity of the alcohol extracts from 16 plant species against citrus red mite Panonychus citri McGregor [J]. J Environ Entomol, 2008, 30(1): 44-49. |
| [8] |
袁海滨, 刘莹, 丁玉骁, 等. 野艾蒿精油对双斑萤叶甲成虫的熏蒸活性及体内酶活力的影响[J]. 吉林农业大学学报, 2014, 36(1): 30-35. YUAN H B, LIU Y, DING Y X, et al. Effects of essential oil from Artemisia lavandulaefolia DC.on fumigation activity and several enzymes activities of Monolepta hieroglyphica (Motschulsky) Adults [J]. J Jilin Agric Univ, 2014, 36(1): 30-35. |
| [9] |
王丹, 尉捷, 许欣然, 等. 天然双四氢呋喃类木脂素化合物的化学研究进展[J]. 中国实验方剂学杂志, 2017, 23(8): 226-234. WANG D, YU J, XU X R, et al. Research progress of chemical compounds in tetrahydrofuran lignans[J]. Chin J Exp Tradit Med Formulae, 2017, 23(8): 226-234. |
| [10] |
KAMAL-ELDIN A, YOUSIF G. A furofuran lignan from Sesamum alatum
[J]. Phytochemistry, 1992, 31(8): 2911-2912. DOI:10.1016/0031-9422(92)83664-K |
| [11] |
CRAWFORD J M, PORTMANN C, ZHANG X, et al. Small molecule perimeter defense in entomopathogenic bacteria[J]. Proc Natl Acad Sci USA, 2012, 109(27): 10821-10826. DOI:10.1073/pnas.1201160109 |
| [12] |
冯志东. 植物病理与研究方法 [M]. 北京: 中国农业出版社, 1998. FANG Z D. Method of plant pathology research[M]. Beijing: China Agriculture Press, 1998. |
| [13] |
TULAKEA, TU P F. Nine lignans from Artemisia absinthium L.
[J]. J Chin Pharm Sci, 2012, 21(4): 360-364. |
| [14] |
AHMED A A, MAHMOUD A A, ALI E T, et al. Two highly oxygenated eudesmanes and 10 lignans from Achillea holosericea
[J]. Phytochemistry, 2002, 59(8): 851-856. DOI:10.1016/S0031-9422(01)00442-3 |
| [15] |
GREGER H, HOFER O. New unsymmetrically substituted tetrahydrofurofuran lignans from Artemisia absinthium
[J]. Tetrahedron, 1980, 36(24): 3551-3558. DOI:10.1016/0040-4020(80)88051-3 |
| [16] |
BROWN R C D, BATAILLE C J R, BRUTON G, et al. C-H insertion approach to the synthesis of endo, exo-furofuranones: synthesis of (±)-asarinin, (±)-epimagnolin a, and (±)-fargesin
[J]. J Org Chem, 2001, 66(20): 6719-6728. DOI:10.1021/jo015829q |
| [17] |
CASTRO-FARIA-NETO H C, MARTINS M A, SILVA P M, et al. Pharmacological profile of epiyangambin: a furofuran lignan with PAF antagonist activity[J]. J Lipid Mediat, 1993, 7(1): 1-9. |
| [18] |
SOLÍS P N, OLMEDO D, NAKAMURA N, et al. A new larvicidal lignan from Piper fimbriulatum
[J]. Pharm Biol, 2005, 43(4): 378-381. DOI:10.1080/13880200590951865 |
| [19] |
AKIYAMA K, YAMAUCHI S, NAKATO T, et al. Antifungal activity of tetra-substituted tetrahydrofuran lignan, (-)-virgatusin, and its structure-activity relationship[J]. Biosci Biotechnol Biochem, 2007, 71(4): 1028-1035. DOI:10.1271/bbb.60696 |
| [20] |
郭宗儒. 天然产物的结构改造[J]. 药学学报, 2012, 47(2): 144-157. GUO Z R. Modification of natural products for drug discovery[J]. Acta Pharmaceutica Sinica, 2012, 47(2): 144-157. |
| [21] |
郭琪, 冯俊涛, 方香玲, 等. 双四氢呋喃木脂素 Prinsepiol 酰化衍生物的合成及其抑菌活性研究[J]. 西北农林科技大学学报(自然科学版), 2008, 36(12): 223-228. GUO Q, FENG J T, FANG X L, et al. Synthesis and antifungal activity of acyl derivatives of Prinsepiol[J]. J Northwest A&F Univ (Nat Sci Ed), 2008, 36(12): 223-228. DOI:10.3321/j.issn:1671-9387.2008.12.037 |
 2019, Vol. 21
2019, Vol. 21


