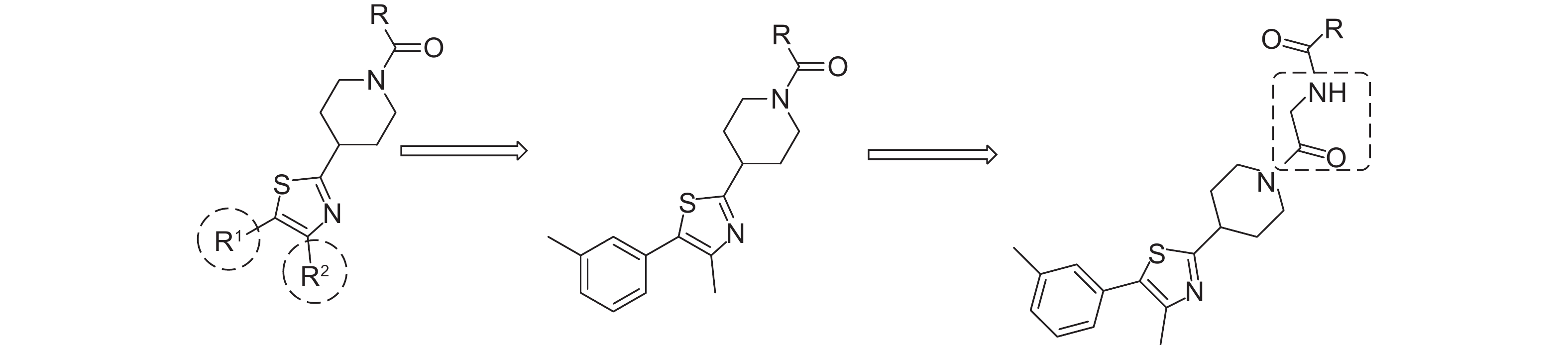
哌啶噻唑类化合物是一类新颖的具有良好杀菌活性的化合物,起初应用于医药领域[1]。杜邦公司最早发现该类化合物具有杀菌活性[2-3],并于2012年推出第一个含哌啶噻唑结构的农药品种—氟噻唑吡乙酮 (oxathiapiprolin),其对黄瓜霜霉病、番茄晚疫病和葡萄霜霉病等都有显著的防治效果,尤其对马铃薯和番茄晚疫病的致病疫霉Phytophthora infestans高效[4]。之后,研究人员对哌啶噻唑结构进行改造修饰,发现了许多具有杀菌活性的哌啶噻唑类化合物[5-7],拜耳公司也推出了结构与氟噻唑吡乙酮相似的新品种fluoxapiprolin[8-9]。此外,甘氨酸常作为药效基团的连接部分出现在农药结构中,以提高农药的生物活性[10-14]。在前期研究中,笔者发现当哌啶环上连接磺酰胺及杂环酰胺时,化合物表现出良好的杀虫、杀菌活性,而连接苯基或取代苯基时却几乎无杀菌活性[15-16]。鉴于此,本研究以哌啶噻唑结构作为母体,以甘氨酸作为纽带连接基团R和哌啶基,设计并合成了一系列含哌啶噻唑结构的乙酰氨基衍生物,对其化学结构进行了鉴定,并初步测定了所有目标化合物对几种常见植物病原真菌的杀菌活性,目标化合物的设计及合成路线见图式1和图式2。
|
图式1 目标化合物设计 Scheme1 Design of title compounds |
|
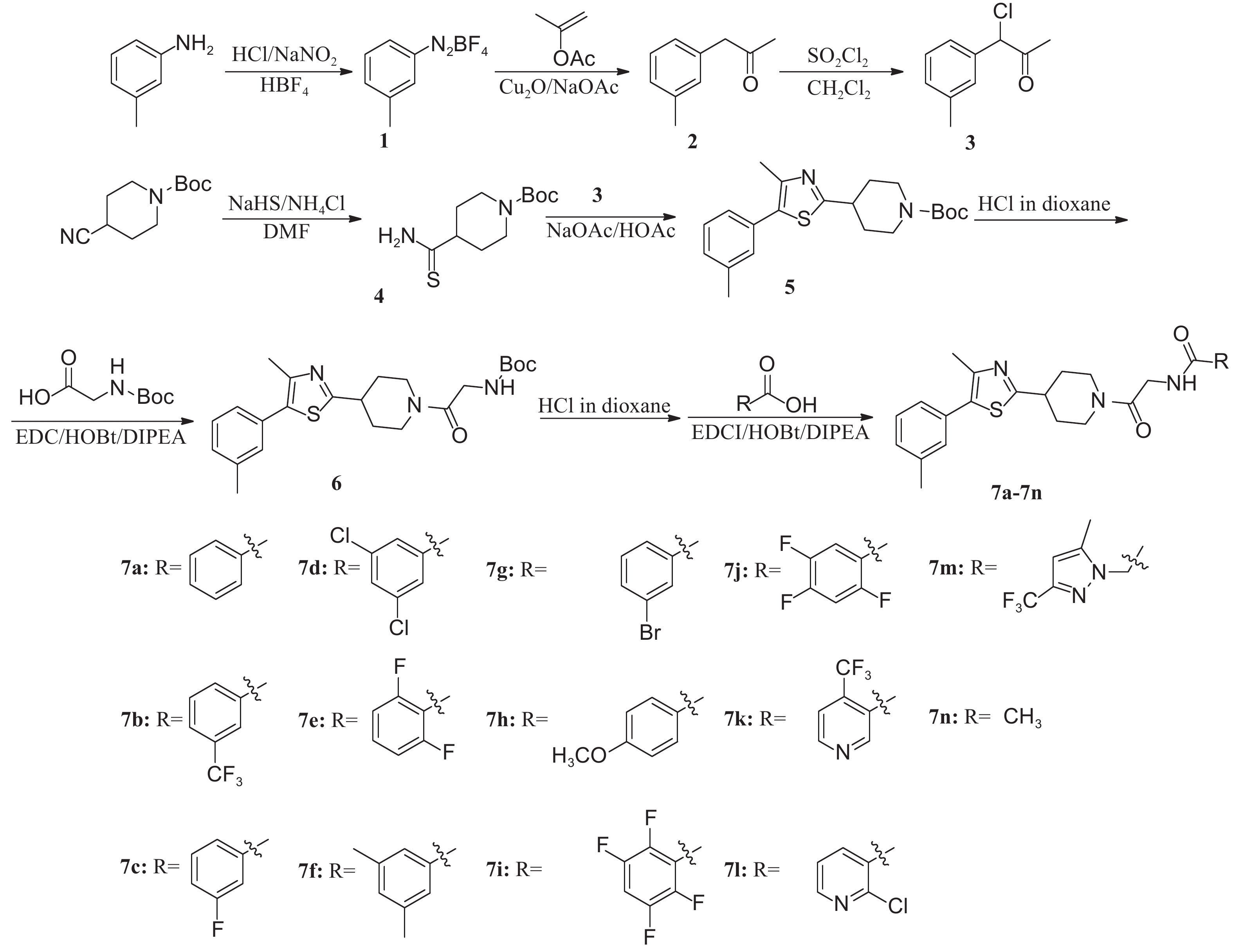
图式2 目标化合物合成路线 Scheme2 Synthesis route of title compounds |
1 实验部分 1.1 仪器与试剂
SHZ-III型循环水式真空泵 (郑州长城);Ry-1G熔点仪(温度计未校正,天津光学仪器厂) AVANCE Ⅲ 500MHz核磁共振仪 (TMS为内标,以CDCl3为溶剂,Bruker);Hei-VAP Value旋转蒸发仪(德国Heidolph);Daltonics Bio-TOF-Q III型质谱仪(Bruker)柱层析硅胶为H型 (青岛海洋化工厂,48~75 μm)。所用试剂和溶剂均为分析纯。97%多菌灵 (carbendazim) 原药 (上海阿拉丁生化科技股份有限公司);98%噻呋酰胺 (thifluzamide) 原药 (上海麦克林生化科技有限公司)。
1.2 化合物的合成 1.2.1 化合物1~4的合成化合物1和2参照文献[17]方法合成;化合物3和4分别参照文献[18]和[16]方法合成。
1.2.2 4-(4-(3-甲基苯基)-5-甲基噻唑-2-基) 哌啶-1-甲酸叔丁酯 (5) 的合成参照文献[16]的方法合成。在250 mL三口瓶中加入10.0g中间体4 (0.04 mol)、7.3 g中间体3 (0.04 mol)、6.6 g无水乙酸钠 (0.08 mol) 和乙酸100 mL,80 ℃下搅拌反应12 h。过滤,滤液旋转蒸发至干。所得产物用50 mL乙酸乙酯溶解后加入到100 mL水中,静置分层。取有机相,水相再用乙酸乙酯萃取3次,每次50 mL。合并萃取液,旋转蒸发脱去溶剂,得黄色油状物11 g,收率76%。1H NMR (500 MHz, CDCl3),δ:7.31 (t, J = 7.7 Hz, 1H), 7.22 (d, J = 7.6 Hz, 2H), 7.16 (d, J = 7.5 Hz, 1H), 4.25 (s, 2H), 3.14 (t, J = 11.3 Hz, 1H), 2.88 (s, 2H), 2.48 (s, 3H), 2.40 (s, 3H), 2.12 (d, J = 14.7 Hz, 2H), 1.80~1.69 (m, 2H), 1.49 (s, 9H)。HRMS (ESI):计算值C21H28N2O2S [M+H]+ 373.194 9;测定值373.195 2。
1.2.3 (2(4-(4-甲基-5-(3-甲基苯基) 噻唑-2-基) 哌啶-1-基)-2-氧代乙基) 氨基甲酸叔丁酯 (6) 的合成在250 mL三口瓶中加入10.0 g (26.8 mmol) 中间体5,再加入4 mol/L的盐酸二氧六环溶液50 mL,室温下搅拌4 h。过滤,滤饼烘干后得白色盐酸盐固体。不经提纯,直接进行下一步反应。
参照文献[19]方法进行缩合反应。取100 mL二氯甲烷置于冰浴中,加入8.0 g (26.0 mmol) 上述盐酸盐和4.6 g (26.0 mmol) N-Boc-甘氨酸,搅拌后依次加入5.4 g (28.6 mmol) 1-乙基-(3-二甲基氨基丙基) 碳酰二亚胺盐酸盐 (EDCI)、6.8 g (52.0 mmol) N,N-二异丙基乙胺 (DIPEA) 和3.8 g (28.6 mmol) 1-羟基苯并三唑 (HOBt),于室温下反应24 h。反应液先用30 mL 5%的盐酸溶液洗涤2次,再用30 mL 5% 碳酸氢钠溶液洗涤2次,最后用30 mL饱和氯化钠水溶液洗涤2次,无水硫酸钠干燥,旋转蒸发至干,得淡黄色油状物8.8 g,收率79%。1H NMR (500 MHz, CDCl3), δ: 7.30 (t, J = 7.6 Hz, 1H), 7.21 (d, J = 7.7 Hz, 2H), 7.16 (d, J = 7.7 Hz, 1H), 5.56 (s, 1H), 4.64 (d, J = 13.5 Hz, 1H), 4.00 (s, 2H), 3.82 (d, J = 13.5 Hz, 1H), 3.35~3.14 (m, 2H), 2.85 (t, J = 12.6 Hz, 1H), 2.46 (s, 3H), 2.39 (s, 3H), 2.18 (t, J = 13.3 Hz, 2H), 1.85~1.71 (m, 2H), 1.46 (s, 9H)。HRMS (ESI):计算值C23H31N3O3S [M+H]+ 430.215 9;测定值430.216 6。
1.2.4 目标化合物7的合成在100 mL三口瓶中加入8 g (18.6 mmol) 中间体6和4 mol/L的盐酸二氧六环溶液20 mL,室温下搅拌4 h。旋转蒸发至干,得黄色盐酸盐固体,不经提纯,直接进行下一步缩合反应。
取上步盐酸盐1.0 mmol和羧酸1.0 mmol于20 mL二氯甲烷中,温度控制在0 ℃左右,依次加入1.1 mmol EDCI、2.0 mmol DIPEA和1.1 mmol HOBt,于室温下搅拌反应过夜。反应液依次经10 mL 5% 的盐酸溶液洗涤2次,10 mL 5%的碳酸氢钠溶液洗涤2次,10 mL饱和氯化钠水溶液洗涤2次后,无水硫酸钠干燥,旋转蒸发脱去溶剂。粗产物经硅胶柱层析分离得产物7(7a~7n),其中7a~7j、7n的洗脱剂为V (石油醚): V (乙酸乙酯) = 6: 1,7k、7l、7m流动相为 V (石油醚): V (乙酸乙酯) = 4: 1。
1.3 杀菌活性测定供试菌株:水稻纹枯病菌Rhizoctonia solani、黄瓜灰霉病菌Botrytis cinerea和马铃薯晚疫病菌Phytophthora infestans (Mont.) de Bary均由浙江省化工研究院有限公司提供。
采用菌丝生长率法[20]测定。以多菌灵和噻呋酰胺为对照药剂,含溶剂的无菌水为空白对照。准确称取0.05 g (精确至0.000 1 g) 样品,用0.20 mL N, N-二甲基甲酰胺 (DMF) 溶解,加入含体积分数为0.1% Tween-80的无菌水溶液98.8 mL,配制成化合物质量浓度为500 mg/L的药液。取各药液2 mL,加入到38 mL冷却至45 ℃的马铃薯葡萄糖琼脂 (PDA) 培养基中,制成终浓度为25 mg/L的含药培养基平板。从培养好供试病原菌菌落边缘打取直径6.0 mm的菌丝块,移至含药培养基上。每处理4次重复。置于28 ℃的恒温生化培养箱中培养,4 d后测量菌落直径,计算菌生长抑制率。
2 结果与分析 2.1 化合物的合成以间甲基苯胺为原料,经重氮化反应制成氟硼酸重氮盐固体1,再在Cu2O催化下与乙酸异丙烯酯反应,生成1-(间甲苯基)-2-丙酮 (2) ;化合物2与磺酰氯发生氯化反应,得到关键中间体3。由于中间体3在氯化过程中易生成二氯取代产物,因此需控制磺酰氯用量和反应时间,投料时磺酰氯与化合物2物质的量之比为1.1: 1.0, 反应时间以40 min为最佳。化合物3与4在80 ℃下, 以乙酸作溶剂、乙酸钠作缚酸剂条件下形成噻唑环,得化合物5。文献中报道,在合成噻唑环时通常使用乙醇、DMF和丙酮[21-23]等作溶剂,但收率低,产物难以分离纯化,而采用乙酸作溶剂,收率可达85%以上,后处理方便。化合物5经过脱Boc保护后,以EDCI作为缩合剂经缩合反应得到一系列目标产物7a~7n。其熔点、收率及高分辨质谱数据见表1,核磁共振氢谱 (1H NMR) 及核磁共振碳谱 (13C NMR) 见表2。
|
|
表 1 目标化合物7a~7n的理化数据及高分辨质谱 Table 1 Physical properties, HRMS of compounds 7a-7n |
|
|
表 2 目标化合物7a~7n的 1H NMR和 13C NMR数据 Table 2 The 1H NMR and 13C NMR data of compounds 7a-7n |
以目标化合物7k为例。在 1H NMR谱图中:δ 7.31、7.22和7.16处为芳环上的质子信号;-CONH-基团含有活泼氢,且位于低场区,在δ 7.26处呈宽单峰;吡啶的氢与苯环氢相比处于低场,化学位移较大,其中与N原子相邻碳上的氢的化学位移更偏于低场,δ 8.89处的单峰和δ 8.87处的双峰为吡啶基N原子邻位质子,δ 7.60处的双峰为吡啶基N原子间位的质子;甲基上的质子在δ 2.47 和2.40处,且为单峰。
2.2 杀菌活性测试结果 (表3) 表明,在25 mg/L剂量下,部分目标化合物对黄瓜灰霉病菌具有较好的抑菌效果,其中化合物7a、7c和7g对黄瓜灰霉病菌的抑制率在70%左右;化合物7a、7g、7i 对马铃薯晚疫病菌也有中等抑制作用。从化合物结构上看:当R为苯基、间溴苯基和间氟苯基时,化合物对黄瓜灰霉病菌表现出良好的杀菌活性,且当R为间溴苯基时,对马铃薯晚疫病菌也有良好的抑制作用;而对于含氟化合物, 当R为间氟苯基时,对黄瓜灰霉病菌的杀菌效果最好,其他含氟化合物杀菌活性一般。与前期报道[15-16]相比,引入甘氨酸作为连接基团,部分化合物生物活性有了一定程度提高,其中化合物7a、7c、7g和7i的杀菌活性较好,可以对其进一步优化以提高活性。
|
|
表 3 25 mg/L下目标化合物7a~7n对3种植物病原菌的抑菌活性 Table 3 Fungicidal activities of compounds 7a-7n against 3 fungi at 25 mg/L |
3 结论
以哌啶噻唑结构为母体,设计并合成了14个未见报道的含哌啶噻唑结构的乙酰氨基衍生物,所有化合物的结构均经过 1H NMR、13C NMR和HRMS确证。杀菌活性测试结果表明,部分目标化合物在25 mg/L下对黄瓜灰霉病和马铃薯晚疫病表现出良好的杀菌活性。其中化合物7a、7c和7g对黄瓜灰霉病菌的杀菌效果显著,抑制率在70%左右;7a、7g和7i对马铃薯晚疫病菌也有中等程度的杀菌效果,抑制率在50%以上。总体而言,化合物7a、7c、7g和7i的杀菌活性较好,具有进一步研究的价值。
| [1] |
黄光, 杨吉春, 李慧超, 等. 具有农药活性的噻唑类化合物的研究进展[J]. 农药, 2011, 50(2): 79-82. HUANG G, YANG J C, LI H C, et al. Research progress on the thiazole derivatives as agrochemicals[J]. Agrochemicals, 2011, 50(2): 79-82. DOI:10.3969/j.issn.1006-0413.2011.02.001 |
| [2] |
BISAHA J J, KOVACS P R, LETT R M, et al. Fungicidal Carboxamides: WO 2007014290[P]. 2007-02-01.
|
| [3] |
PASTERIS R J, LAHM G P. Fungicidal Amides: WO 2008091580[P]. 2008-07-31.
|
| [4] |
杨子辉, 田昊, 张莉. 具有农药活性的哌啶类化合物的研究进展[J]. 世界农药, 2017, 39(4): 43-46. YANG Z H, TIAN H, ZHANG L. Progress on the agrochemical activities of piperidine derivatives[J]. World Pestic, 2017, 39(4): 43-46. |
| [5] |
SULZER-MOSSE S, CEDERBAUM F, LAMBERTH C, et al. Synthesis and fungicidal activity of N-thiazol-4-yl- salicylamides, a new family of anti-oomycete compounds
[J]. Bioorg Med Chem, 2015, 23(9): 2129-2138. DOI:10.1016/j.bmc.2015.03.007 |
| [6] |
SULZER-MOSSE S, LAMBERTH C, KUBIZNA P. Synthesis of ring-opened analogues of oxysterol-binding protein-inhibiting piperidinyl-thiazole fungicides[J]. Synlett, 2017, 28(17): 2277-2280. DOI:10.1055/s-0036-1588473 |
| [7] |
CHEN L, ZHU Y J, FAN Z J, et al. Synthesis of 1, 2, 3-thiadiazole and thiazole-based strobilurins as potent fungicide candidates[J]. J Agric Food Chem, 2017, 65(4): 745-751. DOI:10.1021/acs.jafc.6b05128 |
| [8] |
CRISTAU P, RAHN N, TSUCHIYA T, et al. Thiazolyl oxime ether and hydrazones asl plant protection agent: WO 2010066353[P]. 2010-06-17
|
| [9] |
CRISTAU P, RAHN N, HERRMANN S, et al. Heterocyclyl-substituted thiazoles as plant protection agents: WO 2010037479[P]. 2010-04-08.
|
| [10] |
赵建, 曲文岩, 林德杰, 等. α-氨基酸在农药合成中的应用
[J]. 农药学学报, 2010, 12(4): 371-382. ZHAO J, QU W Y, LIN D J, et al. Application of α-amino acids in agrochemicals synthesis [J]. Chin J Pestic Sci, 2010, 12(4): 371-382. DOI:10.3969/j.issn.1008-7303.2010.04.01 |
| [11] |
KANG S H, SONG B A, WU J, et al. Design, synthesis and insecticidal activities of novel acetamido derivatives containing N-pyridylpyrazole carboxamides
[J]. Eur J Med Chem, 2013, 67: 14-18. DOI:10.1016/j.ejmech.2013.06.023 |
| [12] |
CAI N, LIU C X, FENG Z H, et al. Design, synthesis, and SAR of novel 2-glycinamide cyclohexyl sulfonamide derivatives against Botrytis cinerea
[J]. Molecules, 2018, 23(4): 740-758. DOI:10.3390/molecules23040740 |
| [13] |
方志勇. N-(N’-取代苯基甘氨酰基)-4-氯-3-乙基-1-甲基-5-吡唑酰胺类化合物的合成及生物活性研究[D]. 武汉: 华中农业大学, 2011. FANG Z Y. Synthesis and biological activity of N-(N’-substituted phenylglycyl)-4-chloro-3-ethyl-1-methyl- pyrazolecarboxamide[D]. Wuhan: Huazhong Agricultural University, 2011. |
| [14] |
SPATZ D M. N-substituted-N′,N′-disubstituted glycinamide fungicides: US 4661494[P]. 1987-04-28.
|
| [15] |
丁成荣, 潘亚运, 殷许, 等. 一种含哌啶噻唑类化合物在制备杀菌剂中的应用及其制备方法: CN107646855A[P]. 2018-02-02. DING C R, PAN Y Y, YIN X, et al. Preparation of piperidine thiazole compounds and its application as a fungicide : CN107646855A[P]. 2018-02-02. |
| [16] |
丁成荣, 潘亚运, 殷许, 等. 新型哌啶噻唑类化合物的合成及杀虫活性[J]. 有机化学, 2019, 39(3): 836-841. DING C R, PAN Y Y, YIN X, et al. Synthesis and insecticidal activity of novel piperidine thiazole compounds[J]. Chin J Org Chem, 2019, 39(3): 836-841. |
| [17] |
李丽, 刘展鹏, 林原斌. 1-芳基-2-丙酮的合成研究[J]. 有机化学, 2007, 27(10): 1244-1249. LI L, LIU Z P, LIN Y B. Study on synthesis of 1-aryl-2-propanones[J]. Chin J Org Chem, 2007, 27(10): 1244-1249. |
| [18] |
COHEN M, BRETLER U, ALBECK A. Peptidyl cyclopropenones: Reversible inhibitors, irreversible inhibitors, or substrates of cysteine proteases?[J]. Protein Sci, 2013, 22(6): 788-799. DOI:10.1002/pro.2260 |
| [19] |
XU M H, ZHU J S, DIAO Y Y, et al. Novel selective and potent inhibitors of malaria parasite dihydroorotate dehydrogenase: discovery and optimization of dihydrothiophenone derivatives[J]. J Med Chem, 2013, 56(20): 7911-7924. DOI:10.1021/jm400938g |
| [20] |
农药室内生物测定试验准则 杀菌剂 第 2 部分: 抑制病原真菌菌丝生长试验平皿法: NY/T 1156.2—2006[S].北京:中国农业出版社,2006. Pesticides guidelines for laboratory bioactivity tests Part 2: petri plate test for determining fungicide inhibition of mycelial growth: NY/T 1156.2—2006[S]. Beijing: China Agriculture Press, 2006. |
| [21] |
翁建全, 刘会君, 刘幸海, 等. 2-[4-(对氟苯基)噻唑-2-基]-3-羟基-3-烃氧基丙烯腈的合成及杀菌活性[J]. 农药学学报, 2010, 12(4): 463-467. WENG J Q, LIU H J, LIU X H, et al. Synthesis and fungicidal activity of 2-[4-(4-fluorophenyl) thiazol-2-yl]-3-hydroxy-3-hydrocarbyloxy acrylonitriles[J]. Chin J Pestic Sci, 2010, 12(4): 463-467. DOI:10.3969/j.issn.1008-7303.2010.04.15 |
| [22] |
肖捷, 周雪琴, 刘东志, 等. N-取代2-甲基-4-三氟甲基-5-噻唑甲酰胺的合成及杀菌活性
[J]. 农药学学报, 2012, 14(1): 107-110. XIAO J, ZHOU X Q, LIU D Z, et al. Synthesis and fungicidal activity of N-substituted 2-methyl-4-trifluoromethyl-5-thiazole carboxamides [J]. Chin J Pestic Sci, 2012, 14(1): 107-110. DOI:10.3969/j.issn.1008-7303.2012.01.17 |
| [23] |
MAIENFISCH P, EDMUNDS A J F. Thiazole and isothiazole ring–containing compounds in crop protection[J]. Adv Heterocycl Chem, 2017, 121: 35-88. DOI:10.1016/bs.aihch.2016.04.010 |
 2019, Vol. 21
2019, Vol. 21


