加工方式对农药残留的影响效果可通过加工因子 (PF) 来评估,当PF = 1时,表明加工方式对农药去除没有影响;当PF < 1时,表明加工方式对农药去除有促进作用,PF值越低,农药的残留浓度越低;当PF > 1时,表明加工方式对农药残留浓度有增强作用,PF值越大,农药残留浓度越高 [1-3]。研究结果显示,清洗、去皮以及烹煮等加工方式能降低农药在农产品中的残留量,但加工过程中由于食品水分的流失,也会导致农药残留浓度的增加[4-6]。加工因子不仅被大量用于准确计算消费者膳食摄入量方面的研究,同时也用于食品中农药最大残留限量标准的制定[5, 7-11]。黄瓜在种植过程中常用多菌灵、吡虫啉、啶虫脒、霜霉威和氯氰菊酯等防治病虫害,其中多菌灵的检出频次较高,如Xu等[12]报道,在近几年的中国蔬菜监测中13.2%的黄瓜中检出多菌灵。黄瓜作为人们最喜爱的蔬菜之一,食用方式多样,而所报道的文献仅研究了不同清洗方式[13]和储藏条件[14]对农药残留的影响,有关其他加工方式对黄瓜中农药残留的影响尚未见报道。鉴于此,本研究选择黄瓜种植过程中常用的10种农药在水洗、水煮、炒制、去皮和腌制等5种加工方式下的残留变化情况,并计算相应的加工因子,结合农药的理化性质参数探寻加工因子的变化规律。研究结果可为膳食评估提供数据支撑,也为主管部门对农药残留的管控提供建议和对策,保障蔬菜生产的质量安全。
1 材料与方法 1.1 仪器、试剂与材料WATERS ACQUITY TQ三重四极杆-液相色谱-串联质谱仪 (美国Waters公司);TSQ Quantum GC气相色谱-串联质谱仪 (美国Thermo Fisher公司);Elix5超纯水系统 (美国Millipore公司);SK-1快速混匀器 (浙江省金坛市科析仪器有限公司);移液枪 (德国eppendorf公司);T18-B-S25匀浆仪 (德国IKA公司);TP-402天平 (美国Denver公司)。
10种农药标准品 (纯度 ≥ 96%),农业农村部环境质量监督检验测试中心 (天津),结构式见图式 1,理化性质见表1。80%多菌灵可湿性粉剂 (四川国光农化股份有限公司);70%吡虫啉水分散粒剂和66.5%霜霉威水剂 (德国拜耳);20%啶虫脒水分散粒剂 (河北野田农用化学有限公司);16%乙霉威水分散粒剂和10%嘧霉胺水分散粒剂 (青岛瀚生生物科技股份有限公司);15%丙溴磷乳油和4.5%氯氰菊酯乳油 (济南中科绿色生物工程有限公司);10%三唑磷乳油和80%敌敌畏乳油 (湖北沙隆达股份有限公司)。乙腈和甲醇 (色谱纯,天津四友有限责任公司);氯化钠 (优级纯,上海国光试剂有限责任公司);试验用水均为超纯水 (美国Millipore公司超纯水器制备,电阻率为18.2 Ω · cm)。
|
图式1 十种待测农药的化学结构式 Scheme1 Structural formula of 10 pesticides |
|
|
表 1 十种待测农药的理化性质参数 Table 1 The physico-chemical properties of 10 pesticides |
供试黄瓜Cucumis sativusLinn.购自重庆市农贸市场。
1.2 样品的处理与加工分别称取一定量的10种农药制剂于20 L超纯水中,配制成50 mg/L的混合溶液。称取5 kg黄瓜样品置于该混合溶液中浸泡30 min后捞出、滤干,于通风处静置24 h,即为沉积农药后的样品,用于试验。
1.2.1 水洗分别取约1 000 g沉积农药后的黄瓜样品,在水流速为9 L/min的状态下,分别冲洗3、5和10 min后滤干水,取500 g样品粉碎,备用。
1.2.2 去皮将沉积农药后的黄瓜样品,去皮后称取500 g粉碎,备用。
1.2.3 炒制将沉积农药后的黄瓜样品切片后称取500 g。在炒锅中倒入50 mL食用油,用电磁炉 (2 000 W) 分别炒制3、5和7 min后捞出,粉碎,备用。
1.2.4 水煮将沉积农药后的黄瓜样品切片后称取500 g。于电磁炉 (2 000 W) 下,将其置于盛有1 000 mL沸水的煮锅中分别煮3、5和10 min后捞出,粉碎,备用。
1.2.5 腌制称取沉积农药后的黄瓜样品1 000 g平铺于白瓷盘上,按照黄瓜质量的20%添加氯化钠于黄瓜表面,用保鲜膜密封,并用石头压实。于室温下腌制 1 d后取出,粉碎,备用。
1.3 样品的提取、净化与检测称取25 g粉碎的黄瓜样品于250 mL烧杯中,加入50 mL乙腈,匀浆;过滤至盛有8 g氯化钠的50 mL玻璃具塞比色管中,充分振摇,静置30 min;移取1 mL上清液于具塞玻璃离心管中,加入1 mL体积分数为50%的甲醇水溶液,混匀;过0.22 μm滤膜,待测。
1.4 检测条件色谱条件:ACQUITY UPLC® BEH C18色谱柱 (2.1 mm × 50 mm,1.7 μm),流动相A相为0.05 %甲酸-1 mmol乙酸铵水溶液,B相为甲醇,流速0.3 mL/min,柱温40 ℃,进样量3.0 μL。流动相梯度洗脱条件:0~0.2 min A:95%,> 0.2~5 min A:5%,> 5~6 min A:5%,> 6~7 min A:95%。
质谱条件:毛细管电压3.0 kV,离子源温度150 ℃,脱溶剂温度500 ℃,脱溶剂气流速600 L/h,锥孔反吹气流速40 L/h。除氯氰菊酯采用气相色谱-三重四极杆质谱选择离子反应监测模式测定外,其余9种农药均采用液相色谱-三重四极杆质谱多反应监测模式测定,具体参数分别见表2和表3。
|
|
表 2 九种农药的液相色谱-三重四极杆 (LC-MS/MS) 多反应监测 (MRM) 质谱参数 Table 2 Liquid chromatography-triple quadrupole mass spectrometry (LC-MS/MS) parameters of 9 pesticides in multiple reaction monitoring (MRM) mode |
|
|
表 3 氯氰菊酯的气相色谱-三重四极杆 (GC-MS/MS) 选择离子反应监测 (SRM) 质谱参数 Table 3 Gas chromatography-triple quadrupole mass spectrometry (GC-MS/MS) parameters of cypermethrin in selected reaction monitoring (SRM) mode |
1.5 数据处理
用加工因子 (PF) 来衡量不同加工方式处理后农药残留量的变化情况,其计算公式见 (1) 式[3]。
| $ \begin{split} & \;\\ &{\rm PF} = \frac{c}{{{c_0}}} \end{split} $ | (1) |
式中:c0表示加工前样品中农药含量;c表示经过加工处理后样品中农药含量。单位均以mg/kg计。
2 结果与讨论 2.1 检测方法验证分别向空白黄瓜样品中添加3个水平的10种农药混合标准溶液,添加水平分别为0.32、0.8和3.2 mg/kg,每个水平重复5次,结果发现回收率在70%~110%,RSD在10%以内。准确度和精密度均符合农药残留检测的要求[15]。
2.2 五种加工方式对农药残留的影响表4是黄瓜样品在不同加工方式下,根据10种农药残留量计算的PF值。总体而言,5种加工方式对10种农药的去除效果强弱顺序依次为:去皮 > 水煮 > 炒制、水洗、腌制。经去皮处理后,10种农药在黄瓜中的PF在0.04~0.6之间,可见去除效果非常明显。根据农药的log Kow(辛醇水分配系数) 值 (见表1) 将10种农药分为3组,其中5种在0.2~2之间,3种在2~4之间,2种在4以上 (见表4)。结合表1的理化性质参数可以看出,农药的理化性质不同,其在不同处理方式下所表现出的去除效果也有差异。从表4可看出,在水洗和水煮2种处理方式下,随着农药的log Kow增大,其所对应的PF值总体上呈增大趋势,这可能是由于农药的log Kow越大,其亲水性越弱,在水中越不易被去除;相反地,log Kow越小,在水中越易被去除。该结果与Rasmussen等对苹果中毒死蜱经水洗后的去除效果一致[10]。另外,从表4的结果中还可看出,水煮处理的PF值明显低于水洗的,即水煮对农药的去除效果明显高于水洗的,这说明除了农药的log Kow值外,温度也影响其在黄瓜中的残留量,温度升高不仅加速了农药的挥发性,也提高了农药在水中的溶解度。
|
|
表 4 黄瓜中10种农药在不同加工方式下随时间变化的PF值 Table 4 PF values of 10 pesticide residues with different treatments and different durations |
2.3 加工时间对农药残留的影响 2.3.1 水洗时间对农药残留的影响
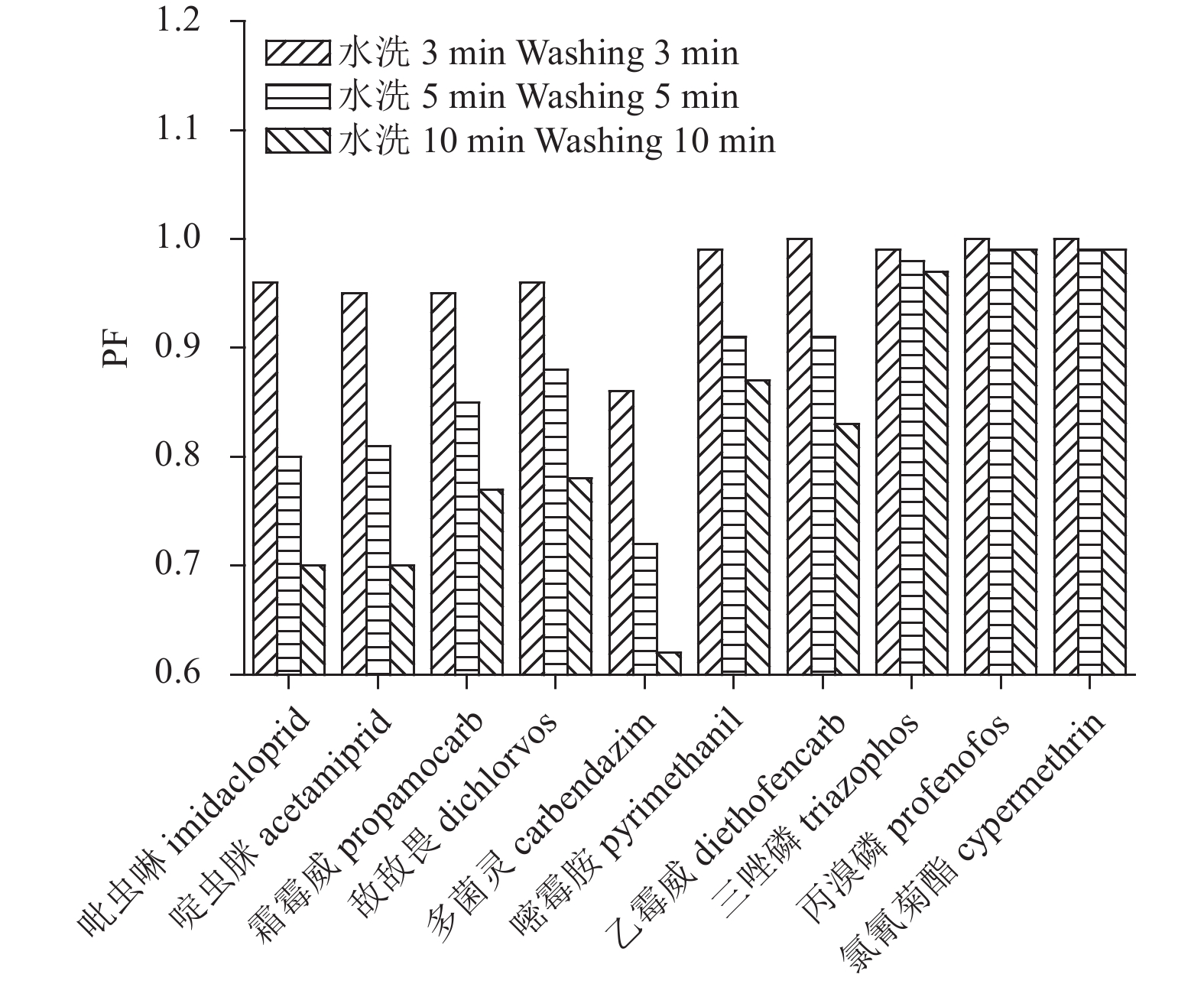
图1显示:根据表4中的分组,吡虫啉、啶虫脒、霜霉威、敌敌畏和多菌灵5种log Kow在0.2~2之间的农药随着水洗时间的增加,PF值在0.96~0.62之间,呈逐渐降低趋势,嘧霉胺、乙霉威和三唑磷3种log Kow在2~4之间的农药,其PF在1.00~0.83之间,随时间的增加虽有减小的趋势,但减小的幅度较小,而丙溴磷和氯氰菊酯log Kow大于4的农药,PF值在1.00~0.97之间,在水洗5 min后PF值不再发生改变。从3组农药的PF随加工时间的变化情况看,农药的log Kow值越大,水洗处理对该农药的去除效果越差,且随着加工时间的增加PF的变化幅度越小。从水洗处理方式对10种农药的去除效果看,多菌灵的去除效果最为明显,水洗10 min后PF为0.62;而丙溴磷和氯氰菊酯的去除效果最差,水洗10 min后PF为0.99。
|
图 1 黄瓜中10种农药加工因子随水洗时间的变化 Fig. 1 PF trends of 10 pesticide residues after washing with different durations |
2.3.2 水煮时间对农药残留的影响
由图2可看出:随着水煮时间的延长,吡虫啉、啶虫脒、霜霉威、敌敌畏和氯氰菊酯的PF值逐渐减小,即其残留量呈逐渐降低的趋势,但多菌灵、嘧霉胺、乙霉威、三唑磷和丙溴磷在水煮5 min后PF值不再减小,即农药残留量不再降低。这可能与农药的log Kow及饱和蒸汽压有关,即农药的log Kow越大,其水溶性越差。但随着水煮时间的延长,农药的饱和蒸汽压增加,其挥发性也增加。如氯氰菊酯的饱和蒸汽压大于丙溴磷的,因此随着水煮时间的增加,其PF值下降幅度更大。总体而言,在一定时间范围内水煮处理对农药有一定的去除效果,但去除率的大小因农药理化性质的不同而异,10种农药中去除效果最为明显的是敌敌畏,在水煮10 min后,PF降为0.37。

|
图 2 黄瓜中10种农药加工因子随水煮时间的变化 Fig. 2 PF trends of 10 pesticide residues after boiling with different durations |
2.3.3 炒制时间对农药残留的影响
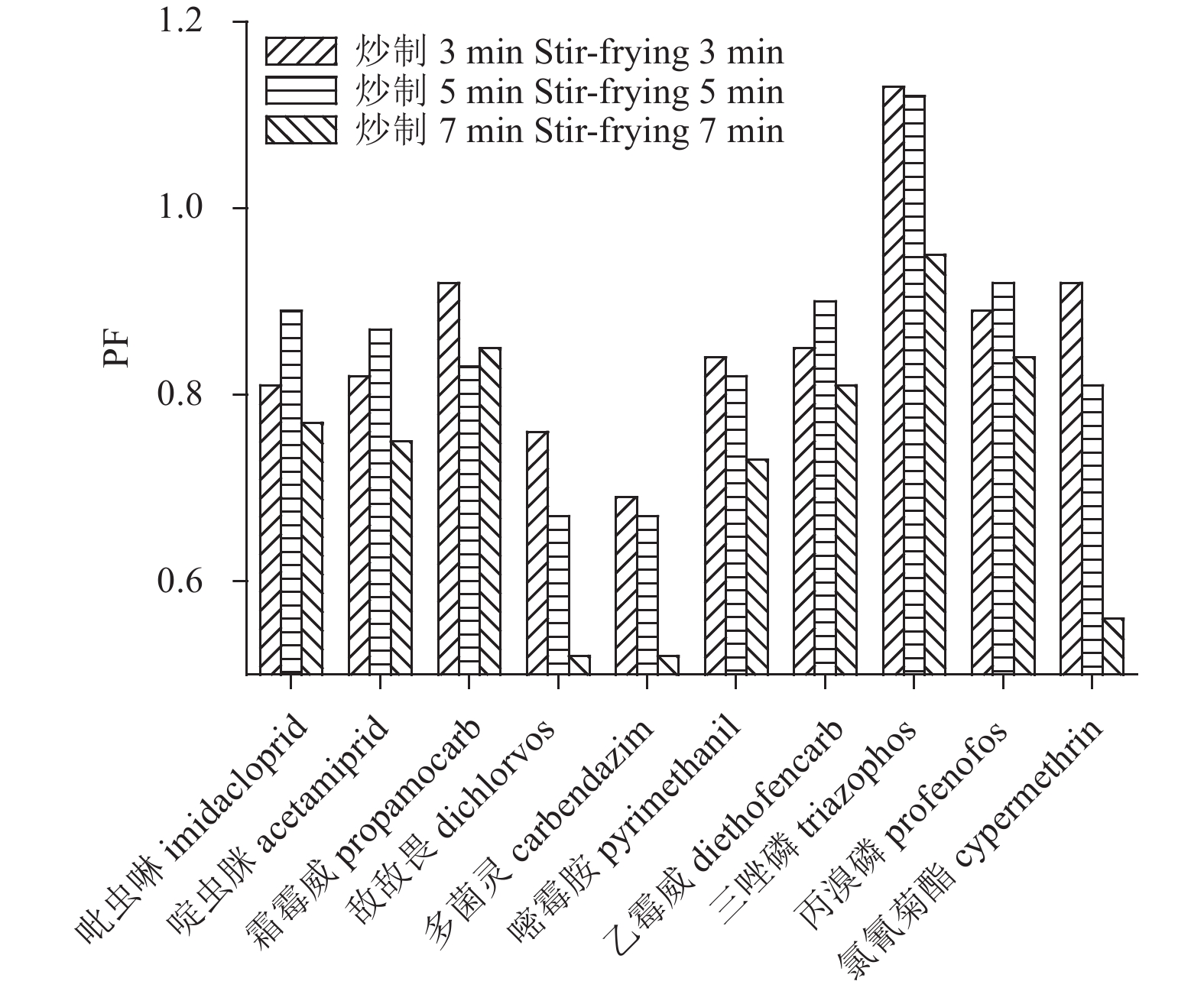
图3显示:炒制处理下,农药残留量随时间的变化规律呈现一定的差异性,这可能与炒制过程引起农药残留量变化的因素较多,导致农药残留量的变化较为复杂有关,不易得到有规律性的变化趋势。在炒制过程中加入了食用油,同时随着炒制时间的增加,温度的变化会改变食品中的水分含量,农药的log Kow会影响农药在油水中的溶解能力,农药的饱和蒸气压及沸点也会随温度的变化影响农药的挥发性,从而使得样品中的农药残留量不随时间呈现规律性变化。总体而言,炒制过程对部分农药的残留量有减小的作用,10种农药中变化最为明显的是敌敌畏、多菌灵和氯氰菊酯,在炒制7min后其PF呈大幅度下降的趋势,但炒制过程的高温会使蔬菜样品大量脱水,导致一些农药在黄瓜中的浓度升高。
|
图 3 黄瓜中10种农药加工因子随炒制时间的变化 Fig. 3 PF trends of 10 pesticide residues after stir-frying with different durations |
3 结论
水洗、水煮、炒制、腌制和去皮5种加工方式对黄瓜中的农药残留均有一定的去除效果,其强弱顺序为去皮>水煮>炒制、水洗、腌制。可见去皮对农药的去除效果最明显,特别是氯氰菊酯和丙溴磷的去皮PF均为0.04,因此建议消费者在食用黄瓜时进行去皮处理。其余4种加工方式对农药的去除率表现出一定的差异性,总体而言,水洗、水煮和炒制处理在0~10 min内随处理时间的增加农药残留量呈降低的趋势,10种农药的PF变化范围为:水洗时PF在1.00~0.62之间,水煮时PF在0.86~0.37之间,炒制时PF在1.13~0.52之间。研究结果显示,引起农药去除率差异性的原因与农药本身的理化特性密不可分,农药的logKow值越小,在水洗和水煮处理下的去除效果越好,而水煮过程随着处理时间的延长,饱和蒸汽压较大的农药残留量较低。炒制过程影响因素较多,黄瓜中农药的残留变化复杂。因此希望有关部门应结合消费者的饮食习惯和农药的理化特性合理指导农药的规范使用。
| [1] |
IKEURA H, HAMASAKI S, TAMAKI M. Effects of ozone microbubble treatment on removal of residual pesticides and quality of persimmon leaves[J]. Food Chem, 2013, 138(1): 366-371. DOI:10.1016/j.foodchem.2012.09.139 |
| [2] |
ZHAO L W, GE J, LIU F M, et al. Effects of storage and processing on residue levels of chlorpyrifos in soybeans[J]. Food Chem, 2014, 150: 182-186. DOI:10.1016/j.foodchem.2013.10.124 |
| [3] |
BONNECHERE A, HANOT V, JOLIE R, et al. Effect of household and industrial processing on levels of five pesticide residues and two degradation products in spinach[J]. Food Control, 2012, 25(1): 397-406. DOI:10.1016/j.foodcont.2011.11.010 |
| [4] |
HOLLAND P, HAMILTON D, OHLIN B, et al. Effects of storage and processing on pesticide residues in plant products[J]. Pure Appl Chem, 1994, 66(2): 335-356. DOI:10.1351/pac199466020335 |
| [5] |
KAUSHIK G, SATYA S, NAIK S. Food processing a tool to pesticide residue dissipation: a review[J]. Food Res Int, 2009, 42(1): 26-40. DOI:10.1016/j.foodres.2008.09.009 |
| [6] |
TIMME G, WALZ-TYLLA B. Effects of food preparation and processing on pesticide residues in commodities of plant origin[J]. Pestic Res Food Drink Water, 2004, 121-148. |
| [7] |
BERRADA H, FERNáNDEZ M, RUIZ M, et al. Surveillance of pesticide residues in fruits from Valencia during twenty months (2004/05)
[J]. Food Control, 2010, 21(1): 36-44. DOI:10.1016/j.foodcont.2009.03.011 |
| [8] |
BOULAID M, AGUILERA A, CAMACHO F, et al. Effect of household processing and unit-to-unit variability of pyrifenox, pyridaben, and tralomethrin residues in tomatoes[J]. J Agric Food Chem, 2005, 53(10): 4054-4058. DOI:10.1021/jf040455y |
| [9] |
BURCHAT C S, RIPLEY B D, LEISHMAN P D, et al. The distribution of nine pesticides between the juice and pulp of carrots and tomatoes after home processing[J]. Food Addit Contam, 1998, 15(1): 61-71. DOI:10.1080/02652039809374599 |
| [10] |
RASMUSSSEN R R, POULSEN M E, HANSEN H C, et al. Distribution of multiple pesticide residues in apple segments after home processing[J]. Food Addit Contam, 2003, 20(11): 1044-1063. DOI:10.1080/02652030310001615221 |
| [11] |
HUAN Z, XU Z, JIANG W, et al. Effect of Chinese traditional cooking on eight pesticides residue during cowpea processing[J]. Food Chem, 2015, 170: 118-22. DOI:10.1016/j.foodchem.2014.08.052 |
| [12] |
XU X M, CHEN J Y, LI B R, et al. Carbendazim residues in vegetables in China between 2014 and 2016 and a chronic carbendazim exposure risk assessment[J]. Food Control, 2018, 91: 20-25. DOI:10.1016/j.foodcont.2018.03.016 |
| [13] |
LIANG Y, WANG W, SHEN Y, et al. Effects of home preparation on organophosphorus pesticide residues in raw cucumber[J]. Food Chem, 2012, 133(3): 636-640. DOI:10.1016/j.foodchem.2012.01.016 |
| [14] |
BIAN Y, LIU F, CHEN F, et al. Storage stability of three organophosphorus pesticides on cucumber samples for analysis[J]. Food Chem, 2018, 250: 230-235. DOI:10.1016/j.foodchem.2018.01.008 |
| [15] |
农作物中农药残留试验准则: NY/T 788—2018[S]. 北京: 中华人民共和国农业农村部, 2018. Guideline for the testing of pesticide residues in crops: NY/T 788—2018[S]. Beijing: Ministry of Agriculture and Rural Affairs of the People’s Republic of China, 2018. |
 2019, Vol. 21
2019, Vol. 21


