农药残留检测是监控食品是否安全的一个重要方法。为确保检测结果的准确性,在农药检测过程中需要借助一些高灵敏、高通量的技术手段,如气相色谱、气相色谱-串联质谱[1]、液相色谱-串联质谱[2]等。但无论采取哪种检测手段,均存在基质效应问题,即在检测过程中一些非待测组分对待测物的质量或浓度的准确测定产生干扰[3],导致假阳性检出的基质增强效应或阳性未检出的基质抑制效应。基质效应的强弱与基质种类有关,同时还受农药结构、浓度等理化性质的影响,如一些含有氨基、羟基和氨基甲酸酯基等官能团的农药极易吸附在检测器进样口的活性位点上,导致基质效应增强。除此之外,检测器和进样方式等也会对基质效应产生影响。
为了克服基质效应对农药残留检测的影响,科研人员开发了各种不同的方法。如标准添加法[4]、同位素内标法[5-6]、直接稀释法[7]以及针对气相色谱使用的保护剂添加法[8]等,但这些方法在应用中都有比较大的局限性,比如:标准添加法虽能很好地克服基质效应,但适用于超出最大残留限量 (MRL) 和/或缺少合适空白基质来配制基质匹配标准溶液的情况,且该方法操作过程比较复杂;同位素内标法成本较高;直接稀释法会降低方法的灵敏度;而添加分析物保护剂复杂且适用农药品种有限。鉴于以上问题目前农药残留分析中大都采用基质匹配标准溶液进行定量,以克服基质效应对定量的影响。欧盟的农药残留检测指导文件SANTE/11813/2017和食品法典委员会指导文件CAC/GL 90-2017都对基质效应进行了规定,在农药残留检测中推荐使用基质匹配标准溶液进行定量[9-10]。中国农业农村部2018年6月发布的一系列基于质谱测定的农药在植物源性食品中的残留检测方法的国家标准,如草铵膦[11]、二氯吡啶酸[12]和氯吡脲[13]等,也大都规定使用基质匹配标准溶液进行定量。
在农药残留检测过程中,为了降低基质效应的影响,使检测结果更准确可靠,采取一种高效的样品前处理方法是十分必要的[14]。自Anastassiades等在2003年首次提出QuEChERS方法[15]后,该方法被多次改进,现已在国际上被广泛认可。目前,中国蔬菜等鲜样的农药残留检测也广泛采用该方法进行样品前处理。因此有必要对基于QuEChERS前处理方法的基质效应进行研究,以保证农药残留定量结果的可靠性。此外,在实际农药残留检测过程中会涉及各种不同类型的样品,不同农药在不同样品基质中会表现出不同的基质效应[2]。近年来已有相关研究考察了不同基质中农药基质效应对定量的影响,但使用的仪器单一,且涉及的基质种类、农药品种等都较少[16]。因此,为了全面深入地考察蔬菜中农药残留的基质效应,本研究采用QuEChERS前处理方法,借助气相色谱-串联质谱 (GC-MS/MS) 及超高效液相色谱-串联质谱 (UPLC-MS/MS) 对17种典型蔬菜品种中的200种农药进行多残留检测,对不同蔬菜基质间的基质效应差异进行分析,以期找到合适的代表性基质,为蔬菜农药多残留检测中基质效应的校正提供科学依据。
1 材料与方法 1.1 供试蔬菜、药剂与试剂17种蔬菜包括叶菜类 (普通白菜、生菜、菠菜、芹菜),瓜类 (黄瓜、西葫芦),芸薹类 (花椰菜),根茎类 (萝卜、胡萝卜),鳞茎类 (大蒜、葱、韭菜),茄果类 (辣椒、番茄、茄子),豆类 (豇豆) 及薯芋类 (姜)。所有蔬菜均购于天津市某有机蔬菜生产基地,未检测出待测农药。
200种农药标准品 (见表1),纯度均大于98%(美国Chemservice公司)。将各农药分别用乙腈或丙酮溶解,配制成农药质量浓度为1 000 mg/L的标准储备液,然后用丙酮稀释,配制成5 mg/L的混合标准溶液,于 –20 ℃保存,备用。乙腈和乙酸乙酯 (色谱纯,美国Fisher Scientific公司);QuEChERS萃取盐包 (内含4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸氢二钠)、陶瓷均质子、无水硫酸镁、N-丙基乙二胺(PSA)、石墨化碳黑(GCB)和针管式微孔滤膜 (0.22 μm)(美国安捷伦公司);试验用水为实验室一级水 (美国Milipore公司)。
|
|
表 1 供试200种农药及其检测仪器 Table 1 200 pesticides and the equipment for their detection |
1.2 主要仪器
Neofuege 23R离心机 (香港Heal Force公司);Vortex Mixi Ⅱ涡旋振荡器 (美国Thermo公司);N-EVAP氮吹仪 (美国Organomation公司);Qtrap 4500超高效液相色谱-串联质谱仪 (美国Sciex公司);7890A-7000C气相色谱-串联质谱仪 (美国安捷伦公司)。
1.3 样品前处理方法称取10 g样品 (精确至0.01 g) 于50 mL塑料离心管中,依次加入10 mL乙腈、萃取盐包及1颗陶瓷均质子,盖上离心管盖,剧烈振荡1 min,于4 200 r/min下离心5 min;吸取6 mL上清液,加入到内含900 mg硫酸镁及150 mg PSA的15 mL塑料离心管中 (对于颜色较深的样品,如普通白菜、辣椒、菠菜、黄瓜、豇豆、韭菜、芹菜、生菜,则加入885 mg硫酸镁、150 mg PSA及15 mg GCB),涡旋混匀1 min,于4 200 r/min下离心5 min;取上清液过微孔滤膜,即为蔬菜空白基质溶液,用于配制基质匹配标准溶液。
1.4 基质匹配标准溶液配制及标准曲线绘制 1.4.1 GC-MS/MS基质匹配标准溶液用乙酸乙酯逐级稀释混合标准溶液,配制成质量浓度分别为5、10、20、50、100和200 μg/L的标准溶液。分别吸取1 mL各蔬菜空白基质溶液于玻璃离心管中。每种蔬菜吸取6份。于40 ℃水浴下氮气吹干后,分别用1 mL上述标准溶液复溶,制备成6个浓度梯度的基质匹配标准溶液。以农药定量离子峰面积为纵坐标,农药标准溶液质量浓度为横坐标,绘制标准曲线。
1.4.2 UPLC-MS/MS基质匹配标准溶液用乙腈逐级稀释混合标准溶液,配制成5、10、20、50、100和200 μg/L的溶剂标准溶液。分别用蔬菜空白基质溶液逐级稀释混合标准溶液,将17种蔬菜基质分别配制成5、10、20、50、100和200 μg/L的基质匹配标准溶液。以农药定量离子峰面积为纵坐标,农药标准溶液质量浓度为横坐标,绘制标准曲线。
1.4.3 基质效应将上述溶剂标准溶液和基质匹配标准溶液分别进行UPLC-MS/MS和GC-MS/MS测定。根据每种农药在标准溶液和基质匹配标准溶液中的峰面积获得线性方程,按公式 (1) 计算基质效应 (ME)。当ME = –20% ~ 20%时为弱基质效应;当 ME = –50% ~ –20%或20% ~ 50%时为中等基质效应;当 ME = < –50%或 > 50%时为强基质效应 [1]。
| $ M_{\rm E} / {\text{%}}=\left( \frac{{{S}_{\text{m}}}}{{{S}_{\text{s}}}}-1 \right) \times 100 $ | (1) |
式中,Sm和Ss分别表示基质匹配标准曲线和溶剂标准曲线的斜率。
1.5 检测条件 1.5.1 GC-MS/MS条件色谱条件:HP-5 ms UI色谱柱 (30 m × 0.250 mm,0.25 μm),载气为氦气 (99.999%);流速1 mL/min;进样量1 μL,不分流进样;柱温箱升温程序:初始温度60 ℃,保持1 min,40 ℃/min升至120 ℃,5 ℃/min升至310 ℃,保持6 min,总运行时间40.5 min;进样口温度280 ℃。
质谱条件:电子轰击离子源;电离能70 eV;传输线温度和离子源温度均为280℃;多反应监测模式 (MRM)。各农药保留时间和质谱参数参见文献方法[17]。
1.5.2 UPLC-MS/MS条件色谱条件:Waters HSS T3 C18色谱柱 (2.1 mm × 100 mm,1.8 μm);柱温40 ℃;流动相A相为甲醇,B相为2 mmol/L的醋酸铵溶液;进样量5 μL;流速0.3 mL/min;梯度洗脱程序见表2。
|
|
表 2 超高效液相色谱-串联质谱流动相梯度洗脱参数 Table 2 The UPLC-MS/MS gradient elution procedure of mobile phase |
2 结果与分析 2.1 整体基质效应分析
在GC-MS/MS检测中,大部分农药在蔬菜[19]、水果、谷物[20]、植物油[17]和茶叶[21]等基质中表现出明显的基质增强效应,这是因为当待测物进入气相色谱系统后,会与进样口色谱柱等部位的活性位点结合,从而出现拖尾和降解等现象,蔬菜基质中的化合物可降低上述位点的活性,使待测物顺利通过气相色谱系统到达检测器,因此表现出良好的峰形和响应值,从而表现出基质增强效应[22]。相比于GC-MS/MS,在UPLC-MS/MS检测中绝大部分农药表现出基质抑制效应[18, 23-24]。这是由于在液相色谱-串联质谱检测中,基质效应主要是由于基质干扰成分的共流出抑制了目标物的离子化效率,从而导致了抑制效应。此外,基质成分和农药结构的差异也会导致基质效应的不同。
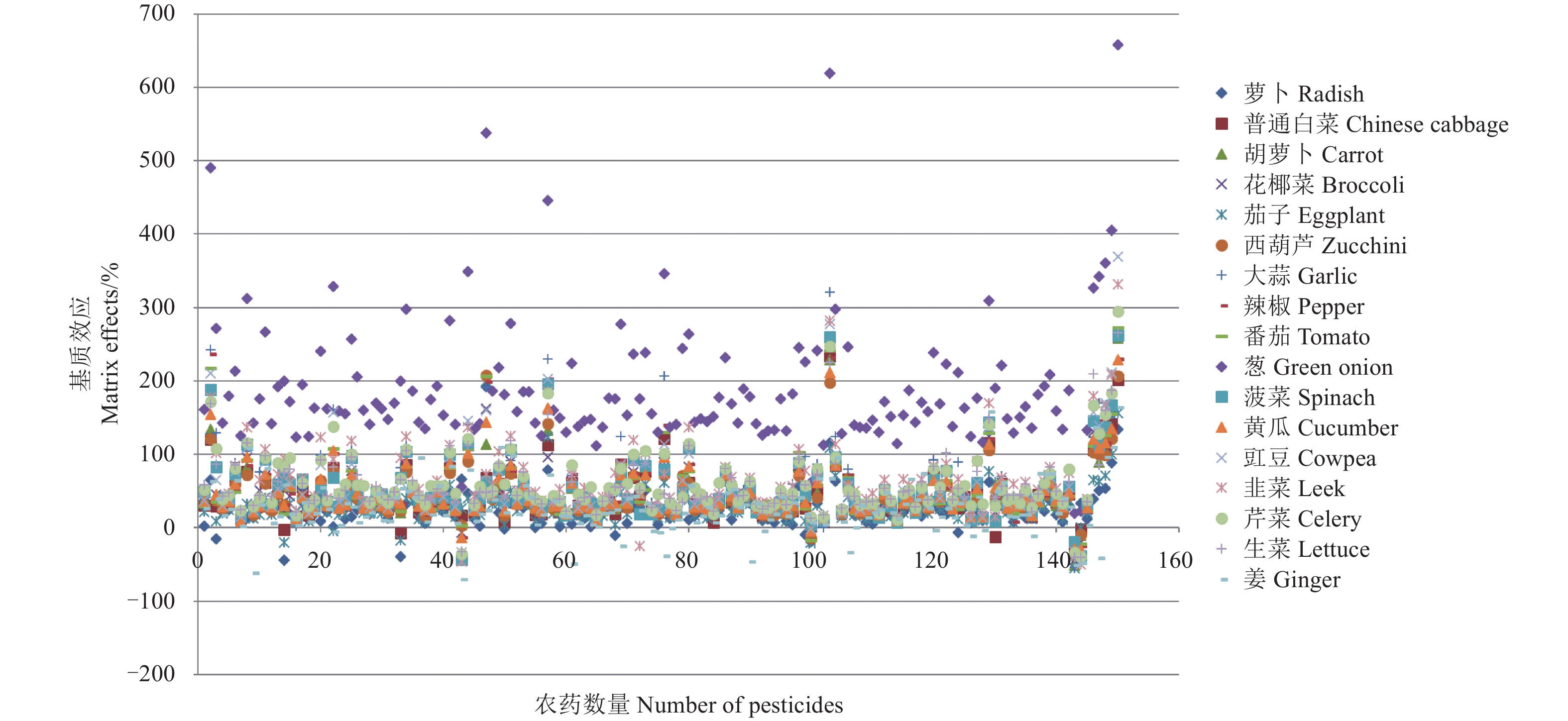
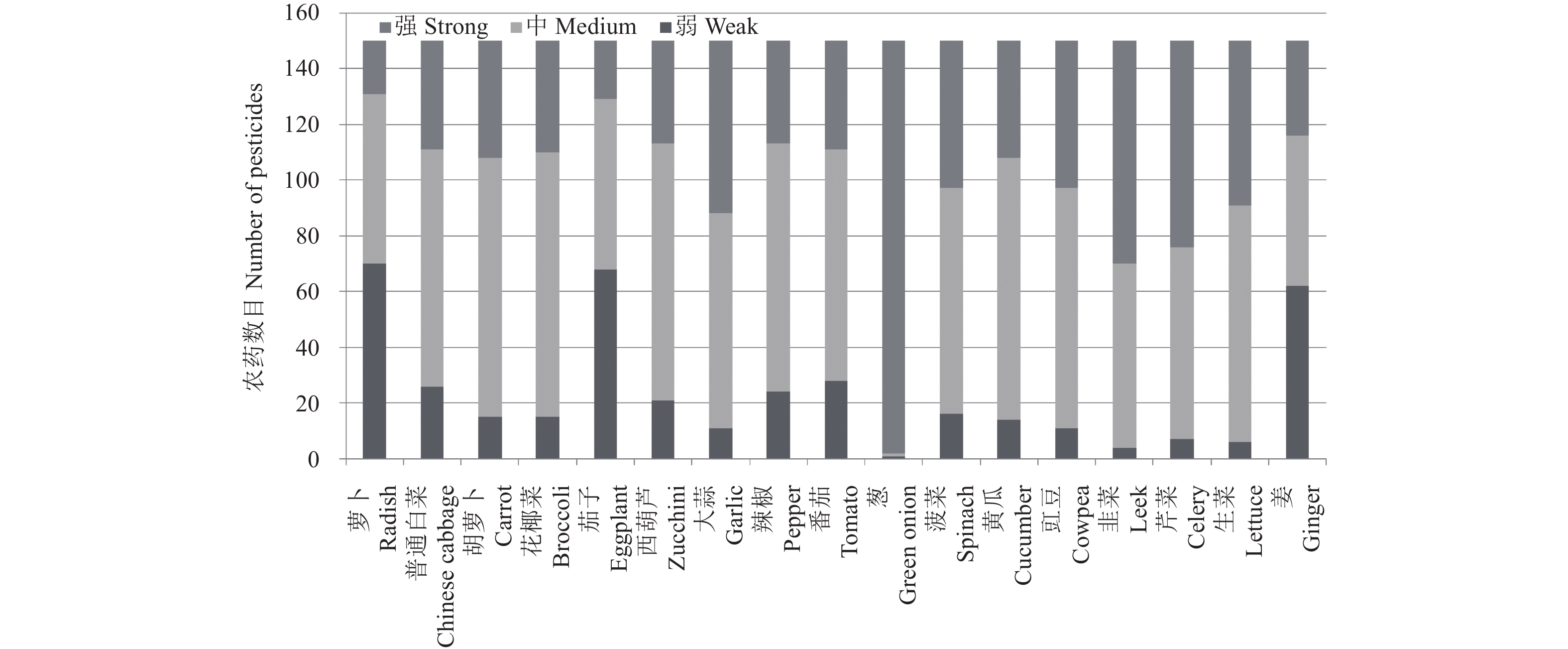
本研究选择17种典型蔬菜品种,考察了200种农药在这17种蔬菜基质中的基质效应,其中采用GC-MS/MS测定150种 (见图1和图2),采用UPLC-MS/MS测定105种 (见图3和图4)。由图可以看出,在GC-MS/MS检测中,供试的150种农药在17种蔬菜基质中几乎都表现为基质增强效应。除苯胺和氯苯胺灵在葱中分别表现出弱和中等基质效应外,其余148种农药在17种蔬菜中全部表现为强基质效应,其中,中等基质效应的数量约占供试农药总数的50%,中等和强基质效应的数量之和占85%以上,部分农药如磷胺、土菌灵、氟胺氰菊酯、噁唑菌酮等的基质效应强度甚至超过了400%(见表3)。但萝卜、茄子和姜的基质效应较低,弱基质效应农药数量占43%以上,强基质效应农药分别只占农药总数的12.7%、14%和22.7%。其他蔬菜品种整体基质效应差异不大,大部分农药品种表现为中等基质效应,而且总体基质效应强度在100%以下。
|
图 1 150种农药在17种蔬菜基质中的基质效应 (GC-MS/MS) Fig. 1 Matrix effect of 150 pesticides in 17 vegetables(GC-MS/MS) |
|
图 2 150种农药在17种蔬菜中的弱、中等和强基质效应数目 (GC-MS/MS) Fig. 2 Number of pesticides with weak, medium and strong matrix effects in 17 vegetables(GC-MS/MS) |
|
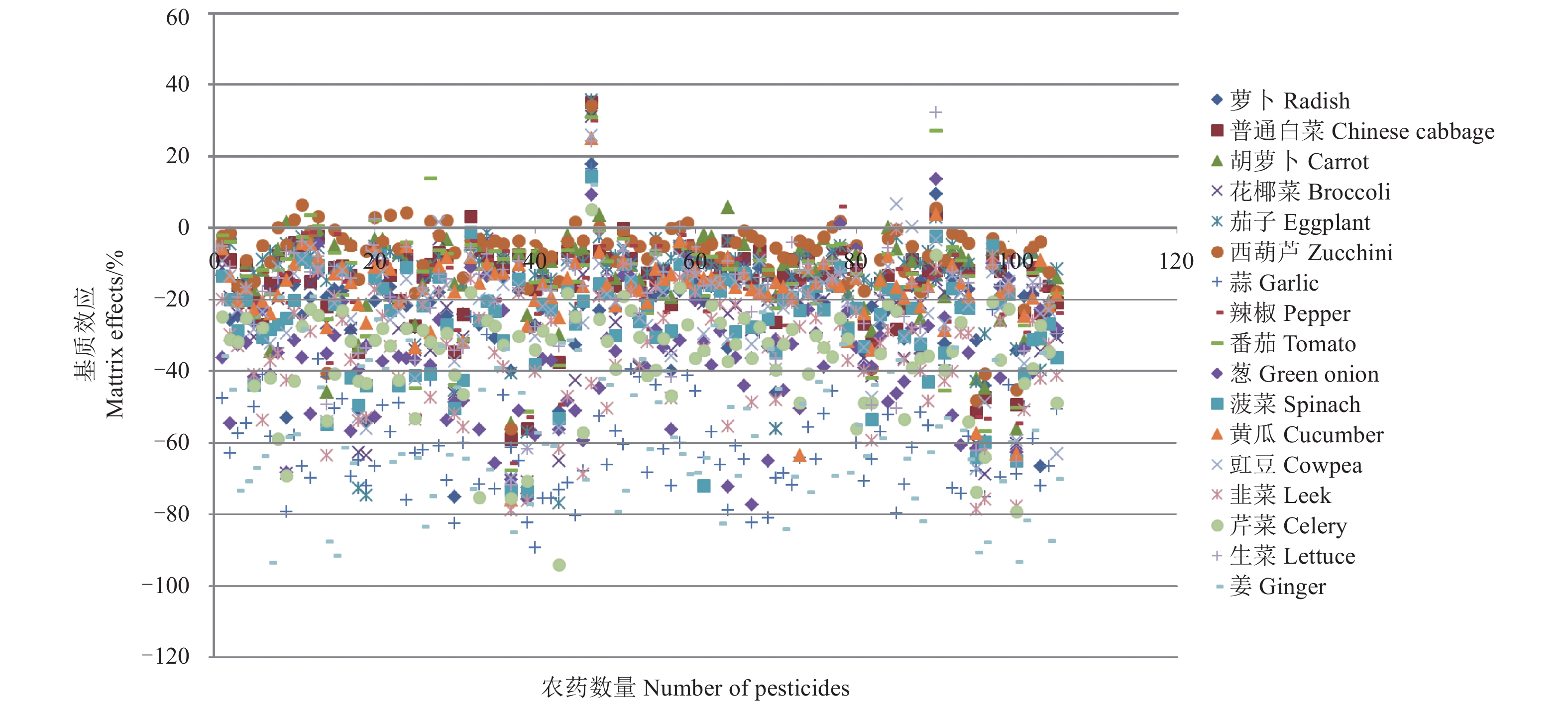
图 3 105种农药在17种蔬菜中的基质效应 (UPLC-MS/MS) Fig. 3 Matrix Effect of 105 Pesticides in 17 vegetables(UPLC-MS/MS) |
|
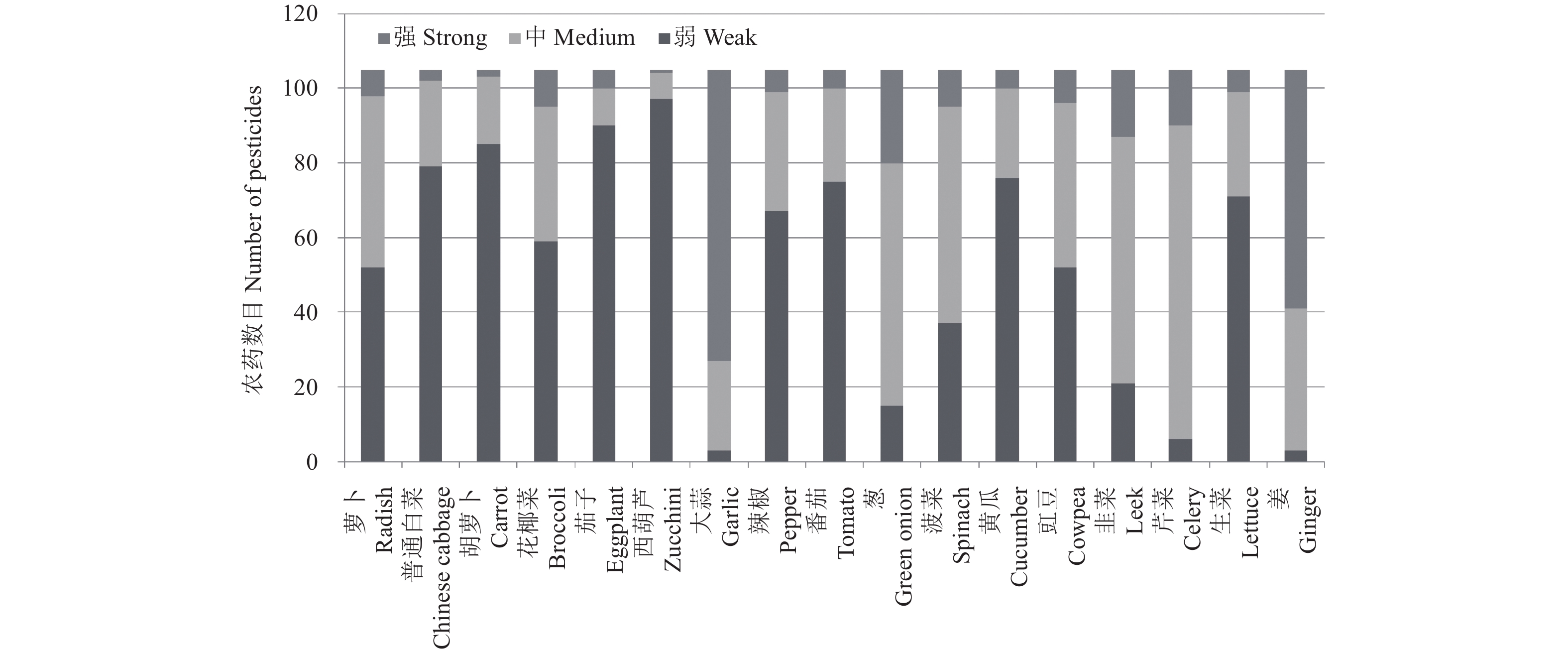
图 4 105种农药在17种蔬菜中的弱、中等和强基质效应数目 (UPLC-MS/MS) Fig. 4 Number of pesticides with weak, medium and strong matrix effects in 17 vegetables(UPLC-MS/MS) |
|
|
表 3 在不同检测方法下17种供试蔬菜不同强度基质效应的农药数量 Table 3 The number of pesticides with different matrix effects in 17 vegetables |
在UPLC-MS/MS检测中,供试的105种农药中绝大部分在17种蔬菜中都表现出基质抑制效应,除芹菜、葱、姜和大蒜外,大部分农药的基质效应在0~–40%之间,只有抑霉唑和噁唑菌酮表现出比较强的基质增强效应。大蒜和姜的基质效应很强,分别有74%和61%的农药表现为强基质抑制效应;葱、韭菜、芹菜和菠菜基质效应较强,分别有62%、63%、80%和55%的农药表现为中等基质抑制效应 (见表3)。西葫芦相对其他蔬菜基质效应最弱,只有联苯菊酯在其中表现出强基质效应 (–56%),绝大部分表现为弱基质效应。此外,普通白菜、胡萝卜、茄子、番茄、黄瓜和生菜的基质效应也较弱,超过70%的农药在这些基质中表现为弱基质效应。对于不同农药品种的检测结果显示,莠去津、丙硫磷、乙酰甲胺磷、萎锈灵和氯菊酯等表现出较强的基质抑制效应。
2.2 GC-MS/MS检测中代表基质的选择实际农药残留检测中涉及的蔬菜多种多样,若对每种蔬菜都进行基质匹配标准溶液的配制和使用,会明显降低样品前处理和数据处理的效率。因此,在样品初筛时可选择代表性的蔬菜基质配制基质匹配标准溶液对不同品种蔬菜进行定量,在保证定量结果准确的前提下简化流程,提高样品前处理效率。如Kwon等使用黄瓜基质制备基质匹配标准溶液来校正基质效应对气相色谱测定的影响[25]。本研究选择日常检测中有代表性的8类17种蔬菜基质,考察其基质效应的差异。总体上,除萝卜和茄子基质效应偏低,葱、姜、大蒜基质效应偏高外,其他蔬菜均表现出了相似的基质效应,这为选择代表性蔬菜基质提供了可能。但萝卜、茄子、葱、姜和大蒜在使用其他蔬菜的基质匹配标准溶液进行定量校正时基质效应也很难消除,如用生菜进行校正时发现葱的基质效应仍然较高,大部分农药在葱中的基质效应强度在60%~100%之间。大蒜经校正后部分农药仍表现为中等基质增强效应。萝卜、茄子和姜因基质效应较弱,经校正后有超过32%的农药表现为中等基质抑制效应,因此建议这5种蔬菜单独使用各自的空白基质进行定量。除上述5种蔬菜外,使用其中任意一种蔬菜基质对其他蔬菜进行定量时,都有超过85%的农药表现为弱基质效应,说明这些蔬菜能较好地进行基质效应校正。其中芹菜、菠菜、豇豆和生菜作为代表性基质对其他蔬菜的基质效应校正结果最好,对韭菜和辣椒等相对复杂的基质也都有比较好的校正效果。使用生菜、芹菜、豇豆和菠菜对除萝卜、茄子、葱、姜和大蒜外的12种蔬菜的基质效应校正结果见图5,校正后强基质效应的农药数目在4种以下,表现出了很好的基质效应校正能力。因此在GC-MS/MS检测中推荐使用芹菜、菠菜、豇豆和生菜作为代表性基质进行定量。
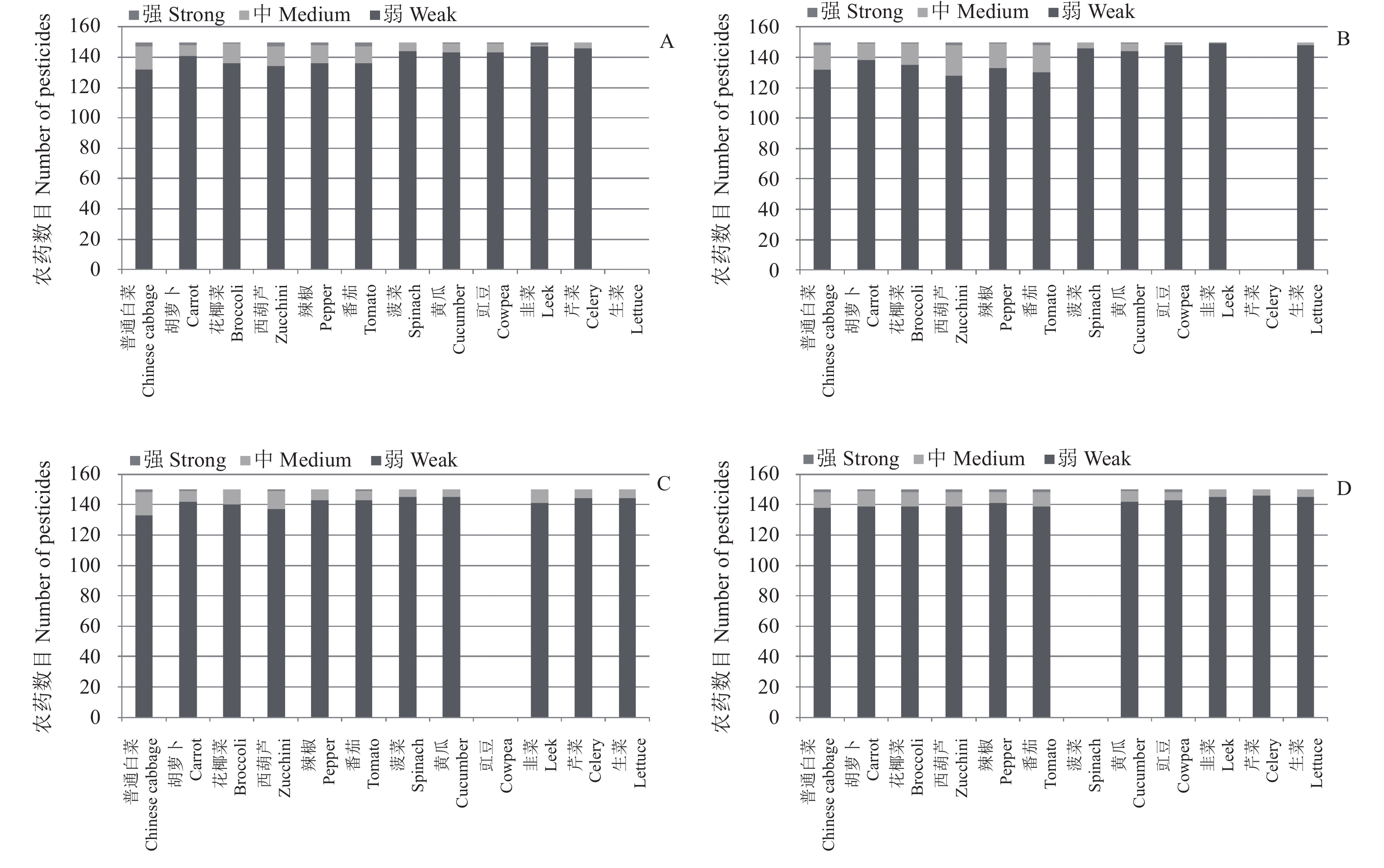
|
A. 生菜;B.芹菜;C. 豇豆;D. 菠菜。 A.Lettuce; B. Celery; C. Cowpea; D. Spinach. 图 5 GC-MS/MS检测中代表性蔬菜作为定量基质时150种供试农药在不同蔬菜品种中的基质效应分布情况 Fig. 5 Matrix effects of different vegetables using typical vegetable as blank matrix(GC-MS/MS) |
2.3 UPLC-MS/MS检测中代表性基质的选择
与GC-MS/MS相比,在UPLC-MS/MS检测中,除了葱、姜和大蒜表现出很强的基质抑制效应外,韭菜、芹菜也表现出较强的基质效应,其他蔬菜品种的基质效应差别也较大。因此在选用几种代表性蔬菜基质对所有蔬菜品种进行基质效应校正时,其校正效果比GC-MS/MS的差。图6给出了在UPLC-MS/MS检测中分别使用4种代表性蔬菜的基质匹配标准溶液校正后除葱、姜、大蒜外的14种蔬菜的基质效应校正结果。由图可以看出,相对于溶剂标准溶液,使用黄瓜、普通白菜、番茄和生菜的基质匹配标准溶液获得了较好的基质效应校正结果。但韭菜和芹菜经校正后的基质效应仍较强,分别有约41%和49%的农药表现为中等基质效应。因此对于葱、姜、大蒜、韭菜和芹菜进行UPLC-MS/MS测定时还需进一步考察选择合适的代表蔬菜品种。目前,对于降低UPLC-MS/MS检测中的基质效应除基质匹配标准溶液法外,直接稀释法也是一个比较可行的方法,有研究表明,通过采用合适的稀释倍数溶液进行稀释,可以将基质效应降低到20%以下[7, 26]。因此实际检测中在灵敏度允许的情况下可对提取溶剂进行适当稀释以降低基质效应的影响。
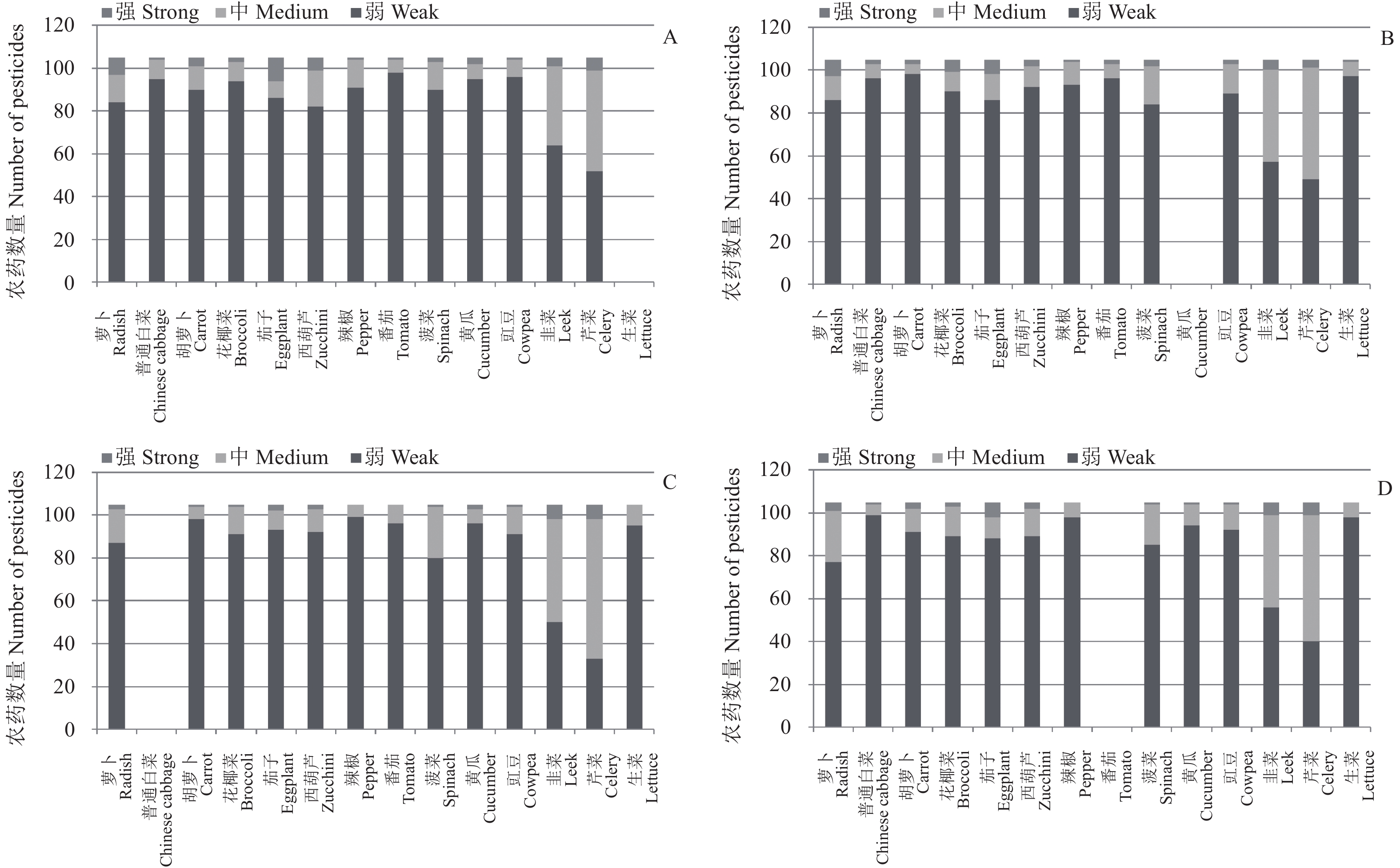
|
A. 生菜;B.黄瓜;C. 普通白菜;D. 番茄。 A. Lettuce; B. Cucumber; C. Chinese cabbage; D. Tomato. 图 6 UPLC-MS/MS检测中代表性蔬菜作为定量基质时105种供试农药在不同蔬菜品种的基质效应分布情况 Fig. 6 Matrix effects of different vegetables using typical vegetable as blank matrix (UPLC-MS/MS) |
3 结论
基质效应是农药残留检测中影响定量准确性的一个重要因素。本研究采用GC-MS/MS及UPLC-MS/MS方法对基于QuEChERS前处理方法的17种常见蔬菜中的200种农药的基质效应进行了研究。结果表明,采用GC-MS/MS检测,绝大部分农药表现出基质增强效应,其中,中等和强基质效应农药数量占总数的85%以上,葱表现出极强的基质效应;采用UPLC-MS/MS检测,绝大部分农药表现出基质抑制效应,但大部分抑制效应较弱,对于不同的蔬菜品种而言,大蒜和姜的基质效应最强,葱、韭菜、菠菜、芹菜的基质效应较强。通过数据分析找出了适用于采用GC-MS/MS和UPLC-MS/MS检测的典型基质。其中,适用于GC-MS/MS检测的典型蔬菜为菠菜、芹菜、豇豆和生菜,适用于UPLC-MS/MS检测的典型蔬菜为黄瓜、普通白菜、番茄和生菜。使用典型蔬菜作为空白基质配制基质匹配标准溶液对其他蔬菜品种中的农药残留进行定量,可很好地对基质效应进行校正,从而得到准确的定量结果。
| [1] |
HE Z Y, WANG L, PENG Y, et al. Multiresidue analysis of over 200 pesticides in cereals using a QuEChERS and gas chromatography-tandem mass spectrometry-based method[J]. Food Chem, 2015, 169: 372-380. DOI:10.1016/j.foodchem.2014.07.102 |
| [2] |
KITTLAUS S, SCHIMANKE J, KEMPE G, et al. Assessment of sample cleanup and matrix effects in the pesticide residue analysis of foods using postcolumn infusion in liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2011, 1218(46): 8399-8410. DOI:10.1016/j.chroma.2011.09.054 |
| [3] |
RIEDEL M, SPEER K, STUKE S, et al. Simultaneous analysis of 70 pesticides using HPLC/MS/MS: a comparison of the multiresidue method of Klein and Alder and the QuEChERS method[J]. J AOAC Int, 2010, 93(6): 1972-1986. |
| [4] |
BASILICATA P, MIRAGLIA N, PIERI M, et al. Application of the standard addition approach for the quantification of urinary benzene[J]. J Chromatogr B, 2005, 818(2): 293-299. DOI:10.1016/j.jchromb.2005.01.013 |
| [5] |
YARITA T, AOYAGI Y, OTAKE T. Evaluation of the impact of matrix effect on quantification of pesticides in foods by gas chromatography-mass spectrometry using isotope-labeled internal standards[J]. J Chromatogr A, 2015, 1396: 109-116. DOI:10.1016/j.chroma.2015.03.075 |
| [6] |
RIMAYI C, ODUSANYA D, MTUNZI F, et al. Alternative calibration techniques for counteracting the matrix effects in GC-MS-SPE pesticide residue analysis: a statistical approach[J]. Chemosphere, 2015, 118: 35-43. DOI:10.1016/j.chemosphere.2014.05.075 |
| [7] |
STAHNKE H, KITTLAUS S, KEMPE G, et al. Reduction of matrix effects in liquid chromatography–electrospray ionization–mass spectrometry by dilution of the sample extracts: how much dilution is needed?[J]. Anal Chem, 2012, 84(3): 1474-1482. DOI:10.1021/ac202661j |
| [8] |
MAŠTOVSKÁ K, LEHOTAY S J, ANASTASSIADES M. Combination of analyte protectants to overcome matrix effects in routine GC analysis of pesticide residues in food matrixes[J]. Anal Chem, 2005, 77(24): 8129-8137. DOI:10.1021/ac0515576 |
| [9] |
Guidance document on analytical quality control and method validation procedures for pesticide residues and analysis in food and feed: SANTE/11813/2017[S]. European Commission, 2017.
|
| [10] |
Guidelines on performance criteria for methods of analysis for the determination of pesticide residues in food and feed: GL90—2017[S]. Codex Alimentarius, 2017.
|
| [11] |
食品安全国家标准. 植物源性食品中草铵膦残留量的测定. 液相色谱-质谱联用法: GB 23200.108—2018[S]. 北京: 中国农业出版社, 2018. National food safety standard. Determination of glufosinate-ammonium residues in foods of plant origin. Liqiud chromatography-tandem mass spectrometry method: GB 23200.108—2018[S]. Beijing: China Agriculture Press, 2018. |
| [12] |
食品安全国家标准. 植物源性食品中二氯吡啶酸残留量的测定. 液相色谱-质谱联用法: GB 23200.109—2018[S]. 北京: 中国农业出版社, 2018. National food safety standard. Determination of clopyralid residues in foods of plant origin. Liqiud chromatography-tandem mass spectrometry method: GB 23200.109—2018[S]. Beijing: China Agriculture Press, 2018. |
| [13] |
食品安全国家标准. 植物源性食品中氯吡脲残留量的测定. 液相色谱-质谱联用法: GB 23200.110—2018[S]. 北京: 中国农业出版社, 2018. National food safety standard. Determination of forchlorfenuron residues in foods of plant origin. Liqiud chromatography-tandem mass spectrometry method: GB 23200.110—2018[S]. Beijing: China Agriculture Press, 2018. |
| [14] |
FERNÁNDEZ-ALBA A R, GARCÍA-REYES J F. Large-scale multi-residue methods for pesticides and their degradation products in food by advanced LC-MS[J]. Trends Anal Chem, 2008, 27(11): 973-990. DOI:10.1016/j.trac.2008.09.009 |
| [15] |
ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and " dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412-431. |
| [16] |
邱世婷, 蒲凤琳, 侯雪, 等. 超高效液相色谱-串联质谱法测定 9 种绿叶类蔬菜中 36 种农药多残留的基质效应[J]. 农药学学报, 2018, 20(5): 661-667. QIU S T, PU F L, HOU X, et al. Matrix effects in the analysis of 36 pesticides residues in nine kinds of green leafy vegetables by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2018, 20(5): 661-667. |
| [17] |
HE Z Y, WANG Y H, WANG L, et al. Determination of 255 pesticides in edible vegetable oils using QuEChERS method and gas chromatography tandem mass spectrometry[J]. Anal Bioanal Chem, 2017, 409(4): 1017-1030. DOI:10.1007/s00216-016-0016-9 |
| [18] |
WANG J S, HE Z Y, WANG L, et al. Automatic single-step quick, easy, cheap, effective, rugged and safe sample preparation devices for analysis of pesticide residues in foods[J]. J Chromatogr A, 2017, 1521: 10-18. DOI:10.1016/j.chroma.2017.09.027 |
| [19] |
HE Z Y, CHEN S S, WANG L, et al. Multiresidue analysis of 213 pesticides in leek and garlic using QuEChERS-based method and gas chromatography-triple quadrupole mass spectrometry[J]. Anal Bioanal Chem, 2015, 407(9): 2637-2643. DOI:10.1007/s00216-015-8485-9 |
| [20] |
GONZÁLEZ-CURBELO M Á, HERNÁNDEZ-BORGES J, BORGES-MIQUEL T M, et al. Determination of pesticides and their metabolites in processed cereal samples[J]. Food Addit Contam: Part A, 2012, 29(1): 104-116. DOI:10.1080/19440049.2011.615032 |
| [21] |
CHEN H P, YIN P, WANG Q H, et al. A modified QuEChERS sample preparation method for the analysis of 70 pesticide residues in tea using gas chromatography-tandem mass spectrometry[J]. Food Anal Methods, 2014, 7(8): 1577-1587. DOI:10.1007/s12161-014-9791-0 |
| [22] |
HAJŠLOVÁ J, ZROSTLı?KOVÁ J. Matrix effects in (ultra)trace analysis of pesticide residues in food and biotic matrices[J]. J Chromatogr A, 2003, 1000(1-2): 181-197. DOI:10.1016/S0021-9673(03)00539-9 |
| [23] |
CHEN G Q, CAO P Y, LIU R J. A multi-residue method for fast determination of pesticides in tea by ultra performance liquid chromatography–electrospray tandem mass spectrometry combined with modified QuEChERS sample preparation procedure[J]. Food Chem, 2011, 125(4): 1406-1411. DOI:10.1016/j.foodchem.2010.10.017 |
| [24] |
WALORCZYK S, DROŻDŻYŃSKI D, KIERZEK R. Determination of pesticide residues in samples of green minor crops by gas chromatography and ultra performance liquid chromatography coupled to tandem quadrupole mass spectrometry[J]. Talanta, 2015, 132: 197-204. DOI:10.1016/j.talanta.2014.08.073 |
| [25] |
KWON H, ANASTASSIADES M, DÖRK D, et al. Compensation for matrix effects in GC analysis of pesticides by using cucumber extract[J]. Anal Bioanal Chem, 2018, 410(22): 5481-5489. DOI:10.1007/s00216-018-1197-1 |
| [26] |
JIAO W T, XIAO Y, QIAN X S, et al. Optimized combination of dilution and refined QuEChERS to overcome matrix effects of six types of tea for determination eight neonicotinoid insecticides by ultra performance liquid chromatography-electrospray tandem mass spectrometry[J]. Food Chem, 2016, 210: 26-34. DOI:10.1016/j.foodchem.2016.04.097 |
 2019, Vol. 21
2019, Vol. 21


