2. 甘肃省中医药大学 基础医学院,兰州 730030
2. Basic Medical College, Gansu University of Chinese Medicine, Lanzhou 730030, China
当归具有润肠、调经止血和补血活血等功效[1],在中医临床中广泛应用。调查发现,为保证当归产量,农药滥用现象普遍存在,而农药滥用也是中药材中农药残留超标的主要原因[2]。为控制农药残留,保证当归产业持续健康发展,建立适用于当归中农药多残留的快速检测方法势在必行。
在2015版《中国药典》通则2341《农药残留测定法》中记载,采用气相色谱-串联质谱 (GC-MS/MS) 技术最多可检测74种农药的残留,分析时间长达40 min[3]。目前,中药材中农药残留检测所用GC-MS/MS检测方法,多采用多反应监测模式 (MRM),而将灵敏度高、定量准确的动态多反应监测模式 (dMRM) 应用于中药材中农药残留检测尚未见报道。MRM模式需分时间段扫描,在不同时间段内扫描特定离子对,每个时间段内至少扫描1种化合物,当检测时间短且化合物多时,每个时间段内就要同时扫描多种化合物,单位时间段内扫描离子越多,驻留时间则越短,数据采集的灵敏度越低。与MRM相比,dMRM单位时间内仅扫描1种化合物,根据色谱分析时间对每个组分的保留时间窗口进行动态分配,仅当组分流出时才被采集,减少了同时扫描不同离子对的数目,提高了分析效率,适合一针分析、检测多个化合物。
当归中含有大量的黄酮类、多糖类、内酯类及挥发油等化合物,这些化合物在样品前处理中会产生较严重的基质效应,从而影响待测物定性与定量的准确性[4]。鉴于此,本研究基于GC-MS/MS的dMRM监测模式,以102种农药残留为目标化合物,优化QuEChERS前处理方法,采用基质匹配标准溶液校准降低基质干扰,建立了一种快速、高效、可靠的当归中农药残留的检测方法。
1 材料与方法 1.1 仪器、药剂与试剂7890B-7000D气相色谱-串联质谱联用仪和HP-5MS UI气相色谱柱 (30 m × 0.25 mm,0.25 μm)(美国Agilent公司);移液枪 (德国Eppendorf公司);Centrifuge 5810R高速离心机 (德国Eppendorf公司);ME204/02电子天平 (瑞士梅特勒公司);EVA50A氮吹仪 (中国北京普立泰科仪器有限公司);KS501摇床 (德国IKA公司);VORTEX-5涡旋混匀器 (中国其林贝尔仪器制造有限公司);MS 205DU 电子天平(精确至0.1 mg,瑞士梅特勒公司);0.22 μm有机滤膜 (中国天津博纳艾杰尔科技有限公司)。
102种农药标准品 (见表1,纯度 ≥ 95%,Dr Ehrenstorfer,德国)。乙腈、正己烷 (色谱纯,德国Merck公司),丙酮 (色谱纯,天津科密欧公司),无水硫酸镁、氯化钠、柠檬酸钠和柠檬酸二钠盐倍半水合物 (分析纯,国药集团化学试剂有限公司);试验用水为Milli-Q超纯水;N-丙基乙二胺吸附剂 (PSA)和十八烷基键合硅胶吸附剂 (C18)(Supelco公司, 美国)。
|
|
表 1 102种农药保留时间及气相色谱-串联质谱检测参数 Table 1 Retention time and GC-MS/MS detection parameters of 102 pesticides |
1.2 试验方法 1.2.1 样品前处理
当归Angelica sinensis采集自甘肃省岷县药材市场,粉碎研磨成粉后过三号筛,混匀,按四分法留样200 g,避光保存,备用。
提取:称取2 g (精确至0.01 g) 当归样品于50 mL离心管中,加入5.0 mL超纯水,涡旋30 s后,静置30 min;加入10.00 mL乙腈,剧烈振荡10 min,加入QuEChERS盐包 (1.0 g氯化钠、4.0 g无水硫酸镁、1.0 g柠檬酸钠和0.5 g柠檬酸二钠盐倍半水合物) 6.5 g,涡旋1 min,静置5 min,于3 900 r/min下离心5 min,取上清液,待净化。
净化:取5.0 mL上清液,转入QuEChERS净化管 (800 mg无水硫酸镁、150 mg PSA、150 mg C18) 中,混匀,涡旋1 min,于3 900 r/min下离心5 min;取2.0 mL上清液于7 mL离心管中,于40 ℃水浴中氮气吹干;加入2.0 mL正己烷,涡旋溶解,过0.22 μm有机滤膜后,待测定。
1.2.2 气相色谱-串联质谱检测条件气相色谱条件:程序升温过程为初始温度60 ℃,保持1 min,以40 ℃/min升温至170 ℃,再以10 ℃/min升温至310 ℃并保持3 min;载气为氦气,流速1.2 mL/min;进样量1.0 μL;不分流进样。
质谱条件:电子轰击 (EI) 离子源;电子能量70 eV;离子源温度250 ℃;气相色谱-串联质谱传输线温度280 ℃;dMRM扫描模式;溶剂延迟3.5 min;Agilent MassHunter工作软件, 其他条件见表1。
1.2.3 标准溶液配制及标准曲线绘制农药单一标准溶液配制:分别准确称取10 mg(精确至0.1 mg)各农药标准品,用丙酮溶解并定容至10 mL,配成质量浓度约为 1 000 mg/mL的农药单一标准储备液,于4 ℃避光保存。
农药混合标准溶液配制:移取一定体积的102种农药单一标准储备液,用正己烷稀释并定容至25 mL,配成质量浓度为 8 mg/L左右的混合标准溶液,于 –18 ℃避光保存,用于质谱离子对确认和保留时间的确定。
基质匹配混合标准工作溶液配制:取当归空白样品,按1.2.1节的方法制得空白基质溶液。量取农药混合标准溶液1.0 mL,用样品空白基质提取液稀释至10 mL,配制系列质量浓度的基质匹配混合标准工作溶液,现配现用。
取基质匹配混合标准工作溶液,按1.2.2节的条件测定,以各种农药的定量离子峰的峰面积响应值为 (y) 为纵坐标,以其质量浓度 (x) 为横坐标绘制标准曲线,得到102种农药残留的线性方程及决定系数R2。
2 结果与分析 2.1 dMRM方法的建立取农药标准溶液在m/z 50~500范围内全扫描,使用NIST标准库匹配检索,确证目标物的保留时间和特征离子碎片。创建不同碰撞能量方法,获得在不同碰撞能量下的子离子扫描数据,选取最优的碰撞能量。
在确定保留时间、离子对和碰撞能量的基础上以化合物的保留时间为中心,调整向前和向后扫描时间长度,当单位时间内组分流出较多时可适当缩短扫描时间长度,使得离子对驻留时间延长,进而改善峰形,提高灵敏度。优化后的结果见表1;当归中102种农药在动态多反应监测模式扫描下的总离子流图见图1。
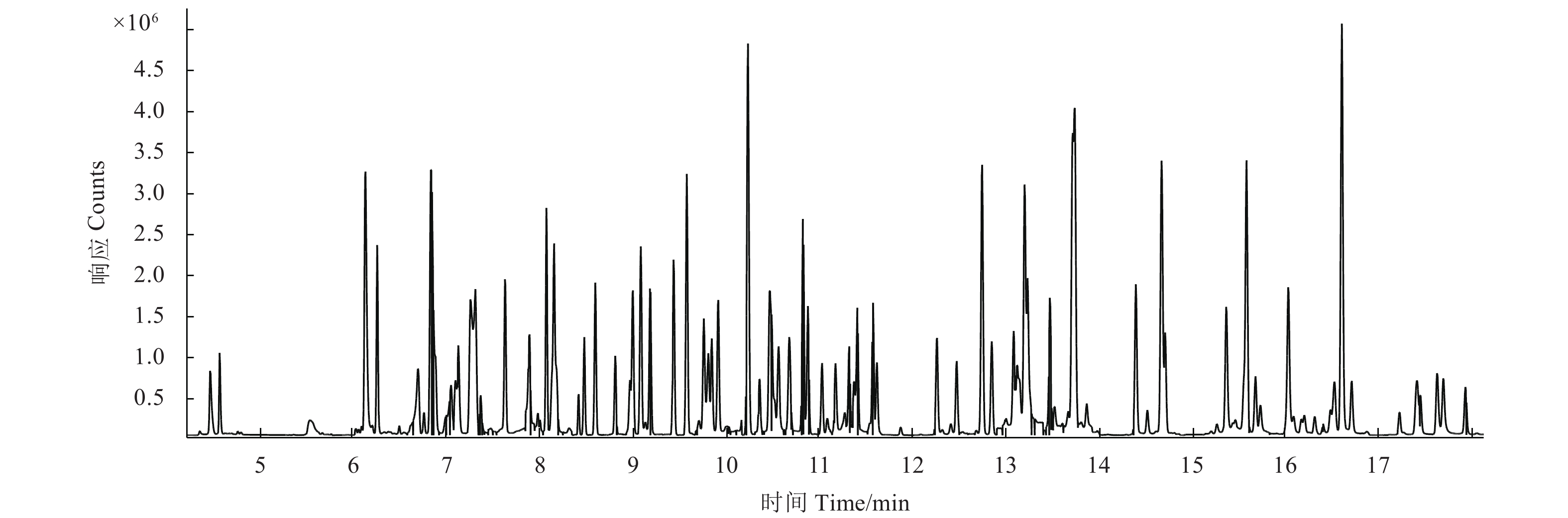
|
图 1 当归中102种农药在动态多反应监测模式扫描下的总离子流图 (0.08 mg/kg) Fig. 1 Total ion chromatograms of 102 pesticides (0.08 mg/kg) using dMRM mode in Angelica sinensis |
2.2 前处理条件优化
选取具有代表性的16种农药 (氯氰菊酯、敌敌畏、氟虫腈、三唑醇、腐霉利、丙溴磷、氰戊菊酯、甲霜灵、二甲戊灵、联苯肼酯、甲基毒死蜱、苯醚甲环唑、倍硫磷、毒死蜱、马拉硫磷、甲拌磷) 混合标准溶液,在添加水平为0.08 mg/kg条件下,对前处理条件进行优化。
2.2.1 提取条件优化在样品提取前加入5.0 mL超纯水涡旋30 s,再静置30 min,提高了样品的分散程度,增大了比表面积,同时乙腈可以与水互溶,增加了其渗透性,提取率明显增高。乙腈的溶解性好,渗透力强,适用农药极性范围相对广泛,故提取溶剂选用乙腈。分别考察了3种提取方式对提取效果的影响:加入1.0 g氯化钠、5.5 g无水硫酸镁 (A);加入1.0 g氯化钠、4.0 g无水硫酸镁、1.0 g柠檬酸钠和0.5 g柠檬酸二钠盐倍半水合物 (B);加入1.5 g NaAc·3H2O、5.0 g无水硫酸镁 (C)。
结果(图2)表明:B组的回收率最好,回收率在75%~110%之间的农药数量为15个,而A组和C组分别为9个和12个。分析其原因可能是在提取过程中形成了缓冲盐体系,使提取环境保持在pH 5.0~6.0之间,这种弱酸性环境更有利于带有酸性基团 (如羧基、酰胺基、醚基等) 的农药在乙腈中溶解[5],同时在水与乙腈中加入氯化钠,更有利于两者分层,所以提取率相对更高。
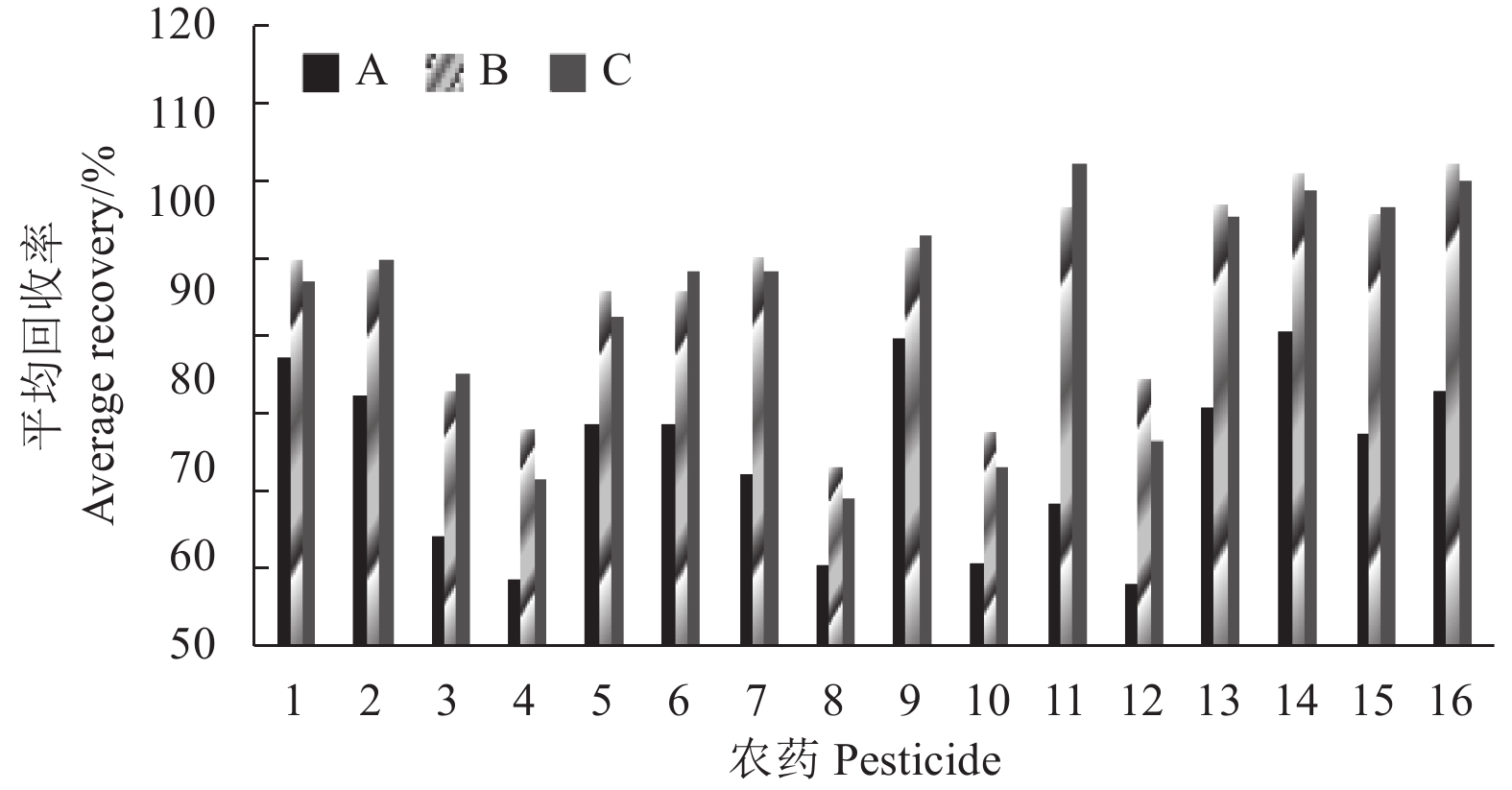
|
1. 氯氰菊酯;2. 敌敌畏;3. 氟虫腈;4. 三唑醇;5. 腐霉利;6. 丙溴磷;7. 氰戊菊酯;8. 甲霜灵;9. 二甲戊灵;10. 联苯肼酯;11. 甲基毒死蜱;12. 苯醚甲环唑;13. 倍硫磷;14. 毒死蜱;15. 马拉硫磷;16. 甲拌磷。A: 1.0 g氯化钠、5.5 g无水硫酸镁;B: 1.0 g氯化钠、4.0 g无水硫酸镁、1.0 g柠檬酸钠和0.5 g柠檬酸二钠盐倍半水合物;C: 1.5 g NaAc · 3H2O、5.0 g无水硫酸镁。 1. cypermethrin; 2. dichlorvos; 3. fipronil; 4. triadimenol; 5. procymidone; 6. profenofos; 7. fenvalerate; 8. metalaxyl; 9. pendimethalin; 10. bifenazate; 11. chlorpyrifos-methyl; 12. difenoconazole; 13. fenthion; 14. chlorpyrifos; 15. malathion; 16. phorate. A: 1.0 g sodium chloride, 5.5 g magnesium sulfate;B: 1.0 g sodium chloride, 4.0 g magnesium sulfate, 1.0 g sodium citrate and 0.5 g sodium hydrogencitrate sesquihydrate;C: 1.5 g NaAc · 3H2O, 5.0 g magnesium sulfate. 图 2 3种提取方式对16种农药回收率的影响(0.08 mg/kg) Fig. 2 Effects of three extraction methods on the average recoveries of 16 pesticides (0.08 mg/kg) |
2.2.2 净化条件优化
QuEChERS常用的吸附剂有阴离子交换吸附剂 (PSA)、反向吸附剂 (C18) 和石墨化碳黑 (GCB)。其中,PSA可通过氢键与化合物作用,从而除去脂肪酸、部分有机酸、糖和色素;C18可除去非极性的干扰物如脂类、花青素、蜡类产生的影响;GCB可去除叶绿素和类胡萝卜素等大分子杂质,但由于会吸附含有平面环状结构的农药而造成回收率降低[6]。由于当归中色素含量较低,且含有挥发油,因此本研究选取具有代表性的16种农药,考察了无水硫酸镁、PSA和C18 3种吸附剂及其用量对净化效果的影响。
2.2.2.1 无水硫酸镁用量的优化在固定C18 200 mg、PSA 200 mg以及混合标准溶液添加水平为0.08 mg/kg条件下,考察了无水硫酸镁400、800、1 000和1 200 mg对农药回收率的影响。结果表明:当无水硫酸镁添加量大于800 mg时回收率在80 %~110 %之间的农药数量维持不变,综合考虑采用无水硫酸镁添加量为800 mg。
2.2.2.2 PSA添加量的优化在固定无水硫酸镁800 mg、C18 200 mg以及混合标准溶液添加水平为0.08 mg/kg条件下,分别比较了50、100、150和200 mg PSA对农药回收率的影响。结果发现:当PSA用量为150 mg时,回收率接近100 %的农药数最多 (图3),所以采用PSA添加量为150 mg。
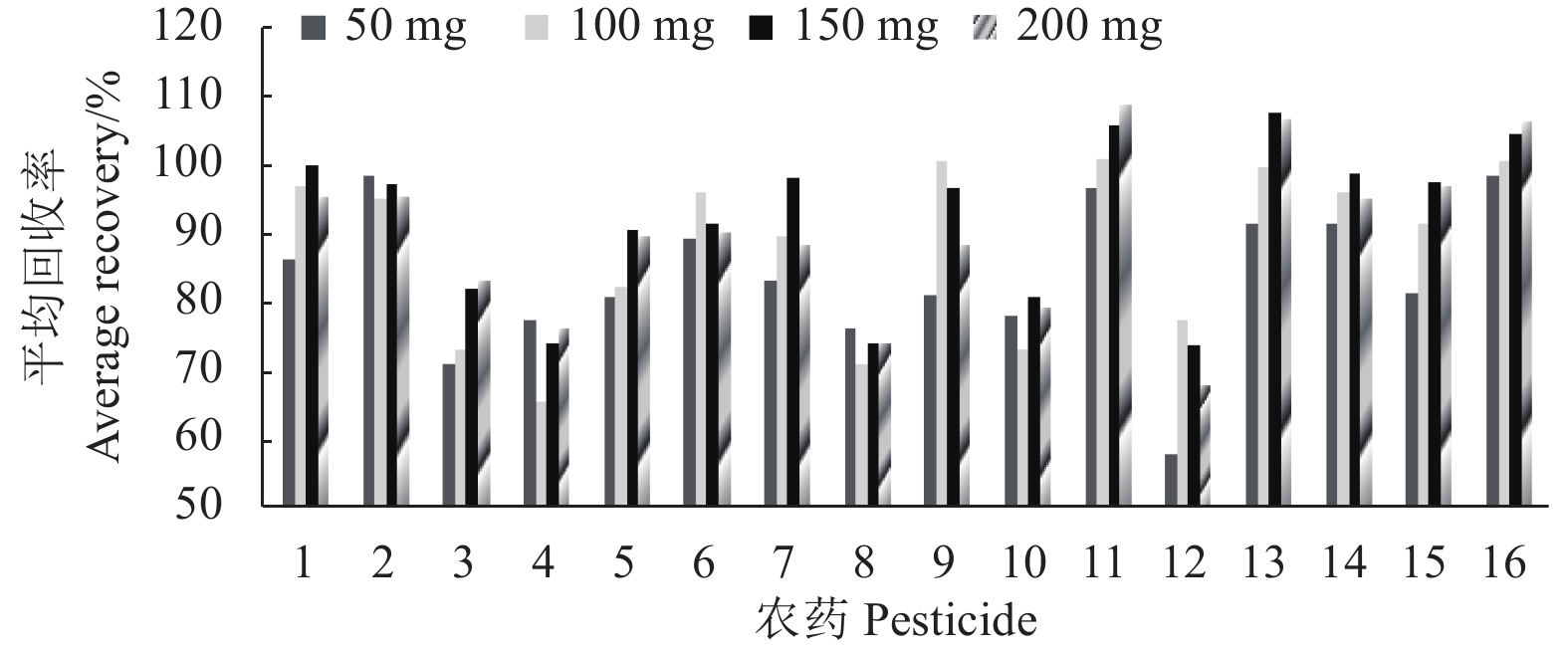
|
1. 氯氰菊酯;2. 敌敌畏;3.氟虫腈;4. 三唑醇;5. 腐霉利;6. 丙溴磷;7. 氰戊菊酯;8. 甲霜灵;9. 二甲戊灵;10. 联苯肼酯 ;11. 甲基毒死蜱;12. 苯醚甲环唑;13. 倍硫磷;14. 毒死蜱;15. 马拉硫磷;16. 甲拌磷。 1. cypermethrin; 2. dichlorvos; 3. fipronil; 4. triadimenol; 5. procymidone; 6. profenofos; 7. fenvalerate; 8. metalaxyl; 9. pendimethalin; 10. bifenazate; 11. chlorpyrifos-methyl; 12. difenoconazole; 13. fenthion; 14. chlorpyrifos; 15. malathion; 16. phorate. 图 3 不同PSA用量对16种农药回收率的影响(0.08 mg/kg) Fig. 3 Effect of different PSA dosages on recoveries of 16 pesticides (0.08 mg/kg) |
2.2.2.3 C18添加量的优化
在固定无水硫酸镁800 mg、PSA150 mg以及混合标准溶液添加水平为0.08 mg/kg条件下,分别比较了50、100、150和200 mg C18对农药回收率的影响。结果发现:当C18用量在150 mg时,回收率接近100%的农药数最多 (图4),故采用C18添加量为150 mg。
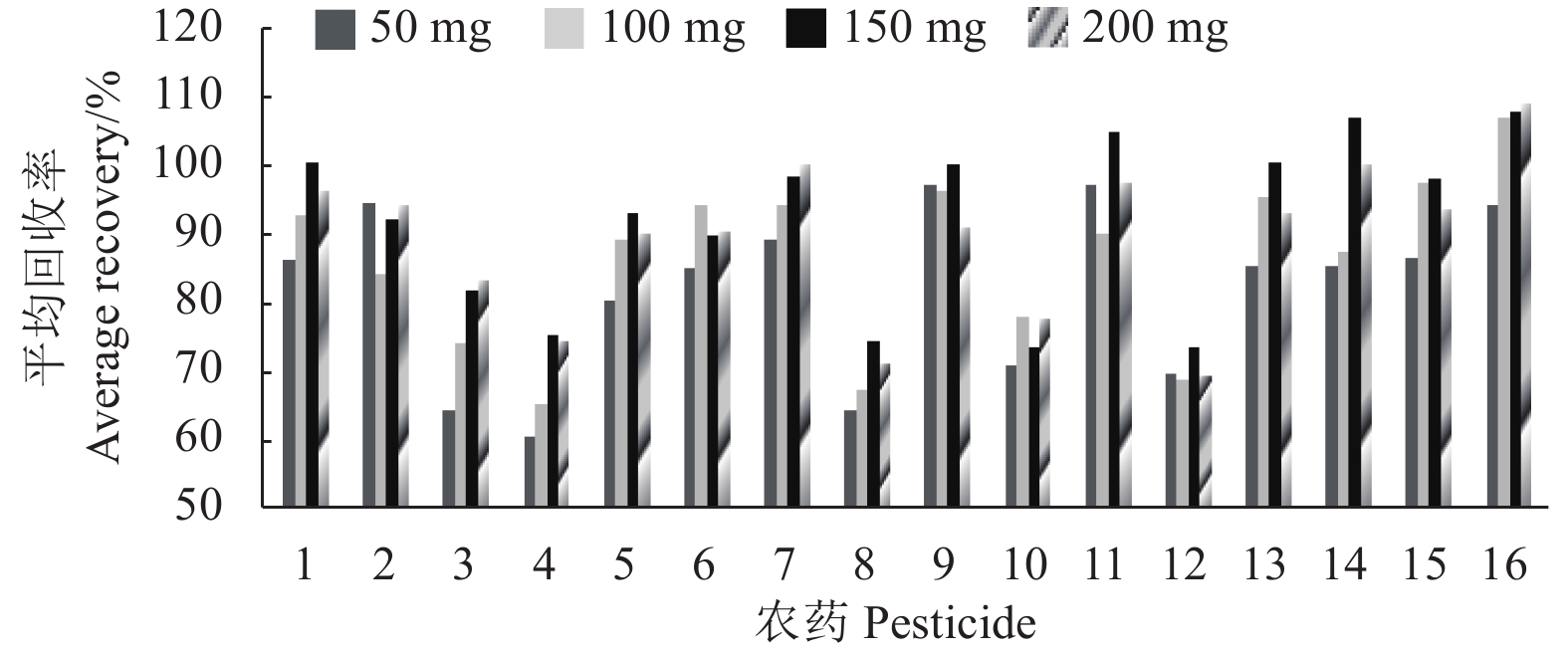
|
1. 氯氰菊酯;2. 敌敌畏;3.氟虫腈;4. 三唑醇;5. 腐霉利;6. 丙溴磷;7. 氰戊菊酯;8. 甲霜灵;9. 二甲戊灵;10. 联苯肼酯 ;11. 甲基毒死蜱;12. 苯醚甲环唑;13. 倍硫磷;14. 毒死蜱;15. 马拉硫磷;16. 甲拌磷。 1. cypermethrin; 2. dichlorvos; 3. fipronil; 4. triadimenol; 5. procymidone; 6. profenofos; 7. fenvalerate; 8. metalaxyl; 9. pendimethalin; 10. bifenazate; 11. chlorpyrifos-methyl; 12. difenoconazole; 13. fenthion; 14. chlorpyrifos; 15. malathion; 16. phorate. 图 4 不同C18用量对16种农药回收率的影响(0.08 mg/kg) Fig. 4 Effect of different C18 dosages on the recoveries of 16 pesticides (0.08 mg/kg) |
2.3 方法的线性范围及检出限
结果 (见表2) 表明:在0.02~0.64 mg/kg范围内,102种农药的质量浓度与对应的峰面积间均呈良好的线性关系,R2均大于0.99。
|
|
表 2 102种农药的检出限、定量限、线性方程、R2、回收率及相对标准偏差 Table 2 LOD, LOQ, linear equation, R2, recoveries and RSDs of 102 pesticides |
采用向当归空白样品中逐渐降低添加水平,在降低水平的同时保证峰形良好,以信噪比等于3作为检出限 (LOD),其LOD在0.002 5~0.025 mg/kg之间,均低于2015版药典四部通则2341第四法中规定的检出限[3];以信噪比等于10作为定量限 (LOQ),其LOQ在0.005~0.04 mg/kg之间。
准确称取2 g当归空白样品进行添加回收率试验。农药混合标准品添加水平为0.04~0.32 mg/kg,每个水平重复6次。结果表明:各农药的平均回收率在52%~128%之间,RSD在1.0 %~10 %之间。有部分检测项目回收率较低,一方面是由于当归基质复杂,存在一定干扰;另一方面是由于自身极性和受热后稳定性降低等多方面原因的影响。
2.4 基质效应气相色谱分析中基质效应普遍存在,且多表现为基质增强效应[7-8]。一般不挥发物质的含量越高,基质效应越强[9]。当归中含有糖类、蛋白质、油脂类等不易挥发化合物,易在进样口以及衬管内的活性点位富集,降低农药吸附量,影响方法的灵敏度和检出限,因此需要对基质效应进行评价。本研究中采用提取后加入法和绝对基质效应法评价基质效应[10-11]。通过检测目标化合物在基质匹配标准溶液中的响应值 (A) 及其在纯溶剂中的响应值 (B),根据公式 (1) 计算基质效应 (ME)。当ME < 15 %时,样品的基质效应对结果的影响可忽略;当 ME ≥ 15%时,样品的基质效应对结果的影响不可忽略[12]。
| $ M_{\rm{E}} / \%=[(A-B) / B] \times 100 $ | (1) |
结果 (表3) 表明:总体上,随着农药质量浓度的升高,其基质效应趋于减弱。具体来看:1) 联苯肼酯在当归中存在基质减弱效应 (ME在 –60%~–46%之间),对结果影响较大。2) 烯草酮在当归中的添加水平为0.02 mg/mL时,存在基质增强效应,而当添加水平大于0.02 mg/mL时,则存在基质减弱效应。3) 其余100种农药均表现为基质增强效应,其中,禾草敌、氟乐灵、治螟磷和硫线磷等31种农药的基质效应在13%~72%之间,且随农药质量浓度的升高,基质效应减弱;甲胺磷、敌敌畏、邻苯基苯酚和氧乐果等70种农药存在较强的基质增强效应 ( ME在15%~190%之间),对结果影响很大。因此本研究采用基质匹配标准溶液进行校正,经校正后可有效消除基质效应带来的影响,满足当归中农药残留检测要求。
|
|
表 3 102种农药在当归中的基质效应 Table 3 Matix effects of 102 pesticides in Angelica sinensis |
2.5 实际样品测定
利用所建立的方法对从甘肃省岷县药材市场购买的43批当归样品进行农药残留检测,重复3次。结果有9批次检出三唑醇、甲基异柳磷、三唑酮、毒死蜱、六氯苯和二苯胺,其最高检出量分别为0.210、0.050、0.025、0.010、0.010和0.010 mg/kg,而甲基异柳磷为中药材禁用农药。
3 结论优化了当归中农药残留检测的QuEChERS前处理方法,利用GC-MS/MS结合动态多反应监测 (dMRM) 模式,建立了当归中102种农药残留的快速检测方法。本研究结果表明:当归基质中成分复杂,基质效应明显;当待测物质量浓度越低时,基质增强效应越明显,采用基质匹配标准溶液进行校正,结果准确。通过实际样品检测证明该方法具有简单、快速、准确及灵敏度高等优点,适用于当归中日常农药残留的检测,成本较低,具有实际应用价值。
| [1] |
徐璨. 当归化学成分分离与鉴定[J]. 亚太传统医药, 2016, 24(12): 42-43. XU C. Separation and identification of chemical constituents of Angelica sinensis [J]. Asia-Pacific Trad Med, 2016, 24(12): 42-43. DOI:10.11954/ytctyy.201612017 |
| [2] |
陈君, 徐常青, 乔海莉, 等. 我国中药材生产中农药使用现状与建议[J]. 中国现代中药, 2016, 18(3): 263-270. CHEN J, XU C Q, QIAO H L, et al. Current situation and consideration on pesticides application in production of Chinese herbal medicine[J]. Mod Chin Med, 2016, 18(3): 263-270. |
| [3] |
中国药典国家药典委员会. 中华人民共和国药典: 四部[S].北京: 中国医药科技出版社, 2015 National committee of Chinese pharmacopoeia. Pharmacopoeia of the People's Republic of China: four[S]. Beijing: China Medical Science and Technology Press, 2015 |
| [4] |
张建莹, 邓慧芬, 李月梅, 等. QuEChERS/超高效液相色谱-串联质谱法测定果蔬中 122 种香港规例农药残留[J]. 分析测试学报, 2017, 36(7): 849-857. ZHANG J Y, DENG H F, LI Y M, et al. Determination of 122 pesticide residues in fruits and vegetables from regulation of pesticides in Hong Kong by QuEChERS combined with ultra performance liquid chromatography-tandem mass spectrometry[J]. J Instrum Anal, 2017, 36(7): 849-857. DOI:10.3969/j.issn.1004-4957.2017.07.002 |
| [5] |
马妍, 陈頔, 陈曦, 等. 分散固相萃取-分散液液微萃取-气相色谱-质谱联用法测定中草药类保健食品中 29 种有机磷农药残留[J]. 中国食品卫生杂志, 2017, 29(5): 556-560. MA Y, CHEN D, CHEN X, et al. Determination of 29 organophosphorus pesticide residues in health food from Chinese herbal medicines by dispersive solid phase extraction and dispersive liquid-liquid microextraction coupled with gas chromatography-mass spectrometry[J]. Chin J Food Hyg, 2017, 29(5): 556-560. |
| [6] |
LEHOTAY S J, ANASTASSIADES M, MAJORS R E. The QuEChERS revolution[J]. LC GC Europ, 2010, 23(9): 1-12. |
| [7] |
黄宝勇, 欧阳喜辉, 潘灿平. 色谱法测定农产品中农药残留时的基质效应[J]. 农药学学报, 2005, 7(4): 299-305. HUANG B Y, OUYANG X H, PAN C P. Matrix effects in the analysis of pesticide residue in agro-products by chromatographic methods[J]. Chin J Pestic Sci, 2005, 7(4): 299-305. DOI:10.3321/j.issn:1008-7303.2005.04.002 |
| [8] |
GILLESPIE A M, WALTERS S M. Rapid clean-up of fat extracts for organophosphorus pesticide residue determination using C18 solid-phase extraction cartridges
[J]. Anal Chimica Acta, 1991, 245: 259-265. DOI:10.1016/S0003-2670(00)80230-5 |
| [9] |
易盛国, 侯雪, 韩梅, 等. 气相色谱-串联质谱法检测蔬菜农药残留基质效应与基质分类的研究[J]. 西南农业学报, 2012, 25(2): 537-543. YI S G, HOU X, HAN M, et al. Study on matrix effects and matrix classification of pesticide residues in vegetable by gas chromatography-tandem mass spectrometry[J]. Southwest China J Agric Sci, 2012, 25(2): 537-543. DOI:10.3969/j.issn.1001-4829.2012.02.038 |
| [10] |
王鹏, 蒋学华, 王凌. LC-MSn 应用于生物样品检测中基质效应的评价
[J]. 中国新药杂志, 2011, 20(20): 1953-1956. WANG P, JIANG X H, WANG L. Assessment of matrix effect in quantitative bioanalytical methods based on LC-MSn[J]. Chin J New Drugs, 2011, 20(20): 1953-1956. |
| [11] |
MATUSZEWSKI B K, CONSTANZER M L, CHAVEZ-ENG C M. Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Anal Chem, 2003, 75(13): 3019-3030. DOI:10.1021/ac020361s |
| [12] |
李俊, 蔡滔, 杜楠, 等. QuEChERS-气相色谱-串联质谱法测定茶青中28种农药残留[J]. 农药学学报, 2017, 19(3): 366-373. LI J, CAI T, DU N, et al. Determination of 28 pesticide residues in fresh tea leaves using QuEChERS-gas chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2017, 19(3): 366-373. |
 2019, Vol. 21
2019, Vol. 21


