2. 浙江经贸职业技术学院 应用工程系,杭州 310018
2. Department of Applied Engineering, Zhejiang Economic & Trade Polytechnic, Hangzhou 310018, China
三唑磷 (triazophos) 是一种中等毒性的广谱有机磷类杀虫、杀螨剂,具有强烈的触杀和胃毒作用且效果明显,是乐果及有机氯类等农药的替代品种,广泛应用于海洋渔业和农业生产[1]。三唑磷主要通过抑制生物体乙酰胆碱酯酶的活性,导致神经递质 (乙酰胆碱) 在突触处积聚,从而过度刺激神经系统中的神经和肌肉而产生毒性,其中毒症状包括自主神经功能障碍、不自主运动、肌肉震颤及活动减少等,最后直至呼吸抑制[2-4]。已有研究表明,短期暴露于三唑磷能够对水生生物的抗氧化系统造成毒性效应[5],而低浓度三唑磷胁迫会对鲫鱼肝脏内的过氧化氢酶产生明显抑制作用,胁迫解除后,过氧化氢酶活性才能得到一定程度恢复[6]。亚致死浓度的三唑磷也会对生物体部分蛋白质的代谢调节造成影响,导致鱼类及虾类等水生生物的死亡,从而造成渔业经济损失和环境污染[7-8]。此外,最新研究发现,三唑磷的毒性效应可能还与微RNA (micro RNA, miRNA) 等非编码RNA有关,其通过miRNA调控相关基因的表达,从而影响水生生物的正常生长发育[9]。
长链非编码RNA (long non-coding RNA,lncRNA) 通常是指长度大于200 nt且不具有编码蛋白质功能的一类RNA分子[10]。lncRNA主要在转录、转录后及翻译阶段,以及表观遗传学水平参与基因表达调控,从而影响生物体的正常生长发育[11]。近年来不断有证据表明,当细胞或生物体暴露于重金属及有毒化学物质等环境污染物时,其lncRNA通常会异常表达,并常与癌症等疾病的发生相关[12-13]。Ye等[14]通过生物信息学方法分析了胰腺癌中的lncRNA与miRNA的调控关系,发现在长链非编码RNA-微RNA-信使RNA(lncRNA-miRNA-mRNA)调控网络中,共有19种miRNA因受到lncRNA的调控出现了表达差异,而miRNA则可以直接影响靶基因的表达。因此,构建与毒理学相关的lncRNA-miRNA-mRNA调控网络,不仅有助于研究lncRNA的功能,还可为研究环境污染物的毒理学效应开辟新思路。
随着人类基因组学研究的发展,部分人类lncRNA的生物学功能已逐渐被发现。1991年,Bartolomei在小鼠中首次发现了lncRNA H19基因。该基因在囊胚阶段开始表达,且在内胚层和中胚层中表达水平较高,出生后,该基因在除骨骼肌外的所有组织中表达均受到抑制[15]。研究表明:将亲代小鼠暴露于p,p′-滴滴伊 (p,p′-DDE) 后能够诱导其精子中H19的甲基化,并造成可遗传的功能性损伤;暴露组的F1子代表现出由H19低甲基化诱导所引起的H19 mRNA表达上调,并出现耐葡萄糖量降低、胰岛素分泌异常以及β细胞功能障碍等症状,且可进一步转移至F3后代[16]。同时,H19已被鉴定为致癌基因,其过高表达与肿瘤发生和癌症恶化紧密相关[17-18]。Sox2OT 基因定位于人体3号染色体,该基因存在多个转录起始点,其转录本存在多种变构体,并参与介导人体不同的生物学过程[19]。Sox2OT基因序列在脊椎动物中高度保守,同时各物种间的Sox2OT基因存在相似的复杂结构和调控表达机制[20]。Sox2OT含有3个雄激素响应元件,活化后的雄激素受体可与雄激素响应元件结合,并促进Sox2OT的转录,在生物体大脑发育的过程中起着增强剂的作用,这可能是有机化合物等环境污染物质干扰激素受体相关信号通路,扰乱雄激素功能的潜在途径[21]。此外,不断有新的研究证实Sox2OT在诸多肿瘤恶性生物学行为调控过程中同样扮演着重要的角色,并且与肿瘤患者的预后密切相关[22]。
斑马鱼Danio rerio具有成本低、易观察及发育快等特点,其基因组与人类基因组相似度高,与人类已知疾病基因的同源性高达80%以上[23],因此被广泛应用于发育生物学、遗传毒理学、医学、药理学和环境毒理学等领域[24],是评估外源化学物质毒性作用的理想模式生物。然而,斑马鱼作为研究人类疾病的理想模式生物,目前对其lncRNA调控机制的研究还相对较少。本研究利用人源基因芯片,初步筛选了亚致死浓度三唑磷处理下表达异常的斑马鱼lncRNA,并通过生物信息学软件预测了与lncRNA相互作用的miRNA及miRNA的靶基因,最后通过实时荧光定量PCR技术验证了其在斑马鱼中的表达,从而构建起lncRNA-miRNA-mRNA调控网络,以期为合理评价三唑磷的环境风险提供新的监测方法和理论依据。
1 材料与方法 1.1 前期准备 1.1.1 生物试材及预处理斑马鱼Danio rerio及其养殖系统均由浙江大学农药与环境毒理研究所提供。本研究团队前期测得三唑磷对斑马鱼的半致死浓度 (LC50) 值为5.20 mg/L[25]。为确保研究的延续性和可比性,将三唑磷处理斑马鱼的浓度设定为该LC50值的1/3,同时设空白对照组和助剂对照组。处理96 h后,将全鱼碾磨,提取总RNA,进行后续试验。试验中所涉及的数据库或网站信息详见表1。
|
|
表 1 试验中所涉及的数据库或网站 Table 1 The database or website used in the experiments |
1.1.2 主要仪器
Mini型接触式匀浆机,IKA worker Guangzhou公司;ND-2000型 NanoDrop2000仪及pico17微量离心机,Thermo公司;ABI 7500实时荧光定量PCR仪,美国应用生物系统公司 (ABI)。
1.1.3 药剂因三唑磷 (triazophos) 难溶于水,故预先将95%的三唑磷原药[德国拜耳 (中国) 公司产品]溶于助剂中 (助剂主要成分包括乳化剂和助溶剂聚乙二醇、无水乙醇和正丁醇),并加水稀释,配制成三唑磷质量分数为30%的微乳剂 (ME)。药剂及试剂均由浙江大学农药与环境毒理研究所提供。
逆转录试剂盒和荧光定量PCR试剂盒均购自宝日医生物技术 (北京) 有限公司 (Takara);总RNA提取试剂盒购自北京艾德莱生物科技有限公司 (Aidlab);DEPC水购自生工生物工程 (上海) 股份有限公司。
1.2 lncRNA芯片初步筛选因人源基因芯片为初步筛选,故仅比对相关基因在空白对照组和处理组间的相对表达情况,待后续荧光定量PCR试验时再在斑马鱼中进行验证。根据lncRNADisease和 Long Noncoding RNA Database v2.0数据库的信息,分别将处理组和空白对照组斑马鱼RNA与已知序列的核酸探针杂交 (表2),从而进行小范围的精确筛选[26],为后续试验与分析做准备。
|
|
表 2 基因芯片中部分核酸探针序列 Table 2 Partial probe sequence in microarray |
1.3 预测与lncRNA作用的miRNA
通过NCBI和EMBL-EBI网站搜索得到人源lncRNA基因序列,运用斑马鱼lncRNA数据库:zflncRNApedia和Zebrafish lncRNA database,寻找同源的鱼源lncRNA基因序列。并利用miRNA数据库miRBase、生物信息学网站RegRNA 2.0和网站Bibiserv,在线预测出lncRNA基因序列中潜在的miRNA结合位点。
1.4 预测miRNA的靶基因利用MicroCosmTargets、TargetScanFish和DIANA等多个预测网站共同进行在线预测分析,筛选出miRNA的靶基因。
1.5 构建lncRNA-miRNA-mRNA调控网络运用Cytoscape作图软件,绘制得到lncRNA-miRNA-mRNA的调控网络,并通过GO功能分析进一步解释说明该调控网络。
1.6 通过qRT-PCR验证基因的表达运用Primer 5.0软件设计上文中筛选或预测所得基因的适用引物 (见表3),将1.1.1节预处理好的三唑磷处理组及空白组斑马鱼总RNA进行反转录。以β-actin为内参,运用荧光定量PCR技术检测lncRNA、miRNA以及靶基因的表达量变化。
|
|
表 3 荧光定量PCR引物序列 Table 3 Primers used for real-time RT-PCR assay |
2 结果与分析 2.1 lncRNA芯片筛选结果
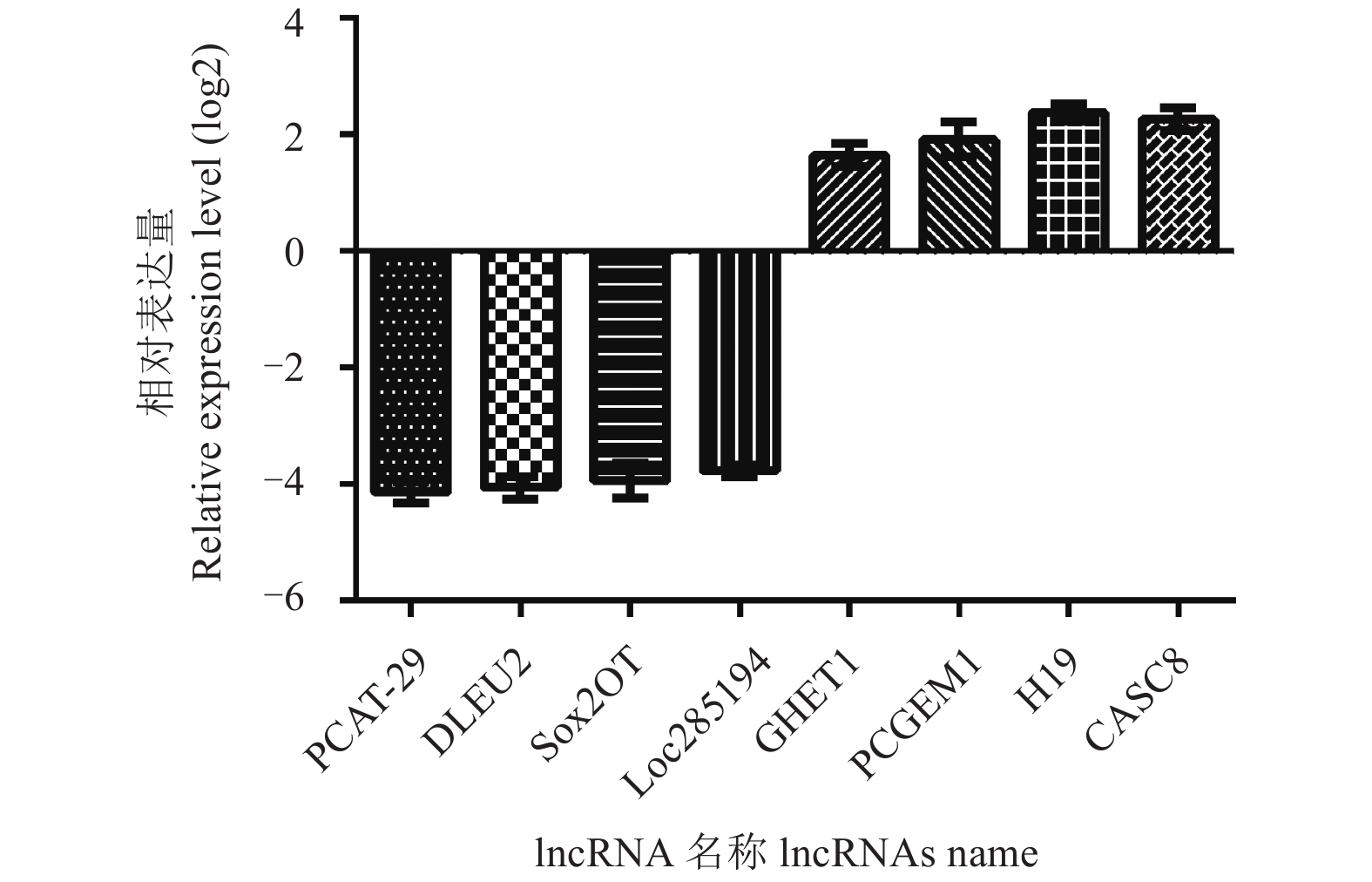
从基因芯片中共筛选出11个显著下调的和6个显著上调的lncRNA (图1)。其中,与空白对照组相比,三唑磷处理组中PCAT-29、DLEU2和Sox2OT等的lncRNA下调了10倍以上,而PCGEM1、H19和CASC8等的lncRNA上调了2倍以上,且表达差异均达极显著水平 (P < 0.01)。
|
图 1 三唑磷处理斑马鱼后基因芯片中部分lncRNAs的相对表达情况 Fig. 1 Relative expression of some lncRNAs in the microarray after the triazophos treatment of zebrafish |
2.2 lncRNA-miRNA-mRNA调控网络的构建 2.2.1 lncRNA选择
通过芯片筛选出8条表达差异明显的lncRNA基因,利用NCBI和Ensembl数据库,找到相应的人源lncRNA基因序列。运用斑马鱼lncRNA数据库的Zebrafish lncRNA database和zflncRNApedia,找到斑马鱼Sox2OT的基因序列[20],发现H19的部分基因序列在脊椎动物中高度保守 (图2A)。因此,选择lncRNA Sox2OT和H19进行lncRNA-miRNA-mRNA调控网络的构建。

|
注:A. H19的部分基因序列在脊椎动物中高度保守;B. 预测结果显示,dre-let-7c与H19在高度保守区存在结合作用;C. 预测结果显示,dre-miR-145与H19在高度保守区存在结合作用。红色表示结合位点;*表示种子区。 Note: A. Partial gene sequence of H19 was highly conserved in several vertebrates; B. The predicted results showed that dre-let-7c combined itself with H19 in a highly conserved region; C. The predicted results showed that dre-miR-145 combined itself with H19 in a highly conserved region (Red indicates binding site; * Indicates seed region). 图 2 H19的部分基因序列具有高度保守性 Fig. 2 Partial gene sequence of H19 is highly conserved |
2.2.2 miRNA的预测结果
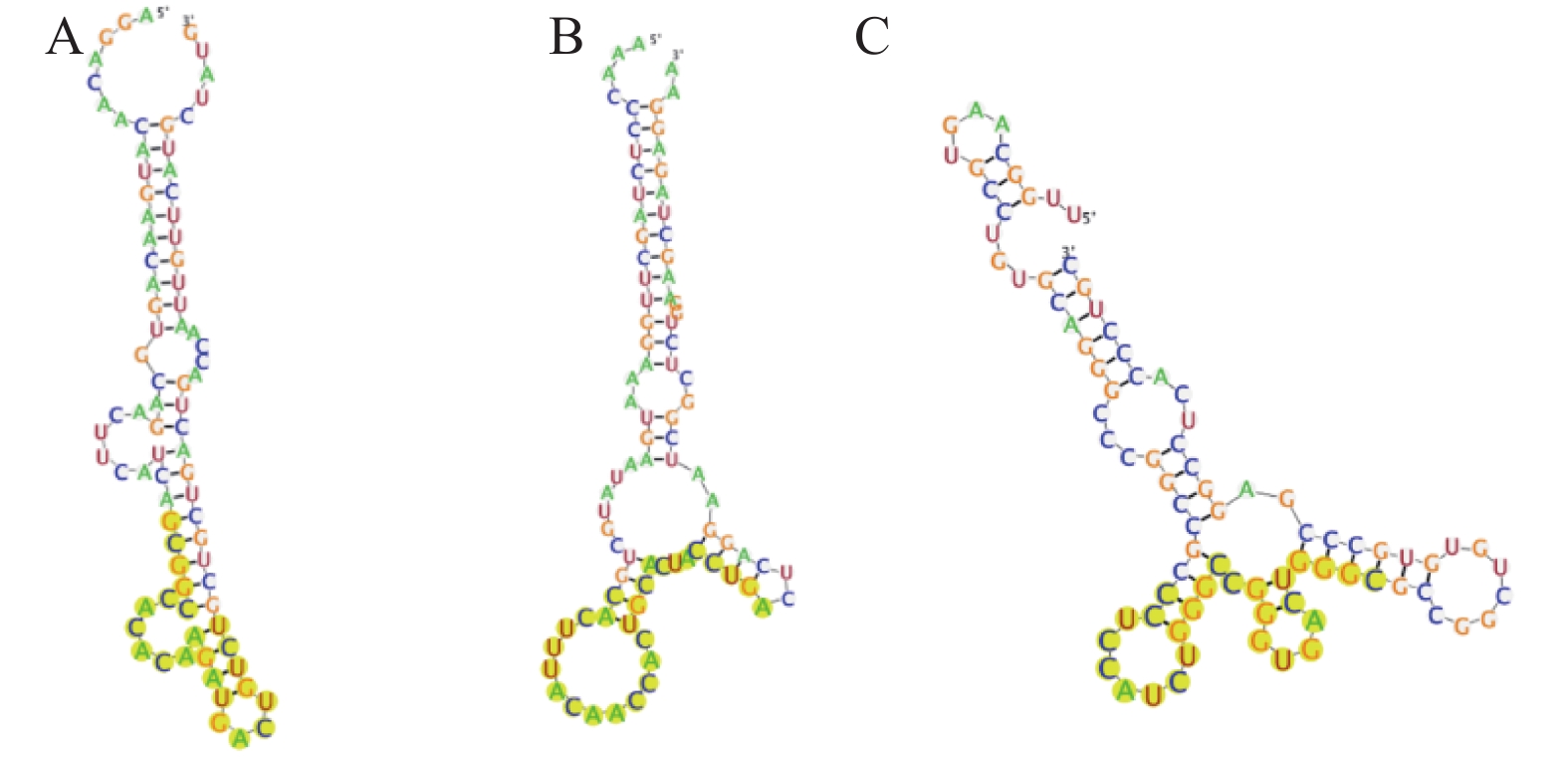
对斑马鱼Sox2OT基因序列和人类H19基因序列中高度保守部分潜在的斑马鱼miRNA结合位点的预测和筛选结果显示:dre-miR-34a、dre-miR-183、dre-miR-124和dre-miR-193b这4个斑马鱼miRNA可能与Sox2OT存在结合作用,而dre-miR-27a、dre-miR-129、dre-miR-141、dre-miR-145、dre-let-7c和dre-miR-196这6个斑马鱼miRNA可能与H19在高度保守区存在结合作用。其中,dre-let-7c和dre-miR-145这2个斑马鱼miRNA最有可能与H19在高度保守区存在结合作用 (图2B及2C)。此外,结合miRbase数据库,发现筛选出的部分miRNA碱基序列与其同源的人类miRNA碱基序列之间具有高度保守性 (表4)。综上,笔者选择dre-miR-34a、dre-miR-145和dre-let-7c进行下一步靶基因的预测,得到它们与相应lncRNA结合时的稳定二级结构 (图3)。
|
|
表 4 人类与斑马鱼之间部分具有同源性的miRNAs Table 4 Several homologous miRNAs between human and zebrafish |
|
A. dre-miR-34a与Sox2OT的预测结合位点; B. dre-miR-7c与H19的预测结合位点; C. dre-miR-145与H19的预测结合位点。 A. Prediction of the binding sites of Sox2OT to dre-miR-34a; B. Prediction of the binding sites of H19 to dre-miR-7c; C. Prediction of the binding sites of H19 to dre-miR-145. 图 3 预测所得lncRNAs与miRNAs的结合作用 Fig. 3 Prediction of the binding sites of lncRNAs to miRNAs |
2.2.3 调控网络及其功能分析
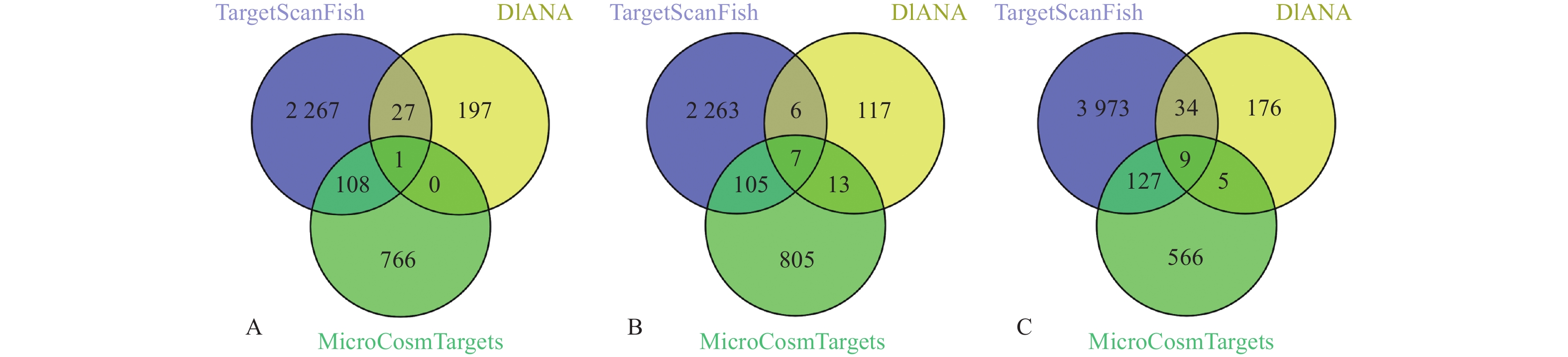
通过生物信息学软件MicroCosmTargets、DIANA和TargetScanFish共同分析,预测dre-miR-34a、dre-miR-145和dre-let-7c的靶基因。其中,针对dre-let-7c和dre-miR-145,通过TargetScanFish分别预测得到2 381个和4 143个靶基因,评分 ≤ 0.5的各有41个和50个;通过MicroCosmTargets分别预测得到930个和707个靶基因;通过DIANA分别预测得到143个和224个靶基因 (阈值 ≥ 0.7)。综合分析发现,通过TargetScanFish和DIANA分别预测出dre-miR-34a的2 803个和225个靶基因,综合MicroCosmTargets的预测结果,dre-miR-34a仅存在crybb1一个靶基因能同时被3个生物信息学软件共同预测到 (图4A)。dre-let-7c和dre-miR-145分别有7个和9个靶基因同时被3个生物信息学软件共同预测到,其中包括ddx18、gata6和fibpl等 (图4B和4C)。
|
A. dre-miR-34a;B. dre-miR-7c;C. dre-miR-145。 图 4 三种不同软件共同预测所得斑马鱼miRNA靶基因的数量 Fig. 4 Quantities of target genes for zebrafish miRNAs predicted by three different softwares |
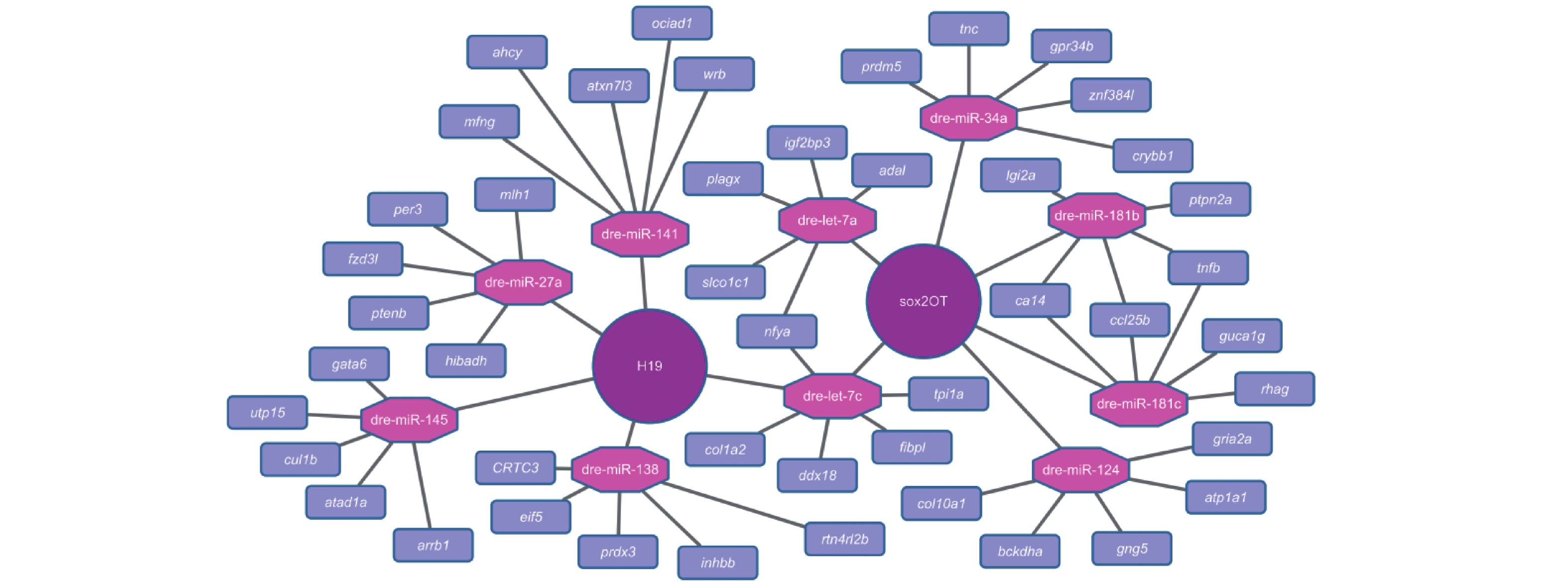
运用Cytoscape作图软件,以圆形表示的2个lncRNA为中心轴,分别辐射出若干以六边形表示的miRNA,每种miRNA又辐射出若干以长方形表示的靶基因mRNA。其中,mRNA为综合3个数据库的预测结果后选择所得评分较高的5个基因。最终,整合相关生物信息,构建得到lncRNA-miRNA-mRNA调控网络 (图5)。其中,H19基因位于该调控网络中心,通过miRNA与多个在脊椎动物中高度保守的基因间接产生作用。为了探究lncRNA H19可能参与的信号通路,笔者将筛选出的基因录入GO (gene ontology enrichment) 数据库中,通过软件进行生物学功能分析。结果表明,在lncRNA H19调控下,相应miRNA作用的靶基因高度富集作用于多个核酸代谢途径、细胞凋亡机制、蛋白磷酸化以及代谢等过程,同时对上皮细胞的组织形态具有调控作用 (图6)。
|
图 5 lncRNA-miRNA-mRNA调控网络 Fig. 5 lncRNA-miRNA-mRNA regulatory network |

|
图 6 H19预测靶基因功能分析 Fig. 6 Analysis of H19 predicted target genes function |
2.3 斑马鱼组织中基因表达的差异性分析
为进一步验证三唑磷作用下斑马鱼中lncRNA Sox2OT和H19对靶基因的调控作用,利用荧光定量PCR技术对各基因表达的变化情况进行了分析 (图7)。与空白对照组相比,助剂组中各基因的表达均无显著差异。而在三唑磷处理组中,lncRNA Sox2OT、dre-miR-34a及其靶基因crybb1的表达量均呈下调趋势。其中,处理组斑马鱼crybb1基因的表达量约减少至空白对照的40%,差异极显著 (P < 0.01);lncRNA H19基因的表达量上调了1.41倍,而与其可能存在相互作用的dre-let-7c和dre-miR-145基因的表达量均显著下调,其中,dre-miR-145的靶基因 gata6和cul1b均未出现明显表达差异,而dre-let-7c的靶基因ddx18表达量上调了2.11倍。已有研究表明,ddx18基因对调控斑马鱼造血细胞的细胞周期具有关键作用[27]。结合相关文献[28]以及试验结果分析,在三唑磷作用下,斑马鱼lncRNA H19可能作为靶基因ddx18的竞争性内源RNA与dre-let-7c相互作用,从而调控靶基因ddx18的表达,进而对斑马鱼的生长发育产生重要影响。
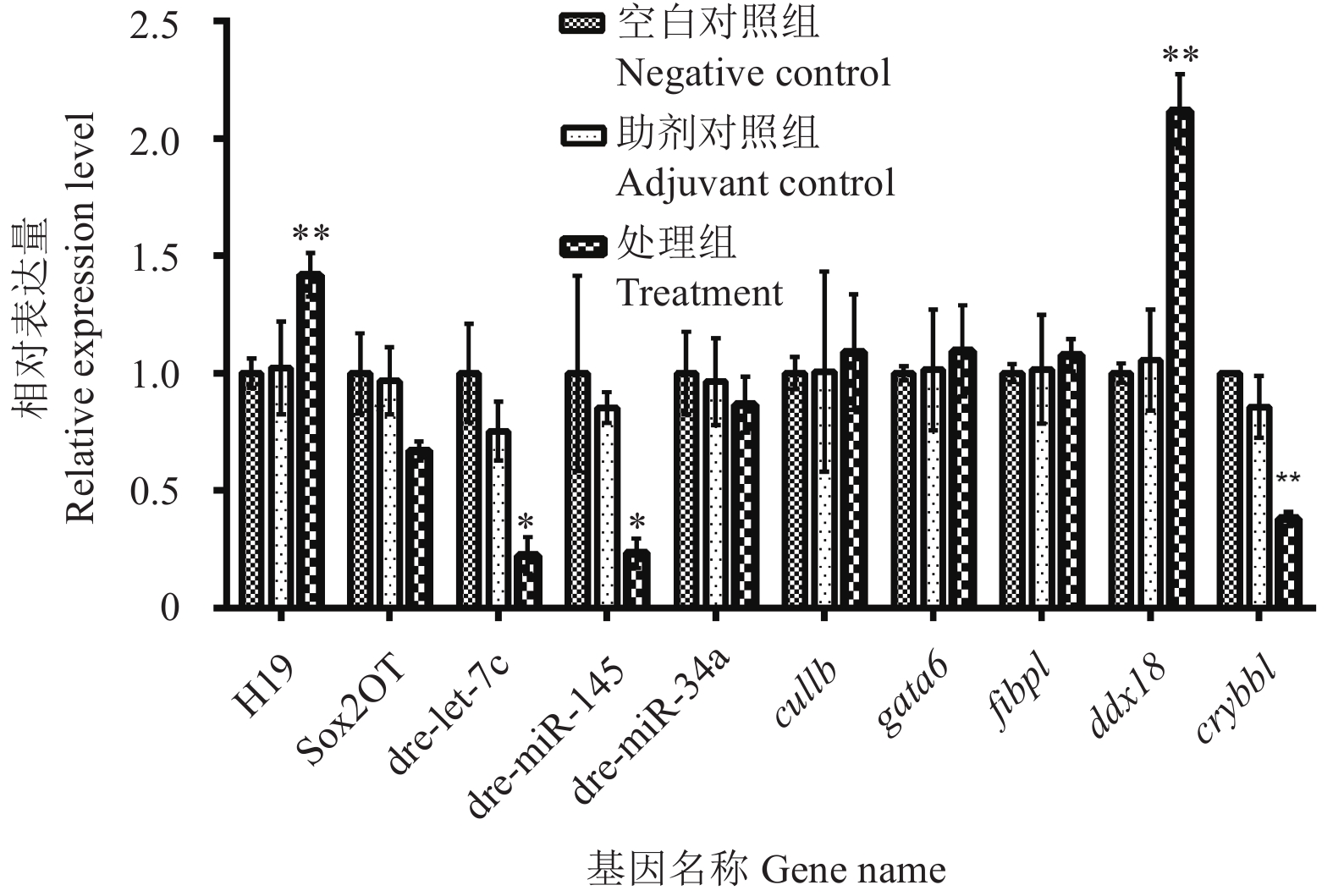
|
图 7 通过荧光定量PCR分析三唑磷处理前后斑马鱼中基因表达的变化 Fig. 7 The analysis of expression of genes in zebrafish after the triazophos treatment by qRT-PCR |
3 讨论与结论
大量研究表明,生物体在暴露于有毒化学物质及重金属等污染物后,其lncRNA会异常表达[29]。然而,关于环境化学物质诱导lncRNA表达变化后间接或直接调控靶基因的复杂机制目前尚不明确。已有研究证实,环境化学物质能够诱导生物体miRNA的异常表达,从而导致害虫对其的抗性,增加蜜蜂及鸟类等植物授粉媒介生物的死亡率,对哺乳动物的生殖系统等产生毒性,甚至间接提高癌症的发生率[30-33]。此外,水生生物暴露于含有机农药化合物的水体中,也会导致miRNA的异常表达,并对相关基因的表达造成影响[25]。例如,在氟虫腈的胁迫下,斑马鱼miR-155、miR-216和miR-499能够分别与cyb561d2基因相互作用,调控该基因的表达[34-35]。Jia等[9]通过双荧光素报告酶试验,证明了在三唑磷作用下,斑马鱼miR-217能够与核孔蛋白基因nup43结合以抑制其表达,从而影响大分子的核质转运以及细胞凋亡等生命过程。与miRNA相比,有关lncRNA在环境毒理学邻域的研究依然滞后,但已明确lncRNA在生物体的正常生长发育中具有至关重要的作用,其可作为靶基因的竞争性内源RNA与miRNA相互作用,间接影响靶基因的表达[14]。因此,探究lncRNA-miRNA-mRNA的相互作用关系,有助于研究环境化学物质在诱导lncRNA表达变化后是如何调控靶基因的这一分子毒理学机制。同时,目前斑马鱼数据库资源较少,其lncRNA信息也不够完善,仍需研究工作者深入探索。因此,利用人类lncRNA数据库筛选出在脊椎动物中高度保守的同源lncRNA,并通过试验初步分析其在斑马鱼中的功能和作用机制,为寻找和研究斑马鱼lncRNA提供了新的思路。
本研究运用芯片筛选和生物信息学软件预测,针对模式生物斑马鱼构建得到了lncRNA-miRNA-mRNA相互作用关系和调控网络布局。通过NCBI数据库比对并运用相关生物信息学软件,分析发现dre-miR-145和dre-let-7c在lncRNA H19的高度保守区可能存在结合位点。lncRNA H19在结肠及直肠癌中的表达显著上调,并可作为miR-138和miR-200a的竞争性内源RNA拮抗其功能,解除miRNA对靶基因的抑制作用,从而促进上皮至间充质转变[17]。本研究中,经三唑磷处理后斑马鱼lncRNA H19基因的表达上调了1.41倍,而与其可能存在相互作用的dre-let-7c和dre-miR-145基因的表达均显著下调,其中dre-let-7c的靶基因ddx18的表达量上调了2.11倍。因此,综合试验结果分析,推测在三唑磷作用下,斑马鱼lncRNA H19可能作为靶基因ddx18的竞争性内源RNA与dre-let-7c相互作用,从而调控靶基因ddx18的表达,影响核酸代谢、细胞凋亡、蛋白磷酸化以及代谢等过程,从而对斑马鱼产生毒性作用。
致谢:感谢浙江大学农药与环境毒理研究所提供斑马鱼及斑马鱼养殖系统。
| [1] |
王晓彬, 吴瑞梅, 凌晶, 等. 表面增强拉曼光谱法快速检测脐橙果肉中三唑磷农药残留[J]. 光谱学与光谱分析, 2016, 36(3): 736-742. WANG X B, WU R M, LING J, et al. Study on the rapid detection of triazophos residues in flesh of navel orange by using surface-enhanced Raman scattering[J]. Spectrosc Spectr Anal, 2016, 36(3): 736-742. |
| [2] |
SÁNCHEZ-SANTED F, COLOMINA M T, HERRERO HERNÁNDEZ E. Organophosphate pesticide exposure and neurodegeneration[J]. Cortex, 2016, 74: 417-426. DOI:10.1016/j.cortex.2015.10.003 |
| [3] |
SINGH M, RISHI S. Plasma acetylcholinesterase as a biomarker of triazophos neurotoxicity in Young and adult rats[J]. Environ Toxicol Pharmacol, 2005, 19(3): 471-476. DOI:10.1016/j.etap.2004.12.009 |
| [4] |
SINGH S, TIWARI R K, PANDEY R S. Evaluation of acute toxicity of triazophos and deltamethrin and their inhibitory effect on AChE activity in Channa punctatus
[J]. Toxicol Rep, 2018, 5: 85-89. DOI:10.1016/j.toxrep.2017.12.006 |
| [5] |
李红艳, 张喆, 陈海刚, 等. 三唑磷短期暴露对翡翠贻贝的毒性效应[J]. 南方水产科学, 2013, 9(5): 71-79. LI H Y, ZHANG Z, CHEN H G, et al. Toxic effects of short-term triazophos exposure on mussel Perna viridis [J]. South China Fish Sci, 2013, 9(5): 71-79. DOI:10.3969/j.issn.2095-0780.2013.05.012 |
| [6] |
罗朝晖, 黄煜, 洪彩熔. 三唑磷农药对鲫鱼肝脏过氧化氢酶活性的影响[J]. 安徽农业科学, 2007, 36: 11867-11868. LUO Z H, HUANG Y, HONG C R. Effect of the triazophos on the catalase activity of crucian (Carassus auratus) liver [J]. J Anhui Agric Sci, 2007, 36: 11867-11868. DOI:10.3969/j.issn.0517-6611.2007.36.075 |
| [7] |
NAVEED A, VENKATESHWARLU P, JANAIAH C. Impact of sublethal concentration of triazophos on regulation of protein metabolism in the fish Channa punctatus (Bloch)
[J]. J Neurosci Res, 2015, 88(2): 360-368. |
| [8] |
ZHU B, GONG Y X, LIU L, et al. Toxic effects of triazophos on rare minnow (Gobiocypris rarus) embryos and larvae
[J]. Chemosphere, 2014, 108: 46-54. DOI:10.1016/j.chemosphere.2014.03.036 |
| [9] |
JIA L, ZHANG D Y, HUANG H N, et al. Triazophos-induced toxicity in zebrafish: miRNA-217 inhibits nup43
[J]. Toxicol Res, 2018, 7(5): 913-922. DOI:10.1039/C8TX00065D |
| [10] |
OKAZAKI Y, FURUNO M, KASUKAWA T, et al. Analysis of the mouse transcriptome based on functional annotation of 60, 770 full-length cDNAs[J]. Nature, 2002, 420(6915): 563-573. DOI:10.1038/nature01266 |
| [11] |
乔嘉凯, 张丹燕, 周胜利, 等. 斑马鱼长链非编码 RNA 的研究进展[J]. 生命科学, 2018, 30(8): 822-830. QIAO J K, ZHANG D Y, ZHOU S L, et al. Research progress in long non-coding RNAs of zebrafish[J]. Chin Bull Life Sci, 2018, 30(8): 822-830. |
| [12] |
DEMPSEY J L, CUI J Y. Long non-coding RNAs: a novel paradigm for toxicology[J]. Toxicol Sci, 2017, 155(1): 3-21. DOI:10.1093/toxsci/kfw203 |
| [13] |
HUANG Q, LIU Y, DONG S. Emerging roles of long non-coding RNAs in the toxicology of environmental chemicals[J]. J Appl Toxicol, 2018, 38(7): 934-943. DOI:10.1002/jat.v38.7 |
| [14] |
YE S, YANG L, ZHAO X, et al. Bioinformatics method to predict two regulation mechanism: TF-miRNA-mRNA and lncRNA-miRNA-mRNA in pancreatic cancer[J]. Cell Biochem Biophys, 2014, 70(3): 1849-1858. DOI:10.1007/s12013-014-0142-y |
| [15] |
LI H, YU B Q, LI J F, et al. Overexpression of lncRNA H19 enhances carcinogenesis and metastasis of gastric cancer[J]. Oncotarget, 2014, 5(8): 2318-2329. |
| [16] |
YANG S, LEI Y. Transgenerational pancreatic impairment with Igf2/H19 epigenetic alteration induced by p,p’-DDE exposure in early life
[J]. Toxicol Lett, 2017, 280: 222-231. DOI:10.1016/j.toxlet.2017.08.083 |
| [17] |
LIANG W C, FU W M, WONG C W, et al. The lncRNA H19 promotes epithelial to mesenchymal transition by functioning as miRNA sponges in colorectal cancer[J]. Oncotarget, 2015, 6(26): 22513-22525. |
| [18] |
ZHOU X Y, YE F, YIN C Q, et al. The interaction between MiR-141 and lncRNA-H19 in regulating cell proliferation and migration in gastric cancer[J]. Cell Physiol Biochem, 2015, 36(4): 1440-1452. DOI:10.1159/000430309 |
| [19] |
ANDREW T, MANIATIS N, CARBONARO F, et al. Identification and replication of three novel myopia common susceptibility gene loci on chromosome 3q26 using linkage and linkage disequilibrium mapping[J]. PLoS Genet, 2008, 4(10): e1000220. DOI:10.1371/journal.pgen.1000220 |
| [20] |
AMARAL P P, NEYT C, WILKINS S J, et al. Complex architecture and regulated expression of the Sox2ot locus during vertebrate development[J]. RNA, 2009, 15(11): 2013-2027. DOI:10.1261/rna.1705309 |
| [21] |
TOSETTI V, SASSONE J, FERRI A L M, et al. Transcriptional role of androgen receptor in the expression of long non-coding RNA Sox2OT in neurogenesis[J]. Plos One, 2017, 12(7): e0180579. DOI:10.1371/journal.pone.0180579 |
| [22] |
李正龙, 徐艺, 冷开明, 等. 长链非编码 RNA SOX2OT 在肿瘤中的调控作用及对预后的影响[J]. 现代肿瘤医学, 2018, 26(14): 2290-2293. LI Z L, XU Y, LENG K M, et al. Regulatory role of lncRNA SOX2OT in neoplasms and intervention of prognosis[J]. J Mod Oncol, 2018, 26(14): 2290-2293. DOI:10.3969/j.issn.1672-4992.2018.14.037 |
| [23] |
KERSTIN H, CLARK M D, TORROJA C F, et al. The zebrafish reference genome sequence and its relationship to the human genome[J]. Nature, 2013, 496(7446): 498-503. DOI:10.1038/nature12111 |
| [24] |
ZON L I, PETERSON R T. In vivo drug discovery in the zebrafish
[J]. Nat Rev Drug Discov, 2005, 4(1): 35-44. DOI:10.1038/nrd1606 |
| [25] |
WANG X X, ZHOU S L, DING X F, et al. Effect of triazophos, fipronil and their mixture on miRNA expression in adult zebrafish[J]. J Environ Sci Heal (Part B), 2010, 45(7): 648-657. DOI:10.1080/03601234.2010.502435 |
| [26] |
LIU H, LI J, KOIRALA P, et al. Long non-coding RNAs as prognostic markers in human breast cancer[J]. Oncotarget, 2016, 7(15): 20584-20596. |
| [27] |
PAYNE E M, BOLLI N, RHODES J, et al. Ddx18 is essential for cell-cycle progression in zebrafish hematopoietic cells and is mutated in human AML[J]. Blood, 2011, 118(4): 903-915. DOI:10.1182/blood-2010-11-318022 |
| [28] |
ZHU M J, CHEN Q, LIU X, et al. LncRNA H19/miR-675 axis represses prostate cancer metastasis by targeting TGFBI[J]. FEBS J, 2014, 281(16): 3766-3775. DOI:10.1111/febs.2014.281.issue-16 |
| [29] |
张丹燕, 贾龙略, 郭江峰. 长链非编码 RNA 在毒理学领域的研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(6): 696-700. ZHANG D Y, JIA L, GUO J F. Reseach progress in long non-coding RNA and its toxicology[J]. Chin J Pharmacol Toxicol, 2017, 31(6): 696-700. DOI:10.3867/j.issn.1000-3002.2017.06.029 |
| [30] |
CHANYSHEV M D, KOSOROTIKOV N I, TITOV S E, et al. Expression of microRNAs, CYP1A1 and CYP2B1 in the livers and ovaries of female rats treated with DDT and PAHs
[J]. Life Sci, 2014, 103(2): 95-100. DOI:10.1016/j.lfs.2014.03.031 |
| [31] |
HALLMANN C A, FOPPEN R P B, VAN TURNHOUT C A M, et al. Declines in insectivorous birds are associated with high neonicotinoid concentrations[J]. Nature, 2014, 511(7509): 341-343. DOI:10.1038/nature13531 |
| [32] |
HONG S C, GUO Q, WANG W J, et al. Identification of differentially expressed microRNAs in Culex pipiens and their potential roles in pyrethroid resistance
[J]. Insect Biochem Mol Biol, 2014, 55: 39-50. DOI:10.1016/j.ibmb.2014.10.007 |
| [33] |
HUANG F, CHEN Z F, CHEN H W, et al. Cypermethrin promotes lung cancer metastasis via modulation of macrophage polarization by targeting MicroRNA-155/bcl6[J]. Toxicol Sci, 2018, 163(2): 454-465. DOI:10.1093/toxsci/kfy039 |
| [34] |
HUANG H N, ZHANG K, ZHOU Y Y, et al. MicroRNA-155targetscyb561d2 in zebrafish in response to fipronil exposure[J]. Environ Toxicol, 2016, 31(7): 877-886. DOI:10.1002/tox.v31.7 |
| [35] |
ZHOU Y, HUANG H, ZHANG K, et al. miRNA-216 and miRNA-499 target cyb561d2 in zebrafish in response to fipronil exposure
[J]. Environ Toxicol Pharmacol, 2016, 45: 98-107. DOI:10.1016/j.etap.2016.05.019 |
 2019, Vol. 21
2019, Vol. 21


