2. 辽宁省生物农药工程技术研究中心,沈阳 110866
2. Engineering & Technological Research Center of Biopesticide, Shenyang 110866, China
灰霉病是一种在世界范围内广泛发生的病害,每年由灰霉病造成的经济损失可达20%~40%,严重者达60%[1]。目前,灰霉病仍以化学农药防治为主,常用的杀菌剂主要有二甲酰亚胺类、苯并咪唑类及苯胺基嘧啶类的嘧霉胺、啶酰菌胺和咯菌腈等[2-3]。采用化学农药防治虽然取得了一定的防治效果,但其带来的残留和抗药性问题已引起社会和国内外有关专家的高度重视。开发高效、低毒及对环境安全的生物农药,已成为农药研发的主要途径之一[4]。
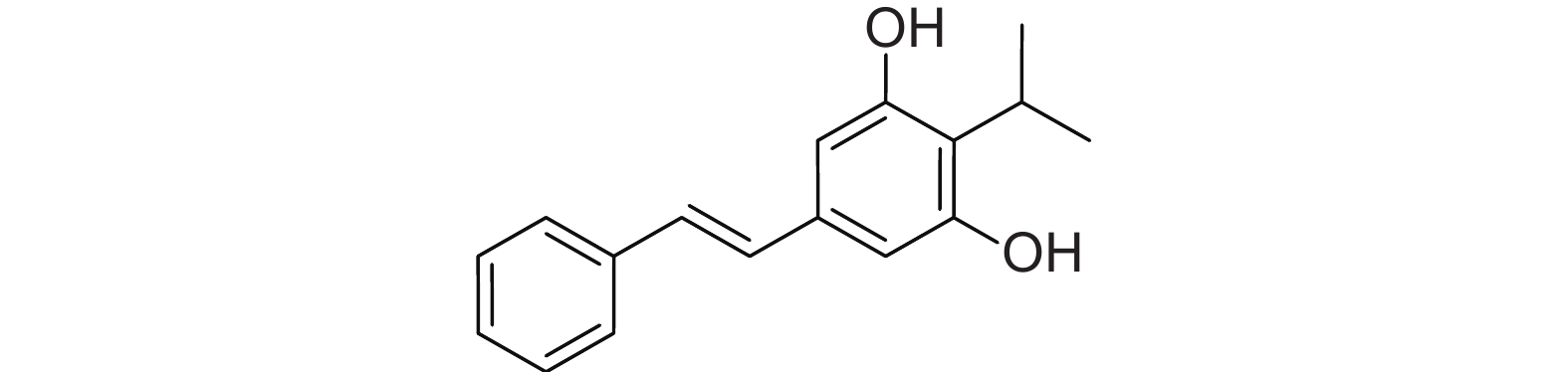
发光杆菌Photohabdus temperata是寄生于异小杆线虫属 (Heterorhabditis) 肠道内的共生菌,通过线虫进入昆虫体内后可大量繁殖,并与线虫一起杀死寄主[5]。目前从发光杆菌属的次生代谢产物中分离得到的化合物主要包括4类,分别是碳青霉烯类 (carbapenems)、蒽醌类 (anthraquinones)、儿茶酚亲铁物质 (photobactin) 和二苯乙烯类 (stilbene)。众多学者分离得到的二苯乙烯类化合物isopropylstilbene,其化学名称为3,5-二羟基-4-异丙基二苯乙烯 (结构式见图式1),具有广泛的生物活性。在医药方面,isopropylstilbene可抑制热带疾病中的原生生物[6-7],可抑制肿瘤细胞的增殖活性[8],可治疗银屑病、免疫和炎症等疾病[9-11]。在农药方面,isopropylstilbene可抗革兰氏阳性菌[12-13]、线虫[14]和真菌[15-17]。Li等[15]研究发现,isopropylstilbene对灰葡萄孢有较强的抑制作用,其MIC值为12 μg/mL。
|
图式1 isopropylstilbene的化学结构 Scheme1 Structural formula of isopropylstilbene |
尽管isopropylstilbene可以通过化学合成得到,但合成方法过于复杂,且收率低、分离纯化困难[6-7]。鉴于此,本研究利用固相萃取及柱层析等技术,从发光杆菌Photohabdus temperata SN35的发酵液中分离纯化得到了isopropylstilbene,采用核磁共振氢谱及高效液相色谱对其结构和纯度进行了确定。结合单因素试验、Plackett-Burman试验和响应面法对发光杆菌SN 35的摇瓶发酵培养条件进行了优化,并通过菌丝生长速率法、凹玻片法和盆栽试验法初步探究了isopropylstilbene对灰葡萄孢菌的抑菌活性以及对灰霉病的防治效果。
1 材料与方法 1.1 供试材料 1.1.1 供试菌株和主要仪器发光杆菌Photohabdus temperata SN35和灰葡萄孢Botrytis cinerea,保存于沈阳农业大学植物保护学院微生物次生代谢产物研究室。
LC-1260高效液相色谱仪,安捷伦公司;AV-600 Hz核磁共振仪,德国Bruker公司;N-1100 旋转蒸发仪,上海爱朗仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器,上海博讯实业有限公司;ZQZY-70FC振荡培养箱,上海知楚仪器有限公司;QUINTIX244-1CN分析天平,赛多利斯有限公司。
1.1.2 试剂及培养基L-亮氨酸和叔丁基对苯二酚 (TBHQ),上海麦克林生化有限公司;甲醇 (分析纯),德国Sigma公司;isopropylstilbene标准品,沈阳农业大学植物保护学院微生物次生代谢产物研究室;98.5%百菌清 (chlorothalonil) 原药,山东潍坊丰化工股份有限公司;柱层析硅胶 (48~74 μm),青岛海洋化工厂;SephadexTM LH-20柱层析凝胶,瑞典Pharmacia公司;XAD-16大孔树脂,罗门哈斯国际贸易有限公司;苯丙氨酸、脯氨酸、石油醚 (沸程为60~90 ℃) 及其他分离用有机溶剂均为国药集团化学试剂有限公司产品。
NBTA培养基:牛肉膏3.0 g/L,蛋白胨10.0 g/L,氯化钠5.0 g/L,琼脂粉15.0 g/L,氯化三苯基四氮唑 (TTC) 0.040 g/L,溴百里酚蓝 (BTB) 0.025 g/L,蒸馏水1 L,pH 值7.0。
LB 培养基:胰蛋白胨 10.0 g/L,酵母提取物5.0 g/L,氯化钠 10.0 g/L,蒸馏水 1.0 L,pH 值7.0。
M培养基:葡萄糖6.13 g/L,蛋白胨21.29 g/L,硫酸镁1.50 g/L,硫酸铵 2.46 g/L,磷酸二氢钾0.86 g/L,磷酸氢二钾1.11 g/L,硫酸钠1.72 g/L,蒸馏水1.00 L,pH 值7.2~7.6。
PDA培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,蒸馏水1 L。
1.2 试验方法 1.2.1 化合物的分离纯化及结构鉴定参考SHI等[17]的方法进行化合物的分离纯化。将保存于 –80 ℃条件下的发光杆菌SN35均匀涂布在NBTA培养基上,在28 ℃培养48 h得到蓝色单菌落。用接种环挑取一个单菌落接种于5 mL液体LB培养基中,于180 r/min、28 ℃的恒温摇床上培养18 h,得到种子发酵液;将种子发酵液按5%的接种量接种于含400 mL M培养基的2 L三角瓶中,总发酵量为48 L,再置于180 r/min、28 ℃的恒温摇床上培养120 h得到发酵液。将发酵液在室温及12000 r/min下离心12 min,除去菌体,收集上清液。向上清液中加入5%的大孔树脂,静态吸附4 h后将大孔树脂取出,于30 ℃烘箱中充分烘干。将烘干的大孔树脂用甲醇浸泡3~4次,每次5 L,每次浸泡4~5 h,收集甲醇液并减压浓缩成固体。将固体用V(甲醇) : V(水) = 1 : 1的溶液再次溶解,用相同体积的二氯甲烷萃取3次,收集有机相并减压浓缩,得到12.90 g棕色浸膏。将得到的浸膏分2次用正相硅胶柱 (350 mm × 30 mm (i.d.)) 分离纯化,依次用V(石油醚) : V(乙酸乙酯) = 100 : 5、100 : 10、100 : 20、100 : 30、100 : 40和0 : 100的混合溶液进行梯度洗脱,每个梯度使用3 L,得到5个组分 (A1~A5)。将A2组分进行3次Sephadex LH-20凝胶柱层析[V(石油醚) : V(二氯甲烷) : V(甲醇) = 2 : 1 : 1],得到目标化合物W。
通过核磁共振氢谱 (1H NMR) 对化合物W的结构进行确证,并采用高效液相色谱测定其纯度,与isopropylstilbene标准品进行比对。
高效液相色谱检测条件:Agilent ZORBAX Eclipse XDB色谱柱 (4.60 mm × 250 mm,5 μm);流动相为V(68% 甲醇水溶液) : V(甲酸) = 1 000 : 1;进样体积10 µL;流速1.0 mL/min,柱温30~39 ℃;检测波长247 nm。
1.2.2 培养条件优化 1.2.2.1 单因素试验采用单因素对照法,分别通过改变M培养基中的碳源、氮源和添加氯化钠、氨基酸 (苯丙氨酸、亮氨酸和脯氨酸) 探寻不同因素对发酵产物中isopropylstilbene产量的影响。
1.2.2.2 Plackett-Burman试验根据单因素试验的结果,利用Plackett-Burman试验设计方法[18],选取试验次数N = 12对发酵培养基中亮氨酸、苯丙氨酸、氯化钠、葡萄糖、蛋白胨和温度6个因素进行试验分析,以化合物isopropylstilbene的产量为响应值,依次设为X1、X2、X3、X5、X6和X7共6项,设X4为空白对照,作为误差分析项。试验数据皆采用Minitab17软件分析。
1.2.2.3 响应面法分析结合单因素试验和Plackett-Burman试验结果,采用Design-Expert Version 8.0对蛋白胨和氯化钠进行2因素3水平的中心组合试验 (CCD)[19]设计。
1.2.3 抑菌活性试验 1.2.3.1 isopropylstilbene对灰葡萄孢菌丝生长的抑制作用采用菌丝生长速率法[20]测定。将所分离的化合物W和对照药剂百菌清分别溶于V(丙酮) : V(吐温-80) = 1 : 1中,配成5 000 μg/mL的母液,吸取不同体积的母液添加至PDA培养基中制成质量浓度分别为50、25、12.5、6.25和3.125 μg/mL的含药平板。以只含V(丙酮) : V(吐温-80) = 1 : 1混合溶剂的培养基为空白对照。在PDA平板中分别接入直径为6 mm的灰葡萄孢菌饼,25 ℃培养4~5 d后采用十字交叉法测量空白对照菌落直径Dc,药剂处理菌落直径Dt。采用 (1) 式计算菌丝生长抑制率,再用SPSS (v.22, SPSS, USA) 计算isopropylstilbene的毒力回归方程、相关系数及EC50值。将空白对照和用50 μg/mL isopropylstilbene处理的菌丝分别制成玻片于显微镜下观察菌丝形态的变化。
| $ I/{\text{%}}= \frac{{D_{\rm{c}} - D_{\rm{t}}}}{{D_{\rm{c}} - 6}} \times 100 $ | (1) |
式中:I为菌丝生长抑制率;Dc为空白对照菌落直径,Dt为药剂处理菌落直径。
1.2.3.2 isopropylstilbene对灰葡萄孢孢子萌发的抑制作用采用凹玻片法[21]测定。用无菌水将灰葡萄孢孢子制成浓度为2 × 105个/mL的孢子悬浮液。将10 μg/mL的isopropylstilbene与孢子悬浮液等体积混匀作为试验组,以相同质量浓度的百菌清作为阳性对照,以蒸馏水作为空白对照。取60 μL滴加在凹玻片上,重复5次,将凹玻片架放于带有湿润滤纸片的培养皿中,于室温 (25 ℃) 下培养至空白对照萌发率大于80%时,观察各试验组孢子萌发数量,计算对孢子萌发的抑制率。
1.2.3.3 isopropylstilbene对灰霉病的防治效果5%的isopropylstilbene乳油的配制:将50 mg isopropylstilbene和10 mg叔丁基对苯二酚 (TBHQ) 溶于0.3 mL甲醇中,混匀;加入0.007 5 g农乳500与0.042 5 g农乳600,混匀;用DMSO定容至1.0 mL。以相同质量浓度的同样方法配制的5%百菌清乳油作为阳性对照,以相同质量浓度的TBHQ为空白对照。
1)黄瓜盆栽试验[22]。当黄瓜幼苗长至2片叶时,将不同药液均匀喷施于叶面至全部湿润,室温下自然通风24 h后,接种6 mm灰葡萄孢菌饼。于温度22 ℃、相对湿度80%~90%条件下培养。每次处理3盆,4次重复。不定期观察发病情况,待空白对照完全发病后从叶片背面测量病斑直径Dy,同时测量药剂处理组的病斑直径Dx,采用 (2) 式计算防治效果。
| $ E/{\text{%}}= \frac{{D_{\rm{y}} - D_{\rm{x}}}}{{D_{\rm{y}} - 6}} \times 100 $ | (2) |
式中:E为防治效果;Dy为空白对照病斑直径,Dx为药剂处理病斑直径。
2)番茄盆栽试验[23]。在番茄幼苗叶片长至30片左右时,将不同药液均匀喷施于叶面至全部湿润,室温下自然通风晾干24 h后,在叶面上喷施1 × 106个/mL的孢子悬浮液。于温度22 ℃、相对湿度80%~90%条件下培养,每处理3盆,4次重复,不定期观察发病情况,待空白对照发病后,根据病情指数分级标准[21],调查所有番茄叶片病情指数,计算防治效果。
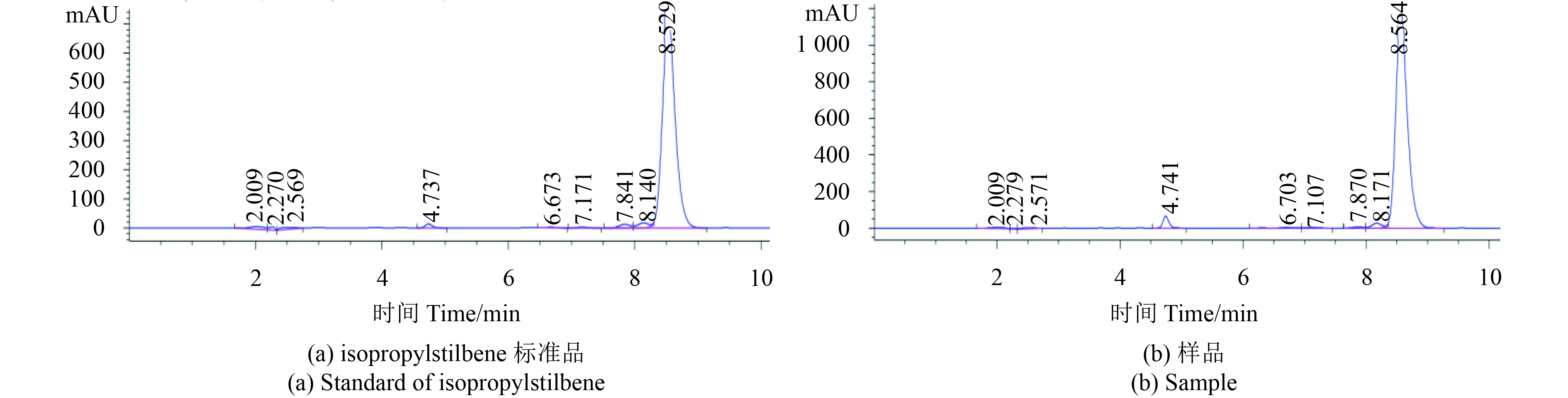
2 结果与分析 2.1 isopropylstilbene的结构鉴定及纯度测定isopropylstilbene,无色晶体,熔点为134.6~136.0 ℃;1H NMR (600 MHz, CDCl3) 测定结果为:δH 7.48 (d, J = 7.5 Hz, 2H) , 7.36 (t, J = 7.5 Hz, 2H) , 7.27 (t, J = 7.3 Hz, 1H) , 6.97-7.01 (m, 1H), 6.89-6.93 (m, 1H) , 6.51 (s, 2H) , 4.91 (s, 2H) , 3.44-3.51 (m, 1H) , 1.40 (d, J = 7.1 Hz, 6H),该数据与Paul等[24]报道的数据基本一致。此外,在所设定的色谱条件下对所分离的化合物进行检测,确定其纯度为93%;经与isopropylstilbene标准品的色谱图比对 (见图1),确证所分离化合物为isopropylstilbene。
|
图 1 isopropylstilbene标准品和样品高效液相谱图 Fig. 1 HPLC chromatograms of standard of isopropylstilbene and sample |
2.2 发酵培养基主要成分的筛选
各因素的添加量见表1。从中可知,当以葡萄糖作为M培养基的碳源时,其发酵液中isopropylstilbene的产量高于以蔗糖和淀粉作为碳源时isopropylstilbene的产量,因此葡萄糖应为该培养基的最佳碳源;当以蛋白胨作为M培养基的氮源时,其发酵液中isopropylstilbene的产量高于以酵母浸粉、牛肉膏和胰蛋白胨作为氮源时的产量,因此蛋白胨应为该培养基的最佳氮源;在基础培养基中添加氯化钠和亮氨酸时isopropylstilbene的产量均有较大的提高。
|
|
表 1 在M培养基中添加不同碳源、氮源、氨基酸和氯化钠时发酵液中isopropylstilbene产量 Table 1 isopropylstilbene yield in the fermentation broth when different carbon sources, nitrogen sources, amino acid and sodium chloride were added to M medium |
2.3 Plackett-Burman试验结果分析
使用Minitab17软件对Plackett-Burman试验结果 (表2) 进行回归分析,得到回归方程:Y= 0.048 83 + 0.001 33X1 – 0.008 67 X2 + 0.010 33X3 + 0.000 83X4 – 0.006 67 X5 + 0.011 50X6 + 0.005 50X7,且R2 = 0.891 1,表明预测值与试验值拟合度较好。对该试验结果进行方差分析 (表3),若P值小于0.05,表明该因素对发光杆菌SN35发酵液中isopropylstilbene的产量有显著影响;若P值大于0.05,则表明该因素影响不显著。由表3数据可知,氯化钠和蛋白胨是对isopropylstilbene产量影响最显著的因素。
|
|
表 2 Plackett-Burman试验设计及结果 Table 2 Experimental design and results of Plackett-Burman design |
|
|
表 3 Plackett-Burman试验设计的效应分析 Table 3 Evaluation for the effect of Plackett-Burman design |
2.4 响应面法设计与结果分析
|
|
表 4 响应面法试验设计因素水平 Table 4 Factors and levels of response surface design |
|
|
表 5 响应面法试验设计及结果 Table 5 Experimental design and results of response surface design |
用Design Expert 8.0软件对试验结果进行分析,经二次回归拟合后,得到2个因素与isopropylstilbene产量之间的模拟方程为:Y = + 14.784 63 + 2.140 72A + 22.285 49B – 0.072 500 AB – 0.028 931 A2 – 3.298 28 B2。
对该模型进行方差分析,由结果 (表6) 可知,该回归模型的显著性显著,R2 = 0.943 2,表明该模型拟合度好,可以良好地预测试验值。由表6还可知,B2对isopropylstilbene的产量有极显著的影响,A对isopropylstilbene产量有显著影响,其他一次项和交互性对isopropylstilbene产量影响不显著。
|
|
表 6 方差分析结果 Table 6 ANOVA (analysis of variance) of regression model |
为了更直观地表现蛋白胨和氯化钠之间的交互关系,使用Design Expert 8.0绘制出2个因素间的三维图和等高线图 (图2)。用该模型预测蛋白胨和氯化钠的最优值分别为33.23和3.01 g/L,即优化后的M培养基成分为:葡萄糖6.13 g/L,蛋白胨33.23 g/L,硫酸镁1.50 g/L,硫酸铵 2.46 g/L,磷酸二氢钾0.86 g/L,磷酸氢二钾1.11 g/L,硫酸钠1.72 g/L,亮氨酸3.00 g/L,氯化钠3.01 g/L,蒸馏水1 L,pH 值7.2~7.6,此时isopropylstilbene产量为83.92 mg/L。为了探究模型的准确性,使用M培养基进行摇瓶发酵试验后得到isopropylstilbene的产量为38.80 mg/L,使用优化后的M培养基得到isopropylstilbene的产量为86.31 mg/L,说明该模型可以很好地预测发光杆菌发酵液中isopropylstilbene的产量,且比优化前提高了2.22倍。

|
图 2 蛋白胨和氯化钠之间的响应面图 (a) 和等高线图 (b) Fig. 2 Response surface graph (a) and the contour map (b) between peptone and sal communis |
2.5 抑菌活性及对灰霉病的防治效果
由菌丝生长速率法试验结果表明,isopropylstilbene对灰葡萄孢菌丝的生长具有较强的抑制作用,其EC50值为9.17 ± 0.17 µg/mL (Y = 1.690 3X + 3.373 4,R2 = 0.9804),但低于对照百菌清 (EC50值为0.90 ± 0.08 µg/mL)。进一步将菌丝制成玻片标本放在显微镜下进行观察,可看到处理组较空白节间增长,增粗,分枝减少,分生孢子减少,顶端缢缩 (图3)。

|
图 3 未经处理 (a) 和经 50 µg/mL isopropylstilbene 处理 (b) 的番茄灰霉病菌菌丝显微镜图 (10×40) Fig. 3 Microscopic image of mycelium of Botrytis cinerea untreated (a) and treated with 50 μg/mL isopropylstilbe (b) (10×40) |
凹玻片法测定结果表明,在10 µg/mL下,isopropylstilbene对灰葡萄孢孢子萌发的抑制率为63.01% (百菌清为100%)。
盆栽试验结果 (表7) 表明,在有效成分质量浓度为200 µg/mL下,5% isopropylstilbene乳油对黄瓜灰霉病的防治效果达92.19%,与百菌清的防治效果 (97.63%) 相当;对番茄灰霉病的防治效果为72.12%,略低于百菌清 (81.61%) 。
|
|
表 7 在黄瓜和番茄盆栽试验中isopropylstilbene对灰霉病的防治效果 Table 7 Control effect of isopropylstilbene on gray mould in pot experiment of cucumber and tomato |
3 结论与讨论
利用固相萃取及柱层析等技术,从发光杆菌SN35的发酵液中分离得到1个化合物,经核磁共振氢谱测定并与文献数据比对,确认该化合物为isopropylstilbene;经高效液相色谱检测,其纯度为93%。
通过单因素试验、Plackett-Burman试验和响应面法对发光杆菌SN 35的摇瓶发酵培养条件进行了优化。Himabindu等[25]探究了氯化钠对棘孢小单孢菌发酵产生庆大霉素产量的影响,结果表明,当氯化钠的添加量 (质量分数) 为0.2%~0.4%时,庆大霉素的产量明显提高。本研究的单因素试验结果显示,在M培养基中添加3.01 g/L的氯化钠有助于isopropylstilbene产量的提高。亮氨酸和苯丙氨酸是isopropylstilbene合成的前体物质[26],本研究的单因素试验结果表明,在M培养基中添加亮氨酸,可大大提高isopropylstilbene的产量,但添加苯丙氨酸,isopropylstilbene的产量却减少了,其原因有待进一步探究。优化后的M培养基组成为:葡萄糖6.13 g/L,蛋白胨33.23 g/L,硫酸镁1.50 g/L,硫酸铵2.46 g/L,磷酸二氢钾0.86 g/L,磷酸氢二钾1.11 g/L,硫酸钠1.72 g/L,亮氨酸3.00g/L,氯化钠3.01 g/L及蒸馏水1 L,pH值7.2~7.6。isopropylstilbene产量比优化前提高了2.22倍。
生物测定结果表明,isopropylstilbene对灰葡萄孢的菌丝生长和孢子萌发均具有较好的抑制作用,在黄瓜盆栽和番茄盆栽试验中其对灰霉病也具有良好的防治效果,这展示了isopropylstilbene在植物病原真菌的防治方面具有潜在价值,可继续进行田间防治效果及其对其他病原真菌的活性研究。
| [1] |
纪军建, 张小风, 王文桥, 等. 番茄灰霉病防治研究进展[J]. 中国农学通报, 2012, 28(31): 109-113. GI J J, ZHANG X F, WANG W Q, et al. Research progress on control of tomato gray mold[J]. Chinese Agric Sci Bull, 2012, 28(31): 109-113. DOI:10.3969/j.issn.1000-6850.2012.31.020 |
| [2] |
赵建江, 王文桥, 马志强, 等. 两种新杀菌剂对番茄灰霉病的作用方式及田间防效[J]. 中国蔬菜, 2016(5): 18-21. ZHAO J J, WANG W Q, MA Z Q, et al. Action mode and field control efficiency of two new fungicides against tomato gray mould[J]. China Vegetables, 2016(5): 18-21. DOI:10.3969/j.issn.1000-6346.2016.05.008 |
| [3] |
纪军建, 张小风, 韩秀英, 等. 8种杀菌剂对番茄灰霉病菌的毒力及田间番茄灰霉病菌对咯菌腈的敏感性[J]. 植物保护, 2012, 38(6): 144-146. JI J J, ZHANG X F, HAN X Y, et al. Fungitoxicity of eight fungicides against Botrytis cinerea and the sensitivity of field strains to fludioxonil [J]. Plant Prot, 2012, 38(6): 144-146. DOI:10.3969/j.issn.0529-1542.2012.06.032 |
| [4] |
张新虎, 何静, 沈慧敏. 苍耳提取物对番茄灰霉病菌的抑制作用及抑菌机理初探[J]. 草业学报, 2008, 17(3): 99-104. ZHANG X H, HE J, SHEN H M. Primary study on fungistasis and fungistatic mechanisms of Xanthium sibiricum on Botrytis cinerea [J]. Acta Prataculturae Sinica, 2008, 17(3): 99-104. DOI:10.3321/j.issn:1004-5759.2008.03.015 |
| [5] |
FORST S, NEALSON K. Molecular biology of the symbiotic-pathogenic bacteria Xenorhabdus spp.
[J]. Microbiol Rev, 1996, 60(1): 21-43. |
| [6] |
KRONENWERTH M, BRACHMANN A O, KAISER M, et al. Bioactive derivatives of isopropylstilbene from mutasynthesis and chemical synthesis[J]. Chembiochem, 2014, 15(18): 2689-2691. DOI:10.1002/cbic.v15.18 |
| [7] |
KRONENWERTH M, DAUTH C, KAISER M, et al. Facile synthesis of cyclohexanediones and dialkylresorcinols-bioactive natural products from entomopathogenic bacteria[J]. Eur J Org Chem, 2014, 2014(36): 8026-8028. DOI:10.1002/ejoc.201403346 |
| [8] |
BUSCATÓ E, BÜTTNER D, BRÜGGERHOFF A, et al. From a multipotent stilbene to soluble epoxide hydrolase inhibitors with antiproliferative properties[J]. ChemMedChem, 2013, 8(6): 919-923. DOI:10.1002/cmdc.201300057 |
| [9] |
BISSONNETTE R, POULIN Y, ZHOU Y, et al. Efficacy and safety of topical WBI-1001 in patients with mild to severe atopic dermatitis: results from a 12-week, multicentre, randomized, placebo-controlled double-blind trial[J]. Br J Dermatol, 2012, 166(4): 853-860. DOI:10.1111/bjd.2012.166.issue-4 |
| [10] |
CHEN G, LI J, LIU W, et al. Novel bioactive diphenyl ethene compounds and their therapeutic applications: WO2004031117A1[P/OL]. 2004-04-15. http://www.google.com/patents/WO2004031117A1?cl=en.
|
| [11] |
CHEN G, WEBSTER J M, LI J, et al. Anti-inflammatory and psoriasis treatment and protein kinase inhibition by hydroxy stilbenes and novel stilbene derivatives and analogues: US 007868047B2[P/OL]. 2011-01-11. http://www.google.com/patents/US7868047.
|
| [12] |
HU K J, LI J X, LI B, et al. A novel antimicrobial epoxide isolated from larval Galleria mellonella infected by the ematode symbiont, Photorhabdus luminescens (Enterobacteriaceae)
[J]. Bioorg Med Chem, 2006, 14(13): 4677-4681. DOI:10.1016/j.bmc.2006.01.025 |
| [13] |
PARK H B, CRAWFORD J M. Lumiquinone A, an α-aminomalonate-derived aminobenzoquinone from Photorhabdus luminescens
[J]. J Nat Prod, 2015, 78(6): 1437-1441. DOI:10.1021/np500974f |
| [14] |
CHALLINOR V L, BODE H B. Bioactive natural products from novel microbial sources[J]. Ann N Y Acad Sci, 2015, 1354: 82-97. DOI:10.1111/nyas.2015.1354.issue-1 |
| [15] |
LI J, CHEN G, WU H, et al. Identification of two pigments and a hydroxystilbene antibiotic from Photorhabdus luminescens
[J]. Appl Environ Microbiol, 1995, 61(12): 4329-4333. |
| [16] |
KUMAR S N, SIJI J V, RAJASEKHARAN K N, et al. Bioactive stilbenes from a Bacillus sp. N strain associated with a novel rhabditid entomopathogenic nematode
[J]. Lett Appl Microbiol, 2012, 54(5): 410-417. DOI:10.1111/lam.2012.54.issue-5 |
| [17] |
SHI D S, AN R, ZHANG W B, et al. Stilbene derivatives from Photorhabdus temperata SN259 and their antifungal activities against Phytopathogenic fungi
[J]. J Agric Food Chem, 2017, 65(1): 60-65. DOI:10.1021/acs.jafc.6b04303 |
| [18] |
KUMAR V, BHALLA A, RATHORE A S. Design of experiments applications in bioprocessing: concepts and approach[J]. Biotechnol Prog, 2014, 30(1): 86-99. DOI:10.1002/btpr.1821 |
| [19] |
MEAD R, PIKE D J. A review of response surface methodology from a biometric viewpoint[J]. Biometrics, 1975, 31(4): 803-851.
|
| [20] |
吴文君. 植物化学保护实验技术导论[M]. 西安: 陕西科学与技术出版社, 1987. WU W J. Introduction to experimental techniques of plant chemical protection[M]. Xi'an: Shaanxi Scientific and Technical Press,1987. |
| [21] |
方中达. 植病研究方法[M]. 3 版. 北京: 中国农业出版社, 1998:146-155. FANG Z D. Methodology on plant pathology research[M]. 3rd ed. Beijing: China Agriculture Press, 1998: 146-155. |
| [22] |
农药室内生物测定试验准则 杀菌剂第 9 部分: 抑制灰霉病菌试验 叶片法: NY/T 1156.9—2008[S]. 北京: 中国标准出版社, 2008. Guideline for laboratory bioassay of pesticides. Part 9: detached leaf test for fungicide control Botrytis cinerea Pers: NY/T 1156.9—2008[S]. Beijing: Standards Press of China, 2008. |
| [23] |
农药田间药效试验准则 (一) 杀菌剂防治蔬菜灰霉病: GB/T 17980.28—2000[S]. 北京: 中国标准出版社, 2000. Pesticide—Guidelines for the field efficacy trials(I): Fungicides against grey mould of vegetables: GB/T 17980. 28—2000[S]. Beijing: Standards Press of China, 2000. |
| [24] |
PAUL V J, FRAUTSCHY S, FENICAL W, et al. Antibiotics in microbial ecology: Isolation and structure assignment of several new antibacterial compounds from the insect-symbiotic bacteria Xenorhabdus spp.
[J]. J Chem Ecol, 1981, 7(3): 589-597. DOI:10.1007/BF00987707 |
| [25] |
HIMABINDU M, POTUMARTHI R, JETTY A. Enhancement of gentamicin production by mutagenesis and non-nutritional stress conditions in Micromonospora echinospora
[J]. Process Biochemistry, 2007, 42(9): 1352-1356. DOI:10.1016/j.procbio.2007.05.002 |
| [26] |
SHI YM, BODE H B. Chemical language and warfare of bacterial natural products in bacteria-nematode-insect interactions[J]. Nat Prod Rep, 2018, 35(4): 309-335. DOI:10.1039/C7NP00054E |
 2019, Vol. 21
2019, Vol. 21


