 草酮在稻田中的残留及消解动态
草酮在稻田中的残留及消解动态
2. 华中农业大学 植物科学技术学院,武汉 430070;
3. 河南联创化工有限公司,河南 济源 459000
 草酮残留的分析方法,结合田间试验研究了环戊
草酮残留的分析方法,结合田间试验研究了环戊 草酮在稻田中的残留及消解动态。结果表明:在0.01~1 mg/L范围内,环戊
草酮在稻田中的残留及消解动态。结果表明:在0.01~1 mg/L范围内,环戊 草酮的质量浓度与相应的峰面积间呈良好的线性关系。在0.02、0.05和0.5 mg/kg添加水平下,环戊
草酮的质量浓度与相应的峰面积间呈良好的线性关系。在0.02、0.05和0.5 mg/kg添加水平下,环戊 草酮在糙米、谷壳、稻秆、土壤和稻田水样品中的平均回收率在75%~95%之间,相对标准偏差在1.5%~9.5%之间,检出限 (LOD) 为0.01 ng,在糙米、谷壳、稻秆、土壤和稻田水中的最低检出浓度 (LOQ) 为0.02 mg/kg。浙江、山东和湖南3地2年的田间试验表明:环戊
草酮在糙米、谷壳、稻秆、土壤和稻田水样品中的平均回收率在75%~95%之间,相对标准偏差在1.5%~9.5%之间,检出限 (LOD) 为0.01 ng,在糙米、谷壳、稻秆、土壤和稻田水中的最低检出浓度 (LOQ) 为0.02 mg/kg。浙江、山东和湖南3地2年的田间试验表明:环戊 草酮在稻秆和土壤中的半衰期分别为4.2~9.0 d和7.0~11.6 d,其消解规律符合一级反应动力学方程。分别以有效成分含量375(低剂量) 和562.5 g/hm2(高剂量)2个剂量施用90 g/L环戊
草酮在稻秆和土壤中的半衰期分别为4.2~9.0 d和7.0~11.6 d,其消解规律符合一级反应动力学方程。分别以有效成分含量375(低剂量) 和562.5 g/hm2(高剂量)2个剂量施用90 g/L环戊 草酮悬浮剂1次,于收获成熟期采样检测发现,环戊
草酮悬浮剂1次,于收获成熟期采样检测发现,环戊 草酮在糙米中的最终残留量均小于0.02 mg/kg,该研究结果可为制定环戊
草酮在糙米中的最终残留量均小于0.02 mg/kg,该研究结果可为制定环戊 草酮在糙米中的最大残留限量值 (MRL) 提供数据支撑。
草酮在糙米中的最大残留限量值 (MRL) 提供数据支撑。 草酮
稻田
残留
消解
超高效液相色谱-串联质谱
草酮
稻田
残留
消解
超高效液相色谱-串联质谱
2. College of Plant Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;
3. Henan Lianchuang Chemical Co. Ltd., Jiyuan 459000, Henan Province, China
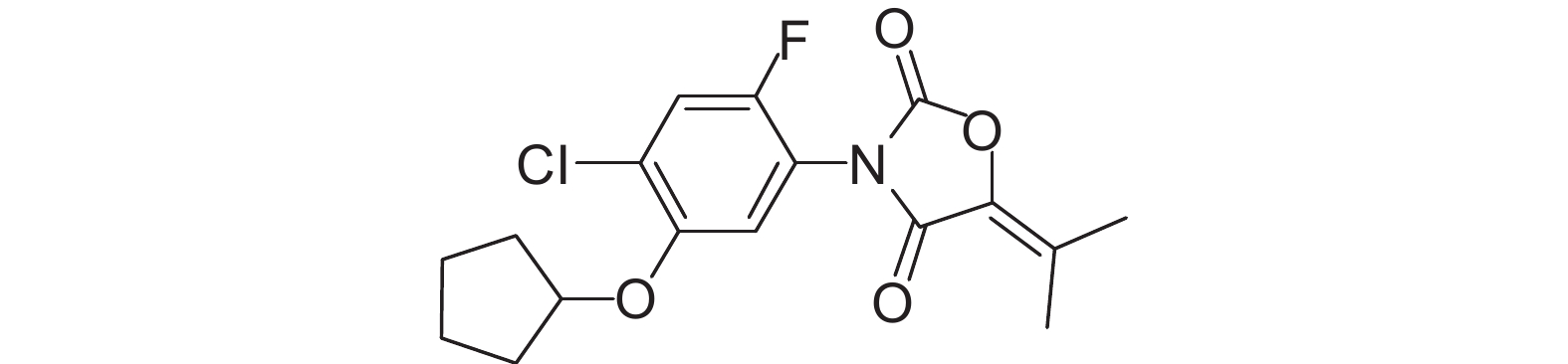
环戊 草酮 (图式1) 是1986年日本科研制药株式会社开发的一种
草酮 (图式1) 是1986年日本科研制药株式会社开发的一种 唑啉二酮类除草剂,其作用机制是抑制叶绿体生物合成过程中的原卟啉原氧化酶的活性,可有效防除稗草、鸭舌草、荸荠、陌上菜、雨久花及部分一年生莎草科杂草[1-4]。环戊
唑啉二酮类除草剂,其作用机制是抑制叶绿体生物合成过程中的原卟啉原氧化酶的活性,可有效防除稗草、鸭舌草、荸荠、陌上菜、雨久花及部分一年生莎草科杂草[1-4]。环戊 草酮具有低水溶性和强土壤吸附性,于稻田施用后可迅速扩散并吸附在土壤表层,具有持效期久的特点[5]。此外,由于水稻生长点位于土壤表层以下,且环戊
草酮具有低水溶性和强土壤吸附性,于稻田施用后可迅速扩散并吸附在土壤表层,具有持效期久的特点[5]。此外,由于水稻生长点位于土壤表层以下,且环戊 草酮不易被水稻吸收和传导,故对移栽水稻具有极高安全性[6]。2017年97%环戊
草酮不易被水稻吸收和传导,故对移栽水稻具有极高安全性[6]。2017年97%环戊 草酮原药和8%环戊
草酮原药和8%环戊 草酮悬浮剂在中国获得登记[7],日本规定了环戊
草酮悬浮剂在中国获得登记[7],日本规定了环戊 草酮在糙米中的最大残留限量 (MRL) 值为0.05 mg/kg[8],而中国目前尚未制定环戊
草酮在糙米中的最大残留限量 (MRL) 值为0.05 mg/kg[8],而中国目前尚未制定环戊 草酮在水稻上的MRL值。
草酮在水稻上的MRL值。
|
图式1 环戊 草酮结构式
Scheme1 The structural formula of pentoxazone 草酮结构式
Scheme1 The structural formula of pentoxazone
|
环戊 草酮的分析方法主要是高效液相法[9],关于其在水稻等基质中的残留检测方法还未见报道。鉴于此,本研究拟建立超高效液相色谱-串联质谱 (UPLC-MS/MS) 测定稻田中环戊
草酮的分析方法主要是高效液相法[9],关于其在水稻等基质中的残留检测方法还未见报道。鉴于此,本研究拟建立超高效液相色谱-串联质谱 (UPLC-MS/MS) 测定稻田中环戊 草酮残留的检测方法,并研究其在稻田中的残留及消解规律,旨在为制定环戊
草酮残留的检测方法,并研究其在稻田中的残留及消解规律,旨在为制定环戊 草酮在糙米中MRL值及在稻田中的合理使用提供依据。
草酮在糙米中MRL值及在稻田中的合理使用提供依据。
UPLC-MS/MS-8050超高效液相色谱-串联质谱仪 (日本岛津公司);SPS402F电子天平 (精确至 0.01 g,奥豪斯公司);AB135-S电子天平 (精确至 0.000 1 g,梅特勒-托利多公司);R-210 旋转蒸发仪及V-700 真空泵 (瑞士BUCHI公司);TYZD-IIA振荡器 (姜堰市天仪电子仪器有限公司);VTX-3000L涡旋仪 (杭州雷琪试验器材公司);3-18 k高速离心机 (德国Sigma公司);SK1200H超声清洗器 (上海科导超声仪器有限公司)。
环戊 草酮 (pentoxazone) 标准品 (纯度99.8%,德国Dr. Ehrenstorfer GmbH公司);90 g/L环戊
草酮 (pentoxazone) 标准品 (纯度99.8%,德国Dr. Ehrenstorfer GmbH公司);90 g/L环戊 草酮悬浮剂 (pentoxazone 90 g/L SC,日本科研制药株式会社);甲醇和乙腈 (色谱纯,德国默克公司);醋酸铵 (色谱纯,上海凌峰化学试剂有限公司);无水硫酸钠和氯化钠 (分析纯,国药集团化学试剂有限公司);净化管 (C18 50 mg、PSA 50 mg、PC 50 mg及MgSO4 150 mg)、弗罗里硅土、酸性氧化铝、中性氧化铝和碱性氧化铝 (农残级,天津博纳艾杰尔科技有限公司)。
草酮悬浮剂 (pentoxazone 90 g/L SC,日本科研制药株式会社);甲醇和乙腈 (色谱纯,德国默克公司);醋酸铵 (色谱纯,上海凌峰化学试剂有限公司);无水硫酸钠和氯化钠 (分析纯,国药集团化学试剂有限公司);净化管 (C18 50 mg、PSA 50 mg、PC 50 mg及MgSO4 150 mg)、弗罗里硅土、酸性氧化铝、中性氧化铝和碱性氧化铝 (农残级,天津博纳艾杰尔科技有限公司)。
试验于2013—2014年在浙江、山东和湖南3地进行,供试药剂为90 g/L环戊 草酮悬浮剂。按文献和农药残留试验准则要求设计试验小区[10-11],小区面积30 m2,重复3次,随机排列,小区间设保护带,另设对照小区。于移栽当天起3日内采用瓶甩法施药1次,推荐的安全间隔期为最后一次施药距收获期的天数。
草酮悬浮剂。按文献和农药残留试验准则要求设计试验小区[10-11],小区面积30 m2,重复3次,随机排列,小区间设保护带,另设对照小区。于移栽当天起3日内采用瓶甩法施药1次,推荐的安全间隔期为最后一次施药距收获期的天数。
于水稻分蘖初期,按有效成分562.5 g/hm2 (制剂用量6250.5 mL/hm2,用水量450 L/hm2) 分别均匀喷施水稻植株和空白土壤,于施药后2 h及1、3、5、7、14、21、28、35、42、60 d采集植株、稻田水和土壤样品,每处理重复3次,处理间设保护隔离区,另设清水空白对照。
1.2.2 最终残留试验设低剂量 (有效成分375.0 g/hm2) 和高剂量 (有效成分562.5 g/hm2) 2个施药剂量,于水稻移栽当天起3日内采用瓶甩法施药1次。于收获期采样。
1.2.3 样本采集水稻:在小区内随机剪取土表以上的全株1 kg,小区边行和每行距离两端0.5 m内不采样,将稻秆剪成1 cm以下的小段,混匀,四分法留样100 g 2份;随机剪取稻穗2 kg,脱粒,糙米和稻壳分开,混匀,分别取糙米100 g 2份和足够量稻壳2份。
田水:在消解动态试验小区内,随机取10个以上采样点,取500 mL水样2份。
土壤:在动态试验小区内,随机取8个以上采样点,用土钻采集0~10 cm深度土层的土壤2 kg以上,除去碎石、杂草和植物根茎等杂物,混匀,留样200 g。
所有田间样品均于采集8 h内处理完毕,并于–20 ℃下保存,备用。
1.3 分析方法 1.3.1 样品前处理田水:取1.5 mL田水,于10 000 r/min下离心5 min;取1 mL上清液,加入1 mL色谱纯乙腈,旋涡混匀,过0.22 μm滤膜,待测。
糙米、谷壳、稻秆和土壤:取5 g样品于150 mL三角瓶中,分别加入10 mL蒸馏水和50 mL乙腈,振荡提取1 h;将提取液抽滤至100 mL含5 g氯化钠的具塞量筒中,剧烈振荡1 min,静置20 min;取10 mL上层乙腈相,于40 ℃下减压浓缩至干;用5 mL正己烷溶解残渣,待净化。
在玻璃层析柱 (1.0 cm × 25 cm) 中依次装入脱脂棉、2 cm高的无水硫酸钠、2 g 5%脱活的弗罗里硅土、2 g 5%脱活的中性氧化铝和2 cm高的无水硫酸钠,用10 mL正己烷预淋洗;加入上述待净化液,用10 mL正己烷预淋洗后,用10 mLV(正己烷) : V(乙酸乙酯) = 7 : 3溶液洗脱;收集洗脱液,于40 ℃下减压浓缩至干,用1 mL色谱纯乙腈超声溶解,加入1 mL超纯水,混匀,过0.22 μm滤膜,待测。
1.3.2 仪器测定条件色谱条件:Waters BEH C18色谱柱 (2.1 mm × 100 mm, 1.7 μm);流动相A相为乙腈,B相为10 mmol/L的醋酸铵水溶液,等度洗脱 [V(A) : V(B) = 80:20];流速0.2 mL/min;柱温40 ℃;进样体积2 μL。
质谱条件:电离方式为ESI-,多反应监测模式 (MRM);喷针电压–4.5 kV;雾化气流速2.5 L/min;干燥气流速10.0 L/min;加热气流速10.0 L/min;喷针温度300 ℃;脱溶剂管温度250 ℃;加热块温度400 ℃;碰撞气为氩气,碰撞电压为19 eV和22 eV,母离子 (m/z 352.0),子离子 (m/z 97.0和m/z 69.0)。
1.3.3 标准溶液配制及标准曲线绘制用乙腈配制100 mg/L的环戊 草酮标准母液,试验时用V(乙腈) : V(水) = 1 : 1溶液将母液稀释成0.01、0.05、0.1、0.5和1.0 mg/L系列环戊
草酮标准母液,试验时用V(乙腈) : V(水) = 1 : 1溶液将母液稀释成0.01、0.05、0.1、0.5和1.0 mg/L系列环戊 草酮标准工作溶液,按1.3.2节条件测定,以进样质量浓度为横坐标,对应的峰面积为纵坐标,绘制标准曲线。
草酮标准工作溶液,按1.3.2节条件测定,以进样质量浓度为横坐标,对应的峰面积为纵坐标,绘制标准曲线。
称取糙米、谷壳、稻秆、土壤和稻田水空白样品,添加环戊 草酮标准品溶液,添加水平分别为0.02、0.05和0.5 mg/kg,每个水平5次重复,按本研究建立的方法进行样品前处理和测定,计算平均添加回收率及相对标准偏差。
草酮标准品溶液,添加水平分别为0.02、0.05和0.5 mg/kg,每个水平5次重复,按本研究建立的方法进行样品前处理和测定,计算平均添加回收率及相对标准偏差。
环戊 草酮虽然在水中的溶解度非常小,但极易溶于有机溶剂,考虑到后期需对提取液净化,故采用盐析后易于与水分层的乙腈作为提取剂。当样品用量为5 g、加入蒸馏水量为10 mL时,比较了不同乙腈用量 (20、30、40和50 mL) 对回收率及净化效果的影响,发现当乙腈用量为50 mL时,可以得到满意的回收效果,且对后期提取液的净化更容易。进一步考察了净化管 (C18 50 mg、PSA 50 mg、PC 50 mg及MgSO4 150 mg) 和自添柱 (弗罗里硅土-酸性氧化铝、弗罗里硅土-中性氧化铝及弗罗里硅土-碱性氧化铝) 对糙米、谷壳、稻秆和土壤样品的净化效果。结果表明:将10 mL乙腈提取液浓缩至干,用2 mL色谱纯乙腈溶解残渣并用净化管净化时,对稻秆和土壤样品的净化效果较好,但对糙米和谷壳的效果较差,净化后的溶液呈浅黄色并存在少量油性液体;当以m(弗罗里硅土) : m(氧化铝) = 1 : 1(各2 g) 为净化剂、V(正己烷) : V(乙酸乙酯) = 7 : 3 (10 mL) 为洗脱液时,对糙米、谷壳、稻秆和土壤4种基质均有较好的净化效果,其中弗罗里硅土-中性氧化铝的回收率 (≥ 75%) 比弗罗里硅土-酸性或-碱性氧化铝的回收率 (≤ 56%) 高,因此,综合上述试验结果,对糙米、谷壳、稻秆和土壤4种样品均采用乙腈为提取溶剂,弗罗里硅土-中性氧化铝为净化剂,正己烷-乙酸乙酯为洗脱液。
草酮虽然在水中的溶解度非常小,但极易溶于有机溶剂,考虑到后期需对提取液净化,故采用盐析后易于与水分层的乙腈作为提取剂。当样品用量为5 g、加入蒸馏水量为10 mL时,比较了不同乙腈用量 (20、30、40和50 mL) 对回收率及净化效果的影响,发现当乙腈用量为50 mL时,可以得到满意的回收效果,且对后期提取液的净化更容易。进一步考察了净化管 (C18 50 mg、PSA 50 mg、PC 50 mg及MgSO4 150 mg) 和自添柱 (弗罗里硅土-酸性氧化铝、弗罗里硅土-中性氧化铝及弗罗里硅土-碱性氧化铝) 对糙米、谷壳、稻秆和土壤样品的净化效果。结果表明:将10 mL乙腈提取液浓缩至干,用2 mL色谱纯乙腈溶解残渣并用净化管净化时,对稻秆和土壤样品的净化效果较好,但对糙米和谷壳的效果较差,净化后的溶液呈浅黄色并存在少量油性液体;当以m(弗罗里硅土) : m(氧化铝) = 1 : 1(各2 g) 为净化剂、V(正己烷) : V(乙酸乙酯) = 7 : 3 (10 mL) 为洗脱液时,对糙米、谷壳、稻秆和土壤4种基质均有较好的净化效果,其中弗罗里硅土-中性氧化铝的回收率 (≥ 75%) 比弗罗里硅土-酸性或-碱性氧化铝的回收率 (≤ 56%) 高,因此,综合上述试验结果,对糙米、谷壳、稻秆和土壤4种样品均采用乙腈为提取溶剂,弗罗里硅土-中性氧化铝为净化剂,正己烷-乙酸乙酯为洗脱液。
流动相组成及比例对农药的色谱分离、峰型及质谱灵敏度具有显著影响。本研究考察了甲醇-水、乙腈-水、乙腈-0.1%甲酸水和乙腈-10 mmol/L醋酸铵水溶液作为流动相对环戊 草酮色谱-质谱分离响应效果的影响。结果表明:以V(乙腈) : V(10 mmol/L醋酸铵水溶液) = 80 : 20为流动相、流速0.2 mL/min时,环戊
草酮色谱-质谱分离响应效果的影响。结果表明:以V(乙腈) : V(10 mmol/L醋酸铵水溶液) = 80 : 20为流动相、流速0.2 mL/min时,环戊 草酮的峰型最好,且基线平稳,响应值最高。以V(甲醇) : V(水) = 80 : 20为流动相时,环戊
草酮的峰型最好,且基线平稳,响应值最高。以V(甲醇) : V(水) = 80 : 20为流动相时,环戊 草酮有轻微的拖尾,且信噪比较高;以V(乙腈) : V(水) = 80 : 20或V(乙腈) : V(0.1%甲酸水) = 80 : 20作为流动相时,峰型虽好,但环戊
草酮有轻微的拖尾,且信噪比较高;以V(乙腈) : V(水) = 80 : 20或V(乙腈) : V(0.1%甲酸水) = 80 : 20作为流动相时,峰型虽好,但环戊 草酮响应值不如以V(乙腈) : V(10 mmol/L醋酸铵水溶液) = 80 : 20作为流动相时高,且0.1%甲酸水对环戊
草酮响应值不如以V(乙腈) : V(10 mmol/L醋酸铵水溶液) = 80 : 20作为流动相时高,且0.1%甲酸水对环戊 草酮有微弱的抑制作用。综合考虑,最终选择以V(乙腈) : V(10 mmol/L醋酸铵水溶液) = 80 : 20作为环戊
草酮有微弱的抑制作用。综合考虑,最终选择以V(乙腈) : V(10 mmol/L醋酸铵水溶液) = 80 : 20作为环戊 草酮检测的流动相。
草酮检测的流动相。
使用1.0 mg/L的环戊 草酮标准溶液,在连接两通的条件下,流动相组成为V(乙腈) : V(水) = 1 : 1,流速0.2 mL/min,进样体积1 μL,分别在电喷雾电离正/负离子模式 (ESI+/ESI-) 下进行母离子全扫描,扫描范围m/z为100~500。结果表明:在ESI-模式下,环戊
草酮标准溶液,在连接两通的条件下,流动相组成为V(乙腈) : V(水) = 1 : 1,流速0.2 mL/min,进样体积1 μL,分别在电喷雾电离正/负离子模式 (ESI+/ESI-) 下进行母离子全扫描,扫描范围m/z为100~500。结果表明:在ESI-模式下,环戊 草酮电离效果最佳,信号强度高于ESI+模式,获得m/z 352的[M-H]-准分子离子峰。对环戊
草酮电离效果最佳,信号强度高于ESI+模式,获得m/z 352的[M-H]-准分子离子峰。对环戊 草酮的[M-H]-进行二级质谱扫描得到碎片离子,选择m/z 352/97和m/z 352/69分别为定量和定性离子对,当碰撞能量为-19 eV时,离子m/z 97的相对丰度最大;当碰撞能量为–22 eV时,离子m/z 69的相对丰度最大。离子 m/z 97的响应值比离子m/z 69大,因此选择m/z 97作为定量离子。
草酮的[M-H]-进行二级质谱扫描得到碎片离子,选择m/z 352/97和m/z 352/69分别为定量和定性离子对,当碰撞能量为-19 eV时,离子m/z 97的相对丰度最大;当碰撞能量为–22 eV时,离子m/z 69的相对丰度最大。离子 m/z 97的响应值比离子m/z 69大,因此选择m/z 97作为定量离子。
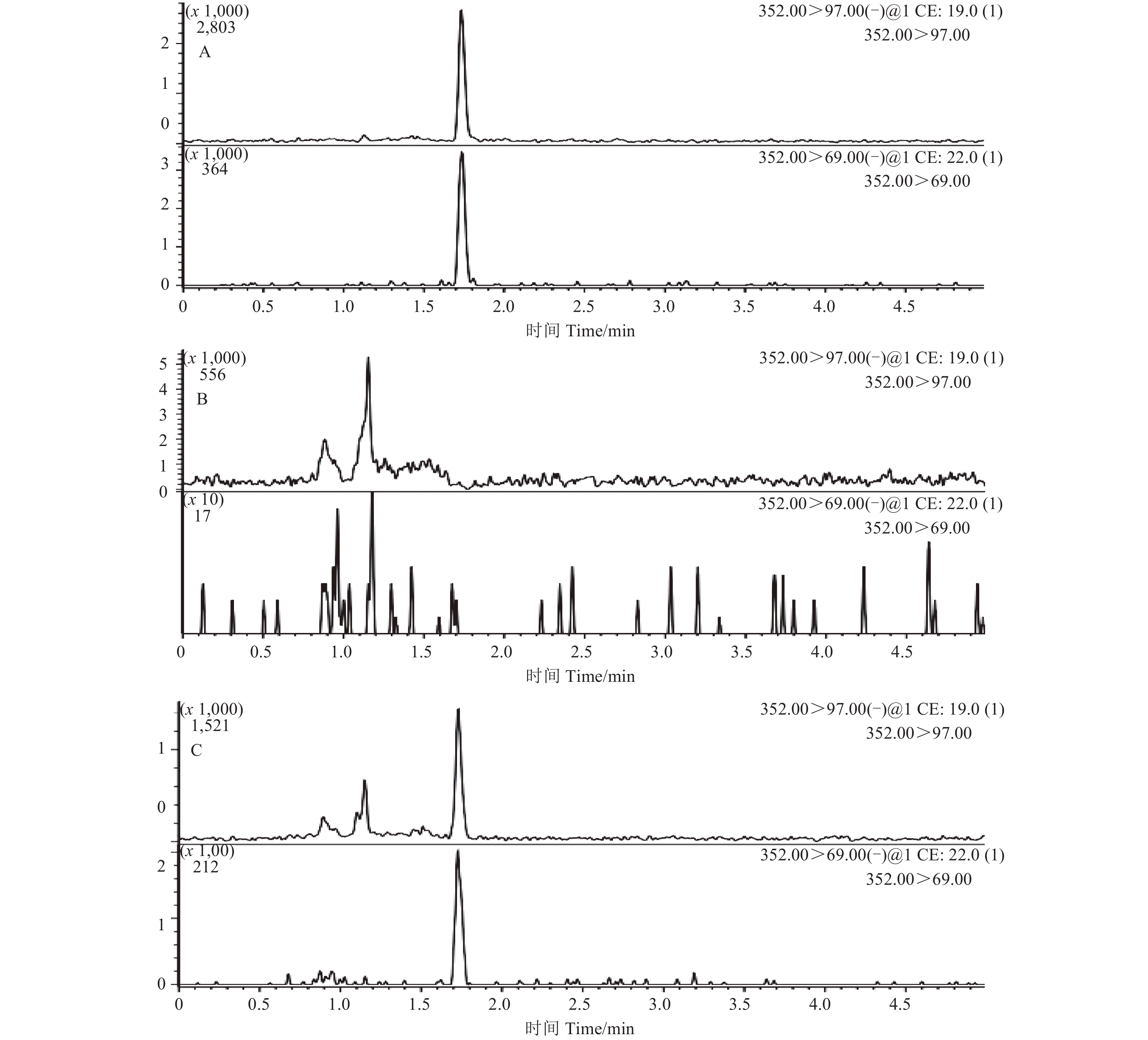
结果 (表1、图1) 表明:在 0.01~1.0 mg/L范围内,环戊 草酮保留时间为1.768 min左右,其质量浓度与相应的峰面积间呈良好的线性关系,经最小二乘法拟合得标准曲线,其回归方程为y = 602 103.519 3x + 5 910.847 9 (R2 = 0.999 3)。在本研究建立的分析方法下,环戊
草酮保留时间为1.768 min左右,其质量浓度与相应的峰面积间呈良好的线性关系,经最小二乘法拟合得标准曲线,其回归方程为y = 602 103.519 3x + 5 910.847 9 (R2 = 0.999 3)。在本研究建立的分析方法下,环戊 草酮的检出限 (LOD) 为0.01 ng。
草酮的检出限 (LOD) 为0.01 ng。
|
A:环戊草酮标准溶液 (0.01 mg/kg);B:空白糙米;C:糙米添加 0.02 mg/kg的环戊草酮。 A: Standard solution of pentoxazone with 0.01 mg/kg; B: Blank rice; C: Rice matrix with spiked pentoxazone of 0.02 mg/kg. 图 1 环戊  草酮标准品、空白样品及添加回收样品超高效液相色谱-串联质谱图
Fig. 1 UPLC-MS/MS chromatograms of standard, blank and spiked rice sample 草酮标准品、空白样品及添加回收样品超高效液相色谱-串联质谱图
Fig. 1 UPLC-MS/MS chromatograms of standard, blank and spiked rice sample
|
在0.02、0.05和0.5 mg/kg添加水平下,环戊 草酮在糙米、谷壳、稻秆、土壤和稻田水中的平均回收率分别为79%~95%,75%~79%,88%~93%,84%~90%和87%~95%;相对标准偏差分别为2.7%~5.7%,2.7%~5.9%,4.0%~8.6%,1.5%~9.5%和3.7%~5.8% (表1)。根据添加回收最低档添加浓度,环戊
草酮在糙米、谷壳、稻秆、土壤和稻田水中的平均回收率分别为79%~95%,75%~79%,88%~93%,84%~90%和87%~95%;相对标准偏差分别为2.7%~5.7%,2.7%~5.9%,4.0%~8.6%,1.5%~9.5%和3.7%~5.8% (表1)。根据添加回收最低档添加浓度,环戊 草酮在糙米、谷壳、稻秆、土壤和稻田水中的最低检出浓度 (LOQ) 均为0.02 mg/kg。本方法的添加回收准确度和精密度较好,目标峰响应值较高,且附近未出现杂质峰,符合规范农药残留试验的要求[12-13]。
草酮在糙米、谷壳、稻秆、土壤和稻田水中的最低检出浓度 (LOQ) 均为0.02 mg/kg。本方法的添加回收准确度和精密度较好,目标峰响应值较高,且附近未出现杂质峰,符合规范农药残留试验的要求[12-13]。
|
|
表 1 环戊 草酮在稻田样品中的添加回收率及相对标准偏差 (n = 5)
Table 1 The recoveries and relative standard deviation of pentoxazone in different samples (n = 5) 草酮在稻田样品中的添加回收率及相对标准偏差 (n = 5)
Table 1 The recoveries and relative standard deviation of pentoxazone in different samples (n = 5)
|
2.4 环戊
 草酮在稻田中的消解动态
草酮在稻田中的消解动态
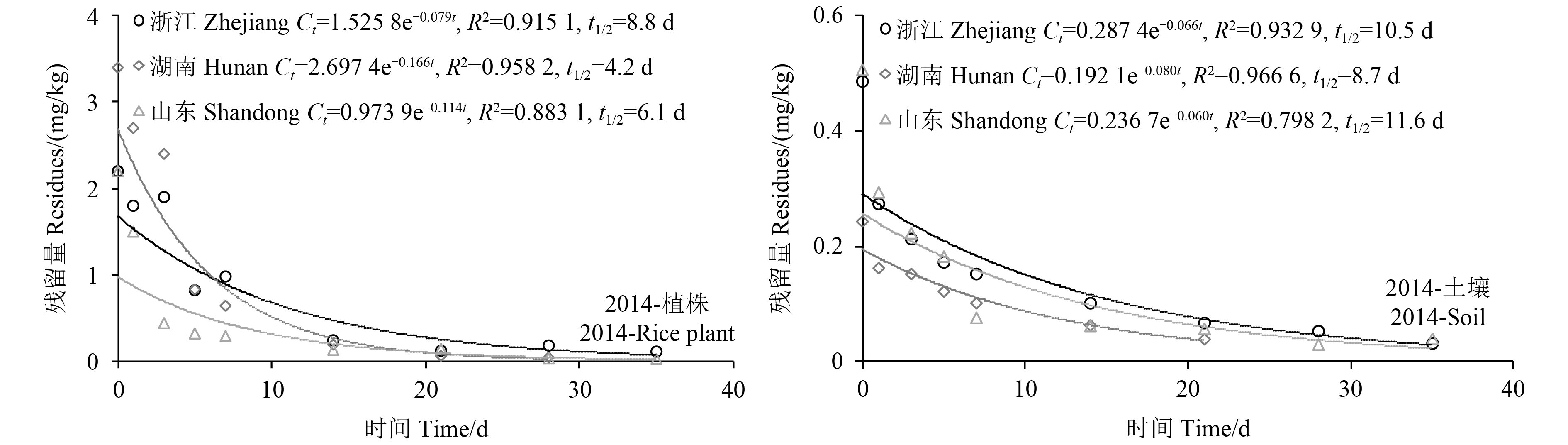
采用90 g/L环戊 草酮悬浮剂在浙江、山东和湖南2年3地植株及土壤中的消解试验结果表明:环戊
草酮悬浮剂在浙江、山东和湖南2年3地植株及土壤中的消解试验结果表明:环戊 草酮在3地植株中的原始沉积量为1.6~3.4 mg/kg,42 d时降解至 < 0.02~0.041 mg/kg,降解率在90%以上,环戊
草酮在3地植株中的原始沉积量为1.6~3.4 mg/kg,42 d时降解至 < 0.02~0.041 mg/kg,降解率在90%以上,环戊 草酮在水稻植株中的消解规律遵循一级反应动力学方程,消解半衰期为4.2~9.0 d;在3地土壤中的原始沉积量为0.22~1.30 mg/kg,35 d时降解至 < 0.02~0.05 mg/kg,降解率同样也在90%以上,其消解规律亦遵循一级反应动力学方程,消解半衰期为7.0~11.6 d(图2)。环戊草酮在稻田水中很难被检测到,这可能是由于环戊
草酮在水稻植株中的消解规律遵循一级反应动力学方程,消解半衰期为4.2~9.0 d;在3地土壤中的原始沉积量为0.22~1.30 mg/kg,35 d时降解至 < 0.02~0.05 mg/kg,降解率同样也在90%以上,其消解规律亦遵循一级反应动力学方程,消解半衰期为7.0~11.6 d(图2)。环戊草酮在稻田水中很难被检测到,这可能是由于环戊 草酮在水中溶解度较低 (0.216 mg/L, 20 ℃),且具有较强的土壤吸附性,土壤吸附系数 (Koc) 为3 160 L/kg [14]。施用环戊
草酮在水中溶解度较低 (0.216 mg/L, 20 ℃),且具有较强的土壤吸附性,土壤吸附系数 (Koc) 为3 160 L/kg [14]。施用环戊 草酮后初期,其在土壤中的残留量 (0.22~1.3 mg/kg) 远高于在田水中 (0.029~0.086 mg/kg) 的残留量。
草酮后初期,其在土壤中的残留量 (0.22~1.3 mg/kg) 远高于在田水中 (0.029~0.086 mg/kg) 的残留量。
|
图 2 环戊 草酮在水稻植株和土壤中的消解动态
Fig. 2 The dissipation kinetics of pentoxazone in the rice plant and soil 草酮在水稻植株和土壤中的消解动态
Fig. 2 The dissipation kinetics of pentoxazone in the rice plant and soil
|
环戊 草酮属于
草酮属于 唑烷二酮类或四取代苯类除草剂,目前在中国登记的产品仅包括2个原药和1个悬浮剂 (登记作物为水稻)[7]。已有的研究表明,与环戊
唑烷二酮类或四取代苯类除草剂,目前在中国登记的产品仅包括2个原药和1个悬浮剂 (登记作物为水稻)[7]。已有的研究表明,与环戊 草酮结构类似的化合物丙炔恶草酮,其在植株中的消解半衰期是4.3~11.8 d,在稻田土壤中的消解半衰期是8.6~11.4 d[15],由此可见,环戊
草酮结构类似的化合物丙炔恶草酮,其在植株中的消解半衰期是4.3~11.8 d,在稻田土壤中的消解半衰期是8.6~11.4 d[15],由此可见,环戊 草酮与丙炔恶草酮在稻田土壤中的消解速率基本一致,均属于在田间较易消散的农药。
草酮与丙炔恶草酮在稻田土壤中的消解速率基本一致,均属于在田间较易消散的农药。
 草酮在水稻及土壤中的最终残留
草酮在水稻及土壤中的最终残留
2013—2014的2年3地试验结果见表2。其中,环戊 草酮在糙米中的最终残留量均 < 0.02 mg/kg,低于日本规定的环戊
草酮在糙米中的最终残留量均 < 0.02 mg/kg,低于日本规定的环戊 草酮在糙米中MRL值 (0.05 mg/kg);环戊
草酮在糙米中MRL值 (0.05 mg/kg);环戊 草酮在谷壳、稻秆和土壤中的最终残留量分别为 ≤ 0.026、≤ 0.15和 ≤ 0.12 mg/kg。
草酮在谷壳、稻秆和土壤中的最终残留量分别为 ≤ 0.026、≤ 0.15和 ≤ 0.12 mg/kg。
|
|
表 2 环戊 草酮在糙米、谷壳、稻秆和土壤中的最终残留量
Table 2 The final residues of pentoxazone in the husked rice, rice hulls, rice plant and soil samples 草酮在糙米、谷壳、稻秆和土壤中的最终残留量
Table 2 The final residues of pentoxazone in the husked rice, rice hulls, rice plant and soil samples
|
3 结论及讨论
本研究建立了超高效液相色谱-串联质谱 (UPLC-MS/MS) 测定糙米、谷壳、稻秆,土壤和稻田水中环戊 草酮残留的分析方法。在0.02、0.05和0.5 mg/kg添加水平下,环戊
草酮残留的分析方法。在0.02、0.05和0.5 mg/kg添加水平下,环戊 草酮在糙米、谷壳、稻秆、土壤和稻田水中的平均回收率为75%~95%,相对标准偏差为1.5%~9.5%。环戊
草酮在糙米、谷壳、稻秆、土壤和稻田水中的平均回收率为75%~95%,相对标准偏差为1.5%~9.5%。环戊 草酮的检出限 (LOD) 为0.01ng,在糙米、谷壳、稻秆、土壤和稻田水中的最低检出浓度 (LOQ) 均为0.02 mg/kg。
草酮的检出限 (LOD) 为0.01ng,在糙米、谷壳、稻秆、土壤和稻田水中的最低检出浓度 (LOQ) 均为0.02 mg/kg。
采用建立的分析方法进一步研究了环戊 草酮在稻田中的消解动态,结果表明:环戊
草酮在稻田中的消解动态,结果表明:环戊 草酮在植株、土壤消解规律符合一级反应动力学方程,在植株上的半衰期为4.2~9.0 d,在土壤中的为7.0~11.6 d,稻田水中的环戊
草酮在植株、土壤消解规律符合一级反应动力学方程,在植株上的半衰期为4.2~9.0 d,在土壤中的为7.0~11.6 d,稻田水中的环戊 草酮可以快速扩散并吸附在土壤表面,导致其在稻田水中的浓度较低,不易被检测到。
草酮可以快速扩散并吸附在土壤表面,导致其在稻田水中的浓度较低,不易被检测到。
以375.0 (低剂量) 和562.5 g/hm2 (高剂量) 施用90 g/L环戊 草酮悬浮剂,于水稻移栽当天起3日内采用瓶甩法施药1次,收获成熟期采收。最终残留试验结果表明:环戊
草酮悬浮剂,于水稻移栽当天起3日内采用瓶甩法施药1次,收获成熟期采收。最终残留试验结果表明:环戊 草酮在糙米中的最终残留量均小于0.02 mg/kg,低于日本规定的环戊
草酮在糙米中的最终残留量均小于0.02 mg/kg,低于日本规定的环戊 草酮在糙米中的MRL值 (0.05 mg/kg)[8]。因此,建议采用90 g/L环戊
草酮在糙米中的MRL值 (0.05 mg/kg)[8]。因此,建议采用90 g/L环戊 草酮悬浮剂防治一年生杂草、多年生莎草科的牛毛毡和萤蔺以及多年生泽泻科的窄叶泽泻时,于水稻移栽当天起3日内采用瓶甩法施药1次,有效成分施药剂量不超过562.5 g/hm2,收获的水稻食用是安全的。目前,中国尚未制定环戊
草酮悬浮剂防治一年生杂草、多年生莎草科的牛毛毡和萤蔺以及多年生泽泻科的窄叶泽泻时,于水稻移栽当天起3日内采用瓶甩法施药1次,有效成分施药剂量不超过562.5 g/hm2,收获的水稻食用是安全的。目前,中国尚未制定环戊 草酮在糙米中的MRL值,本研究结果可为制定环戊
草酮在糙米中的MRL值,本研究结果可为制定环戊 草酮在糙米中的MRL值提供数据支撑。同时本研究是首次报道环戊
草酮在糙米中的MRL值提供数据支撑。同时本研究是首次报道环戊 草酮在稻田中的残留和消解动态,后续研究应重点关注环戊
草酮在稻田中的残留和消解动态,后续研究应重点关注环戊 草酮在稻田中的代谢物生成、其环境毒理及环境归趋等方面。
草酮在稻田中的代谢物生成、其环境毒理及环境归趋等方面。
| [1] |
KENJI H, TAKAMASA F, ATSUKO M, et al. Oxazolidinedione derivatives, process for their preparation, and herbicides containing the same: EP0241559[P]. 1986-10-09.
|
| [2] |
KENJI H, TOMOYUKI Y, UGAI S, et al. Development of a herbicide, pentoxazone[J]. J Pest Sci, 2001, 26(2): 194-202. DOI:10.1584/jpestics.26.194 |
| [3] |
MATSUNAKA S. Historical review of rice herbicides in Japan[J]. Weed Biol Manage, 2001, 1(1): 10-14. DOI:10.1046/j.1445-6664.2001.00005.x |
| [4] |
HAMAMURA K. Development of herbicides for paddy rice in Japan[J]. Weed Biol Manage, 2018, 18(2): 75-91. DOI:10.1111/wbm.2018.18.issue-2 |
| [5] |
SATSUMA K, HAYASHI O, SATO K, et al. Microbial degradation of herbicide pentoxazone in soils[J]. J Pest Sci, 2000, 25(3): 201-206. DOI:10.1584/jpestics.25.201 |
| [6] |
中国农药信息网. 农药登记信息[EB/OL].[2018-10-23]. http://www.chinapesticide.org.cn/hydt/5261.jhtm. China Pesticide Information Network. Information of pesticide registration[EB/OL].[2018-10-23]. http://www.chinapesticide.org.cn/hydt/5261.jhtm. |
| [7] |
中国农药信息网. 农药登记信息[EB/OL].[2018-10-23]. http://www.icama.org.cn/hysj/index.jhtml. China Pesticide Information Network. Information of pesticide registration[EB/OL].[2018-10-23]. http://www.icama.org.cn/hysj/index.jhtml. |
| [8] |
The Japan Food Chemical Research Foundation. Maximum residue limits (MRLs) list of agricultural chemicals in foods[EB/OL].[2018-11-12]. http://db.ffcr.or.jp/front/pesticide_detail?id=71000
|
| [9] |
孙占岳, 于荣, 王胜翔. 环戊 SUN Z Y, YU R, WANG S X. Analytical method of 90 g/L pentoxazone SC by HPLC[J]. Pestic Sci Admin, 2013, 34(11): 35-37. DOI:10.3969/j.issn.1002-5480.2013.11.008 |
| [10] |
农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004. Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
| [11] |
李文卓, 钱圆, MATSUMOTO H, et al. 五氟磺草胺在稻田中的消解动态及残留特性[J]. 农药学学报, 2017, 19(1): 61-67. LI W Z, QIAN Y, MATSUMOTO H, et al. Dissipation and residue characteristic of penoxsulam in rice paddy[J]. Chin J Pestic Sci, 2017, 19(1): 61-67. |
| [12] |
朱国念. 农药残留快速检测技术[M]. 北京: 化学工业出版社, 2008: 59-61. ZHU G N. Rapid detection of pesticide residues[M]. Beijing: Chemical Industry Press, 2008: 59-61. |
| [13] |
农业部农药检定所. 农药残留量实用检测方法手册[M]. 北京: 中国农业科技出版社, 1995. Institute for the Control of Agrochemicals. Handbook of practical methods for the determination of pesticide residues[M]. Beijing: China Agricultural Science and Technology Press, 1995. |
| [14] |
PPDB, Pesticide Properties DataBase[EB/OL].[2018-09-03]. http://sitem.herts.ac.uk/aeru/ppdb/en/Reports/1162.htm
|
| [15] |
施晨辉. 丙炔草酮在稻田环境中的行为研究[D]. 杭州: 浙江大学, 2009. SHI C H. fate of oxadiargyl in the environment of paddy field[D]. Hangzhou: Zhejiang University, 2009. |
 2018, Vol. 20
2018, Vol. 20


