2. 浙江农林大学 理学院,浙江 临安 311300
2. College of Science, Zhejiang A&F University, Lin’an 311300, Zhejiang Province, China
农药缓释胶囊是利用微囊化技术将液体或固体农药等包裹在囊壁材料中形成的微小囊状制剂,制备方法有化学法、物理法及物理化学法等,目前应用较多的是物理化学法中的界面聚合法、相分离法及溶剂挥发法[1]。Suttia等[2]以两亲性聚(乙二醇)-嵌段-聚(双酚A碳酸酯)共聚物作为囊壁材料,采用相分离法制备的纳米胶囊,粒径达60~120 nm。张小军等[3]以水为反应介质,采用界面聚合法制备了壁材为聚脲的阿维菌素微囊,平均粒径2.0~4.0 μm。章彬[4]以聚乙烯醇-1788为乳化分散剂、二氯甲烷为有机溶剂,运用溶剂挥发法制备了以改性聚羟基烷酸酯为载体的七氟菊酯微囊,平均粒径6.0~10.0 μm。研究表明,胶囊粒径大小对农药缓释效果具有重要影响,而纳米胶囊的缓释效果明显优于常规农药缓释胶囊,防治效果更好[5-6]。
在制备纳米胶囊过程中,壁材的选择是决定胶囊性能的关键因素之一。近年来,选用的壁材主要以高分子聚合物为主,虽然获得的胶囊具有韧性好、时效长等优点,但同时存在难降解、污染环境等不足[7-8]。因此探寻环境友好型的新型材料作为壁材备受关注。由有机高分子物质组成的生物质材料为壁材可克服传统材料的缺点,其中羧甲基纤维素钠 (CMC-Na) 作为典型的改性纤维素基质材料[9-12],由于其分子链骨架上存在羟基和羧基基团,因而具有亲水性的特点。如果将羧甲基纤维素表面进行疏水性改性,即合成具有两亲性的多糖基质聚合物,进而采用溶剂挥发法,可在溶剂中自组装成胶束或囊泡结构,用于包埋疏水性的农药,从而达到控制农药释放的目的。
当前,由山核桃干腐病菌 (茶藨子葡萄座腔菌Botryosphaeria dothidea) 引起的山核桃干腐病广泛频繁爆发,常用农药如戊唑醇、腐霉利和百菌清等传统剂型在使用过程中普遍存在突释率高,实效短的缺点[13-15]。为此,本研究选用羧甲基纤维素钠作为多糖基质材料,通过离子液体活化法使其与生育酚琥珀酸酯发生酯化反应,合成新型多糖基质材料羧甲基纤维素钠衍生物 (CMCD) (反应式见图式1),进而采用超声/溶剂挥发法制备载戊唑醇纳米胶囊,测试其包封率、载药量及缓释性能,并采用培养基法探究其抑菌效果。
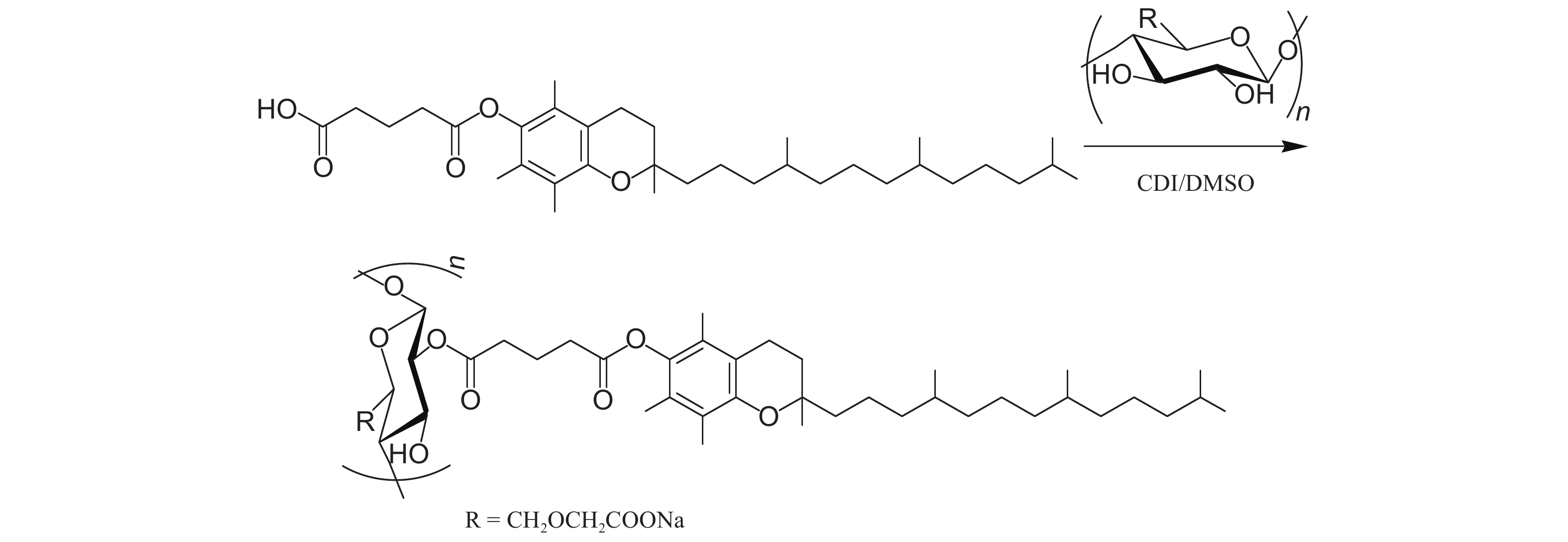
|
图式1 羧甲基纤维素钠衍生物 (CMCD) 合成路线 Scheme1 The synthetic route of CMCD |
1 材料与方法 1.1 供试材料与仪器
羧甲基纤维素钠 (CMC-Na),取代度 ≥ 80%,上海麦克林生化科技有限公司产品;D-α-生育酚琥珀酸酯 (≥98%,Ts)、N,N-羰基二咪唑 (≥ 98%,CDI) 和二甲基亚砜 (≥97.0%,DMSO),均为上海阿拉丁生化科技股份有限公司产品;丙酮 (≥98%),衢州巨化试剂有限公司;芘 (≥99%),Sigma有限公司;磷钨酸 (≥98%),成都市科龙化工试剂厂;H2O2(30%) 和乙醇 (≥99.7%),购于国药集团化学试剂有限公司;乙酸乙酯 (≥99%),安耐吉化学。
戊唑醇 (tebuconazole) 原药 (≥98%),上海三鹰化学试剂有限公司;430 g/L戊唑醇悬浮剂 (tebuconazole 430 g/L SC),德国拜耳作物科学公司。
山核桃干腐病菌 (茶藨子葡萄座腔菌Botryosphaeria dothidea),浙江农林大学森林保护学实验室保藏并提供。
IR Prestige-21型傅里叶变换红外光谱仪 (日本Shimadzu公司);AVANCE III/500 MHz核磁共振仪氢谱仪 (瑞士Bruker公司);XRD 6000X-射线衍射仪 (日本Shimadzu公司);TA Q500型热重分析仪 (美国TA公司);F-7000荧光分光光度计 (日本日立高新技术有限公司);ZetaPALS型高灵敏度Zeta电位及粒径分析仪 (美国Brookhave公司);Aglient1200高效液相色谱仪 (安捷伦科技有限公司);JEM2100型高分辨透射电子显微镜 (日本Joel公司);VD-650超净工作台 (苏州净化设备有限公司);LRH-250A生化培养箱 (广东省医疗器械厂);MS104TS型电子分析天平 (梅特勒-托利多国际股份有限公司);KQ-250DB型超声波清洗仪 (昆山市超声仪器有限公司);DF-101S型集热式磁力搅拌器 (上海聚昆仪器设备有限公司);PS-1000型磁力搅拌恒温油浴锅 (日本Eleya公司);DHG-9123A型电热恒温鼓风干燥箱 (上海一恒科学仪器有限公司);SHZ-C型循环水式多用真空泵 (河南予华仪器有限责任公司)。
1.2 低分子质量羧甲基纤维素钠的制备参考文献方法[16-17]进行。将5 g羧甲基纤维素钠溶于100 mL 0.1 mol/L的乙酸水溶液,35 ℃搅拌溶胀3 h,加入4 mg磷钨酸及4 mL H2O2 (质量分数30%),70 ℃回流反应1.5 h,超声30 min。反应结束后醇沉,抽滤 (35 ℃),得低分子质量羧甲基纤维素钠 (LMW CMC-Na)。
1.3 羧甲基纤维素钠衍生物的制备采用离子液体法[18]。将0.1 g CDI和0.2 g TS溶于2 mL无水DMSO中,室温下搅拌活化2 h。将1 g LMW CMC-Na溶于20 mL无水DMSO中,100 ℃下放置1 h,冷却至室温。向LMW CMC-Na/DMSO体系中逐滴加入预先活化的TS和CDI溶液,氮气保护下反应24 h。加入100 mL无水乙醇使之产生沉淀,4 000 r/min下离心10 min。取沉淀物浸泡于无水乙醇中,再次进行离心分离。重复4次 (以除去CDI和未反应的CMC-Na),35 ℃下真空干燥,得到羧甲基纤维素钠衍生物 (CMCD)。
1.4 原料及终产物的结构表征采用红外光谱仪测定CMC-Na、LMWCMC-Na、Ts和CMCD的红外光谱 (KBr压片法)。采用核磁共振仪测定LMW CMC-Na、Ts和CMCD的1H NMR谱[CMC-Na与LMW CMC-Na的溶剂为重水 (D2O),Ts的溶剂为氘代二甲基亚砜 (DMSO-d6)]。采用X-射线衍射仪测定CMC-Na、LMW CMC-Na和CMCD的XRD谱,测试条件:铜靶,40 kV,40 Ma,步长0.04°,扫描速度35.4 s/步,扫描范围:2θ = 5°~40°。采用热重分析仪测定LMW CMC-Na及CMCD的热稳定性能,样品质量8~10 mg,N2气氛,测定范围为室温至800 ℃,升温速率10 ℃/min。
1.5 CMCD临界胶束浓度 (CAC) 测定将10 mg CMCD溶于10 mL蒸馏水中,常温搅拌30 min后进行超声分散[19-20],超声功率50 W,分散15 min,得到质量浓度为1 mg/mL的胶束溶液,用蒸馏水稀释成0.001、0.01、0.05、0.1、0.2、0.3、0.4、0.5和0.6 mg/mL的胶束溶液。将100 μL浓度为6 × 10–5 mol/L的芘-丙酮溶液分别加入到各浓度胶束溶液中,超声2 h,55 ℃烘箱放置12 h,冷却至室温。使用荧光光度计测定不同聚合物胶束浓度下的荧光强度。测定条件:激发波长334 nm,扫描范围360~550 nm,激发和发射的狭缝宽度均为5.0 nm。
1.6 戊唑醇CMCD纳米胶囊的制备采用超声/溶剂挥发法[21]。将10 mg CMCD溶于10 mL蒸馏水中,得到1 000 mg/L的CMCD水溶液。将10 mg戊唑醇溶于0.5 mL乙酸乙酯,并缓慢滴加到上述CMCD水溶液中。用0.10 mol/L的盐酸和0.10 mol/L的氢氧化钠调节pH = 5.5,超声 (50 W) 2次,每次2 min。40 ℃下旋转蒸发5 min,除去乙酸乙酯,得到质量浓度为1 × 104 mg/L的载戊唑醇CMCD纳米胶囊(以下简称戊唑醇纳米胶囊)。
1.7 纳米胶囊的粒径分布和形貌观测采用粒径分析仪测试载药及未载药纳米胶囊的粒径大小及分布。测试条件:温度25 ℃,激光波长698 nm,散射角90°。用透射电镜测试并观察其形态特征。
1.8 载药量及包封率测定 1.8.1 戊唑醇含量测定 1.8.1.1 分析方法采用高效液相色谱 (HPLC) 法。检测条件:C18反相色谱柱 (Waters公司);流动相为V (甲醇) : V (水) = 80 : 20,流速1.0 mL/min;检测波长223 nm;柱温20 ℃;进样量20 μL。
1.8.1.2 标准曲线的建立将25 mg戊唑醇原药用色谱纯V (甲醇):V (水) = 80:20混合溶剂溶解并定容至25 mL,得到1 mg/mL的戊唑醇甲醇水溶液,再用甲醇水溶液稀释配制成0.08、0.06、0.04、0.02、0.01和0.008 mg/mL的系列戊唑醇甲醇水溶液,充分摇匀,过0.22 μm尼龙膜,在选定条件下采用高效液相色谱仪测定并绘制戊唑醇的标准曲线。
1.8.2 包封率测定量取3 mL质量浓度为1 × 104 mg/L的戊唑醇纳米胶囊,在12 000 r/min下离心1 h。取0.1 mL上清液,用V (甲醇):V (水) = 80:20甲醇水溶液定容至10 mL,过0.22 μm尼龙膜,采用HPLC法测定上清液中戊唑醇含量。按公式 (1) 计算戊唑醇纳米胶囊包封率θ。
| $\theta /{\text{%}}= \frac{{{M_1} - {m_1}}}{{{M_1}}} \times 100$ | (1) |
式中M1表示总戊唑醇质量,mg;m1表示上清液中戊唑醇质量,mg。
1.8.3 载药量测定取3 mL质量浓度为1 × 104 mg/L的戊唑醇纳米胶囊,在12 000 r/min下离心1 h。将沉淀物真空干燥4 h后得到戊唑醇粉末。取少量戊唑醇粉末用V (甲醇) : V (水) = 80 : 20水溶液定容至10 mL,过0.22 μm尼龙膜,经HPLC法测定沉淀物中戊唑醇的含量。采用公式 (2) 计算载药量 (φ)。
| $\varphi /{\text{%}}= \frac{{{m_2}}}{{{M_2}}} \times 100$ | (2) |
式中m2表示沉淀物中戊唑醇质量,mg;M2表示干燥后戊唑醇胶囊的总质量,mg。
1.9 戊唑醇CMCD纳米胶囊缓释性能测定参考文献方法[22]进行。将15 mL 1 × 104 mg/L戊唑醇纳米胶囊溶液与有效成分等质量的430 g/L戊唑醇悬浮剂装入透析袋中,分别置于1 000 mL V (甲醇) : V (水) = 80 : 20水溶液,低速搅拌,并在0.5、1、2、4、7、11、16、24、36及48 h分别量取0.5 mL混合液,经0.22 μm尼龙膜过滤,HPLC分析戊唑醇的含量。在原溶液体系中加入0.5 mL的V (甲醇) : V (水) = 80 : 20水溶液,以维持释放介质体积恒定。
对载药纳米胶囊的缓释行为进行释放动力学研究,采用释放规律Peppas方程 (式3) 进行拟合,并对Peppas方程释药特征指数n值进行相关性讨论。
| $\ln \left ({\frac{{{M_ {\rm{t}}}}}{{{M_\infty }}}} \right) = {\ln K} + n\ln t$ | (3) |
式中:Mt为t时间的累积释放量,M∞为 ∞ 时的累积释放量;k、n为模型参数;t为释放时间。可利用该公式描述戊唑醇纳米胶囊释药过程。
1.10 抑菌活性测定参考文献方法[23]进行。
1.10.1 供试菌种的活化将200 g马铃薯在1 000 mL水中煮沸30 min后用纱布过滤,收集滤液。将14 g琼脂粉在滤液中煮化,加入18 g葡萄糖,搅拌溶解,用蒸馏水定容至1 000 mL,高压 (100 kPa) 灭菌30 min (121 ℃) 得到马铃薯葡萄糖琼脂 (PDA) 培养基。无菌条件下制成PDA平板,将山核桃干腐病菌接种到PDA平板中,26 ℃培养箱中培养,待用。
1.10.2 含药培养基的制备将1 × 104 mg/L戊唑醇纳米胶囊溶液用甲醇水溶液稀释至50 mg/L。取3 mL 50 mg/L的戊唑醇纳米胶囊溶液和有效成分质量相等的430 g/L戊唑醇悬浮剂作为处理组,以二次蒸馏水和未载药的纳米胶囊作为对照组,无菌条件下制成含药PDA平板。各处理重复3次。
1.10.3 菌株接种和培养无菌条件下,打取直径为5 mm经活化后的山核桃干腐病菌菌饼,分别接种到处理组和对照组的PDA培养基平板中央 (每皿接种1块菌饼),用保鲜膜封口,于26 ℃培养箱中培养。分别在1、2、3、4、5、6、7、8、9、10、11和12 d测量菌落直径,采用公式 (4) 计算菌丝生长抑制率I。
| $I/{\text{%}}= \frac{{{d_1} - {d_2}}}{{{d_1} - d}} \times 100$ | (4) |
式中d1表示对照组菌落平均直径;d2表示处理组菌落平均直径;d表示菌饼直径。
2 结果与分析 2.1 化合物的结构表征 2.1.1 红外光谱分析羧甲基纤维素钠 (CMC-Na)、低分子质量的羧甲基纤维素钠 (LMW CMC-Na)、生育酚琥珀酸酯 (Ts) 及羧甲基纤维素钠衍生物 (CMCD) 的红外光谱如图1所示。
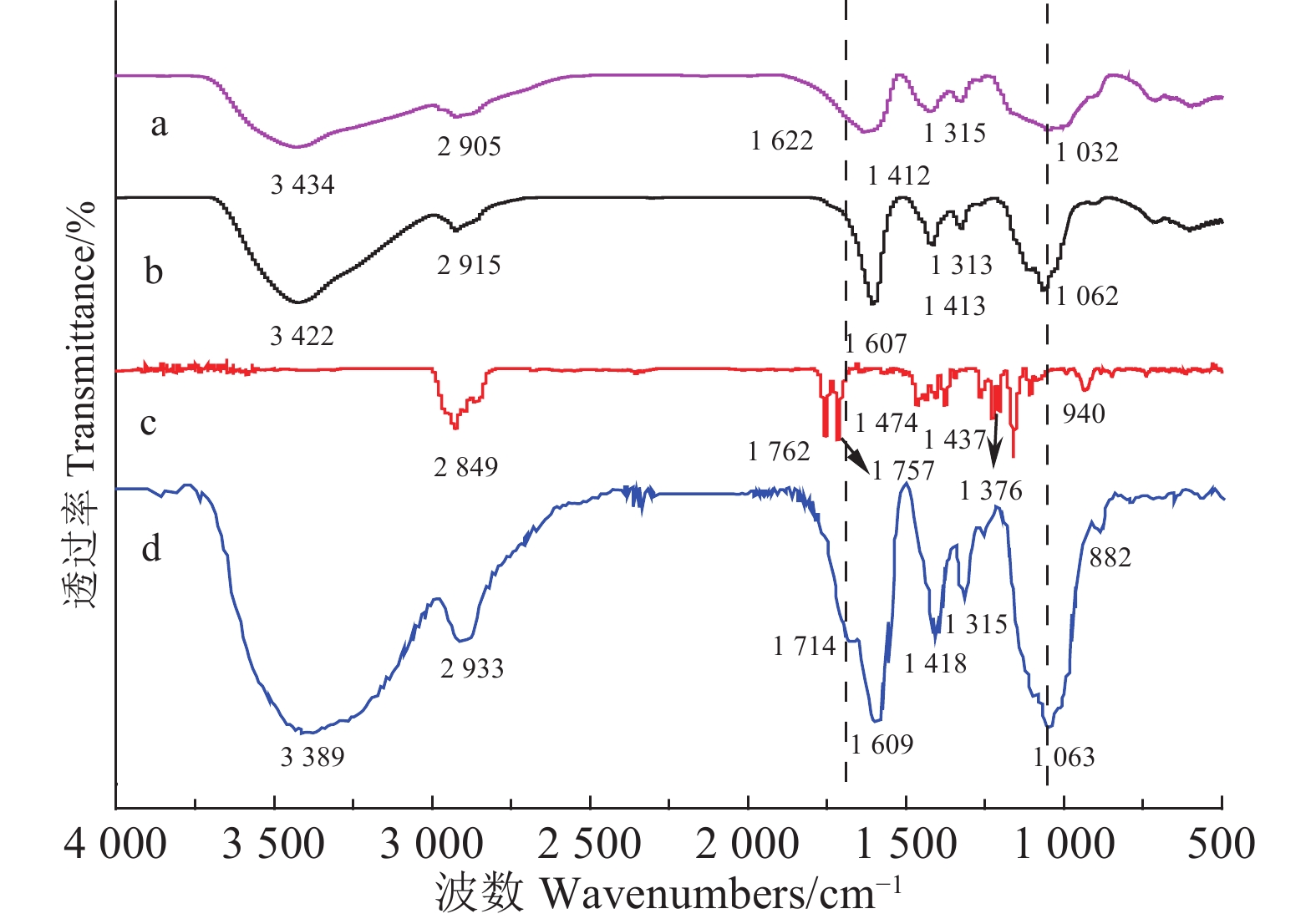
|
图 1 CMC-Na (a)、LMW CMC-Na (b)、Ts (c) 及CMCD (d) 的红外光谱图 Fig. 1 FT-IR spectra of CMC-Na(a), LMW CMC-Na(b), Ts(c) and CMCD(d) |
由图1可知:材料a (CMC-Na)和b (LMW CMC-Na) 在3 200~3 500 cm–1处均出现了强而宽的 –OH伸缩振动峰;在2 800~3 000 cm –1处存在–CH2– 和C–H的伸缩振动,在1 380~1 450 cm–1存在 –CH 2– 和C–H的弯曲振动,可见材料a和b均存在 –CH2– 和C–H基团;另外,两者在1 000~1 270 cm–1处存在C–O–C的伸缩振动峰,且在1 608 cm–1存在大量的 –CO–CH 2–CO– 结构,可知存在羧甲基纤维素糖苷键[24];由此判断材料a与b为具有相同化学结构的物质,进一步说明CMC-Na经降解后化学基团未发生改变。材料c (Ts) 在1 762 cm–1存在C=O伸缩吸收峰,在940 cm–1存在烯烃类C–H的弯曲振动峰,在2 849 cm–1存在 –OH (羧酸类) 的伸缩振动峰。
与材料b和c相比,材料d (CMCD) 在1 714 cm–1处存在C=O伸缩振动吸收峰,在1 063 cm–1存在C–O–C伸缩振动吸收峰,由此推测存在酯键,在3 200~3 500 cm–1处出现强而宽的吸收峰为 -OH的伸缩振动产生,是由于起始反应物CMC-Na中大量羟基的引入所致。由于在897 cm–1存在烯烃类C–H的弯曲振动峰,且在1 418 cm–1处出现苯环骨架振动峰,推测存在苯环结构。综上所述,各化合物红外图谱所得结果与预期一致。
2.1.2 核磁共振氢谱 (1H NMR) 分析低分子质量的羧甲基纤维素钠 (LMW CMC-Na)、生育酚琥珀酸酯 (Ts) 及羧甲基纤维素钠衍生物 (CMCD) 的核磁共振氢谱如图2所示。

|
图 2 LMW CMC-Na、Ts 及CMCD的核磁共振氢谱 Fig. 2 1H NMR of LMW CMC-Na, Ts and CMCD |
由图2可知,在LMW CMC-Na的1H NMR谱图中,δ 3.0~5.0的峰为LMW CMC-Na主链上C的化学位移[25],δ 2.0为羧甲基上CH2的化学位移。Ts的 1H NMR谱图中δ = 1.4~1.7为-CH−CH2-的化学位移[13],δ 12.1为羧甲基的化学位移,δ 3.1为羧甲基上CH2的化学位移,δ 2.2为苯上CH3的化学位移。通过产物与原料的 1H NMR对比可知,CMCD的 1H NMR谱图中未出现H1信号峰,同时H2的化学位移发生了改变。由H2化学位移发生改变可以初步断定是由于新形成的酯基具有负诱导效应,使得与之相连C上的质子周围电子云密度降低,屏蔽效应减少,δ增大所致。
2.1.3 X射线衍射 (XRD) 分析由图3曲线a可见,在2θ = 20.06°有较尖锐的馒头峰,这属于羧甲基纤维素钠的特征衍射峰[26]。与曲线a相比,曲线b虽然在2θ = 20.8°处也出现了馒头峰,但该峰形变宽,峰值减弱,基本无晶体衍射峰出现,经分析发现,主要是由于CMC-Na经物理研磨及化学降解后,从相对有序的晶型结构变为了无序杂乱的结构。与曲线b相比,曲线c在2θ = 38.6°出现了晶体衍射峰,在2θ = 21.9°出现了馒头峰,该峰形变窄,推测主要是由于在LMW CMC-Na分子链上接枝了生育酚琥珀酸酯,其晶形又从相对无序的结构变为了有序结构。结合XRD、FTIR及1H NMR分析,证实了生育酚琥珀酸酯接枝到了羧甲基纤维素钠分子链上,说明产物合成制备成功。
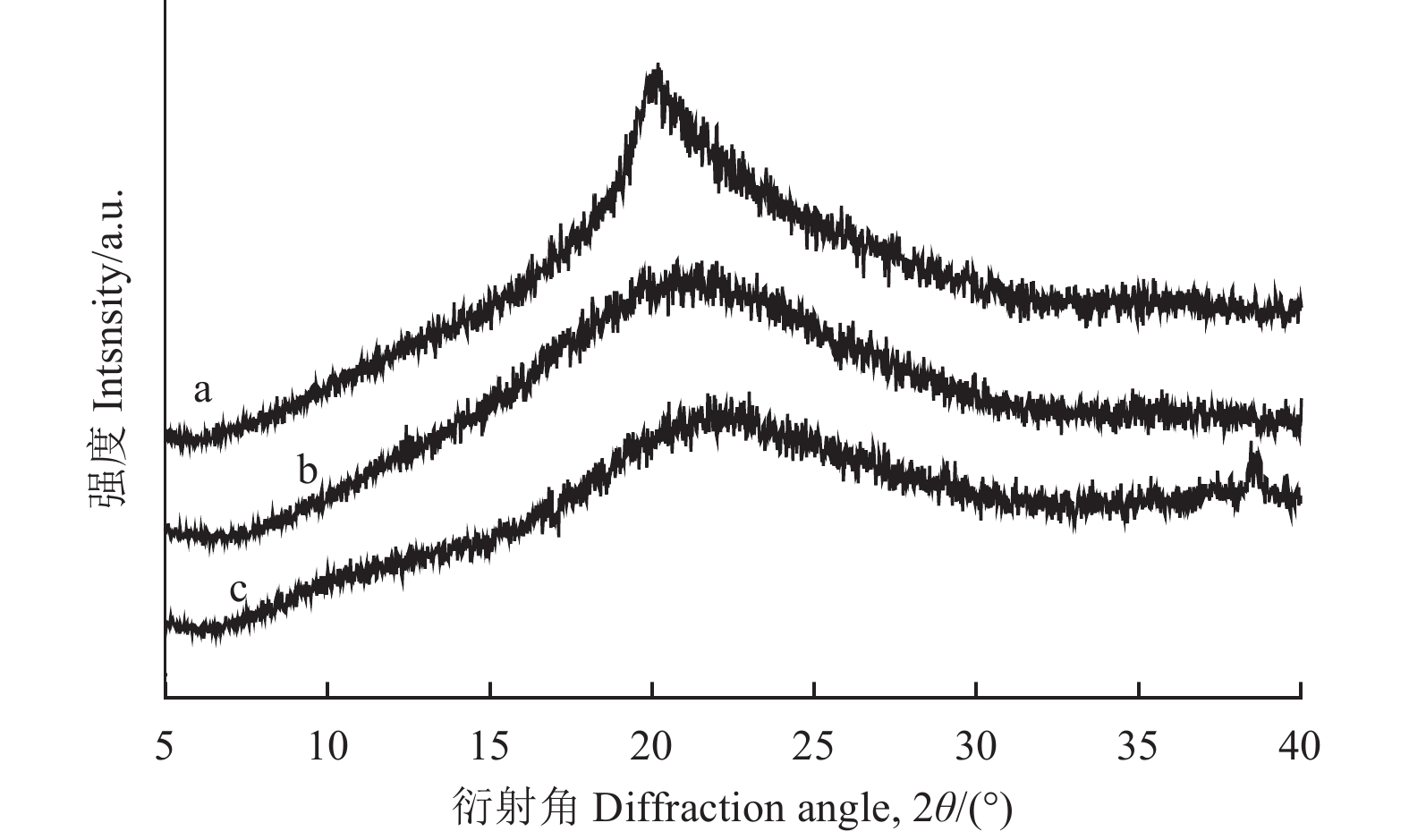
|
图 3 CMC-Na (a),LMW CMC-Na (b) and CMCD (c) 的X射线衍射图谱 Fig. 3 X-ray diffraction patterns of CMC-Na (a) , LMW CMC-Na (b) and CMCD (c) |
2.1.4 热重 (TG) 分析
羧甲基纤维素钠 (CMC-Na) 与羧甲基羧甲基纤维素钠衍生物 (CMCD)的 TG谱如图4所示。
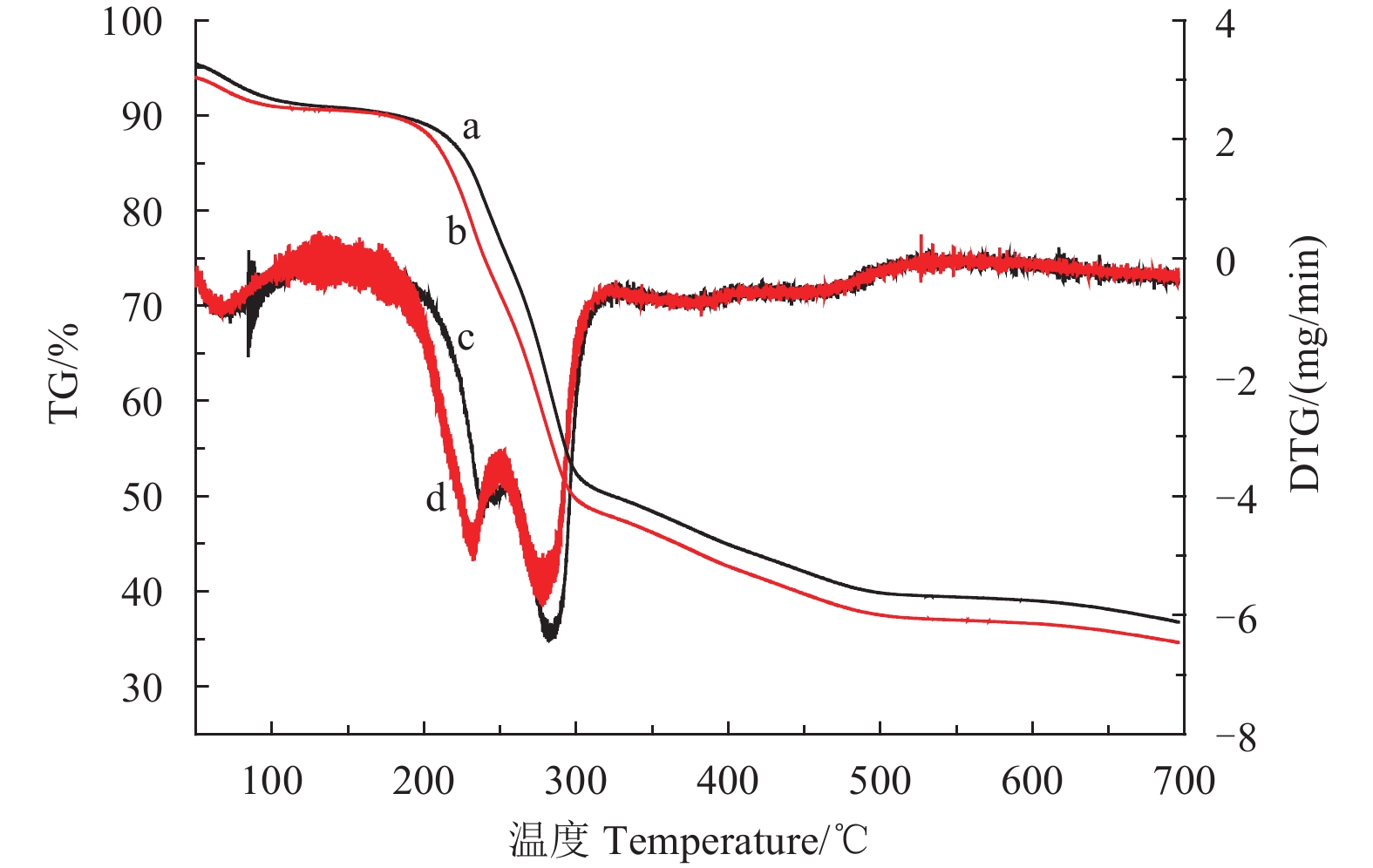
|
a:CMC-Na (TG);b: CMCD (TG);c:CMC-Na (DTG);d:CMCD (DTG) 图 4 CMC-Na及CMCD的热失重曲线 (TG和DTG) Fig. 4 Thermogravimetric (TG and DTG) curve of CMC-Na and CMCD |
从图4可知,CMC-Na在200 ℃之前会发生部分降解,这主要是由于吸附水的物理蒸发而引起的[27-28]。在242 ℃和284 ℃出现了2次急剧降解,并在310 ℃时降解基本完成,质量剩余约50%,这可能是由于CMC-Na中的羰基和C—H键被氧化,以脱去挥发性气体的方式为主产生的失重所导致的。CMCD的降解涉及到物理及化学变化,在190 ℃之前发生部分降解,主要是由于吸附水的蒸发;在232 ℃和277 ℃出现了2次急剧降解,并在300 ℃失去约50%的质量,这主要是由于CMCD中羰基及C—H键发生了氧化降解所导致的。此外,DTG曲线显示,CMC-Na的降解温度在200~310 ℃之间,而CMCD的降解温度在190~300 ℃之间,表明CMC-Na的降解温度高于CMCD。上述现象证明了CMC-Na经高温反应生成CMCD后热稳定性能变差。
2.2 CMCD自组装纳米胶束表征芘是一种具有高度对称结构的疏水性物质,借助其在水相与疏水相间的相互选择性分配原理可制备成荧光探针,其荧光发射谱的形状与荧光强度对环境极性的变化非常敏感[29]。临界胶束浓度 (CAC) 可通过观测在聚合两亲性分子存在的情况下芘散射荧光光谱峰1与峰3之间荧光强度比率的变化来确定。
临界胶束浓度值是表征两亲性聚合物的重要参数,当聚合物胶束浓度高于临界胶束浓度值时,聚合物可自组装形成纳米胶束[30]。图5为芘在CMCD胶束中的荧光光谱图。可见,随着CMCD质量浓度(ρ)的增加,荧光强度逐渐减小。
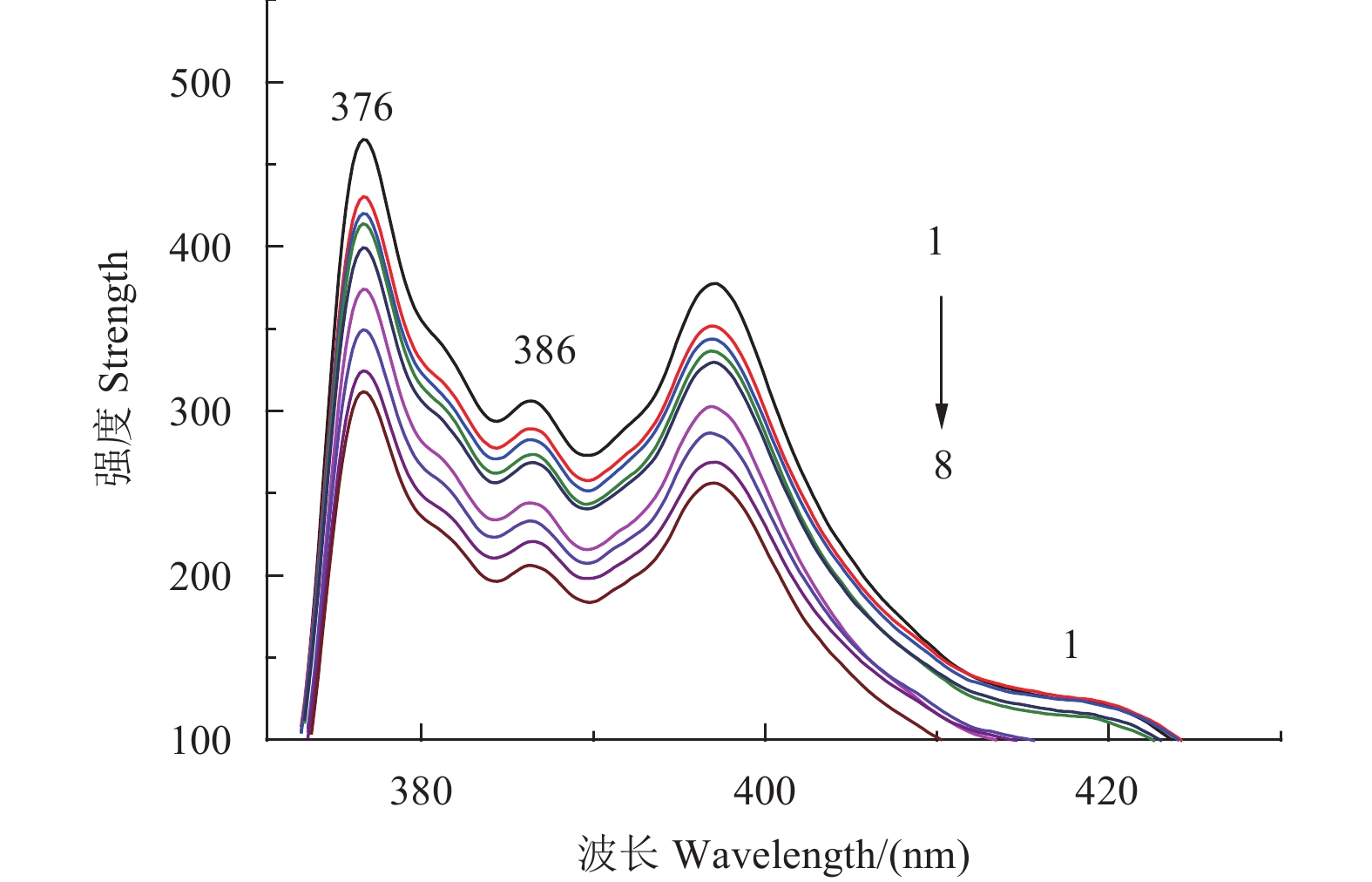
|
注:1~8表示胶束中CMCD的质量浓度分别为0.001、0.01、0.05、0.1、0.2、0.3、0.4、0.5和0.6 mg/mL。 Note: The concentrations of CMCD from 1 to 8 were 0.001, 0.01, 0.05, 0.1, 0.2, 0.3, 0.4, 0.5 and 0.6 mg/mL, respectively. 图 5 芘在CMCD胶束中的荧光光谱图 Fig. 5 Pyrene emission spectra of CMCD solutions |
图6为芘散射荧光光谱的I1/I3比值随CMCD胶束浓度变化的曲线。
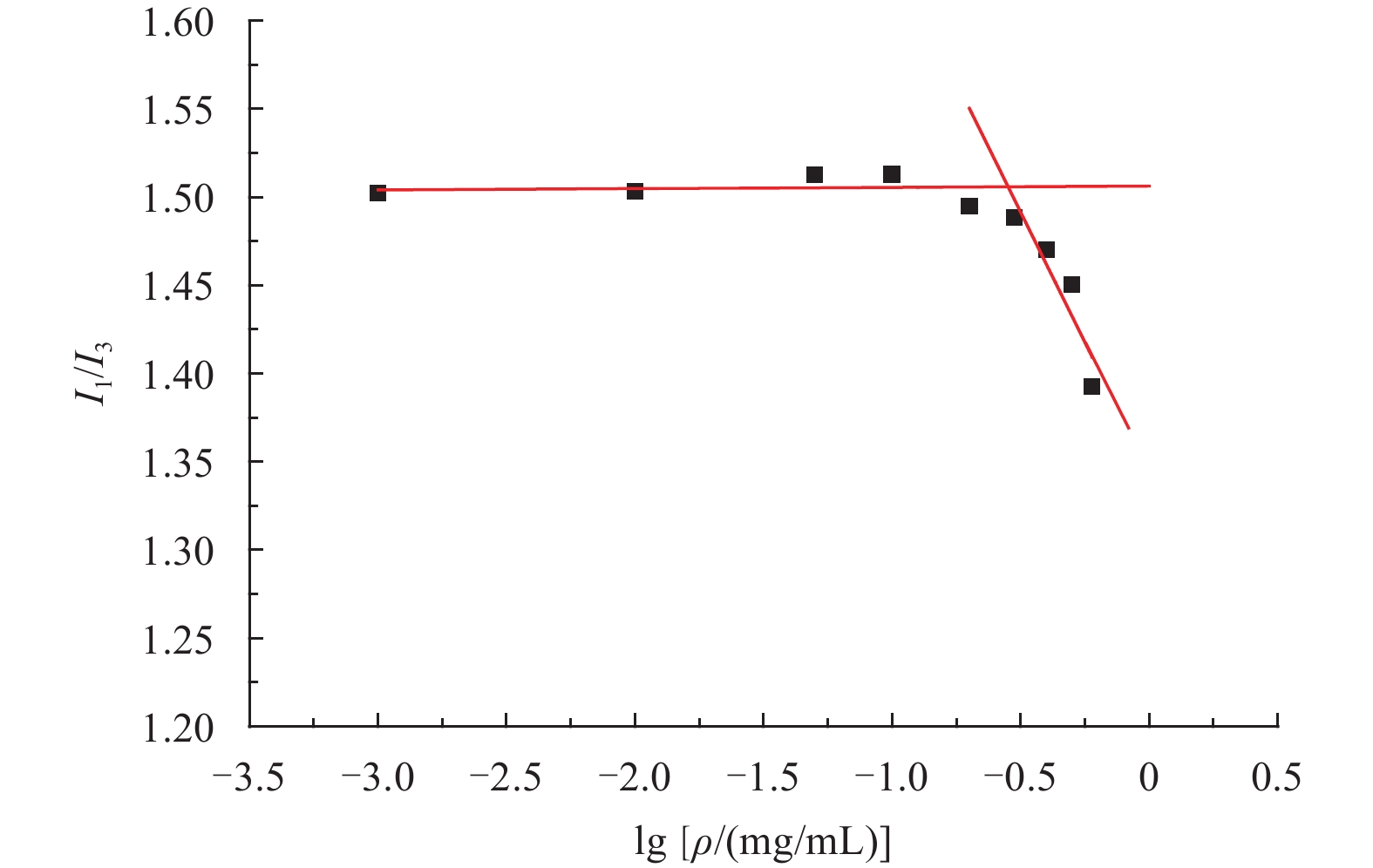
|
图 6 I1/I3值随胶束中CMCD质量浓度对数的变化曲线 Fig. 6 Intensity ratio (I1/I3) of the pyrene emission spectra versus the logarithm of concentration of CMCD coplolymers |
由图6可知:在低浓度时,CMCD水溶液的荧光强度比值保持在1.5左右基本不变;当浓度增大到一定程度时,荧光强度的比值急剧下降,说明此时芘进入了胶束的疏水内核,CMCD在水溶液中形成了胶束。试验测得两曲线交点处聚合物的胶束浓度为0.28 mg/mL,故得CMCD胶束的临界胶束浓度为0.28 mg/mL。
CMCD胶束含有大量亲水基团,具有亲水性,而其接枝生育酚琥珀酸酯后又使其分子具有疏水性,即成为两亲性分子。该分子在水中能自发形成内核疏水与外壳亲水的“核-壳”典型结构[31-32],即形成胶束自组装体。当CMCD胶束的浓度高于临界胶束浓度值时,自组装形成纳米胶束,芘由于分子间和分子内疏水作用力而通过微相萃取的作用进入胶束的核内部,此时芘处于疏水环境。当CMCD胶束浓度低于其临界胶束浓度时,CMCD以自由分子链的形式存在于水溶液中,此时芘处于亲水环境[33-34]。
2.3 戊唑醇纳米胶囊粒径分布和形貌载药和空白纳米胶囊的粒径分布图及透射电镜(TEM)图分别见图7和图8。
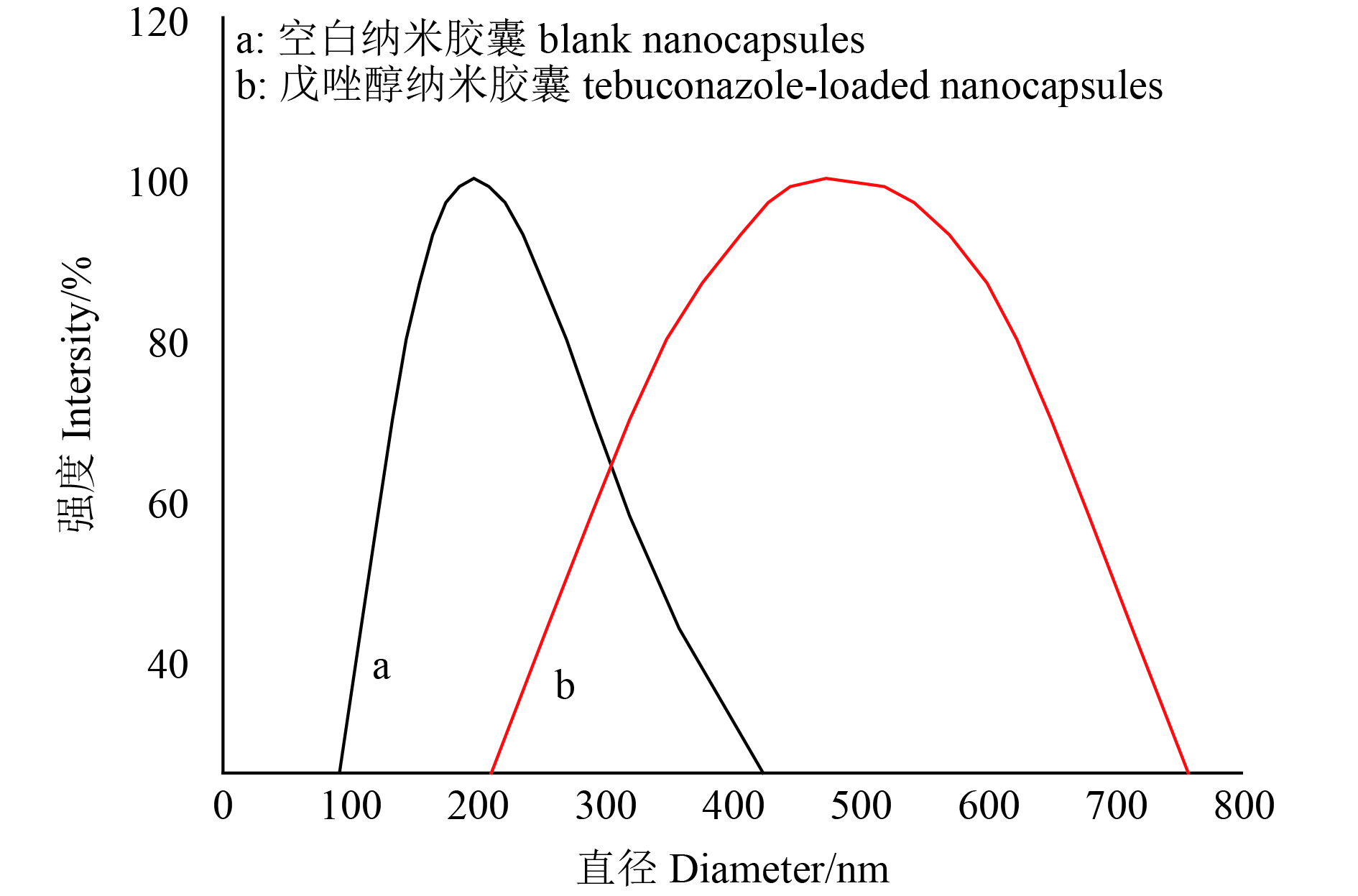
|
图 7 空白纳米胶囊(a)和戊唑醇纳米胶囊(b)的粒径分布图 Fig. 7 Particle size distributions of blank nanocapsules(a) and tebuconazole-loaded nanocapsules(b) |
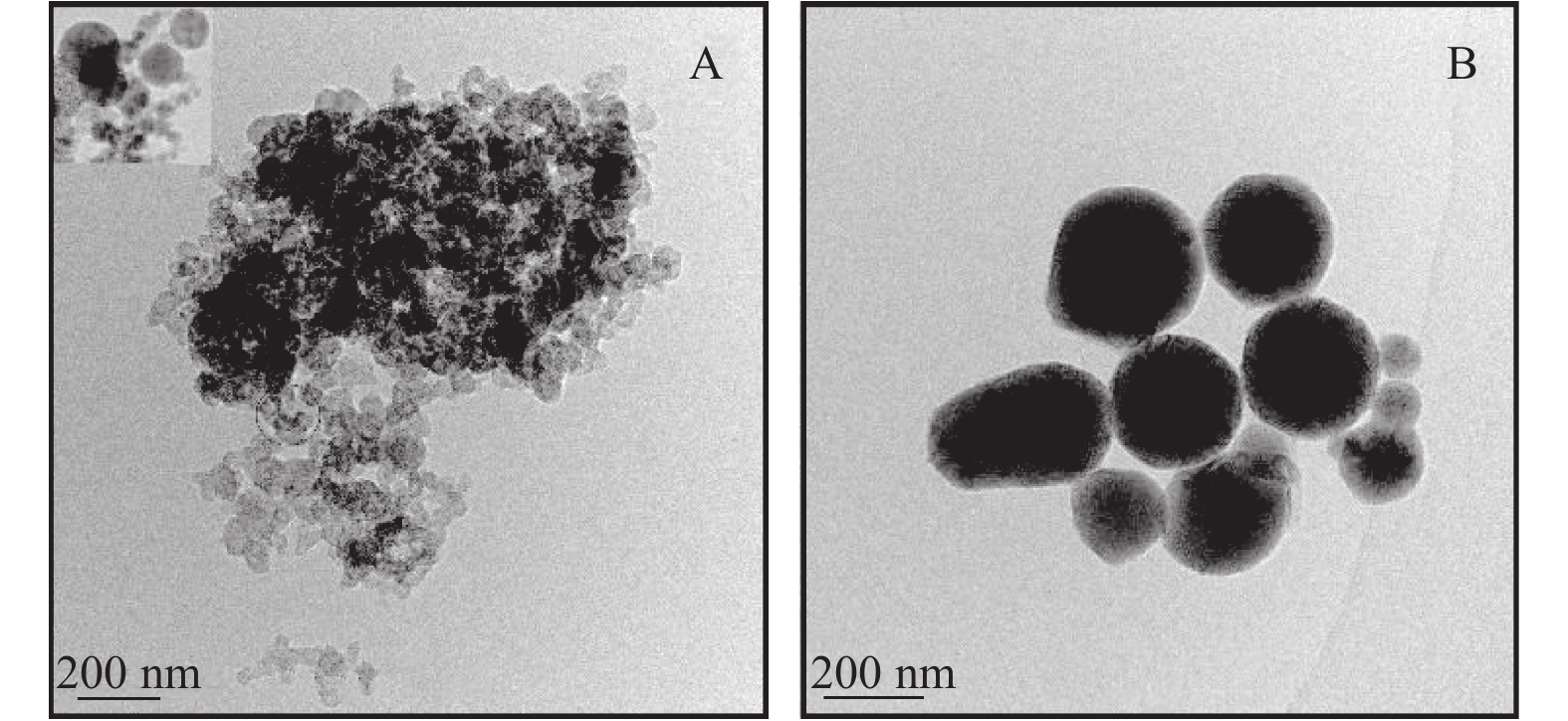
|
图 8 空白纳米胶囊 (A) 和戊唑醇纳米胶囊 (B) 的透射电镜照片 Fig. 8 TEM images of blank nanocapsules (A) and tebuconazole-loaded nanocapsules (B) |
由图7可知:经动态光散射 (dynamic light scattering,DLS) 测得空白纳米胶囊的平均粒径为197.0 nm,多分散系数 (PDI) 为0.303;载药纳米胶囊的平均粒径为493.7 nm,PDI为0.243。载药纳米胶囊的平均粒径大于空白,主要是由于疏水性的药物进入纳米胶囊的疏水性内核中,使得粒径变大。载药纳米胶囊的PDI小于空白纳米胶囊,但二者均在0.2~0.4之间,表明其分散性均良好。
由Zeta电位测试结果可知,载药及空白纳米胶囊的Zeta电位分别为 –25.05和 –29.72,前者绝对值小于后者,说明载药纳米胶囊的稳定性变差。图8中照片A和B均为球形颗粒,空白纳米胶囊的粒径约为50~100 nm,而载药纳米胶囊的粒径约为400~500 nm,其原因与动态光散射结果一致,但动态光散射测量得到的粒径大于透射电镜测得的粒径,这主要是由于纳米胶囊在溶液中发生了部分聚集,故所测的粒径偏大。由图7结合图8可知,初步获得预期的载戊唑醇纳米胶囊。
2.4 戊唑醇纳米胶囊的载药及释放性能 2.4.1 HPLC标准曲线由戊唑醇标样及戊唑醇纳米胶囊中戊唑醇的高效液相色谱图(图9)可知,戊唑醇的保留时间为4.5 min。以谱图峰面积对戊唑醇的质量浓度进行线性回归,建立戊唑醇HPLC标准曲线,得到线性关系良好的回归方程:y = 46 042.60x + 3.08 × 107 (SD = 893 883.16,N = 7,R2 = 0.997 8,P < 0.999 1)。
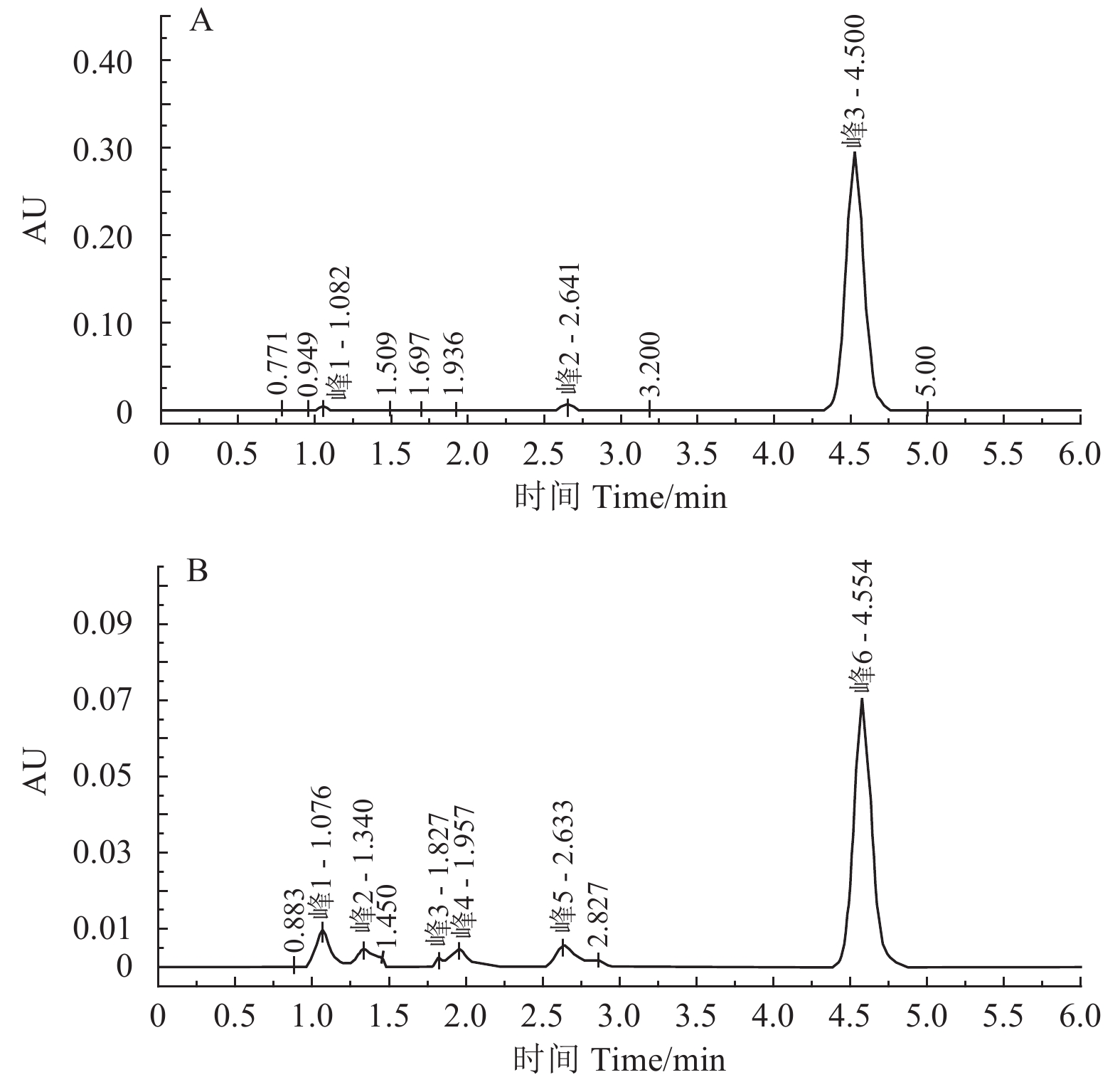
|
图 9 戊唑醇标样 (1 000 mg/L,A) 及戊唑醇纳米胶囊 (1 × 104 mg/L,B) 的高效液相色谱图 Fig. 9 HPLC spectra of tebuconazole standard sample (1 000 mg/L, A) and tebuconazole-loaded nanocapsules (1 × 104 mg/L, B) |
2.4.2 包封率与载药量
本研究结果表明,所制备的戊唑醇纳米胶囊的包封率为50.8%,载药量为40.4%,载药性能较好。由于少量游离的戊唑醇会附着在胶束表面而未被分离到上清液中,因此,在计算载药量和包封率时包括了这部分戊唑醇,这与Gaueher等[35]和张旭等[36]的研究报道类似。
2.4.3 缓释性能及其释放动力学由所制备的戊唑醇纳米胶囊及430 g/L戊唑醇悬浮剂的累积释药率(图10)结果可知:2种剂型的累积释药率均具有先快速增加后缓慢增加的变化趋势。在4 h前,戊唑醇悬浮剂的累积释药率明显高于戊唑醇纳米胶囊,累积释药率达到93.21%;4 h后,戊唑醇纳米胶囊累积释药率的速率缓慢增加,48 h时仅为77.78%,说明此时微囊中戊唑醇还未被完全释放,表明载药纳米胶囊具有良好的缓释特性。
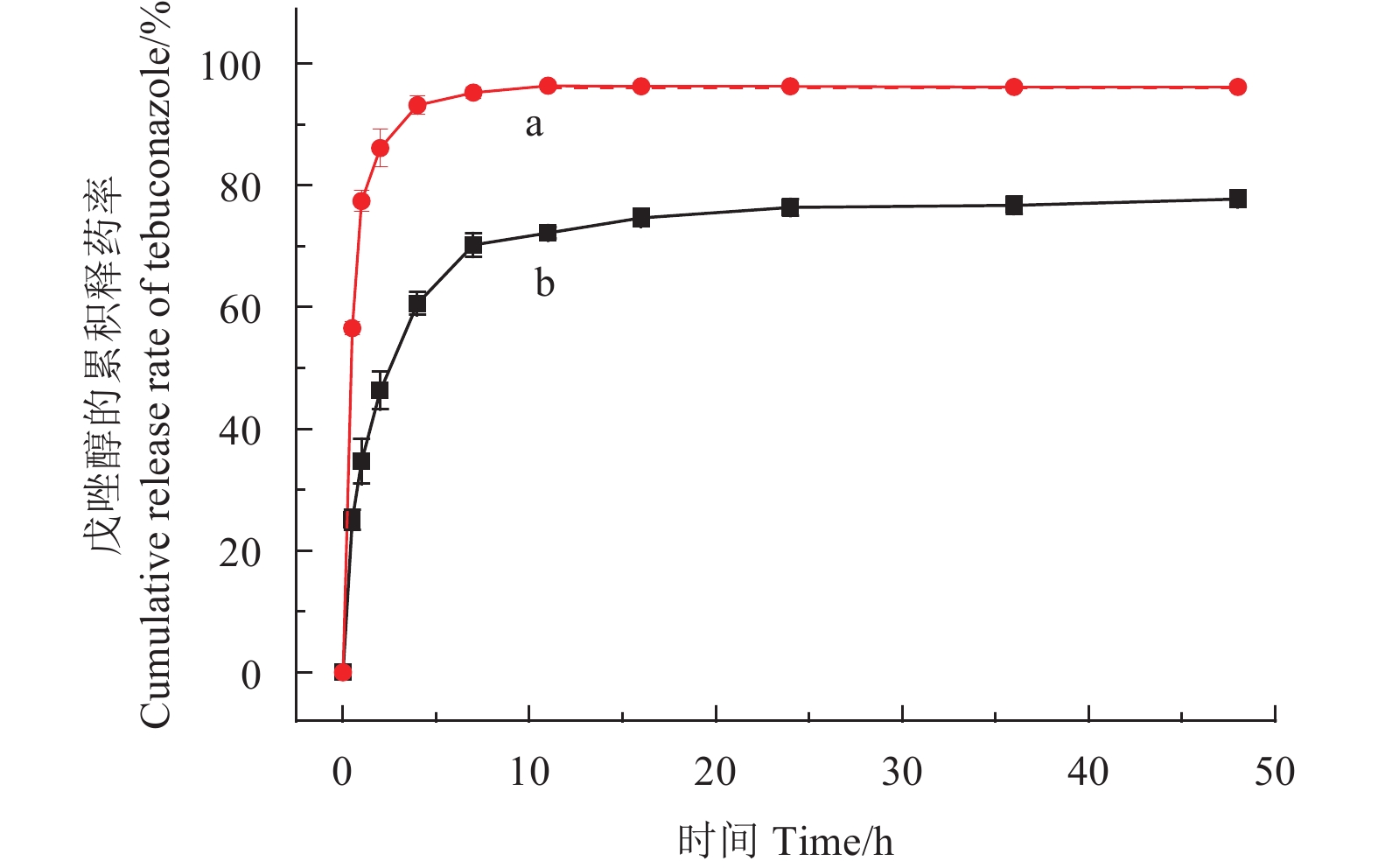
|
图 10 戊唑醇纳米胶囊(b)和戊唑醇悬浮剂(a)的累积释放曲线 Fig. 10 Release profiles of tebuconazole-loaded nanocapsules (b) and tebuconazole SC (a) |
对载药纳米胶囊的缓释行为进行释放动力学研究,采用释放规律Peppas[37-38]方程进行拟合,得到各模型参数(表1)。
|
|
表 1 戊唑醇纳米胶囊及430 g/L戊唑醇悬浮剂释药率拟合结果 Table 1 Data fitting results of three types of tebuconazole-loaded nanocapsules and tebuconazole 430 g/L SC pesticides release |
由表1可见:决定系数R2 ≥ 0.99,说明戊唑醇纳米胶囊及戊唑醇悬浮剂的释药过程均符合Peppas释放方程;n < 0.45,说明该药物释放属于Fick扩散类型 [22],是药物扩散作用。其释放机理大致可阐述为:当戊唑醇与羧甲基纤维素钠衍生物在水中形成纳米胶囊后,随着外界环境,如温度和水流运动等的变化,载戊唑醇纳米胶囊的稳定性变差,水分进入到疏水核内,而同时戊唑醇也从纳米胶囊的疏水核内释放而进入到溶剂中。
2.5 载戊唑醇纳米胶囊的抑菌作用为探究相同质量有效成分的戊唑醇纳米胶囊和戊唑醇悬浮剂对山核桃干腐病菌的抑制作用,粗略测得不同时间段各制剂有效成分含量(表2)。其抑菌试验结果(图11)。可见,其不同处理组对山核桃干腐病菌的抑菌率均随时间的延长而降低,前6 d纳米胶囊的抑菌效果略低于悬浮剂,但之后前者则明显高于后者,同时在第10天时戊唑醇悬浮剂的抑菌率为0,而载药纳米胶囊在第12天时的抑菌率仍有17.67%。说明载药微纳米胶囊具有良好的缓释性能。
|
|
表 2 戊唑醇纳米胶囊及戊唑醇悬浮剂在不同时间段的有效成分质量分数 Table 2 Active component contents of tebuconazole-loaded nanocapsules and tebuconazole SC in different time periods |
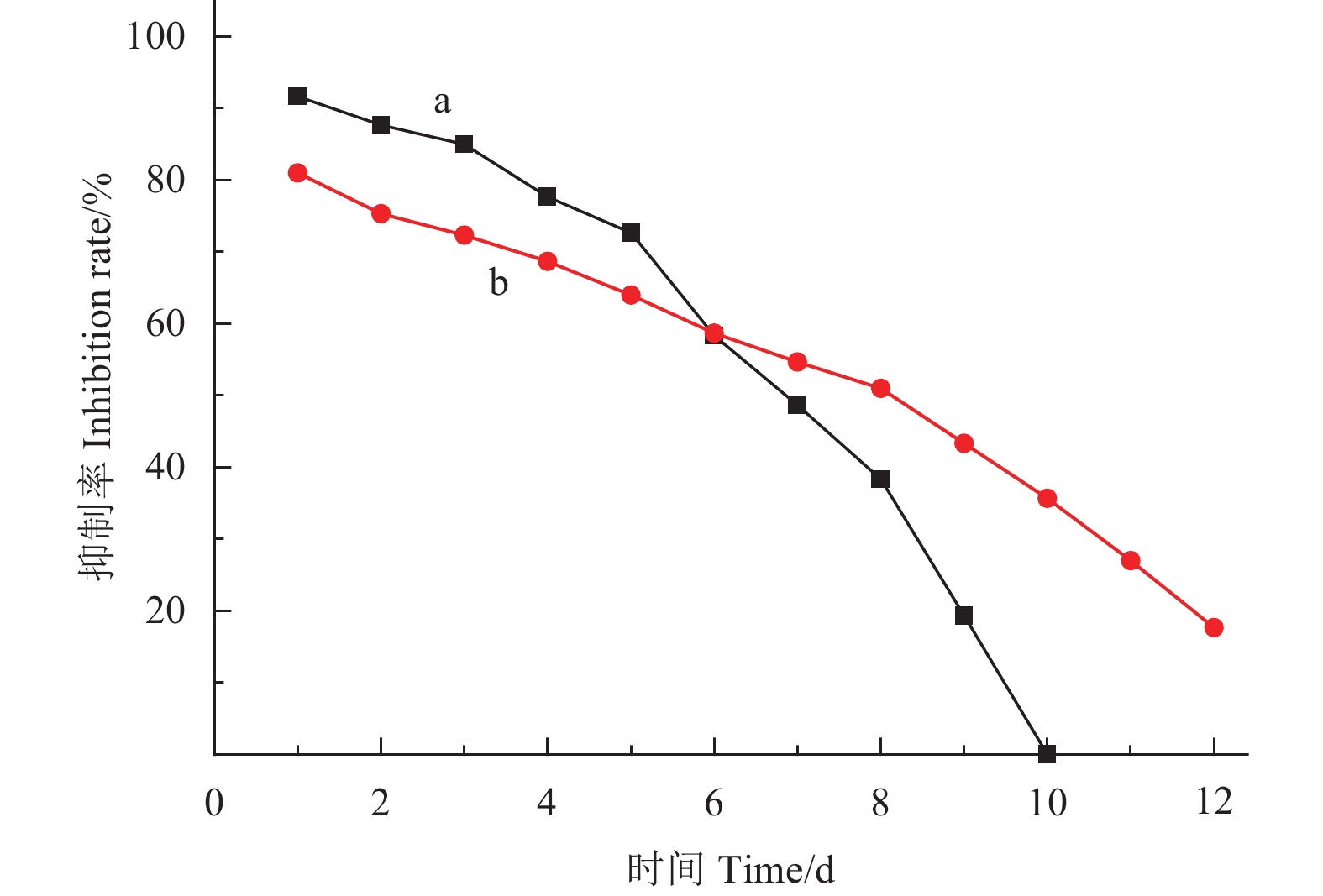
|
图 11 不同时间戊唑醇纳米胶囊(b)和戊唑醇悬浮剂(a)对山核桃干腐病菌的抑制作用 Fig. 11 Inhibifion curves of tebuconazole loaded nanocapsules (b) and tebuconazole SC (a) against Botryosphaeria dothidea |
3 结论
本研究首次采用羧甲基纤维素钠 (CMC-Na) 为原料,使其通过离子液体活化法发生酯化反应,合成了新型羧甲基纤维素钠衍生物 (CMCD),并通过超声/溶剂挥发法成功制备得到了新型两亲性戊唑醇纳米胶囊,测得其包封率为50.8%,载药量为40.4%。该纳米胶囊具有良好缓释及抑菌性能,其48 h最终累积释药率仅为77.78%;施药12 d时对山核桃干腐病菌菌丝生长的抑制率仍可达17.67%,具有良好的缓释性能及较好的应用潜质。
本研究为农药控释剂型提供了新的包载材料,具有一定的参考价值和实际应用意义,但对其林间实际防效还有待进一步研究。
| [1] |
冯建国, 徐妍, 罗湘仁, 等. 浅谈溶剂蒸发法制备微胶囊与农药微胶囊的开发[J]. 农药学学报, 2011, 13(6): 568-575. FENG J G, XU Y, LUO X R, et al. Discussion on the solvent evaporation method for preparation of microcapsules and the development of the pesticides microcapsules[J]. Chin J Pestic Sci, 2011, 13(6): 568-575. DOI:10.3969/j.issn.1008-7303.2011.06.02 |
| [2] |
SUTTI A, CHAFFRAIX T, VODA A S, et al. Nano-capsules of amphiphilic poly (ethylene glycol)-block-poly (bisphenol A carbonate) copolymers via thermodynamic entrapment[J]. RSC Adv, 2016, 6(8): 6065-6071. DOI:10.1039/C5RA23555C |
| [3] |
张小军, 王海涛, 张宗俭, 等. 界面聚合法制备阿维菌素微胶囊悬浮剂[J]. 现代农药, 2011, 10(4): 24-26. ZHANG X J, WANG H T, ZAHNG Z J, et al. Interfacial polymerization preparation of abamectin capsule suspension[J]. Mod Agrochem, 2011, 10(4): 24-26. DOI:10.3969/j.issn.1671-5284.2011.04.005 |
| [4] |
章彬. 溶剂挥发法制备的七氟菊酯生物可降解农药微胶囊研究[D]. 长沙: 湖南农业大学, 2014. ZHANG B. Studies on tefluthrin pesticide microcapsule based on the biodegradable material carrier by solvent evaporation method[D]. Changsha: Hunan Agricultural University, 2014. |
| [5] |
WIBOWO D, ZHAO C X, PETERS B C, et al. Sustained release of fipronil insecticide in vitro and in vivo from biocompatible silica nanocapsules
[J]. J Agric Food Chem, 2014, 62(52): 12504-12511. DOI:10.1021/jf504455x |
| [6] |
HU J, XIAO Z B, ZHOU R J, et al. Properties of aroma sustained-release cotton fabric with rose fragrance nanocapsule[J]. Chin J Chem Eng, 2011, 19(3): 523-528. DOI:10.1016/S1004-9541(11)60016-5 |
| [7] |
RAMADOSS P, ARUL K T, RAMYA J R, et al. Enhanced mechanical strength and sustained drug release of gelatin/keratin scaffolds[J]. Mater Lett, 2017, 186: 109-112. DOI:10.1016/j.matlet.2016.09.095 |
| [8] |
李继昭, 袁志强, 闫萌, 等. cRGD介导的pH敏感性紫杉醇羧甲基壳聚糖-软脂酸胶束[J]. 药学学报, 2016, 51(4): 642-649. LI J Z, YUAN Z Q, YAN M, et al. pH-sensitive micelles loaded paclitaxel using carboxymethyl chitosan-palmitic acid mediated by cRGD[J]. Chin J Pestic Sci, 2016, 51(4): 642-649. |
| [9] |
YUSOFF S N M, KAMARI A, ALJAFREE N F A. A review of materials used as carrier agents in pesticide formulations[J]. Int J Environ Sci Technol, 2016, 13(12): 2977-2994. DOI:10.1007/s13762-016-1096-y |
| [10] |
郭成功, 王亮, 王彩旗, 等. 两亲性生物降解羟丙基纤维素-聚己内酯接枝共聚物在蛋白药物微胶囊中的应用[J]. 高分子材料科学与工程, 2012, 28(10): 110-113. GUO C G, WANG L, WANG C Q, et al. Application of the hydroxypropyl cellulose-graft-polycaprolactone copolymer in drug microencapsulation[J]. Polym Mate Sci Eng, 2012, 28(10): 110-113. |
| [11] |
HASSANI L N, HENDRA F, BOUCHEMAL K. Auto-associative amphiphilic polysaccharides as drug delivery systems[J]. Drug Discov Today, 2012, 17(11-12): 608-614. DOI:10.1016/j.drudis.2012.01.016 |
| [12] |
张子勇, 翟溯航, 王金慧. 高效氯氟氰菊酯微乳剂的制备及其液径尺寸[J]. 农药, 2012, 51(5): 351-354, 357. ZHANG Z Y, ZHAI S H, WANG J H. Preparation of cyhalothrin micro-emulsion formulation and its micro-droplet size[J]. Agrochemicals, 2012, 51(5): 351-354, 357. DOI:10.3969/j.issn.1006-0413.2012.05.011 |
| [13] |
张传清, 章祖平, 孙品雷, 等. 山核桃干腐病菌对7种杀菌剂的敏感性比较及其对苯醚甲环唑敏感基线的建立[J]. 农药学学报, 2011, 13(1): 84-86. ZAHNG C Q, ZHANG Z P, SUN P L, et al. Comparison of sensitivity of botryosphaeria dothidea to 7 fungicides and its baseline sensitivity to difenoconazole[J]. Chin J Pestic Sci, 2011, 13(1): 84-86. DOI:10.3969/j.issn.1008-7303.2011.01.14 |
| [14] |
SHAPIRO-ILAN DI, COTTRELL T E, JACKSON M A, et al. Control of key pecan insect pests using biorational pesticides[J]. J Eco Entomol, 2013, 106(1): 257-266. DOI:10.1603/EC12302 |
| [15] |
戴德江, 马海芹, 沈瑶, 等. 几种杀菌剂对山核桃干腐病的室内活性筛选与应用[J]. 农药, 2015, 54(3): 217-230. DAI D J, MA H Q, SHEN Y, et al. Application and screening of fungicides for controlling carya tree canker caused by botryosphaeria dothidea[J]. Agrochemicals, 2015, 54(3): 217-230. |
| [16] |
褚旭东, 宋传虎, 周益宁, 等. 新型降解剂制备窄分子量纤维素的研究[J]. 黑龙江大学自然科学学报, 2012, 29(5): 653-657. CHU X D, SONG C H, ZHOU Y N, et al. Preparation of narrow molecular-weight cellulose using novel degradation reagent[J]. J Nat Sci Heilongjiang Univ, 2012, 29(5): 653-657. |
| [17] |
强丹丹. 杂多酸选择性水解纤维素技术与机理的研究[D]. 西安: 陕西科技大学, 2016. QIANG D D. Research on technology and mechanism of selective hydrolysis of cellulose by heteropoly acid[D]. Xi’an: Shaanxi University of Science & Technology, 2016. |
| [18] |
刘明灯, 赵文军, 杨丹红, 等. 高活性Brönsted离子液体催化酯化反应[J]. 化学试剂, 2007, 29(10): 587-588, 616. LIU M D, ZHAO W J, YANG D H, et al. Brönsted acidic ionic liquids:an efficient catalyst for esterification[J]. Chem Reag, 2007, 29(10): 587-588, 616. DOI:10.3969/j.issn.0258-3283.2007.10.004 |
| [19] |
贺少龙, 洪彤彤, 刘艳华, 等. 水飞蓟素载药纳米胶束的制备及初步评价[J]. 宁夏医科大学学报, 2016, 38(8): 868-871, 978. HE S L, HONG T T, LIU Y H, et al. Preparation and preliminary evaluation of silymarin-loaded mano-micelle[J]. J Ningxia Med Univ, 2016, 38(8): 868-871, 978. |
| [20] |
丛萌逸, 王海鹏, 殷加奇, 等. 1种新型海洋多糖纳米材料的制备及载药特性研究[J]. 中国海洋药物, 2017, 36(1): 76-82. CONG M Y, WANG H P, YIN J Q, et al. Synthesis and characterization of a novel marine polysaccharide based nanoparticle[J]. Chin J Mar Drugs, 2017, 36(1): 76-82. |
| [21] |
王芳, 肖军, 王经文, 李淑琴. 溶剂蒸发法微胶囊固化剂的制备与表征[J]. 南京航空航天大学学报, 2008, 40(1): 120-124. WANG F, XIAO J, WANG J W, et al. Preparation and characterization of microcapsule mold-curing agent by solvent evaporation technique[J]. J Nanjing Univ Aeronaut Astronaut, 2008, 40(1): 120-124. DOI:10.3969/j.issn.1005-2615.2008.01.025 |
| [22] |
韩志任, 杜有辰, 李刚, 等. 阿维菌素脲醛树脂微胶囊的制备及其缓释性能[J]. 农药学学报, 2007, 9(4): 405-410. HAN Z R, DU Y C, LI G, et al. Preparation and sustained-release behavior of abamectin urea-formaldehyde resin microcapsules[J]. Chin J Pestic Sci, 2007, 9(4): 405-410. DOI:10.3321/j.issn:1008-7303.2007.04.015 |
| [23] |
王宁, 齐麟, 王娅, 等. 温度响应型吡唑醚菌酯微囊的制备与性能表征[J]. 农药学学报, 2017, 19(3): 381-387. WANG N, QI L, WANG Y, et al. Preparation and performance of thermo-sensitive pyraclostrobin microcapsules[J]. Chin J Pestic Sci, 2017, 19(3): 381-387. |
| [24] |
李伟雪, 朱国华, 吕东军, 等. 羧甲基纤维素钠接枝日落黄的合成、表征和抗还原性研究[J]. 化学研究与应用, 2017, 29(6): 805-809. LI W X, ZHU G H, LV D J, et al. Synthesis, characterization and research on against reducibility of Sodium carboxymethyl cellulose grafted sunset yellow[J]. Chem Res Appl, 2017, 29(6): 805-809. DOI:10.3969/j.issn.1004-1656.2017.06.009 |
| [25] |
李红卫, 赵岚, 吴坤. α-生育酚琥珀酸酯的合成及抑制肿瘤作用[J]. 中国公共卫生, 2005, 21(2): 173-175. LI H W H, ZHAO L, WU K. Synthesis of α-tocopherol succinate and study on its function form in inhibiting[J]. Chin J Public Health, 2005, 21(2): 173-175. DOI:10.3321/j.issn:1001-0580.2005.02.023 |
| [26] |
史晋辉, 胡昕, 吴淑茗, 等. 生物质基羧甲基纤维素钠的合成与表征[J]. 河南化工, 2013, 30(18): 35-38. SHI J H, HU X, WU S M, et al. Preparation and characterization of sodium carboxymethyl cellulose from biomass resource[J]. Henan Chem Ind, 2013, 30(18): 35-38. DOI:10.3969/j.issn.1003-3467.2013.18.009 |
| [27] |
李永艳, 陈玉惠, 敖新宇. 茶藨生柱锈重寄生木霉产毒条件的优化[J]. 东北林业大学学报, 2011, 39(5): 102-104. LI Y Y, CHEN Y H, AO X Y. Optimal conditions for toxin production of mycoparasite trichoderma atroviride on cronartium ribicola[J]. J Northeast For Univ, 2011, 39(5): 102-104. DOI:10.3969/j.issn.1000-5382.2011.05.032 |
| [28] |
VEITCH N C. Horseradish peroxidase: a modern view of a classic enzyme[J]. Phytochemistry, 2004, 65(3): 249-259. DOI:10.1016/j.phytochem.2003.10.022 |
| [29] |
MATSUI J, MITSUISHI M, MIYASHITA T. Characterization of the molecular environment of polymer langmuir−blodgett films using a pyrene fluorescent probe[J]. Macromolecules, 1999, 32(2): 381-386. DOI:10.1021/ma981471x |
| [30] |
杨涛, 李文娟, 周从山. 芘荧光探针光谱法测定CTAB临界胶束浓度[J]. 石化技术与应用, 2007, 25(1): 48-50, 54. YANG T, LI W J, ZHOU C S, et al. Determination of critical micelle concentration of CTAB by pyrene fluorescence probe spectrometry[J]. Petrochem Technol Appl, 2007, 25(1): 48-50, 54. DOI:10.3969/j.issn.1009-0045.2007.01.012 |
| [31] |
GEVORKYAN M G. Influence of micelles of different types of surfactant on the mechanism of diphenylamine oxidation with potassium persulfate[J]. Kinet Catal, 2005, 46(3): 364-367. DOI:10.1007/s10975-005-0085-9 |
| [32] |
LIU N J, HE Q, BU W F. Self-assembly of star micelle into vesicle in solvents of variable quality: The star micelle retains its core-shell nanostructure in the vesicle[J]. Langmuir, 2015, 31(8): 2262-2268. DOI:10.1021/la504817q |
| [33] |
刘晨光, 董学猛, 金晓明, 等. 基于疏水化修饰水溶性多糖的纳米粒制备及应用研究进展[J]. 功能材料, 2007, 38(S1): 1941-1946. LIU C G, DONG X M, JIN X M, et al. Preparations and applications of hydrophobized polysaccharides nanoparticle[J]. Funct Mater, 2007, 38(S1): 1941-1946. |
| [34] |
AGUIAR J, CARPENA P, MOLINA-BOı́VAR J A, et al. On the determination of the critical micelle concentration by the pyrene 1: 3 ratio method[J]. J Colloid Interface Sci, 2003, 258(1): 116-122. DOI:10.1016/S0021-9797(02)00082-6 |
| [35] |
GAUCHER G, DUFRESNE M H, SANT V P, et al. Block copolymer micelles: preparation, characterization and application in drug delivery[J]. J Control Release, 2005, 109(1-3): 169-188. DOI:10.1016/j.jconrel.2005.09.034 |
| [36] |
张旭, 周月英, 陈安良, 等. 负载戊唑醇的聚乙二醇-聚己内酯胶束的制备与性能研究[J]. 农药学学报, 2012, 14(3): 327-333. ZHANG X, ZHOU Y Y, CHEN A L, et al. Preparation and performances of poly (ethyleneglycol)-polycaprolactone micelles loaded with tebuconazole[J]. Chin J Pestic Sci, 2012, 14(3): 327-333. DOI:10.3969/j.issn.1008-7303.2012.03.14 |
| [37] |
RITGER P L, PEPPAS N A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs[J]. J Control Release, 1987, 5(1): 23-36. DOI:10.1016/0168-3659(87)90034-4 |
| [38] |
林亚平, 卢维伦. 非溶蚀型药物体系的释放动力学新模型-Fick第一扩散定律的修正及其应用[J]. 药学学报, 1997, 32(11): 869-873. LIN Y P, LU W L. A new dynamic model of release for not-corroded drug systezxm-revision and use of Fick’s first law[J]. Acta Pharmaceutica Sinica, 1997, 32(11): 869-873. |
 2018, Vol. 20
2018, Vol. 20


