绿叶菜具有生育期短、病虫害种类多的特点,农药残留问题较为严重[1-2]。为保证消费者食用安全,满足国内外对蔬菜中农药残留日益严苛的限量标准,对绿叶菜类蔬菜中的农药残留进行准确定性定量十分必要。
液相色谱-串联质谱技术 (LC-MS/MS) 灵敏度高,抗干扰能力强,已被广泛用于农药残留检测中[3-4],但普遍存在基质减弱效应而影响分析结果的准确性与精密度,因此在LC-MS/MS分析中必须考虑基质效应[5]。目前,补偿基质效应最基本的方法是基质净化法[6]、标准加入法[7]、同位素标记法[8]、基质匹配标准溶液法[9]和加入分析保护剂等[10]。基质匹配标准溶液法由于方法简单,是目前LC-MS/MS中消除基质效应的常用方法,但在实际工作中,不同样品基质性质不同,获得每种基质的空白样品并配制标准溶液较为困难。目前应对方法为根据主要成分组成将基质分类,每类选择1种或多种代表性基质进行校正[11]。欧盟推荐可依据基质的含水量、含糖量、含油脂量和含蛋白质量进行分类[11],但即便是同一个种属,基质效应的强弱也有很大差异[12]。
本研究采用超高效液相色谱-串联质谱 (UPLC-MS/MS) 技术,选择绿叶菜中常用的36种农药,比较了QuEChERS前处理方法中N-丙基乙二胺 (PSA)、C18和石墨化碳黑 (GCB) 3种净化剂对基质效应的影响。选择QuEChERS法净化下,比较基质种类和农药种类产生基质效应的差别,并探讨样品稀释法对基质效应的补偿效果,旨在为消除或补偿农药残留测定中的基质效应提供理论依据。
1 材料与方法 1.1 材料与试剂36种农药标准品纯度均大于97%[Dr. Ehrenstorfer公司 (德国)];C18、N-丙基乙二胺 (PSA)、石墨化碳黑 (GCB) 和硫酸镁 (德国CNW科技公司);NH2净化柱 (天津博纳艾杰尔科技有限公司,1 g/6 mL);乙腈、甲醇、甲酸和乙酸均为色谱纯 (美国Fisher Scientific公司);水 (纯净水,Milli-Q超纯水仪制备)。香菜、木耳菜、油麦菜、冬苋菜、蕹菜、生菜、芹菜、菠菜和茼蒿均购自于成都当地市场。
1.2 仪器与设备UPLC-MS/MS-8060超高效液相色谱-三重四极杆串联质谱仪 (日本岛津公司);WH-3微型涡旋混合仪 (上海沪西分析仪器厂有限公司);TGL-16 LM高速离心机 (湖南星科科学仪器有限公司);R-210旋转蒸发仪 (瑞士BUCHI公司)
1.3 试验方法 1.3.1 标准溶液的配制称取适量36种农药标准品,分别用甲醇配成1 000 mg/L的标准品混合储备液,于 –20 ℃保存。准确量取一定体积的储备液,用甲醇稀释成2 mg/L的混合标准溶液,于 –4 ℃保存,继而再用甲醇稀释,得到0.05、0.1、0.25、0.5、1和2 μg/mL系列标准工作溶液。根据需要,用试剂或基质溶液配制标准储备液,得到不同浓度梯度的标准工作溶液。
1.3.2 超高效液相色谱-串联质谱条件色谱条件:Shim-pack XR-ODSⅢ PKA-C18 色谱柱 (150 mm × 2.0 mm,2.2 μm);正/负离子模式:流动相A为含5 mmol/L乙酸铵和体积分数为0.1%甲酸的水溶液,流动相B为甲醇。流速0.3 mL/min;进样量1 μL;柱温40 ℃。梯度洗脱程序:0~2 min,10%B~50%B;>2~6 min,50%B~95%B;>6~11 min,95%B;>11~14 min,10%B。
质谱条件:ESI源;接口电压4 000 V;正离子和负离子扫描方式同时扫描;多反应监测(MRM)模式;雾化气流量3 L/min,干燥气流量10 L/min,气体均为氮气;加热气流量10 L/min,气体为空气;接口温度300 ℃;脱溶剂管温度250 ℃;加热模块温度400 ℃;碰撞气压力 270 kPa,气体为氩气。36种农药残留的质谱分析参数见表1。
|
|
表 1 36种农药的质谱参数及保留时间 Table 1 Mass spectral parameters and retention times of 36 pesticides |
1.3.3 样品的前处理方法
所有前处理方法所得到的空白基质溶液质量浓度均为1 g/mL。
1.3.3.1 未净化法称取40 g样品于250 mL锥形瓶中,加入50 mL乙腈,振荡30 min,滤液收集于盛有8~10 g氯化钠的50 mL具塞比色管中,振摇l min,静置分层;取25 mL上清液,于40 ℃水浴中旋转蒸发至近干,用V (甲醇) : V (水) = 1 : 1溶液定容至20 mL,振荡摇匀,过0.22 μm滤膜,得到未净化法提取基质溶液,现配现用。
1.3.3.2 氨基柱固相萃取法参考文献方法[13]进行。称取25 g样品于250 mL锥形瓶中,加入50 mL乙腈,振荡30 min,滤液收集于盛有6~7 g氯化钠的50 mL具塞比色管中,振摇l min,静置分层;取10 mL上清液过氨基柱净化,用25 mL V (乙腈) : V (甲苯) = 3 : 1溶液分5次淋洗;收集洗脱液,于40 ℃水浴下氮气吹至近干,用V (甲醇) : V (水) = 1 : 1溶液定容至5 mL,过0.22 μm滤膜,得到氨基柱净化法制得的基质溶液,现配现用。
1.3.3.3 QuEChERS法参考美国AOAC 2007.01标准方法[14],并加以改进。称取10 g样品于50 mL离心管中,加入20 mL乙腈,振荡1 min,加入提取盐包 (4 g无水硫酸镁和1 g氯化钠),涡旋1 min,于室温、8 000 r/min下离心3 min;取6 mL上清液于15 mL离心管中,加入不同的净化剂包 (① C18 0.30 g + 无水硫酸镁0.9 g;② PSA 0.30 g + 无水硫酸镁0.9 g;③ GCB 0.30 g + 无水硫酸镁0.9 g;④ C18 0.30 g + PSA 0.30 g + 无水硫酸镁0.9 g;⑤ C180.30 g + PSA 0.30 g + GCB 0.30 g + 无水硫酸镁0.9 g),涡旋1 min,再次于室温、8 000 r/min下离心3 min;取4 mL上清液至10 mL离心管中,于40 ℃水浴下氮气吹至近干,用V (甲醇) : V (水) = 1 : 1溶液定容至2 mL,过0.22 μm滤膜,得到QuEChERS净化法制得的基质溶液,现配现用。
1.3.4 空白基质匹配标准溶液的制备及基质效应评价方法将按1.3.3节中3种方法所制得的基质溶液配制不同浓度的基质匹配标准溶液:0.005、0.01、0.025、0.05、0.1和0.2 mg/L,现配现用。按1.3.2节的条件测定,绘制标准曲线。根据公式 (1) 计算基质效应 (ME)。当 –20% < ME < 20%时为弱基质效应;当 –50% < ME ≤ –20%或20% ≤ME < 50%为中等基质效应,当 ME ≤ –50%或 ≥ 50%为强基质效应[15]。
| ${M_{\rm{E}}}/{\text{%}} = ({k_{\rm{m}}}/{k_{\rm{s}}} - 1) \times 100$ | (1) |
式中:km和ks分别为基质标准曲线和溶剂标准曲线的斜率。
2 结果与分析 2.1 净化方式对基质效应的影响以蕹菜为例,比较氨基柱固相萃取法、QuEChERS法和未净化法3种前处理方式的净化效果及36种基质效应的差异,结果见图1。可见QuEChERS法优于氨基柱固相萃取法。

|
A: QuEChERS法;B: 氨基柱固相萃取法;C:未净化法。 A: QuEChERS extraction method; B: Solid phase extraction on an amino column method; C: No treatment method. 图 1 不同净化方式下36种农药的基质效应差异分布图 Fig. 1 Distribution of matrix effects of 36 pesticides under different purification conditions |
2.2 QuEChERS方法基质效应分析
比较QuEChERS方法中C18、PSA和GCB 3种常用吸附剂对绿叶菜中基质效应的影响,结果见图2。与未净化法相比,PSA净化后存在弱基质效应的农药数量最多,其次为GCB,再次为C18,可见PSA对绿叶菜中的杂质净化效果较好。比较了混合吸附剂C18 + PSA和 C18 + PSA + GCB的基质效应。发现加入GCB后,基质效应变化不大,且GCB虽能去除色素,但对某些农药具有吸附作用,导致回收率偏低[16]。因此,最终选择C18 + PSA作为QuEChERS方法的净化剂。
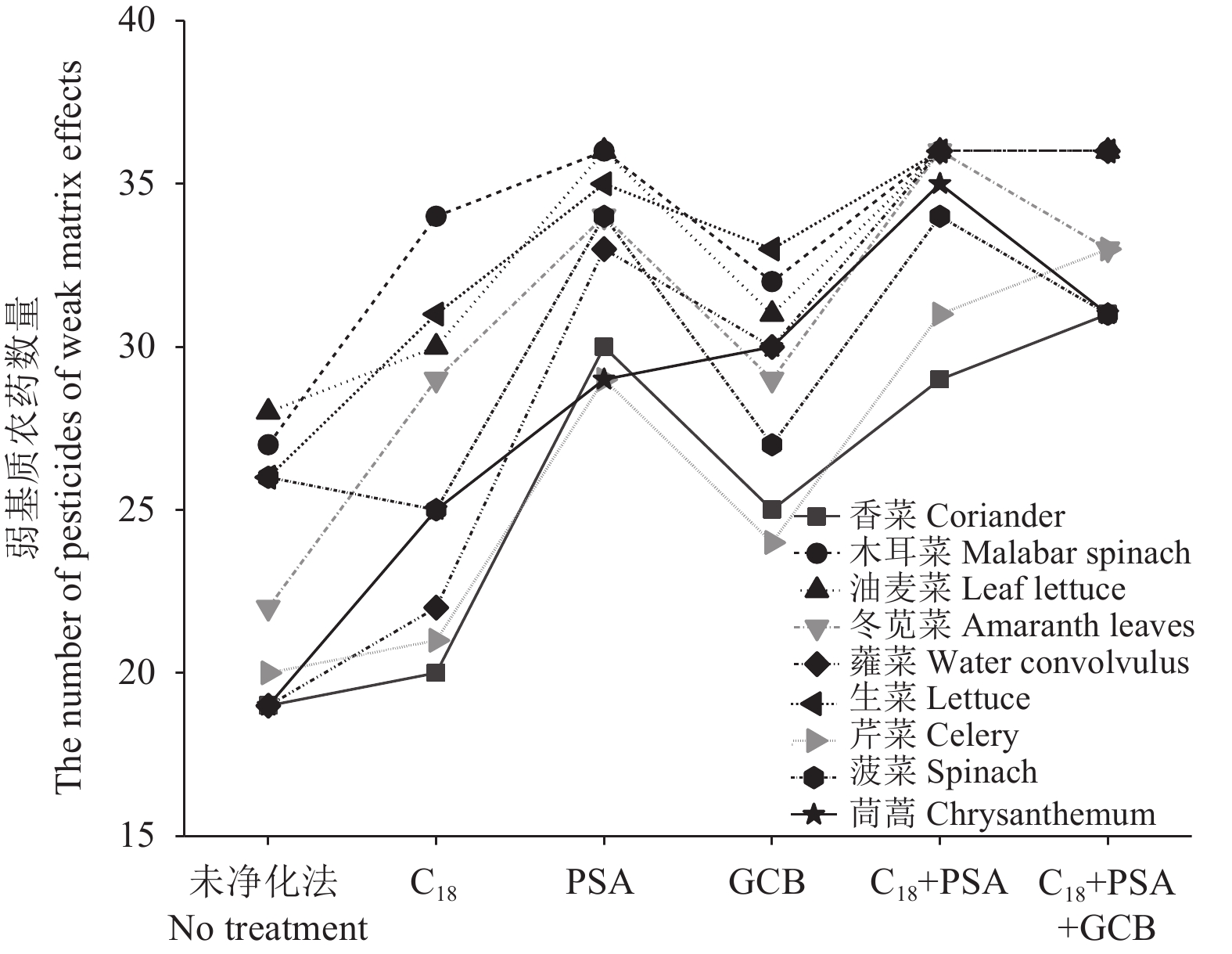
|
图 2 不同吸附剂对基质效应影响 Fig. 2 Matrix effects of different sorbents |
2.3 基质种类和农药种类对基质效应的影响
选取常见的香菜、木耳菜、油麦菜、冬苋菜、蕹菜、生菜、芹菜、菠菜和茼蒿等9种绿叶菜,在QuEChERS法条件下,考察了36种农药的基质效应。从图3可以看出:经QuEChERS法净化后,除涕灭威砜、啶虫脒和甲氨基阿维菌素苯甲酸盐等为基质增强效应外,大部分农药均为基质抑制效应。不同基质对同一农药呈现不同的基质效应,如吡虫啉在香菜中为基质增强效应,而在冬苋菜和菠菜中为基质抑制效应。基质效应由强到弱依次为:香菜 > 芹菜 > 菠菜 > 茼蒿 > 油麦菜 = 冬苋菜 = 蕹菜 = 生菜 = 木耳菜。这可能是由于香菜和芹菜中芳香性化合物含量较高,相对而言基质更为复杂。

|
图 3 不同农药在不同蔬菜基质中的基质效应 Fig. 3 Matrix effects of different pesticides in different vegetables |
经QuEChERS法净化后,36种农药在木耳菜、油麦菜、冬苋菜、蕹菜、生菜中均为弱基质效应,可忽略基质效应因素,直接采用试剂标准品进行定量分析。但对于净化后仍然为中等强度基质效应的农药,必须考虑基质效应对定量结果的影响。多效唑、烯酰吗啉、灭幼脲和除虫脲等经净化后仍表现为中等基质效应,但其值在香菜、芹菜和茼蒿中差别不大,表明此3类蔬菜可作为通用基质相互替换,配制基质匹配标准溶液对此类农药进行定量分析。
2.4 样品稀释法对强基质效应的补偿本研究发现:无论采用何种净化方式,香菜中的甲萘威和克百威基质效应值均在 –70%左右,可见改变净化方式无法降低此类农药的基质效应。针对此类农药,进一步考察了样品稀释法对基质效应的影响,选取采用未净化法得到的香菜样品,用V (甲醇) : V (水) = 1 : 1溶液稀释。考察稀释因子分别为100、50、20、10、5、2和1时的基质效应。定义稀释因子d = Vf/Vi,其中Vf为空白基质稀释后最终体积;Vi为空白基质最初体积[17]。移取一定体积按照1.3.3.1节的未净化法得到的空白香菜基质溶液,配制基质匹配标准溶液测定。结果 (图4) 表明:随着稀释倍数的增加,基质效应明显减弱,当稀释因子为20,即基质溶液中基质含量为0.05 g/L时,克百威和甲萘威均为弱基质效应。可见样品稀释法有助于减小基质效应,但在选取样品稀释倍数时还应综合考虑目标化合物的灵敏度和仪器检出限。本研究中基质标准曲线的范围为0.005~0.2 mg/L,若稀释后目标化合物质量浓度大于0.005 mg/L,则均能满足灵敏度要求。

|
图 4 稀释对香菜中克百威和甲萘威的基质效应 Fig. 4 The effect of dilution on the matrix effects in the analysis of carbofuran and carbaryl in coriander |
3 结论
本研究系统评价了在UPLC-MS/MS检测模式下,36种农药在香菜、木耳菜、油麦菜、冬苋菜、蕹菜、生菜、芹菜、菠菜和茼蒿等9种绿叶菜类基质中不同净化方法下的基质效应,发现基质种类影响基质效应强度。通过对QuEChERS法中C18、PSA和GCB 3种吸附剂的考察,发现PSA对绿叶菜中的杂质净化效果较好。通过比较QuEChERS净化后36种农药在不同基质中的基质效应,发现大部分农药经过QuEChERS净化后可直接采用试剂标准溶液进行定量,对于基质效应明显的蔬菜和农药,建议采用基质匹配标准溶液进行定量。另外,采用样品稀释法可降低基质效应。本研究结果为绿叶菜中36种常用农药日常检测的定性、定量分析提供了依据。
| [1] |
金彬, 吴丹亚, 陈宇博, 等. 宁波市城郊散户种植叶菜类蔬菜农药残留情况调查[J]. 江西农业学报, 2016, 28(1): 119-122. JIN B, WU D Y, CHEN Y B, et al. Investigation of pesticide residues in leaf vegetables farmed by small peasants in Ningbo City[J]. Acta Agriculturae Jiangxi, 2016, 28(1): 119-122. DOI:10.3969/j.issn.1001-8581.2016.01.024 |
| [2] |
王洁莲, 张琳. 山西省叶菜类蔬菜农残检测结果及治理对策[J]. 农业工程, 2017, 7(4): 84-86. WANG J L, ZHANG L. Results and countermeasures of leaft vegetables pesticide residue testing in Shanxi Province[J]. Agric Eng, 2017, 7(4): 84-86. DOI:10.3969/j.issn.1008-7540.2017.04.043 |
| [3] |
蒋建功, 杨松, 林琎, 等. 优化的QuEChERS-超高效液相色谱-串联质谱法检测黄瓜中29种杀菌剂残留[J]. 农药学学报, 2017, 19(6): 735-743. JIANG J G, YANG S, LIN J, et al. Determination of 29 fungicide residues in cucumber by modified QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2017, 19(6): 735-743. |
| [4] |
DEBAYLE D, DESSALCES G, GRENIER-LOUSTALOT M F. Multi-residue analysis of traces of pesticides and antibiotics in honey by HPLC-MS-MS[J]. Anal Bioanal Chem, 2008, 391(3): 1011-1020. DOI:10.1007/s00216-008-2003-2 |
| [5] |
王立琦, 贺利民, 曾振灵, 等. 液相色谱-串联质谱检测兽药残留中的基质效应研究进展[J]. 质谱学报, 2011, 32(6): 321-332. WANG L Q, HE L M, ZENG Z L, et al. Progress in matrix effect of veterinary drug residues analysis by high-performance liquid chromatography-tandem mass spectrometry[J]. J Chin Mass Spectrom Soc, 2011, 32(6): 321-332. |
| [6] |
KEMMERICH M, RIZZETTI T M, MARTINS M L, et al. Optimization by central composite design of a modified quechers method for extraction of pesticide multiresidue in sweet pepper and analysis by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Anal Methods, 2015, 8(3): 728-739. DOI:10.1007/s12161-014-9951-2 |
| [7] |
GARRIDO FRENICH A, MARTINEZ VIDAL J L, FERNÁNDEZ MORENO J L, et al. Compensation for matrix effects in gas chromatography-tandem mass spectrometry using a single point standard addition[J]. J Chromatogr A, 2009, 1216(23): 4798-4808. DOI:10.1016/j.chroma.2009.04.018 |
| [8] |
FISCHER J, HAAS T, LEPPERT J, et al. Fast and solvent-free quantitation of boar taint odorants in pig fat by stable isotope dilution analysis-dynamic headspace-thermal desorption-gas chromatography/time-of-flight mass spectrometry[J]. Food Chem, 2014, 158: 345-350. DOI:10.1016/j.foodchem.2014.02.113 |
| [9] |
王连珠, 周昱, 陈泳, 等. QuEChERS样品前处理-液相色谱-串联质谱法测定蔬菜中66种有机磷农药残留量方法评估[J]. 色谱, 2012, 30(2): 146-153. WANG L Z, ZHOU Y, CHEN Y, et al. Evaluation of QuEChERS methods for the analysis of 66 organophosphorus pesticide residues in vegetables by liquid chromatography-tandem mass spectrometry[J]. Chin J Chromatogr, 2012, 30(2): 146-153. |
| [10] |
许秀丽, 赵海香, 李礼, 等. 分析保护剂补偿基质效应-气相色谱-质谱法快速测定水果中40种农药残留[J]. 色谱, 2012, 30(3): 267-272. XU X L, ZHAO H X, LI L, et al. Rapid determination of 40 pesticide residues in fruits using gas chromatography-mass spectrometry coupled with analyte protectants to compensate for matrix effects[J]. Chin J Chromatogr, 2012, 30(3): 267-272. |
| [11] |
European Commission. Guidance document on analytical quality control and method validation procedures for pesticide residues and analysis in food and feed. SANTE/11813/2017[EB/OL]. [2018-08-07]. https://ec.europa.eu/food/sites/food/files/plant/docs/pesticides_mrl_guidelines_wrkdoc_2017-11813.pdf.
|
| [12] |
GEORGAKOPOULOS P, FOTEINOPOULOU E, ATHANASOPOULOS P, et al. Recoveries of four representative organophosphorus pesticides from 18 plant products belonging to different botanical categories: implications for matrix effects[J]. Food Addit Contam, 2007, 24(4): 360-368. DOI:10.1080/02652030601101144 |
| [13] |
水果和蔬菜中450种农药及相关化学品残留量的测定液相色谱-串联质谱法: GB/T 20769—2008[S]. 北京: 中国标准出版社, 2009. Determination of 450 pesticides and related chemicals residues in fruits and vegetables-LC-MS-MS method: GB/T 20769—2008[S]. Beijing: Standards Press of China, 2009. |
| [14] |
LEHOTAY S J. Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate: collaborative study[J]. J AOAC Int, 2007, 90(2): 485-520. |
| [15] |
孟明辉, 贺泽英, 徐亚平, 等. QuEChERS方法结合高效液相色谱-串联质谱法同时测定土壤中20种抗生素[J]. 农业环境科学学报, 2017, 36(8): 1672-1679. MENG M H, HE Z Y, XU Y P, et al. Simultaneous extraction and determination of antibiotics in soils using a QuEChERS-based method and liquid chromatography-tandem mass spectrometry[J]. J Agro Environ Sci, 2017, 36(8): 1672-1679. |
| [16] |
段毅宏, 张婷, 刘建辉, 等. QuEChERS-气相色谱-质谱联用法检测茶叶中3种杀虫剂残留[J]. 食品安全质量检测学报, 2017, 8(10): 3814-3818. DUAN Y H, ZHANG T, LIU J H, et al. Determination of 3 kinds of pesticide residues in tea by QuEChERS-gas chromatography-mass spectrometry[J]. J Food Saf Qual, 2017, 8(10): 3814-3818. DOI:10.3969/j.issn.2095-0381.2017.10.021 |
| [17] |
刘进玺, 秦珊珊, 冯书惠, 等. 高效液相色谱-串联质谱法测定食用菌中农药多残留的基质效应[J]. 食品科学, 2016, 37(18): 171-177. LIU J X, QIN S S, FENG S H, et al. Matrix effects in the analysis of pesticides residues in edible fungi by HPLC-MS/MS[J]. Food Science, 2016, 37(18): 171-177. DOI:10.7506/spkx1002-6630-201618028 |
 2018, Vol. 20
2018, Vol. 20


