2. 中国农业科学院 植物保护研究所,北京 100193
2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China
溴氰菊酯 (deltamethrin, DM) 是一种常用的高效拟除虫菊酯类杀虫剂,具有触杀、胃毒、驱避和拒食等作用,在农业生产中应用广泛[1],已造成茶叶[2]、水果[3]、蔬菜[4]、粮食作物[5]、中药材[6]、水产品[7]及土壤中[8]普遍存在溴氰菊酯残留现象,严重影响到农产品的质量安全。此外,溴氰菊酯为弱致敏物,有蓄积作用,可引起细胞凋亡和睾丸精母细胞染色体畸变率增加[9-10],人体中毒表现为皮肤刺激和神经系统症状,严重中毒会导致昏迷甚至死亡[9]79。在未找到更好的替代农药品种之前,溴氰菊酯仍将被广泛使用,因此市场亟需研究开发此类农药的降解技术或产品。
目前农药残留降解的主要方式有化学降解、微生物降解及光降解等[11-12],其中微生物降解具有成本低、对环境友好、数量繁多、种类多样和降解效率高等优势而成为农药降解的重要途径[13-15]。已报道的溴氰菊酯降解菌主要有阴沟肠杆菌Enterobacter cloacap[16]、荧光假单胞菌Pseudomonas fluorescens[16]22、醋酸钙不动杆菌Acinetobacter calcoaceticus[17]、蜡状芽孢杆菌Bacillus cereus[18]、微球菌属Micrococcus sp.[19]以及洋葱伯克霍尔德菌Burkholderia cepacia、嗜水气单胞菌Aeromonas hydrophila和浅黄假单胞菌Pseudomonas luteola[20]等。现有关于溴氰菊酯降解菌的研究主要是在实验室纯培养条件下对菌株的分离鉴定、筛选、降解特性和降解机制等方面[16-23],鲜有进行田间生物修复应用阶段的研究以及菌剂应用潜力评价的报道,对于将嗜麦芽寡养单胞菌应用于溴氰菊酯降解的研究则尚未见报道。为此,本研究从长期受溴氰菊酯污染的土壤中分离筛选到1株对溴氰菊酯降解活性较高的菌株,通过生理生化试验、形态学特征及16S rDNA同源性比对法对菌株进行了鉴定,并对其发酵条件、菌剂制备方法及应用潜力进行了研究与探讨,旨在丰富溴氰菊酯降解菌资源库,同时为其微生物降解技术研究及降解菌剂的应用提供参考。
1 材料与方法 1.1 试验材料 1.1.1 土壤样品采自贵州省贵阳市花溪区贵州大学农学院实验农场长期受溴氰菊酯污染的试验田。供试土壤的部分理化性质见表1。
|
|
表 1 供试土壤的部分理化性质 Table 1 Selected physicochemical properties of the tested soil |
1.1.2 培养基
无机盐培养基:0.5 g KH2PO4,0.5 g (NH4)2SO4,1.0 g NH4NO3,1.5 g K2HPO4,0.5 g MgSO4,0.5 g NaCl,加蒸馏水定容至1 000 mL,调节pH = 7.3。
牛肉膏蛋白胨培养基:10.0 g蛋白胨,5.0 g牛肉膏,5.0 g NaCl,加蒸馏水定容至1 000 mL,调节pH = 7.0。
1.1.3 试剂与主要仪器99.2%的溴氰菊酯 (deltamethrin) 标准品,购自国家农药质量监督检验中心;25 g/L溴氰菊酯乳油 (EC),购自拜耳作物科学中国有限公司;甲醇为色谱纯,其余未特别说明的试剂及药品均为分析纯。
UV1102紫外-可见分光光度计,上海天美科学仪器有限公司;Waters 600高效液相色谱仪,美国Waters公司;菌株Biolog自动分析仪,美国Biolog公司;RE-52AA旋转蒸发器,上海雅荣生化仪器设备有限公司;PHS-3C精密pH计,航海虹益仪器仪表有限公司。
1.2 试验方法 1.2.1 溴氰菊酯降解菌的分离筛选及鉴定 1.2.1.1 菌株分离与筛选参考陈玉洁等[24]的方法。称取50 g长期受溴氰菊酯污染的土样,按培养基中溴氰菊酯质量浓度分别为10、20、30、40和50 mg/L的标准逐级提高浓度进行富集驯化培养,驯化后进行分离、纯化,以液体培养基制备菌悬液。将菌悬液添加至含50 mg/L溴氰菊酯的无机盐培养基中,并以含药不接菌的无机盐培养基为对照。采用高效液相色谱法 (HPLC) 测定各菌株对溴氰菊酯的降解能力,按公式 (1) 计算降解率。选取降解率较高的菌株进行后续研究。
| $R/{\text\%} = \left[ {1-\left( {\rho/{\rho_{_0}}}\right)}\right] \times 100$ | (1) |
式中:R为降解率,%;ρ为接菌组中溴氰菊酯残留质量浓度,mg/L;ρ0为对照组中溴氰菊酯残留质量浓度,mg/L。
高效液相色谱检测条件为:Agilent ZORBAX SB-C18色谱柱 (250 mm × 4.6 mm,5 μm);流动相V(甲醇):V(水) = 80:20;流速1 mL/min;柱温25 ℃;检测器波长230 nm;进样量10 μL;保留时间19.08 min。
1.2.1.2 添加回收试验无机盐培养基中添加回收率测定:向无机盐培养基中分别添加0.1、0.5、1.0和5.0 mg/L的溴氰菊酯标准品溶液,重复3次,经二氯甲烷液-液分配提取后,按1.2.1节HPLC条件测定,计算添加回收率及相对标准偏差。
香菜样品中添加回收率测定:除去根部,取植株茎、叶混合样品5.0 g,分别添加0.1、0.5、1.0和5.0 mg/L的溴氰菊酯标准品溶液,重复3次,经丙酮萃取、二氯甲烷液-液分配、弗罗里硅土和活性炭净化及V(正己烷):V(二氯甲烷) = 4 : 1混合溶剂洗脱后,待HPLC测定。
1.2.1.3 菌株鉴定对纯化培养后的菌株进行显微镜及形态学观察,并进行生理生化试验和16S rDNA基因序列分析 (菌株16S rDNA测序由上海英骏生物公司完成)。将测定的序列在NCBI上用BLAST软件与GenBank数据库中16S rDNA序列进行相似度比对,利用MEGA6进行多序列同源性分析,构建系统发育树。
1.2.2 降解菌发酵条件筛选分别从发酵温度、培养基起始pH值、培养基氮源和碳源等方面就菌株的最适发酵条件进行筛选:调节pH = 7,分别在25、30、35和40 ℃条件下发酵;固定温度为35 ℃,在培养基pH值分别为4、6、8和10的条件下发酵;固定培养基pH = 8,35 ℃,分别用相同质量分数的氯化铵、酵母膏、硝酸钾替换培养基中的氮源蛋白胨膏后进行发酵,其他成分不变;固定培养基pH = 8,35 ℃,氮源为1.0%氯化铵,分别用相同质量分数的麦芽糖、葡萄糖、乳糖替换培养基中的碳源牛肉膏后进行发酵,其他成分不变。以接菌前的培养基为空白对照。其余基础条件为:牛肉膏蛋白胨培养基,接种培养基体积分数1%的菌液,摇床转速150 r/min,振荡培养24 h。取菌悬液采用紫外分光光度计测定OD600值,即为菌株生物量。
1.2.3 降解菌剂制备方法将菌株接种于pH = 8的牛肉膏蛋白胨培养基中,150~200 r/min、35 ℃下振荡培养至对数生长期,获得菌种;向牛肉膏蛋白胨培养基中添加体积分数为1%的菌种,150~200 r/min、35 ℃下振荡培养至对数生长期,获得种子液;向发酵培养基中接入体积分数为10%的种子液,在150~200 r/min、35 ℃下振荡培养至OD600值大于1.5,得到发酵液;向发酵液中添加体积分数为2%的葡萄糖溶液,稀释至OD600为0.6,即获得溴氰菊酯降解菌的液体菌剂。
1.2.4 降解菌剂实际应用效果测定采用室内盆栽试验与田间试验相结合的方式。为加强试验效果,参照制剂使用说明书推荐方法,按10倍推荐剂量 (有效成分6.25 g/hm2) 分别均匀喷施于盆栽和田间种植的香菜植株上,在施药后2、24和48 h,分别以40 L/hm2的剂量喷施1.2.3节中制备的菌剂,以仅喷施溴氰菊酯不喷菌剂的处理为空白对照。试验重复3次。于药后2 h及3、5、7、9 d分别采集香菜样品,通过HPLC测定溴氰菊酯的残留量并计算降解率。以微生物一级降解动力学方程[式 (2)][25]进行拟合,评价菌剂在不同施用时间下的降解动力学特性。
| ${C_t} = {C_0}{{\rm{e}}^{-kt}}$ | (2) |
式中:k为降解速率常数,mg/(L·h);t为降解时间,h;Ct为溴氰菊酯残留量,mg/kg;C0为初始时溴氰菊酯的量,mg/kg。
1.3 数据分析处理试验数据通过DPS v7.05版中的Duncan’s新复极差法进行差异显著性分析 (P < 0.05,P < 0.01);采用Microsoft Excel 2010软件进行数据整理并作图。
2 结果与分析 2.1 添加回收率在0.1、0.5、1.0和5.0 mg/L添加水平范围内,溴氰菊酯在无机盐培养基中的平均回收率为84%~94%,相对标准差为0.5%~3.0%;在香菜中的平均回收率在83%~97%之间,相对标准差为1.9%~3.4%。表明所采用的检测方法符合农药残留分析质量控制技术要求[26]。
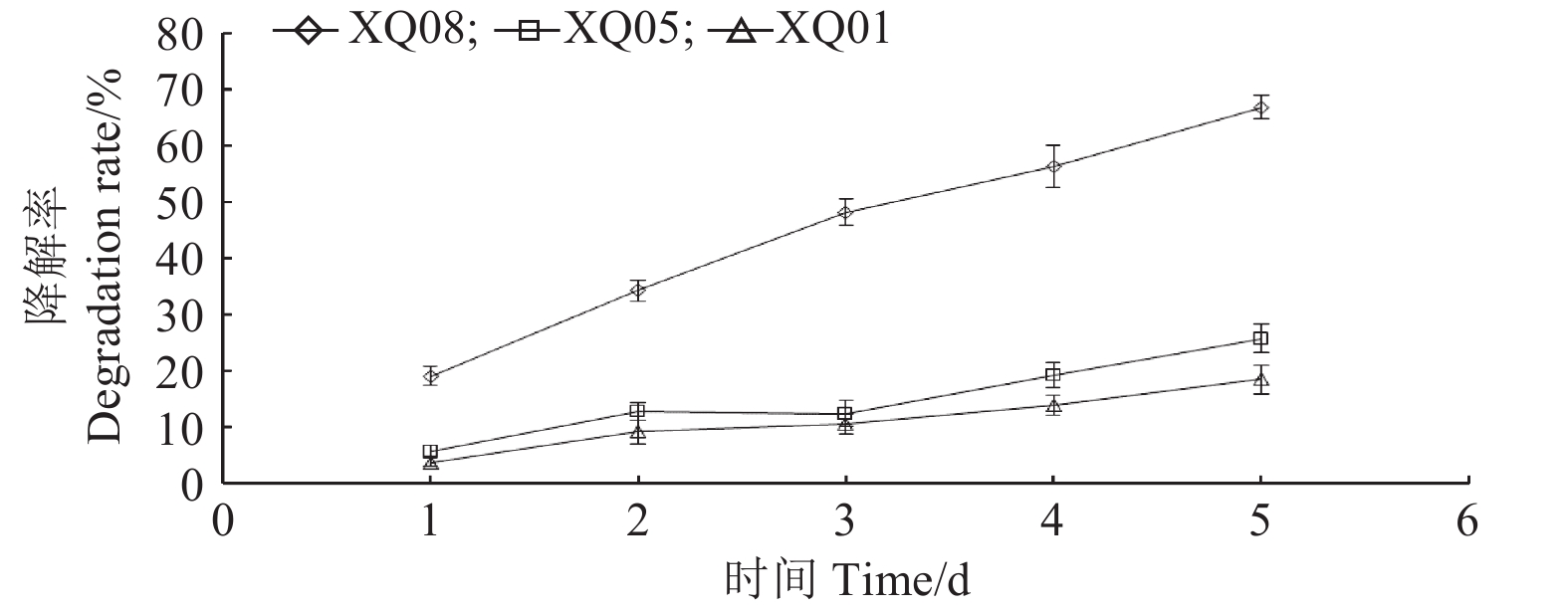
2.2 降解菌筛选从供试土样中共分离纯化得到18株菌株,分别编号为XQ01~XQ18,其中XQ01、XQ05和XQ08菌株对溴氰菊酯的降解效果较好,5 d的降解率分别为18.45%、25.73%和66.76%。如图1所示,上述3株菌株5 d内对溴氰菊酯的降解率均呈上升趋势,其中XQ08的降解能力最优,因此针对XQ08菌株进行了鉴定。
|
图 1 纯培养条件下XQ01、XQ05和XQ08菌株对溴氰菊酯的降解率 Fig. 1 Degradation rates of deltamethrin by the strain XQ01, XQ05 and XQ08 in pure culture conditions |
2.3 菌株XQ08的鉴定 2.3.1 形态学特征及生理生化特性
将菌株XQ08划线接种于牛肉膏蛋白胨培养基平板,培养3 d后,观察到其菌落呈稍有光泽的乳白色圆形或近似圆形,质地软、不黏稠,易挑取,生长较快。其生理生化特性分析结果见表2。
|
|
表 2 菌株XQ08的生理生化特性 Table 2 Physiological and biochemical characteristics of strain XQ08 |
2.3.2 16S rDNA鉴定
将菌株XQ08 的16S rDNA基因测序结果1 412 bp与GenBank数据库中序列进行同源性对比,登录号为KU198337。分析发现,该序列与嗜麦芽寡养单胞菌S. maltophilia ATCC 13637等菌株的16S rDNA 基因序列相似度达99%;从系统发育树 (图2) 可看出,XQ08菌株与S. maltophilia ATCC 13637菌株处于同一分支。综合生理生化特性、形态学观察和16S rDNA基因序列分析结果,鉴定菌株XQ08为嗜麦芽寡养单胞菌S. maltophilia。该菌株已采用冷冻真空干燥法 (4 ℃,保护剂为脱脂牛奶) 保存于武汉大学中国典型培养物保藏中心,保藏号为CCTCC M 2015726。

|
图 2 菌株XQ08的系统发育树 Fig. 2 The phylogenetic tree of strain XQ08 |
2.4 溴氰菊酯降解菌发酵条件 2.4.1 发酵温度的确定
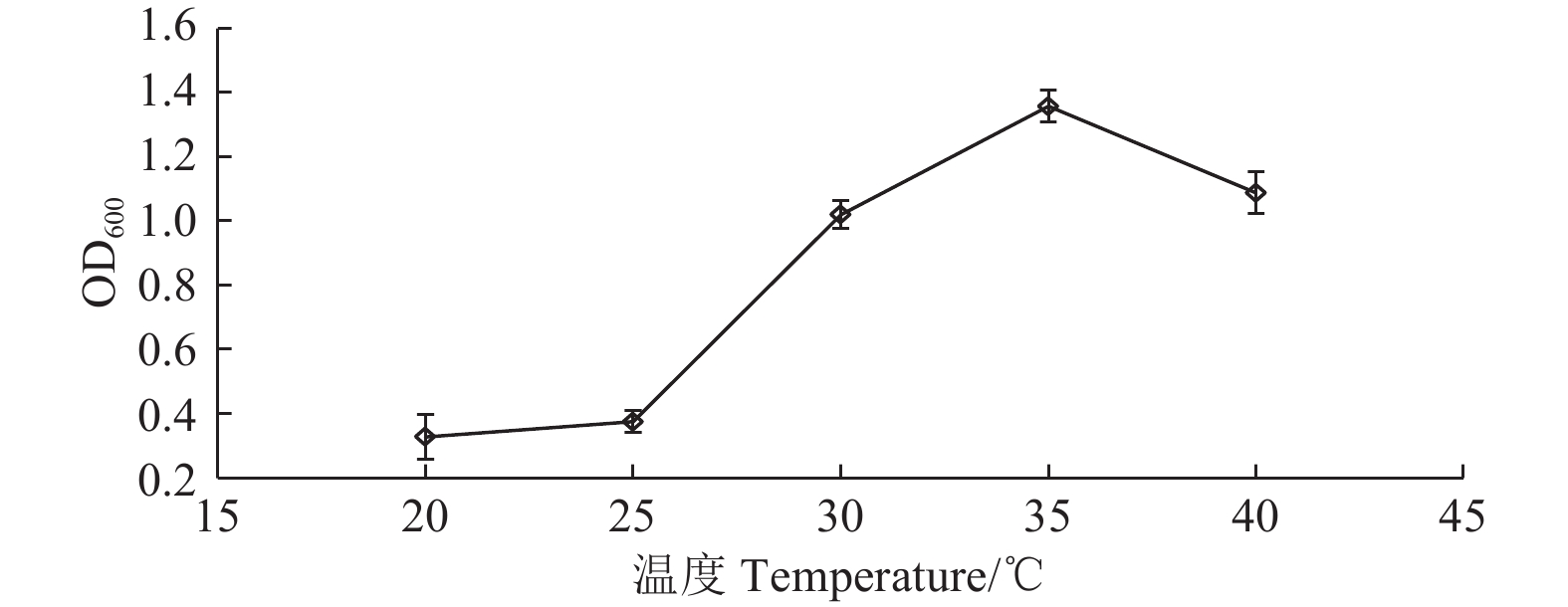
菌株XQ08在不同发酵温度下振荡培养24 h,其生物量 (OD600) 测定结果见图3。从中可看出,该菌株对温度的适应范围较宽,在20~40 ℃均能生长,因而在实际应用时受季节和地域温度的影响较小,仅在低于25 ℃时生长量减少。在20~40 ℃范围内,随培养温度升高,XQ08的OD600值呈先上升后下降的趋势,35 ℃时OD600值最大,为1.36。因此其理想的发酵培养温度宜控制在35 ℃左右。
|
图 3 温度对菌株XQ08生长的影响 Fig. 3 Effects of temperature on strain XQ08 growth. |
2.4.2 发酵pH值的确定
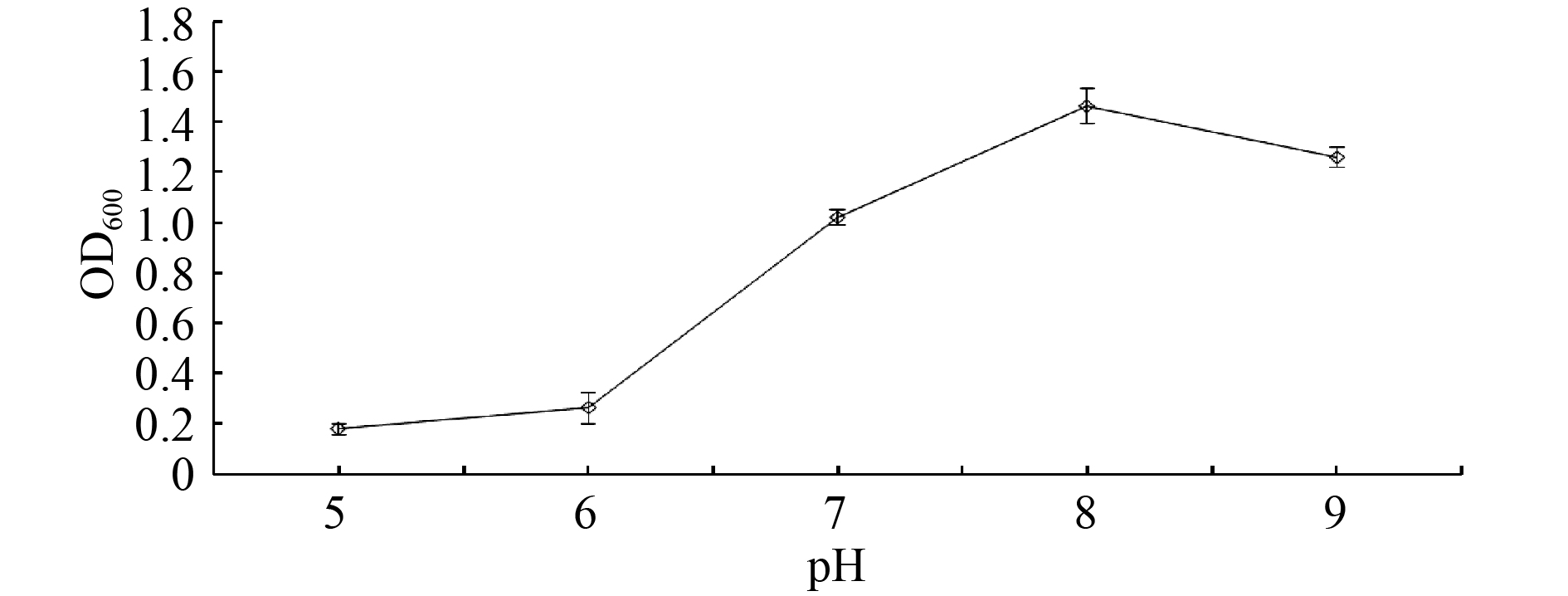
由图4可知,菌株XQ08在pH 6~9范围内均能生长,表明在实际应用中其受土壤酸碱性影响相对较小,适用范围较广,可用于弱酸性、中性和偏碱性土壤。但pH值对菌株生长仍有一定影响,发酵24 h,OD600值随pH值的增大呈先升高后降低的趋势,pH = 8时OD600值较大。因此其理想的发酵培养pH值宜控制在8左右。
|
图 4 pH对菌株XQ08生长的影响 Fig. 4 Effects of pH on strain XQ08 growth |
2.4.3 发酵培养基氮源的筛选
分别以相同浓度的氯化铵、酵母膏和硝酸钾替换牛肉膏蛋白胨培养基中的1.0%蛋白胨后培养XQ08,随时间推移,各处理菌液的OD600值均逐渐增大,24 h后分别为2.13、1.05和0.83(图5)。其中以氯化铵为氮源时OD600值较高,表明在菌株XQ08的发酵培养中选择氯化铵作为氮源效果较为理想。

|
图 5 不同氮源对菌株XQ08生长的影响 Fig. 5 Effects of nitrogen source on strain XQ08 growth |
2.4.4 发酵培养基碳源的确定
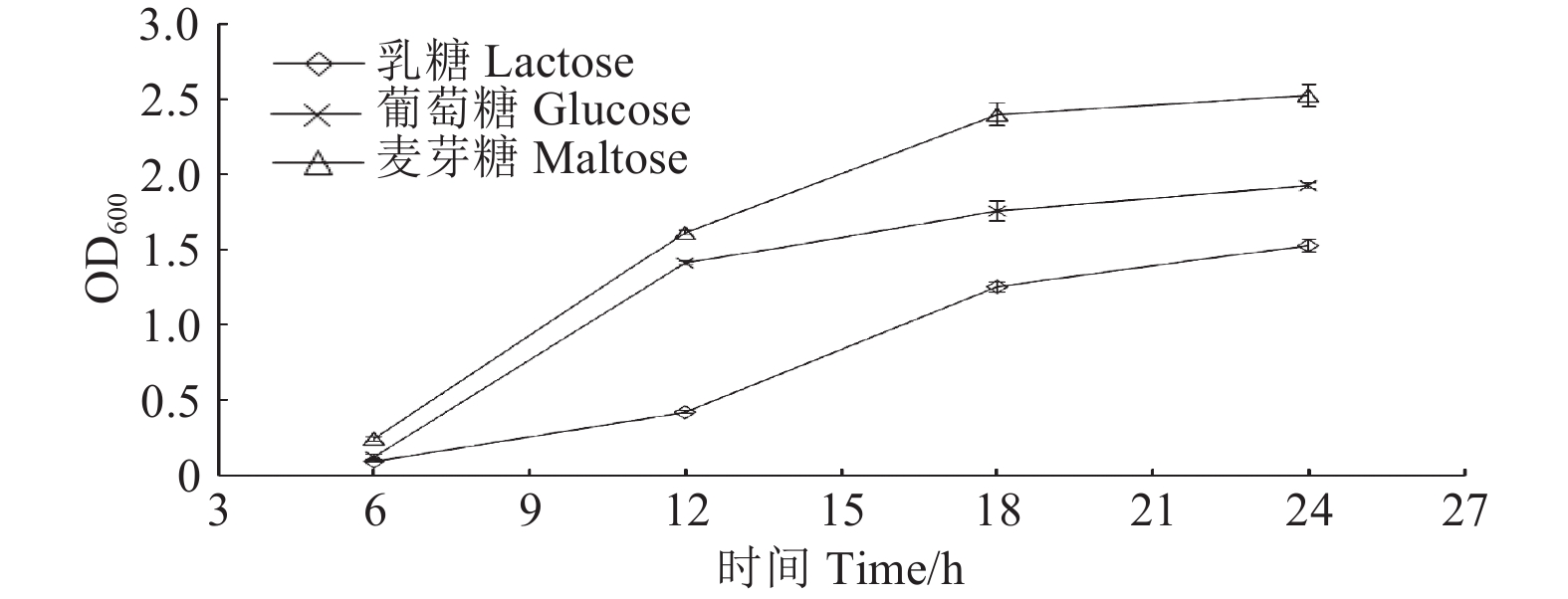
分别采用相同浓度的麦芽糖、葡萄糖和乳糖替换牛肉膏蛋白胨培养基中的0.5%牛肉膏后培养XQ08,随时间推移,各处理菌液的OD600值均逐渐增大,24 h后分别为2.53、1.93和1.53(图6)。表明以麦芽糖作为发酵碳源可取得较理想的效果。
|
图 6 不同碳源对菌株XQ08生长的影响 Fig. 6 Effects of carbon source on strain XQ08 growth |
2.5 降解菌剂应用潜力评价 2.5.1 室内盆栽试验降解效果
结果 (表3) 表明,按有效成分6.25 g/hm2剂量喷施25 g/L的溴氰菊酯乳油后施用XQ08菌剂,可明显加快香菜上溴氰菊酯的降解,且各处理间差异达显著或极显著水平 (P < 0.5,P < 0.01)。
降解菌剂对室内盆栽香菜上溴氰菊酯残留的降解过程可用一级动力学方程进行描述,其动力学参数见表4。与CK相比,喷施溴氰菊酯后2、24和48 h施用XQ08菌剂的处理,降解速率分别提高了114.3%、142.9%和200.0%,半衰期分别缩短了52.8、58.2和66.0 h。表明XQ08菌剂对盆栽香菜上溴氰菊酯残留的降解具有促进作用。
|
|
表 3 降解菌剂对室内盆栽香菜中溴氰菊酯降解的影响 Table 3 Effect of microbial agent on residues of deltamethrin on the indoor potted C. sativum |
|
|
表 4 室内盆栽香菜中溴氰菊酯残留的降解动力学参数 Table 4 Kinetic parameters of deltamethrin on the indoor potted C. sativum |
2.5.2 田间降解效果
XQ08菌剂对田间香菜上溴氰菊酯残留降解的影响 (表5) 与室内盆栽试验结果相似,即降解菌剂可促进溴氰菊酯的降解,且各处理间差异达显著或极显著水平 (P < 0.05,P < 0.01)。但可能由于田间自然环境复杂,其降解速率总体比盆栽试验快。
XQ08菌剂对田间种植香菜上溴氰菊酯的降解过程也可采用一级动力学方程进行描述,其动力学参数见表6。表明田间施用XQ08菌剂对溴氰菊酯残留的降解同样具有促进作用。
|
|
表 5 降解菌剂对大田香菜中溴氰菊酯降解的影响 Table 5 Effect of microbial agent on residues of deltamethrin on the field C. sativum |
|
|
表 6 大田香菜中溴氰菊酯残留的降解动力学参数 Table 6 Kinetic parameters of deltamethrin on the field C. sativum |
结合盆栽和田间试验结果,菌剂施用后5、7和9 d,其对溴氰菊酯的降解率总体趋势表现为:药后48 h施用菌剂 > 药后24 h施用菌剂 > 药后2 h施用菌剂,表明在施药48 h后施用XQ08菌剂降解效果更为理想。由于目前尚未见有关溴氰菊酯在香菜上最大残留限量 (MRL) 的规定,故参照“食品中农药最大残留限量” [27]标准,由表3和表5中残留量数据可知,按推荐剂量10倍 (有效成分6.25 g/hm2) 施用25 g/L溴氰菊酯乳油后再施用XQ08降解菌剂,7 d 后香菜上溴氰菊酯的残留量为0.249~0.417 mg/kg,已低于中国制定的花椰菜、白菜、莴苣及结球甘蓝等叶类蔬菜中溴氰菊酯的MRL值 (0.5 mg/kg),9 d后更低至0.043 mg/kg;而仅施溴氰菊酯的处理9 d后药剂残留量仍高于其在叶类蔬菜中的MRL值。表明XQ08菌株能有效降解或清除蔬菜上的溴氰菊酯残留,具有一定的应用潜力和开发价值。所得结果可为解决蔬菜生产中溴氰菊酯残留污染问题提供参考。
3 结论与讨论微生物在生物修复中起着主导作用,而获得高效的降解菌株是进行农药残留污染微生物修复的前提[28-29]21,74。本研究从长期受溴氰菊酯污染的土壤中分离筛选得到1株溴氰菊酯的高效降解菌XQ08,经鉴定为嗜麦芽寡养单胞菌S. maltophilia。向骊羽等[30]从农药厂废水排放口污泥中分离获得的假单胞菌属Pseudomonas sp. DE29菌株7 d对100 mg/L溴氰菊酯的降解率为96.32%;崔俊涛等[31]从过期溴氰菊酯中获得的X09肠杆菌属Enterobacter sp. 和X20假单胞菌属菌株7 d对50 mg/L溴氰菊酯的降解率分别为62.8%和43.3%;杨晓棠[16]1从长期使用溴氰菊酯的菜园土壤和过期溴氰菊酯中筛选出的X09阴沟肠杆菌E. cloacae和X20荧光假单胞菌P. fluorescens 7 d对50 mg/L溴氰菊酯的降解率分别为62.82%和43.25%;唐洁等[17]108从长期施用溴氰菊酯的茶园土壤中分离得到的醋酸钙不动杆菌Acinetobacter calcoaceticus DXQ018菌株5 d内对50 mg/L溴氰菊酯的降解率为49.6%。本研究所分离的菌株XQ08在纯培养条件下,5 d对50 mg/L溴氰菊酯的降解率为66.76%,其降解效能高于上述报道中除菌株DE29外的其他溴氰菊酯降解菌。
嗜麦芽寡养单胞菌是一种需氧的非发酵型极生多鞭毛革兰氏阴性杆菌,在植物根系、土壤、水、人和动物的体表与消化道中均有广泛分布[32]。吴小倩等[33]和鲁丹等[34]曾报道嗜麦芽寡养单胞菌可用于降解羽毛废弃物;李红权等[35]的研究表明其具有降解DDT的能力;李雪云[36]指出嗜麦芽寡养单胞菌还可用于生产能降解天然高分子材料的聚羟基烷酸酯。本研究首次报道了嗜麦芽寡养单胞菌可降解溴氰菊酯,进一步拓展了其在农药污染治理领域的用途,同时丰富了溴氰菊酯降解菌资源库。
同时,本研究确定了XQ08液体菌剂的最优制备方法,并采用所制备的菌剂进行了室内盆栽及田间降解试验。结果表明,在室内盆栽与田间条件下,所制备液体菌剂对香菜上残留溴氰菊酯的降解均符合一级动力学方程特征,药后施用降解菌剂能有效降解或清除香菜上的溴氰菊酯残留,具有较好的开发应用潜力。此外,对菌株XQ08进行定向诱导优化培养以提高其降解效率,明确其降解机理,探究菌剂及降解产物的安全性等将是后续研究的重点。
| [1] |
罗守进. 溴氰菊酯应用的研究[J]. 农业灾害研究, 2012, 2(3): 45-48. LUO S J. Study on application of deltamethrin[J]. J Agric Catastrophol, 2012, 2(3): 45-48. |
| [2] |
陈宗懋, 韩华琼, 岳瑞芝. 溴氰菊酯 (DECIS) 在茶叶中的残留降解[J]. 昆虫学报, 1983, 26(2): 146-153. CHEN Z M, HAN H Q, YUE R Z. Degradation of pyrethroid DECIS (Nrdc 161) on tea-shoots[J]. Acta Entomologica Sinica, 1983, 26(2): 146-153. |
| [3] |
丁明, 方学智, 费学谦, 等. 柿果和土壤中菊酯类农药的残留检测和消解动态研究[J]. 江西农业大学学报, 2006, 28(4): 512-515. DING M, FANG X Z, FEI X Q, et al. Quick determination and degradation of pyrethrins residuses in non-environmental pollution persimmon fruit and soil[J]. Acta Agriculturae Universitatis Jiangxiensis, 2006, 28(4): 512-515. DOI:10.3969/j.issn.1000-2286.2006.04.007 |
| [4] |
李雪飞, 杨艳刚, 孙胜龙, 等. 蔬菜中有机磷、拟除虫菊酯类农药残留调查[J]. 环境与健康杂志, 2006, 23(5): 418-420. LI X F, YANG Y G, SUN S L, et al. Analysis of organophosphorus and pyrethroid pesticides multi-residues in vegetables[J]. J Environ Health, 2006, 23(5): 418-420. DOI:10.3969/j.issn.1001-5914.2006.05.010 |
| [5] |
刘永明, 葛娜, 崔宗岩, 等. 进口粮谷中农药残留状况普查与分析[J]. 食品安全质量检测学报, 2016, 7(3): 1233-1239. LIU Y M, GE N, CUI Z Y, et al. Survey and analysis for pesticide residues in the imported grain[J]. J Food Saf Qual, 2016, 7(3): 1233-1239. |
| [6] |
张艳, 苟春林, 姜瑞, 等. 宁夏枸杞中拟除虫菊酯类农药残留风险评估[J]. 新疆农业科学, 2015, 52(12): 2273-2278. ZHANG Y, GOU C L, JIANG R, et al. Risk assessment of pyrethroid pesticides in wolfberry of Ningxia[J]. Xinjiang Agric Sci, 2015, 52(12): 2273-2278. |
| [7] |
赵李娜, 赖子尼, 张威振, 等. 珠江河网水产品中菊酯类农药残留调查及健康风险评价[J]. 生态毒理学报, 2014, 9(3): 437-444. ZHAO L N, LAI Z N, ZHANG W Z, et al. Residual levels and health risk assessment of pyrethroid pesticides in aquatic products of the pearl river delta[J]. Asian J Ecotoxicol, 2014, 9(3): 437-444. |
| [8] |
王文蝶, 邓玉君, 钱坤. 溴氰菊酯农药在土壤中的残留·迁移研究[J]. 安徽农业科学, 2011, 39(21): 12782-12783. WANG W D, DENG Y J, QIAN K. Study on residues and migration of deltamethrin in soil[J]. J Anhui Agric, 2011, 39(21): 12782-12783. DOI:10.3969/j.issn.0517-6611.2011.21.052 |
| [9] |
郑伟华, 赵建庄, 马德英, 等. 溴氰菊酯的毒性和致突变性的研究进展[J]. 北京农学院学报, 2004, 19(1): 77-80. ZHENG W H, ZHAO J Z, MA D Y, et al. Development of deltamethrin toxicity and mutagenicity[J]. J Beijing Agric College, 2004, 19(1): 77-80. DOI:10.3969/j.issn.1002-3186.2004.01.022 |
| [10] |
ARSLAN H, ALTUN S, ÖZDEMIR S. Acute toxication of deltamethrin results in activation of iNOS, 8-OHdG and up-regulation of caspase 3, iNOS gene expression in common carp (Cyprinus carpio L.)
[J]. Aquat Toxicol, 2017, 187: 90-99. DOI:10.1016/j.aquatox.2017.03.014 |
| [11] |
李艳, 张有林, 王宏. 农药残留降解方法研究[J]. 食品研究与开发, 2004, 25(6): 31-33. LI Y, ZHANG Y L, WANG H. Studies on the methods of degrading pesticide residues[J]. Food Res Dev, 2004, 25(6): 31-33. DOI:10.3969/j.issn.1005-6521.2004.06.011 |
| [12] |
钱玉琴, 陈巧, 董秀云, 等. 农药残留降解技术研究现状与展望[J]. 质量技术监督研究, 2010(6): 64-69. QIAN Y Q, CHEN Q, DONG X Y, et al. The current status and the prospect of the degradation of pesticide residues[J]. Qual Tech Superv Res, 2010(6): 64-69. |
| [13] |
崔中利, 崔利霞, 黄彦, 等. 农药污染微生物降解研究及应用进展[J]. 南京农业大学学报, 2012, 35(5): 93-102. CUI Z L, CUI L X, HUANG Y, et al. Advances and application of microbial degradation in pesticides pollution remediation[J]. J Nanjing Agric Univ, 2012, 35(5): 93-102. |
| [14] |
BARRAGÁN-HUERTA C, COSTA-PÉREZ J, PERALTA-CRUZ J, et al. Biodegradation of organochlorine pesticides by bacteria grown in microniches of the porous structure of green bean coffee[J]. Int Biodeterior Biodegrad, 2007, 59(3): 239-244. DOI:10.1016/j.ibiod.2006.11.001 |
| [15] |
WEN J P, LI H M, BAI J, et al. Biodegradation of 4-chlorophenol by Candida albicans PDY-07 under anaerobic conditions
[J]. Chin J Chem Eng, 2006, 14(6): 790-795. DOI:10.1016/S1004-9541(07)60013-5 |
| [16] |
杨晓棠. 溴氰菊酯降解菌的筛选及降解特性研究[D]. 长春: 吉林农业大学, 2008: 1-30. YANG X T. Study on isolation and degrading characteristics of deltamethrin-degrading bacteria[D]. Changchun: Jilin Agricultural University, 2008: 1-30. |
| [17] |
唐洁, 张庆, 曾朝懿, 等. 溴氰菊酯降解菌的分离与鉴定及其降解特性[J]. 西华大学学报(自然科学版), 2014, 33(3): 108-112. TANG J, ZHANG Q, ZENG C Y, et al. Isolation and characterization of deltamethrin degrading strain and its degradation characteristic[J]. J Xihua Univ( Nat Sci Ed), 2014, 33(3): 108-112. DOI:10.3969/j.issn.1673-159X.2014.03.025 |
| [18] |
MALONEY S E, MAULE A, SMITH A R. Microbial transformation of the pyrethroid insecticides: permethrin, deltamethrin, fastac, fenvalerate, and fluvalinate[J]. Appl Environ Microbiol, 1988, 54(11): 2874-2876. |
| [19] |
TALLUR P N, MEGADI V B, NINNEKAR H Z. Biodegradation of cypermethrin by Micrococcus sp. strain CPN 1
[J]. Biodegradation, 2008, 19(1): 77-82. DOI:10.1007/s10532-007-9116-8 |
| [20] |
KALWASIŃSKA A, KĘSY J, WILK I, et al. Neustonic versus epiphytic bacteria of eutrophic lake and their biodegradation ability on deltamethrin[J]. Biodegradation, 2011, 22(4): 699-707. DOI:10.1007/s10532-010-9414-4 |
| [21] |
YANG Z H, JI G D. Quantitative response relationships between degradation rates and functional genes during the degradation ofbeta-cypermethrin in soil
[J]. J Hazard Mater, 2015, 299: 719-724. DOI:10.1016/j.jhazmat.2015.08.005 |
| [22] |
CHEN S H, LIN Q S, XIAO Y, et al. Monooxygenase, a novel beta-cypermethrin degrading enzyme from Streptomyces sp.
[J]. PLoS One, 2013, 8(9): e75450. DOI:10.1371/journal.pone.0075450 |
| [23] |
YANG Z H, JI G D. Stereoselective degradation and molecular ecological mechanism of chiral pesticides beta-cypermethrin in soils with different pH values
[J]. Environ Sci Technol, 2015, 49(24): 14166-14175. DOI:10.1021/acs.est.5b04672 |
| [24] |
陈玉洁, 束长龙, 刘新刚, 等. 咪唑乙烟酸降解菌的分离、鉴定及降解特性研究[J]. 农药学学报, 2011, 13(4): 387-393. CHEN Y J, SHU C L, LIU X G, et al. Isolation, identification and characterization of a Shewanella hafniensis strain capable of degrading imazethapyr [J]. Chin J Pestic Sci, 2011, 13(4): 387-393. DOI:10.3969/j.issn.1008-7303.2011.04.10 |
| [25] |
廖敏, 张海军, 马爱丽, 等. 两株拟除虫菊酯类农药高效降解菌混合降解性能研究[J]. 农药学学报, 2009, 11(4): 472-479. LIAO M, ZHANG H J, MA A L, et al. Study on degrading performance of two efficient mixed strains for synthetic pyrethroid insecticides degradation[J]. Chin J Pestic Sci, 2009, 11(4): 472-479. DOI:10.3969/j.issn.1008-7303.2009.04.12 |
| [26] |
植物性食品中氯氰菊酯、氰戊菊酯和溴氰菊酯残留量的测定:GB/T 5009. 110—2003 [S]. 北京: 中国标准出版社, 2004. Determination of cypermethrin, fenvalerate and deltamethrin residues in vegetable foods: GB/T5009. 110—2003[S]. Beijing: China Standards Press, 2004. |
| [27] |
食品安全国家标准 食品中农药最大残留限量: GB 2763—2016[S]. 北京: 中国标准出版社, 2017. National food safety standard—maximum residue limits for pesticides in food: 2763—2016[S]. Beijing: Standards Press of China, 2017. |
| [28] |
涂书新, 韦朝阳. 我国生物修复技术的现状与展望[J]. 地理科学进展, 2004, 23(6): 20-32. TU S X, WEI C Y. The progress and prospects of bioremediation studies in China[J]. Prog Geogr, 2004, 23(6): 20-32. DOI:10.3969/j.issn.1007-6301.2004.06.003 |
| [29] |
尤民生, 刘新. 农药污染的生物降解与生物修复[J]. 生态学杂志, 2004, 23(1): 73-77. YOU M S, LIU X. Biodegradation and bioremediation of pesticide pollution[J]. Chin J Ecol, 2004, 23(1): 73-77. DOI:10.3321/j.issn:1000-4890.2004.01.016 |
| [30] |
向骊羽, 赵浩宇, 黄孟飞, 等. 一株溴氰菊酯降解菌的筛选及其降解特性研究[J]. 四川大学学报(自然科学版), 2012, 49(4): 914-918. XIANG L Y, ZHAO H Y, HUANG M F, et al. Isolation andidentification of a strain of deltamethrin degrading bacteria and its degradation characteristics[J]. J Sichuan Univ (Nat Sci Ed), 2012, 49(4): 914-918. DOI:10.3969/j.issn.0490-6756.2012.04.035 |
| [31] |
崔俊涛, 张伟, 杨晓棠, 等. 溴氰菊酯降解菌的筛选及其降解特性研究[J]. 安全与环境学报, 2009, 9(6): 59-62. CUI J T, ZHANG W, YANG X T, et al. Isolating and degrading features of deltamethrin-degrading bacteria[J]. J Saf Environ, 2009, 9(6): 59-62. DOI:10.3969/j.issn.1009-6094.2009.06.016 |
| [32] |
耿毅, 汪开毓, 陈德芳, 等. 嗜麦芽寡养单胞菌研究进展[J]. 动物医学进展, 2006, 27(5): 28-31. GENG Y, WANG K Y, CHEN D F, et al. Progress on research of Stenotrophomnas maltophilia [J]. Prog Vet Med, 2006, 27(5): 28-31. DOI:10.3969/j.issn.1007-5038.2006.05.008 |
| [33] |
吴小倩, 王晶, 鲁丹, 等. 固定化嗜麦芽寡养单胞菌的制备及其降解羽毛废弃物的初步研究[J]. 环境污染与防治, 2012, 34(12): 17-21. WU X Q, WANG J, LU D, et al. Preparation of immobilized Stenotrophomonas maltophilia DHHJ cells and its performance of feather degradation [J]. Environ Pollut Control, 2012, 34(12): 17-21. DOI:10.3969/j.issn.1001-3865.2012.12.005 |
| [34] |
鲁丹, 曹张军, 周美华. 嗜麦芽寡养单胞菌降解羽毛 5 L 发酵罐工业小试过程研究[J]. 环境工程学报, 2009, 3(8): 1513-1516. LU D, CAO Z J, ZHOU M H. Study on Stenotrophomonas maltophilia DHHJ fermentation in 5 L fermenter pilot plant [J]. Chin J Environ Eng, 2009, 3(8): 1513-1516. |
| [35] |
李红权, 李红梅, 蒋继志, 等. 一株 DDT 降解菌的筛选、鉴定及降解特性的初步研究[J]. 微生物学通报, 2008, 35(5): 696-699. LI H Q, LI H M, JIANG J Z, et al. Isolation and characterization of a DDT degradation bacterium strain D-1[J]. Microbiol China, 2008, 35(5): 696-699. DOI:10.3969/j.issn.0253-2654.2008.05.009 |
| [36] |
李雪云. 嗜麦芽寡养单胞菌产聚羟基烷酸酯的研究[D]. 广州: 华南理工大学, 2011: 67. LI X Y. Study on the production of polyhydroxyalkanoates from Stenotrophomonas maltophlia[D]. Guangzhou: South China University of Technology, 2011: 67. |
 2018, Vol. 20
2018, Vol. 20


