香蕉炭疽病是由香蕉炭疽菌Colletotrichum musa侵染引起的,是香蕉采后贮藏、运输和销售过程中发生的主要病害之一。目前,该病的防治仍以化学杀菌剂为主,使用较多的是多菌灵可湿性粉剂和咪鲜胺水乳剂[1-3]。但长期使用化学杀菌剂不仅使病原菌产生抗药性,而且残留农药也会导致环境污染及威胁人类健康,因此研究安全有效的防治措施势在必行,其中生物防治是最具应用前景的措施之一[4]。而利用生防菌防治香蕉炭疽病是一种可能的替代措施。
链霉菌广泛存在于不同的自然生态环境中,种类繁多,代谢功能各异,是一类具有广泛实际用途和产生巨大经济价值的微生物资源[5]。李立梅等[6]发现,盐屋链霉菌对杨树烂皮病菌、杨树溃疡病菌和苹果斑点落叶病菌等13种植物病原菌均有抑制作用,抑菌谱广。针对炭疽病菌等植物病原菌,研究人员从陆生环境中已筛选出大量的生防放线菌。梁春浩[7]从葡萄园的土壤样品中分离筛选到1株对葡萄霜疫霉病菌具有良好拮抗作用的暗黑链霉菌Streptomyces atratusHigashide etal.,其发酵液原液对葡萄霜霉病中期防效可达90%以上,高于58%甲霜锰锌可湿性粉剂1 000倍稀释液,且该菌对辣椒疫霉等9种病原菌都具有较好的拮抗作用,抑菌谱较广,且其在复杂的自然环境下防效稳定。罗建军等[8]从砂糖橘果实表面分离到1株拮抗放线菌,并鉴定为小白链霉菌Streptomyces albulus Routien,该菌株对香蕉炭疽菌有很强的拮抗作用,其平板抑菌带宽度达17.08 mm,同时其无菌发酵液对柑橘绿霉病菌等16种果蔬病原真菌均具有拮抗作用。
笔者从土壤中分离出1株放线菌CY-14,初步研究发现其对香蕉炭疽菌具有较好的拮抗效果,于是利用常规方法结合16S rDNA序列分析对该菌株进行了初步鉴定,并研究了其发酵液对香蕉炭疽菌的活性。现将结果报道如下。
1 材料与方法 1.1 供试菌株和培养基香蕉炭疽菌Colletotrichum musae、香蕉枯萎病菌Fusarium oxysporumf. sp. Cubense、芒果蒂腐病菌Botryodiplodia theobromaePat.、橡胶炭疽菌Colletotrichum gloeosporioides、火龙果镰刀菌Fusarium dimerum、番石榴拟盘多毛菌Pestalotia mangiferae P.Henn.、小麦赤霉病菌Fusarium graminearum、稻瘟病菌Magnaporthe oryzea和番茄早疫霉菌Alternaria solani,均由海南大学热带农林学院实验室提供。
高氏一号培养基:可溶性淀粉20.0 g,氯化钠0.5 g,硝酸钾1.0 g,三水合磷酸氢二钾0.5 g,七水合硫酸镁0.5 g,七水合硫酸亚铁0.01 g,琼脂粉18.0 g,蒸馏水1 000 mL (为抑制细菌和霉菌的生长,在分离培养基中每升加入0.05 g重铬酸钾和0.2 mL制霉菌素)。PDA培养基:马铃薯200.0 g,葡萄糖20.0 g,琼脂粉18.0 g,蒸馏水1 000 mL。PDB培养基:马铃薯200.0 g,葡萄糖20.0 g,蒸馏水1 000 mL。LB培养基:氯化钠10.0 g,胰蛋白胨10.0 g,酵母提取物5.0 g,蒸馏水1 000 mL。NB培养基:牛肉膏3.0 g,胰蛋白胨10.0 g,葡萄糖2.5 g,蒸馏水1 000 mL。小米培养基:小米20 g,葡萄糖20 g,碳酸钙2 g,氯化钠2.5 g,蛋白胨3 g,蒸馏水1 000 mL。
明胶液化培养基、牛奶凝固胨化培养基、柴斯纳 (Tresner) 琼脂培养基、酪氨酸琼脂培养基、淀粉水解琼脂培养基、纤维素水解培养基和硝酸盐还原培养基,用于生理生化测定。高氏一号琼脂培养基、察氏培养基、葡萄糖天门冬素琼脂培养基、伊莫松培养基、葡萄糖酵母膏琼脂培养基、苹果酸钙琼脂培养基、胰蛋白胨琼脂培养基 (ISP2)、甘油天门冬素琼脂培养基 (ISP3)、L-酪氨酸琼脂培养基 (ISP4) 和燕麦琼脂培养基 (ISP5),用于菌株培养特征观察。
1.2 土壤放线菌的初步筛选土壤样品采自海南大学农科基地菜园。称10 g待分离的土壤样品,加入90 mL无菌水,制成质量分数为10–1土壤悬浮液,再分别稀释到10–3、10–4和10–5 3个梯度,每个梯度吸取200 μL涂布于高氏一号培养基平板 (含重铬酸钾) 表面,每个梯度重复3次。于28 ℃恒温培养箱中培养7 d后,挑取单菌落于PDA培养基划线培养,在28 ℃恒温培养箱中培养7 d。以香蕉炭疽菌为受试菌,采用平板对峙法[11]进行初筛。用接种环分别挑取少量放线菌,于距培养皿中心2 cm处各画一条贯穿培养皿的平行直线,封好膜后倒置培养4 d后,再用直径为5 mm的打孔器选取生长5 d的香蕉炭疽菌菌块,接种于PDA培养基中央。每株放线菌的处理做3个重复,以只接种香蕉炭疽菌的菌块为对照。于28 ℃倒置培养7 d后观察,比较不同处理下香蕉炭疽菌的生长情况。
1.3 菌株CY-14的鉴定 1.3.1 形态特征和培养特征的观察采用插片培养法[9-10]在高氏一号培养基上培养菌株CY-14。将培养5~7 d的插片经烘干和镀金处理后,用扫描电子显微镜观察孢子丝形态特征。依据《链霉菌鉴定手册》[12]和《放线菌的分类和鉴定》[13]的方法,将菌株CY-14分别接种到ISP1、ISP2、ISP3、ISP4、ISP5、ISP6和ISP7培养基上,在28 ℃恒温培养箱中培养7~15 d,观察其培养特征,包括生长情况、基内菌丝颜色、气生菌丝颜色和有无可溶性色素产生。
1.3.2 菌株生理生化指标测定参照《链霉菌鉴定手册》[12]测定明胶液化、牛奶凝固和胨化、硫化氢产生、纤维素和碳源利用等情况。
1.3.3 16S rDNA序列测定及系统发育分析参照文献方法提取基因组DNA[14]。PCR扩增采用通用引物,PCR反应体系:10 µL Premix Taq,8 µL灭菌去离子水,1µL提取的CY-14 DNA模板,0.5 µL引物1 (5'-AGAGTTTGATCATGGCTCAG-3'),0.5 µL引物2 (5'-TAGGGTTACCTTGTTACGACTT-3')。PCR反应条件:95 ℃预变性 5 min;95 ℃变性 30 s、57 ℃退火 30 s、72 ℃延伸60 s,30 个循环;72 ℃延伸 10 min。PCR扩增产物进行琼脂糖凝胶电泳检测,回收PCR产物,连接到pMD18-T载体并转化至大肠杆菌感受态细胞中,挑取阳性单克隆送上海英骏生物技术有限公司进行测序。所得序列在EZ Biocloud (www.ezbiocloud.net/) 进行多序列比对分析,利用MEGA5.0软件以邻近相接法 (Neighbor-joining) 构建系统进化树。
1.4 菌株CY-14发酵培养基的筛选用LB液体培养基接种菌株CY-14,于28 ℃振荡培养48 h;分别接种于小米培养基、PDB、LB、NB和高氏一号液体培养基中,于28 ℃振荡培养4 d,用脱脂棉过滤掉菌丝体,取发酵液的上清液,用0.22 μm的细菌过滤器过滤备用。采用菌丝生长速率法[15]测定其发酵液的杀菌活性。在50 ℃的9 mL PDA培养基中加入1 mL无菌发酵液,摇匀待其凝固后在培养皿中间接入已培养5 d、直径为5 mm的香蕉炭疽菌菌饼。以加入1 mL无菌水的处理为对照,每处理重复3次。于28 ℃黑暗培养3 d,用十字交叉法测量香蕉炭疽菌的菌饼直径,并计算其抑制率。
1.5 菌株CY-14发酵液抗菌谱测定采用菌丝生长速率法测定CY-14发酵液对9种植物病原真菌的抑制作用。9 mL PDA培养基中分别加入1 mL无菌发酵液。以加无菌水为对照,每处理重复3次,试验方法同1.4节。
1.6 菌株CY-14发酵液热稳定性测定参照文献方法[16],将发酵液分别在40、60、80和100 ℃下处理1 h,用无菌水补齐挥发掉的水分,经0.22 μm细菌过滤器进行除菌处理,然后采用菌丝生长速率法[15]测定其对香蕉炭疽菌的抑制作用,计算抑制率。
1.7 菌株CY-14发酵液对香蕉炭疽菌孢子萌发的影响将香蕉炭疽菌接种于PDA培养基上,于28 ℃下黑暗培养7 d,待菌丝长满平板后,向培养基内加入10 mL无菌水,用盖玻片轻扫平板表面,后经适量脱脂棉过滤,收集孢子液,用血球计数板计算孢子数量,并将香蕉炭疽菌孢子浓度调至1.0 × 104个/mL。分别吸取200、100、50、20、10、5、2和1 μL无菌发酵液,分别加入上述孢子液中,制成1 mL含CY-14发酵液的香蕉炭疽菌孢子悬浮液,摇匀后吸取40 μL滴于载玻片上,于25 ℃保湿培养6 h,观察孢子萌发情况并进行统计[16]。
1.8 菌株CY-14发酵液对香蕉炭疽病的防效从海南大学实验基地采收八成熟的香蕉,参照文献方法[17],先用棉花蘸取95%的酒精擦拭香蕉表面,再用无菌水擦拭3次。用已灭菌的束针在香蕉上制造伤口,每个香蕉制造6个伤口。以水为溶剂,将75%的百菌清可湿性粉剂配制成有效成分质量浓度1 000 mg/L的百菌清药液,备用。分别用棉花蘸取1 000 mg/L的百菌清药液和CY-14发酵液原液,涂抹于香蕉表面,待其晾干后重新涂抹,共涂抹3次。以涂抹无菌水的处理作为对照。把在PDA培养基上培养5 d的香蕉炭疽菌菌饼接种于伤口处,于28 ℃下保湿培养,观察发病情况。
2 结果与分析 2.1 菌株CY-14的皿内拮抗活性对峙培养法测定结果(图1)表明,放线菌CY-14对香蕉炭疽菌具有明显的拮抗作用,其皿内抑制率达51.4%。
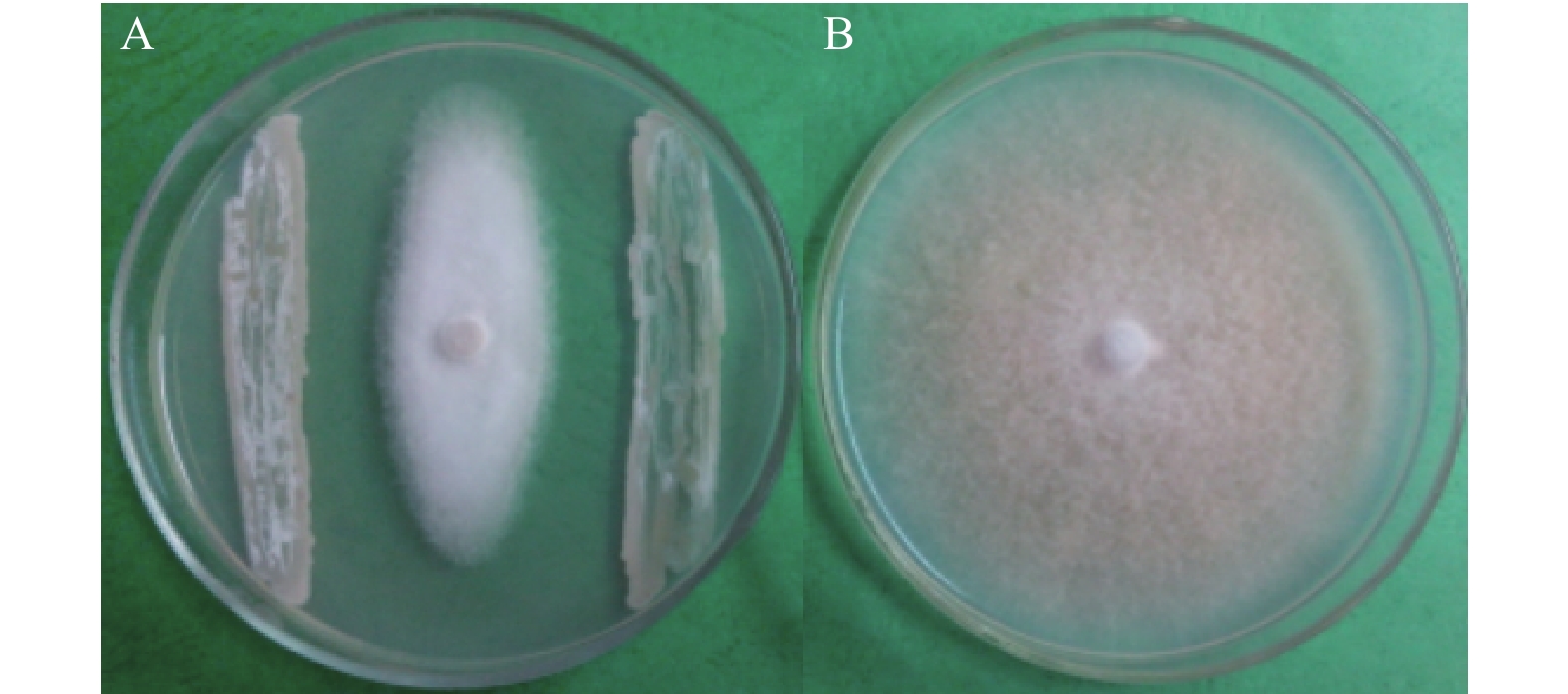
|
A. 菌株CY-14的拮抗作用;B. 香蕉炭疽菌对照。 A. The antagonistic effect of strain CY-14; B. The control of C. musae. 图 1 菌株CY-14对香蕉炭疽菌的抑制作用 Fig. 1 The inhibitory effect of strain CY-14 on Colletotrichum musae |
2.2 菌株CY-14的鉴定
菌株CY-14在高氏一号培养基上单菌落的形态:气生菌丝丰富且有粉色的粉状物突起,基内菌丝无色,不产色素,干燥,较嫩时菌落边缘有一圈白色“干粉”,链珠状的孢子丝 (图2)。形态培养特征和生理生化指标结果如下:菌株在12种不同培养基中,培养特征不同,但其气生菌丝主要以浅黄色和白色为主,基内菌丝以无色为主,生长状况一般 (表1);菌株CY-14可利用D-甘露醇、葡萄糖、麦芽糖、D-木糖、棉籽糖、D-半乳糖、蔗糖、鼠李糖和D-果糖,不能利用肌醇和阿拉伯糖;明胶液化、牛奶凝固胨化及硝酸盐还原试验呈阳性,不可以水解纤维素和淀粉,在柴斯纳琼脂培养基不产硫化氢,在酪氨酸琼脂培养基上不产色素 (表2)。对菌株的16S rDNA序列进行PCR扩增,测序得到1 488 bp的碱基序列 (GenBank登陆号:MH254884),将得到的16S rDNA序列进行比对分析,发现其与Streptomyces bambusae (竹沥链霉菌) 的亲缘关系最近,相似度达到98.68%,利用MEGA5.0构建系统进化树 (图3),结合形态学特征将放线菌CY-14初步鉴定为链霉菌属 (Streptomyces sp.)。
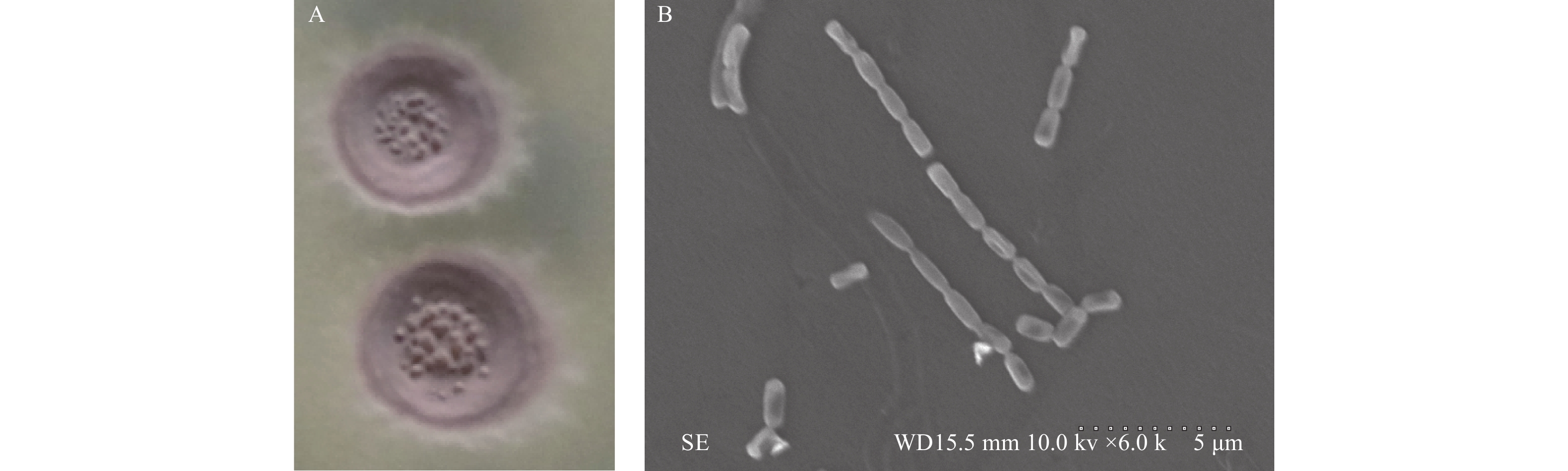
|
A. 菌落形态;B. 扫描电子显微照片。 A. Colony morphology; B.Scanning electron micrograph. 图 2 菌株CY-14形态 Fig. 2 Morphology of strain CY-14 |
|
|
表 1 菌株 CY-14菌株在不同培养基中培养的特征 Table 1 Culture characteristics of strain CY-14 in different media |
|
|
表 2 菌株CY-14 的生理生化特征 Table 2 Physiological and biochemical characteristics of strain CY-14 |
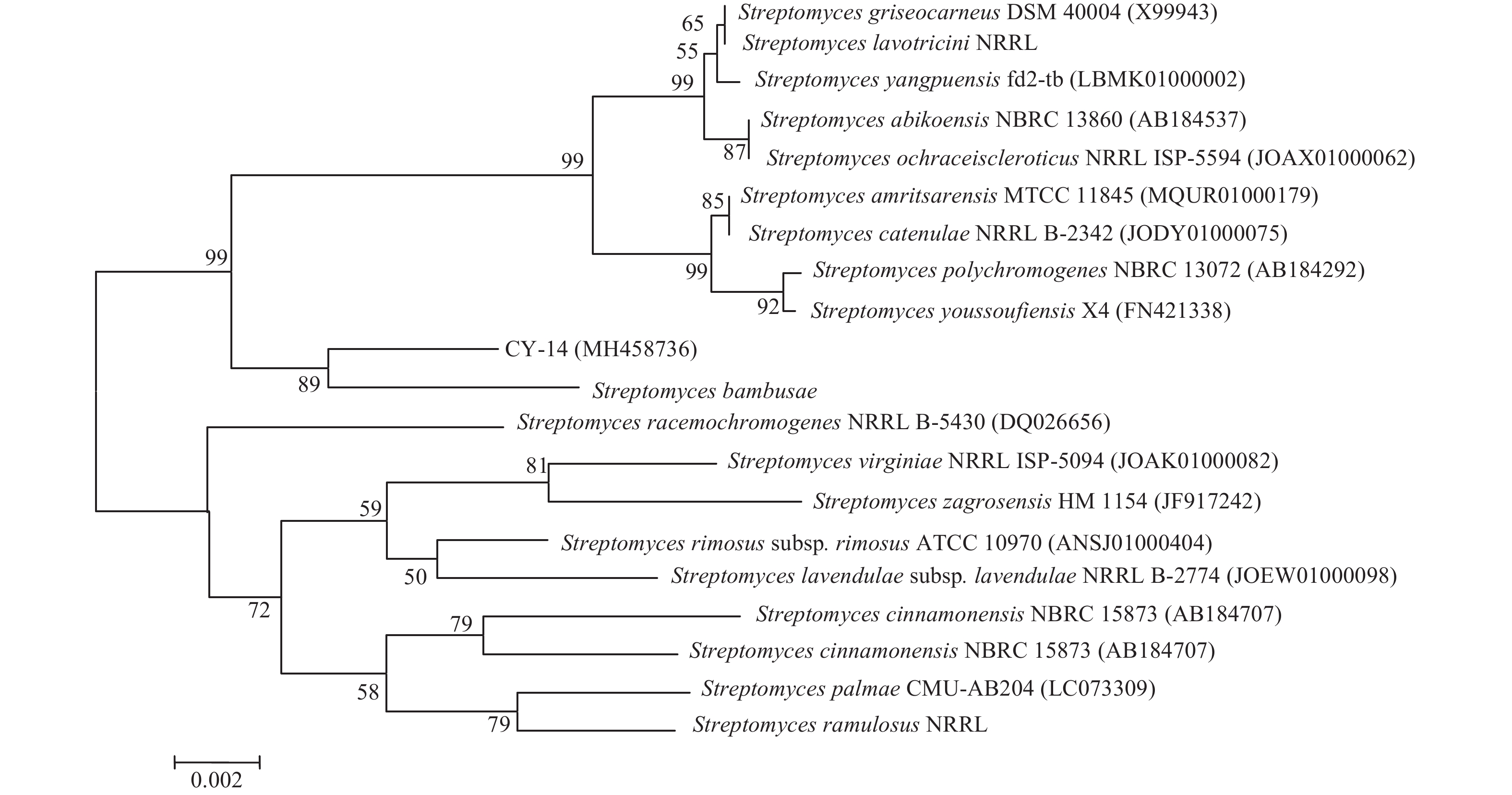
|
注:聚集方法为邻近相接法,括号中的字母和数字是改序列在GenBank上的登录号,分支处的数字代表置信度,标尺代表进化距离。 Note:The aggregation method is the adjacent contiguity method. The letters and numbers in brackets are the login numbers of the modified sequence on GenBank. The numbers at the branches represent the confidence and the rulers represent evolutionary distances. 图 3 基于16S rDNA序列的菌株CY-14系统进化树 Fig. 3 Phylogenetic tree based on 16S rDNA sequences of strain CY-14 |
2.3 菌株CY-14发酵培养基的筛选
利用生长速率法测定了菌株不同培养基的发酵液对香蕉炭疽菌的拮抗活性。结果 (图4) 表明:小米培养基发酵液的抑制作用最强,抑制率达92.5%,LB和PDB发酵液次之,分别为86.4%和74%,NB和高氏一号培养基发酵液的抑制作用较弱。因此,后期试验选用小米培养基作为菌株CY-14发酵培养基。
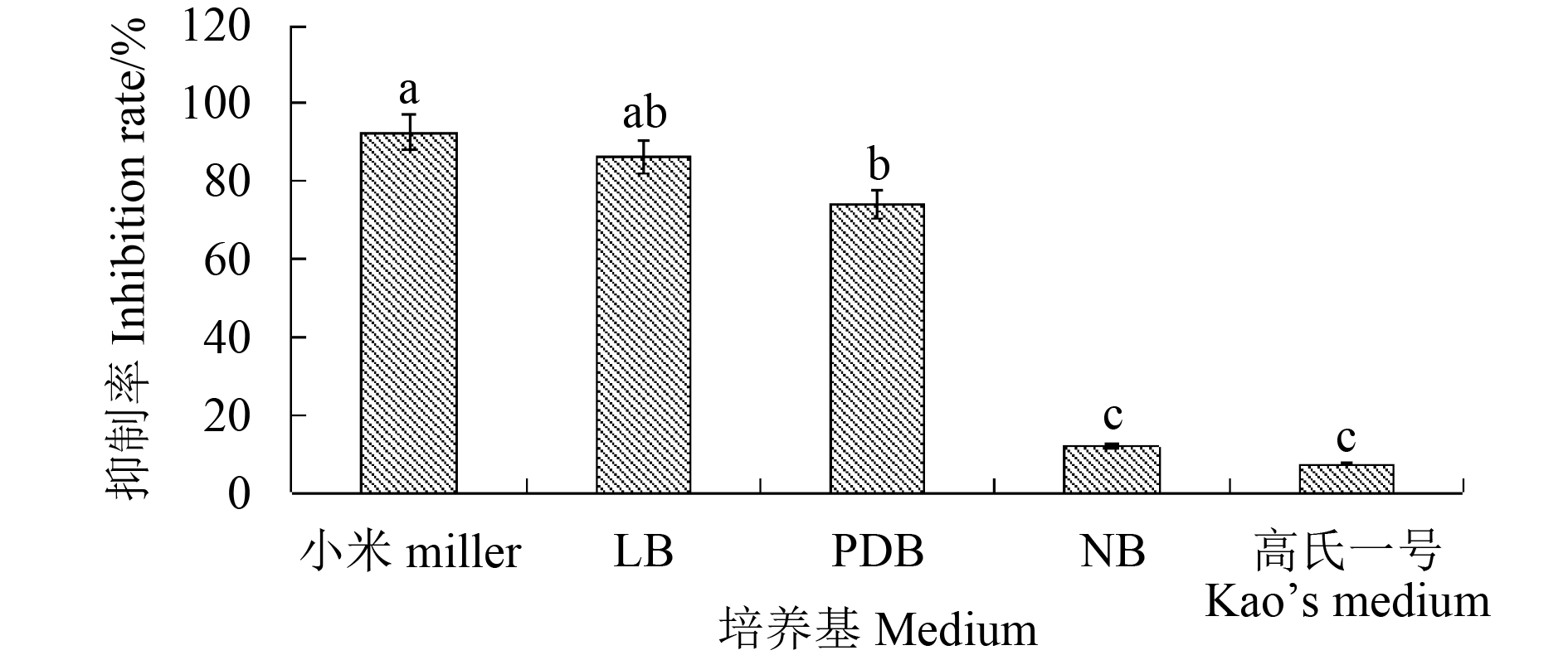
|
注:图柱上的小写字母表示在0.05水平上差异显著。 Note: The lowercase letters on the column show significant differences at the 0.05 level. 图 4 不同的培养基发酵液对香蕉炭疽菌的抑制作用 Fig. 4 Inhibitory effects of different medium fermentation broth on C. musae |
2.4 菌株CY-14发酵液对9种植物病原真菌的抑制作用
结果 (表3和图5) 表明:菌株CY-14发酵液对9种供试植物病原真菌均有较强的拮抗作用,抑制率在50%以上,其中对稻瘟病菌的抑制率最低,为51.33%,对小麦赤霉病菌抑制效果最为明显,达91.8%,说明其发酵液对大部分的病原真菌都有较好的抑制作用,具有较广的抗菌活性。
|
|
表 3 CY-14发酵液对9种植物病原真菌的抑制作用 Table 3 Inhibitory effects of the fermentation broth on 9 plant pathogenic fungi |

|
图 5 发酵液对9种植物病原真菌的抑制作用 Fig. 5 Inhibitory effects of the fermentation broth on 9 plant pathogenic fungi |
2.5 菌株CY-14发酵液热稳定性
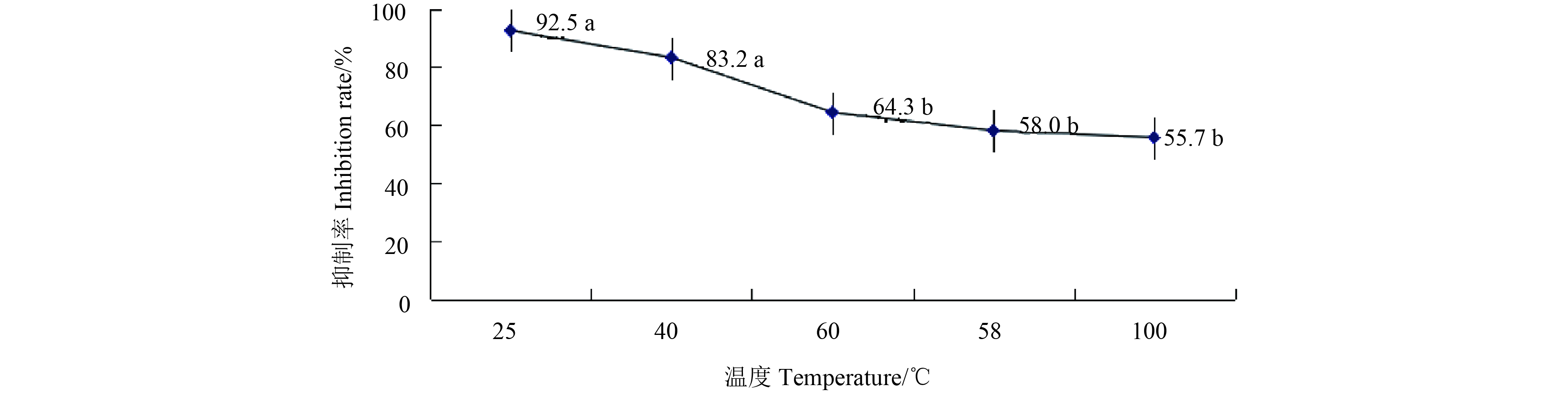
菌丝生长速率法测定结果 (图6) 表明:CY-14发酵液热稳定性较好。处理温度在100 ℃以下时,其对香蕉炭疽菌抑制率均在50%以上;随着处理温度逐渐升高,抑制率有小幅下降,在60 ℃后,抑制率保持在50%~70%之间;在100 ℃处理1 h后,抑制率为55.7%。
|
注:数据后的小写字母表示在0.05水平上差异显著。 Note: Lowercase letter means significantly different at 0.05 level. 图 6 不同温度下处理发酵液对香蕉炭疽菌的抑制作用 Fig. 6 Inhibition effect of fermentation broth on C. musae at different temperatures |
2.6 菌株CY-14发酵液对香蕉炭疽菌孢子萌发的影响
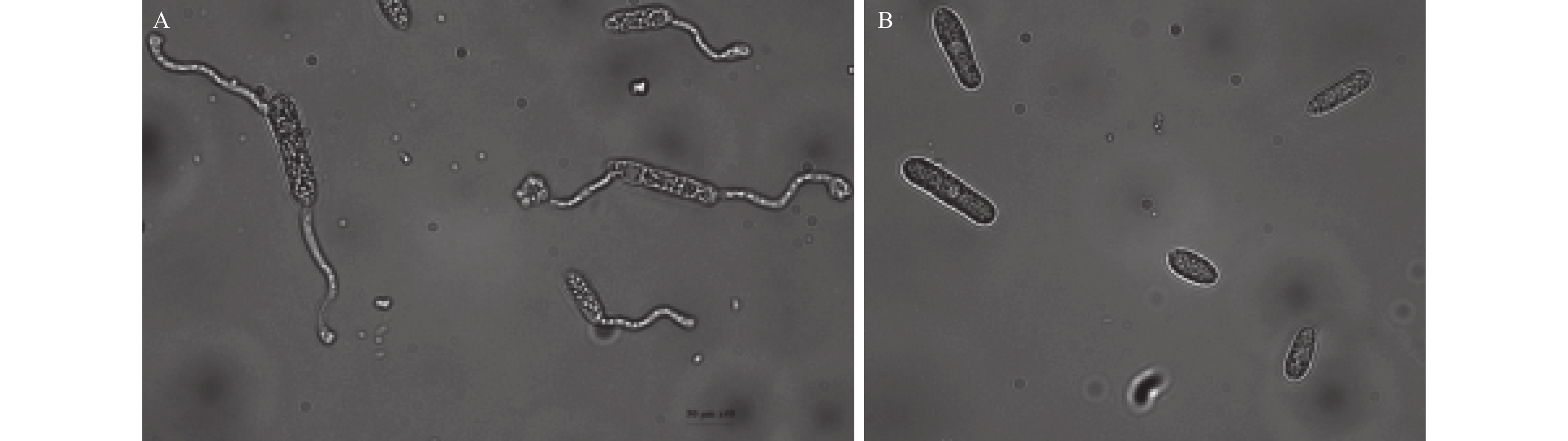
测定结果 (图7) 显示:CY-14发酵液对香蕉炭疽菌孢子萌发有很强的抑制作用,将发酵液稀释1 000倍,处理后孢子的萌发率依然为0,而空白对照的孢子萌发率已达95%。
|
A:对照;B:发酵液稀释1 000倍处理的孢子萌发情况。 A:Control; B Germination of spores treated by 1 000 times diluted fermentation broth. 图 7 发酵液对香蕉炭疽菌的孢子萌发的抑制作用 Fig. 7 Inhibitory effect of fermentation broth on spore germination of Colletotrichum musae |
2.7 菌株CY-14发酵液对香蕉炭疽病的防效
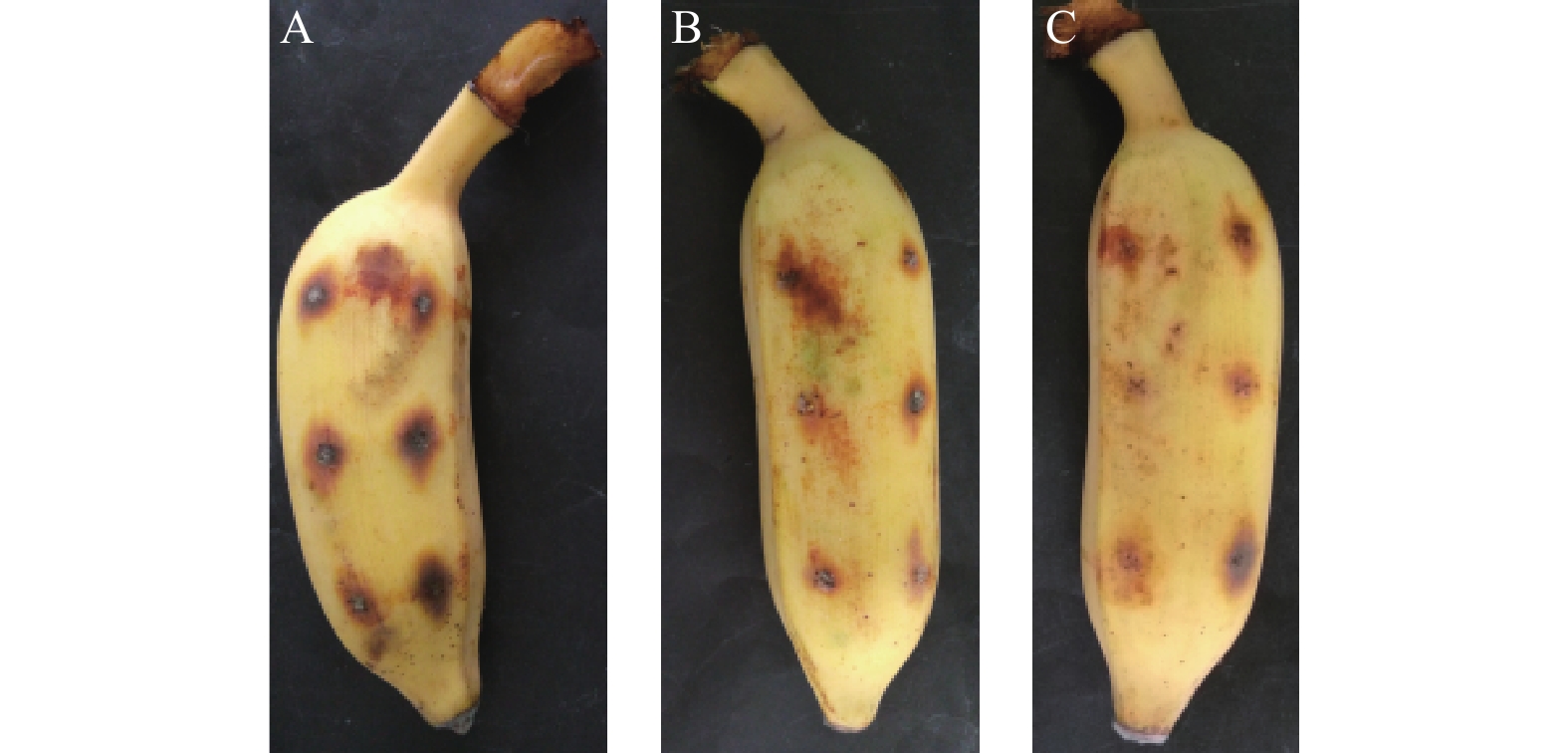
利用香蕉果实测试了菌株CY-14发酵液对香蕉炭疽病的防效,测定结果如图8所示。CY-14发酵液对香蕉炭疽病的防效与百菌清相当。
|
A. 无菌水对照;B.1 000 mg/L百菌清药液;C. 发酵液。 A.The control with sterile water; B.Chlorothalonil solution; C. Fermentation broth. 图 8 菌株CY-14发酵液对香蕉果实炭疽病的防效 Fig. 8 The control efficacy on the banana fruits infected with anthracnose |
3 讨论与结论
香蕉炭疽菌主要为害香蕉果实,其可潜伏在幼果上,待果实成熟后发病。目前,在关于香蕉炭疽病的生物防治方面,报道较多的是采用一些生防细菌进行防治[18-19],也有一些采用放线菌防治的报道。李振华等[20]从海南的土壤中分离到6株放线菌,其活菌及其无菌发酵液对香蕉炭疽菌均有较强的抑制作用,用其无菌发酵液浸泡香蕉果实可有效防治香蕉炭疽病的发生。土壤是放线菌的主要生存场所,放线菌作为土壤中的优势微生物类群,在土壤中的适应性很广,其主要存在于中性偏碱的土壤中[21]。付岗等[22]发现,枯草芽孢杆菌B106 (1 × 108 CFU/mL) 对田间香蕉炭疽病的防效为48.6%。罗萍等[23]从香蕉组织中分离筛选到5株香蕉炭疽菌拮抗菌,均对香蕉炭疽病表现出显著的防治效果,防效在50%~70%,其中有1株AtC-13被初步鉴定为解淀粉芽孢杆菌Bacillus amyloliquefaciens,不仅在平板上有活性,而且在香蕉自然发病的防效试验中表现出显著的防治效果,其病情指数为18.67%,比对照降低了13%。
采用植物源农药进行的生物防治也有报道,例如,静玮等[24]的研究结果表明,茶树油熏蒸处理能显著抑制香蕉炭疽菌的菌丝生长和香蕉果实病害的发生,并能保持较好的果实果皮颜色和硬度,常温贮藏后果实仍具有较好的外观品质。据报道,在50 ℃下用含20%红柳和牧豆树的提取物处理香蕉,可减少炭疽病的发生,从而延长香蕉的保质期,且不影响香蕉的理化性质[25];使用10%的阿拉伯胶和1%壳聚糖处理香蕉,可有效控制香蕉炭疽病的发生[26]。
本研究从土壤中分离到1株对香蕉炭疽菌有拮抗活性的生防放线菌CY-14菌株,其体积分数为10%的发酵液对香蕉炭疽菌的抑制率达92.5%,且抑菌谱较广,发酵液原液的防治效果与对照1 000 mg/L的百菌清相当。本研究发现,随着处理温度升高,CY-14发酵液活性逐渐降低,推测其活性物质可能是蛋白类物质,加热后发生变性,进而造成活性下降;也可能是因为其活性组分不止1种,部分活性成分热稳定性欠佳。菌株CY-14发酵液对香蕉炭疽菌孢子的萌发具有较强的抑制作用,这可能是发酵液抑制香蕉炭疽菌生长的作用机制之一,即通过抑制其孢子的萌发而控制菌丝的生长,致使病菌不易侵入果实以及蕉叶上。菌株CY-14发酵液原液处理香蕉,其对炭疽病的防效与对照药剂1 000 mg/L的百菌清效果相当,在防治炭疽病方面有一定的应用前景。有关其防病机理有待进一步研究。
| [1] |
雷照鸣, 梁艳琼, 贺春萍, 等. 20%咪鲜胺水乳剂防治香蕉炭疽病效果评价[J]. 安徽农业科学, 2013, 41(11): 4830-4831. LEI Z M, LIANG Y Q, HE C P, et al. Evaluation on 20% prochoraz emulsion water on controlling banana anthracnos[J]. J Anhui Agric Sci, 2013, 41(11): 4830-4831. DOI:10.3969/j.issn.0517-6611.2013.11.048 |
| [2] |
付岗, 黄思良, 谢玲, 等. 45%咪鲜胺水乳剂对香蕉采后炭疽病的控制效果[J]. 安徽农业科学, 2009, 37(23): 11056-11057, 11063. FU G, HUANG S L, XIE L, et al. Control effect of 45% prochloraz EW against postharvest banana anthracnose[J]. J Anhui Agric Sci, 2009, 37(23): 11056-11057, 11063. DOI:10.3969/j.issn.0517-6611.2009.23.098 |
| [3] |
KHAN S H, AKED J, MAGAN N. Control of the anthracnose pathogen of banana (Colletotrichum musae) using antioxidants alone and in combination with thiabendazole or imazalil
[J]. Plant Pathol, 2001, 50(5): 601-608. DOI:10.1046/j.1365-3059.2001.00599.x |
| [4] |
周亚奎, 陈旭玉, 郑服丛. 香蕉炭疽病生物防治研究进展[J]. 中国农学通报, 2008, 24(4): 328-331. ZHOU Y K, CHEN X Y, ZHENG F C. Advance in the study on biological control of banana anthracnose[J]. Chin Agric Sci Bull, 2008, 24(4): 328-331. |
| [5] |
李其利, 宁平, 郑露, 等. 不同培养条件对球孢链霉菌JK-1生长及其产生抗菌物质的影响[J]. 南方农业学报, 2012, 43(11): 1682-1687. LI Q L, NING P, ZHENG L, et al. Different culture conditions' effects on growth and antifungal substances production of Streptomyces globisporus JK-1 [J]. J Southern Agric, 2012, 43(11): 1682-1687. DOI:10.3969/j:issn.2095-1191.2012.11.1682 |
| [6] |
李立梅, 李鑫, 沈佳龙, 等. 杨树烂皮病生防链霉菌的筛选及鉴定[J]. 植物保护学报, 2017, 44(1): 137-144. LI L M, LI X, SHEN J L, et al. Screening and indentification of an actinomycete Streptomyces for the biocontrol of poplar canker disease [J]. J Plant Prot, 2017, 44(1): 137-144. |
| [7] |
梁春浩. 葡萄霜霉病生防放线菌PY-1鉴定及抑菌活性物质结构解析[D]. 沈阳: 沈阳农业大学, 2016. LIANG C H. Identification of actinomycetes PY-1 against Plasmopara viticola and structure determination of antimicrobial substances[D]. Shenyang: Shenyang Agricultural University, 2016. |
| [8] |
罗建军, 李辉, 耿鹏, 等. 拮抗放线菌MY-4的分离、鉴定及其对果蔬病原菌的抑制作用[J]. 果树学报, 2012, 29(4): 644-649. LUO J J, LI H, GENG P, et al. Isolation and identification of actinomyce strain MY-4 and its antagonistic activity against pathogenic fungi of fruits and vegetables[J]. J Fruit Sci, 2012, 29(4): 644-649. |
| [9] |
刘重喜. 大豆根部内生放线菌的筛选、鉴定及其活性代谢产物研究[D]. 哈尔滨: 东北农业大学, 2013. LIU C X. Sreening and indentification of endophytic actinomycetes from soybean roots and study of their metabolites with bioactivity[D]. Harbin: Northeast Agricultural University, 2013. |
| [10] |
韩秀芳. 土壤放线菌分离菌株的分类鉴定与拮抗性筛选[D]. 北京: 北京理工大学, 2015. HAN X F. Taxonomic identification and resistance screening of actinomycetes[D]. Beijing: Beijing Institute of Technology, 2015. |
| [11] |
李小俊, 成丽霞, 吴彦彬, 等. 拮抗菌抗菌谱及发酵液拮抗能力测定的新方法[J]. 生物技术, 2007, 17(1): 55-58. LI X J, CHENG L X, WU Y B, et al. New methods of testing fermentation liquid antagonistic effect of antagonistic bacteria and antimicrobial spectrum[J]. Biotechnology, 2007, 17(1): 55-58. DOI:10.3969/j.issn.1004-311X.2007.01.020 |
| [12] |
中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975: 13-15. Taxonomy of Actinomycetes from the Institute of Microbiology, Academy of Sciences of China Academy of Sciences. Streptomyces identification manual[M]. Beijing: Science Press, 1975, 13-15. |
| [13] |
阎逊初. 放线菌的分类和鉴定[M]. 北京: 科学出版社, 1992. YAN X C. Classification and identification of actinomycetes[M]. Beijing: Science Press, 1992. |
| [14] |
MEHLING A, WEHMEIER U F, PIEPERSBERG W. Nucleotide sequences of Streptomycete 16S ribosomal DNA: towards a specific identification system for streptomycetes using PCR[J]. Microbiology, 1995, 141(9): 2139-2147. DOI:10.1099/13500872-141-9-2139 |
| [15] |
CAI Z Y, LI G H, LIN C H, et al. Identifying pathogenicity genes in the rubber tree anthracnose fungus Colletotrichum gloeosporioides through random insertional mutagenesis
[J]. Microbiol Res, 2013, 168(6): 340-350. DOI:10.1016/j.micres.2013.01.005 |
| [16] |
徐大勇, 李志栋, 李峰, 等. 番茄灰霉病菌拮抗放线菌的筛选、鉴定及其活性评价[J]. 中国生物防治学报, 2012, 28(2): 298-302. XU D Y, LI Z D, LI F, et al. Screening, identification and inhibitory activity of an actinomycete strain and against Botrytis cinerea [J]. Chin J Biol Control, 2012, 28(2): 298-302. DOI:10.3969/j.issn.2095-039X.2012.02.024 |
| [17] |
柳志强, 郑媛, 吴亚腾, 等. 阴香内生细菌YX6的鉴定及对香蕉炭疽病的防效[J]. 西南农业学报, 2014, 27(6): 2402-2404. LIU Z Q, ZHENG Y, WU Y T, et al. Study on identification of Cinnamomum burmannii endophytic bacterial strain YX6 and its control effect on Colletotrichum musae [J]. Southwest China J Agric Sci, 2014, 27(6): 2402-2404. |
| [18] |
张斯颖, 骆焱平, 胡坚, 等. 阴香内生菌YXG2-3的抑菌活性与生长条件优化[J]. 西北农林科技大学学报 (自然科学版), 2018, 46(7): 87-94. ZHANG S Y, LUO Y P, HU J, et al. Optimal growth conditions and antibacterial activities of endophyte YXG2-3 from Cinnamoumum burmanii [J]. J Northwest A&.F Univ (Nat. Sci. Ed.), 2018, 46(7): 87-94. |
| [19] |
欧雄常, 柳凤, 何红, 等. 红树内生细菌AmS2防治香蕉采后炭疽病的研究[J]. 保鲜与加工, 2013, 13(5): 15-19. OU X C, LIU F, HE H, et al. Biological control banana anthracnose by endophytic bacterial strain AmS2 from mangrove[J]. Storage and Process, 2013, 13(5): 15-19. DOI:10.3969/j.issn.1009-6221.2013.05.003 |
| [20] |
李振华, 凌金锋, 曾会才. 6株土壤链霉菌的抑真菌活性及其发酵液对采后香蕉果实炭疽病的防效[J]. 热带农业科学, 2006, 26(3): 35-37, 55. LI Z H, LING J F, ZENG H C. Antifungal activity of six soil Streptomyces strains and their control effects against banana postharvest anthracnose [J]. Chin J Trop Agric, 2006, 26(3): 35-37, 55. |
| [21] |
郝永丽, 宗兆锋. 4株放线菌的防病促生作用研究[J]. 西北农业学报, 2007, 16(3): 257-259. HAO Y L, ZONG Z F. Biocontrol and growth promotion effects of four actinomycetes strains[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2007, 16(3): 257-259. DOI:10.3969/j.issn.1004-1389.2007.03.063 |
| [22] |
付岗, 黄思良, 史国英, 等. 香蕉叶斑病的药剂防治研究[J]. 植物保护, 2010, 36(1): 143-147. FU G, HUANG S L, SHI G Y, et al. Studies on the control of the banana leaf spot diseases with pesticides[J]. Plant Prot, 2010, 36(1): 143-147. DOI:10.3969/j.issn.0529-1542.2010.01.033 |
| [23] |
罗萍, 区建发, 杨炜钊, 等. 香蕉炭疽菌拮抗生防菌株的筛选及鉴定[J]. 现代食品科技, 2011, 27(3): 275-278. LUO P, OU J F, YANG W Z, et al. Screening and identification of antagonistic organisms against banana anthracnose fungus[J]. Mod Food Sci Technol, 2011, 27(3): 275-278. |
| [24] |
静玮, 张鲁斌, 朱德明, 等. 茶树油控制香蕉采后炭疽病害的研究[J]. 热带作物学报, 2011, 32(3): 500-503. JING W, ZHANG L B, ZHU D M, et al. Evaluation of tea tree oil to control postharvest banana disease of Colletotrichum musae [J]. Chin J Trop Crops, 2011, 32(3): 500-503. |
| [25] |
BAZIE S, AYALEW A, WOLDETSADIK K. Integrated management of postharvest banana anthracnose (Colletotrichum musae) through plant extracts and hot water treatment
[J]. Crop Prot, 2014, 66: 14-18. DOI:10.1016/j.cropro.2014.08.011 |
| [26] |
MAQBOOL M, ALI A, RAMACHANDRAN S, et al. Control of postharvest anthracnose of banana using a new edible composite coating[J]. Crop Prot, 2010, 29(10): 1136-1141. DOI:10.1016/j.cropro.2010.06.005 |
 2018, Vol. 20
2018, Vol. 20


