2. 陕西省生物农药工程技术研究中心,陕西 杨凌 712100;
3. 陕西上格之路生物科学有限公司,陕西 周至710400
2. Biopesticide Technology & Engineering Center of Shaanxi Province, Yangling 712100, Shaanxi Province, China;
3. Shaanxi Sunger Road Bio-Science Co., Ltd, Zhouzhi 710400, Shaanxi Province, China
苯肽胺酸 (N-苯基邻苯二甲酸单酰胺,N-phenyl-phthalamic acid) 是一种植物生长调节剂,具有调控作物生长发育及诱导植株抗逆性等功效[1-2]。目前关于其应用研究主要集中在果树上,如在苹果、酸樱桃、甜樱桃和李子等果树上使用苯肽胺酸,能够促进开花,提高果实品质和产量[3-4],也有少量在玉米、苜蓿、油菜及向日葵上应用的相关报道[1, 5],但该药剂对蔬菜的应用研究较少,更未见其相关生长发育调控机理的报道。笔者前期研究发现,苯肽胺酸对辣椒的生长具有一定的促进作用,并能诱导提高辣椒植株抗逆性[2, 6]。然而,关于苯肽胺酸对辣椒的增产效应、增产机理及果实品质的影响均不清楚。
辣椒在生长中由于营养不足或植株内源激素缺乏等问题,会引起落花落果,导致产量大幅降低[7]。植物内源激素具有复杂的生理效应,能够调控植物生长发育的各个阶段,其含量的多少及比例对植物正常生命活动有重要影响[8]。研究表明,植物生长调节剂DTA-6能够影响大豆内源激素的含量和比例,在生长发育的各个时期维持激素的动态平衡,可保障大豆丰产增收[9]。另外,果实品质是衡量植物生长调节剂使用效果的关键指标,决定着农作物有效产量的多少,但目前尚未见苯肽胺酸对辣椒果实品质影响的报道。鉴于此,本研究在田间条件下测定了经苯肽胺酸处理后辣椒叶片中内源激素含量、果实品质和产量的变化情况,以明确其在辣椒上的应用效果,为指导该植物生长调节剂在辣椒生产上的科学应用及进一步深入研究其作用机理提供依据。
1 材料与方法 1.1 供试材料 1.1.1 作物供试辣椒Capsicum annuum L. 品种为世纪红,由西北农林科技大学园艺学院提供。
1.1.2 供试药剂20%苯肽胺酸可溶性液剂 (phthalanilic acid SL),陕西上格之路生物科学有限公司产品;0.007 5%芸苔素内酯水剂 (brassinolide AS),成都新朝阳作物科学有限公司产品。
1.1.3 主要仪器和试剂高效液相色谱系统 (HPLC,由Waters 1525高效液相色谱泵与Waters 2487检测器组成,美国Waters科技有限公司);PS810 游标卡尺 (德国帕司特集团有限公司);UV-120-02 型紫外-可见分光光度计 (日本岛津公司);KQ-250B型超声波清洗器 (昆山市超声仪有限生产公司);GSHA-B型多功能恒温水浴振荡器 (金坛市正基仪器有限公司);l-16G-Ⅱ型高速冷冻离心机 (上海安亭科学仪器厂);Mode 550酶标仪 (美国伯乐公司)。
辣椒素标准品 (CAS编号:2444-46-4,北京普天同创生物科技有限公司)。
1.2 试验设计田间试验于2017 年 4月—10月在西北农林科技大学试验基地进行。
试验地概况:前茬作物为小麦,土质为关中塿土,土壤肥力中等。耕层 10~20 cm,含有机质 15.14 g/kg、全氮 1.30 g/kg、全磷 (P2O5 ) 0.20 g/kg、有效磷 (P) 6.65 mg/kg和速效钾 222 mg/kg。
苯肽胺酸处理设有效成分质量浓度133.3、200.0和 266.7 mg/L 3个剂量,以有效成分为0.075 mg/L的 0.007 5% 芸苔素内酯水剂为药剂对照,清水处理为空白对照,共5个处理。每处理3个重复,每重复为1个小区,面积20 m2,小区随机区组排列。辣椒于2017 年 4 月 30 日 (6~7片真叶期) 单株定植,行距0.60 m,株距0.30 m,垄带沟110 cm。采用背负杠杆式手动喷雾器分别于显蕾期 (喷液量300 kg/hm2) 和初花期 (喷液量600 kg/hm2) 整株常量喷雾各施药1次,喷药时间为9:00—10:00。常规田间管理。
1.3 测定方法 1.3.1 辣椒叶片内源激素含量的测定参照张红菊等[10]的方法取样并加以改进:分别于蕾期、花期和果期,每小区随机选取辣椒植株10株,选取每株顶端 (茎尖1~2节) 成熟度不同的15片叶 (10片幼叶和5片成龄叶),剪碎混匀后称取0.5g(精确到0.001 g),用液氮速冻后研磨成粉,每处理重复4次,于 –80℃下保存,待测。
吲哚乙酸 (IAA)、赤霉素 (GA3)、脱落酸 (ABA) 和玉米素 (ZT) 含量采用酶联免疫吸附法 (ELISA)[11]测定:取0.5g(精确到0.001 g) 样品,用体积分数为80%的甲醇溶液[含二叔丁基对甲苯酚 (BHT)1 mmol/ L]研磨匀浆后,在4 ℃下提取8 h,于4 ℃、1 000 × g下离心10 min;取上清液重复提取2次;合并上清液,用Sep-Pack C18柱纯化,经氮气吹干后用含明胶和吐温的磷酸缓冲液 (含0.5%明胶和0.1%吐温-20的PBS) 溶解并定容至2 mL,待测。ELISA试剂盒由中国农业大学提供,在 492 nm下测定吸光值,以ng/(g FW) 表示辣椒鲜叶中激素的含量。
1.3.2 果实品质指标的测定采摘第3批辣椒果实进行品质指标测定。从每小区随机挑选10个成熟辣椒果 (果实充分膨大, 果肉变硬、色变深且保持绿色未转红),用电子台秤 (感量0.001 g) 测定单果质量;分别用直尺和游标卡尺测定辣椒的纵径和横径,计算果形指数 (纵径/横径)[12];取100 g切碎的辣椒鲜果,用烘干法测定干物质质量;将辣椒果实用搅拌机匀浆后,参照高俊凤[13]的方法,测定维生素C、可溶性蛋白和可溶性糖含量,每处理重复3次。辣椒素含量测定参照王燕等[14]的方法并加以改进:Waters色谱柱 (4.6 mm × 150 mm,5 μm),柱温40 ℃,进样量15 μL。流动相为V(甲醇): V(0.5% 甲酸水) = 7: 3溶液,等度洗脱,流速1 mL/min。
1.3.3 辣椒产量的测定参照Rameshwaran等[15]的方法:从第1批辣椒果实成熟 (果实色泽深绿) 开始,采摘到最后1批,分别统计各处理各批次的产量;将所有产量累加,计算各处理的总产量。
1.4 数据分析试验数据采用SPSS 22.0处理,结果以3次重复的平均值 ± SD表示。采用Duncan’s新复极差法进行差异显著性分析。
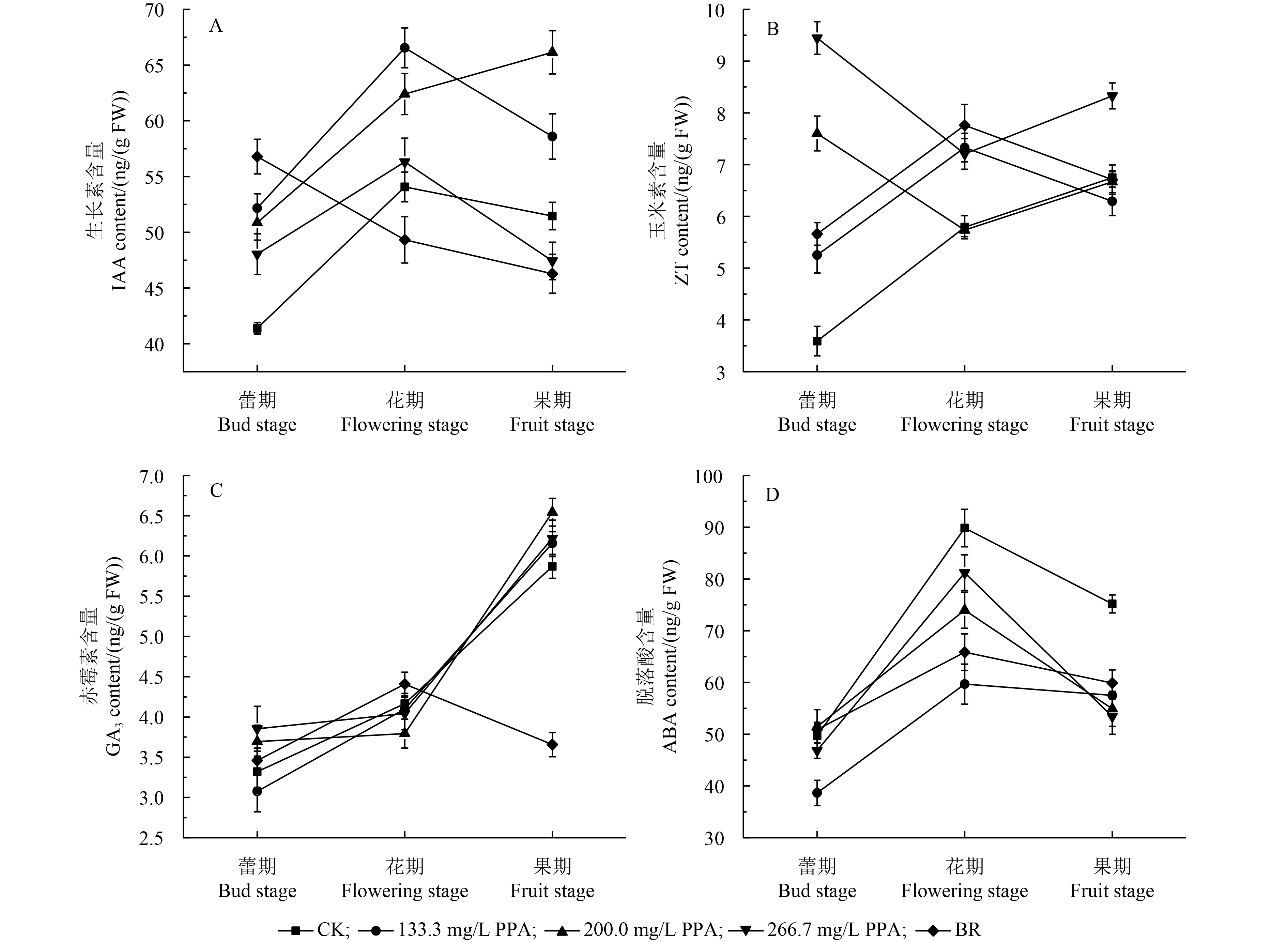
2 结果与分析 2.1 苯肽胺酸对辣椒叶片中内源激素含量及比例的影响 2.1.1 对辣椒植株内源激素含量的影响结果 (图1) 表明:与空白对照相比,经苯肽胺酸处理后,辣椒叶片中IAA和ZT含量升高,ABA含量明显降低,GA3含量无明显变化;与对照药剂芸苔素内酯相比,经苯肽胺酸处理后,辣椒叶片中IAA含量除蕾期外均有所升高,GA3含量在果期明显降低,ZT和ABA含量在3个时期基本保持一致。
由图1-A可以看出,随着辣椒的生长发育 (蕾期、花期和果期),空白对照、133.3和200.0 mg/L苯肽胺酸处理组辣椒叶片中IAA含量均先升高后降低,266.7 mg/L苯肽胺酸处理组一直升高,而芸苔素内酯处理组一直降低,变化趋势差异较大。在蕾期和花期,随着苯肽胺酸处理浓度的增大,辣椒叶片中IAA含量显著降低,但均明显高于空白对照;而在果期,200.0 mg/L苯肽胺酸处理叶片中IAA含量明显高于其他处理;经芸苔素内酯处理的辣椒叶片中IAA含量在蕾期明显高于空白对照,但在花期和果期明显低于空白对照及苯肽胺酸处理。
由图1-B可以看出,随着辣椒的生长发育,空白对照叶片中的ZT含量逐渐升高;苯肽胺酸处理可显著提高辣椒叶片中ZT的含量,尤其是在蕾期和果期,266.7 mg/L苯肽胺酸处理叶片中的ZT含量较空白对照分别提高了163.10%和23.41%,且呈现出明显的剂量依赖性,但在花期,剂量效应则不明显;芸苔素内酯处理叶片中的ZT含量在蕾期和花期也显著高于空白对照,但在果期与对照差异不显著。
由图1-C可以看出,随着辣椒的生长发育,叶片中的GA3含量逐渐升高;在蕾期和花期,各药剂处理辣椒叶片中的GA3含量与空白对照不存在显著性差异;在果期,200.0 mg/L苯肽胺酸处理叶片的GA3含量比空白对照高11.45%,差异显著,而芸苔素内酯处理较空白降低了36.18%。
由图1-D可以看出,随着辣椒的生长发育,空白对照叶片中的ABA含量先升高后降低;各药剂处理也表现出与空白对照同样的规律,但ABA含量低于同期空白对照;其中,133.3 mg/L苯肽胺酸处理叶片的ABA含量变化最为显著,在各时期 (蕾、花和果) 较空白对照分别降低了22.25%、26.70%和23.49%;芸苔素内酯处理辣椒叶片中的ABA含量在蕾期与空白对照无显著性差异,在花期和果期分别比空白对照低36.43%和10.33%。
|
CK为空白对照;PPA为苯肽胺酸;BR为芸苔素内酯。 CK is the blank; PPA is phthalanilic acid; BR is brassinolide. 图 1 苯肽胺酸对辣椒内源激素含量的影响 Fig. 1 Effect of phthalanilic acid on the endogenous hormone content of peppers |
2.1.2 对辣椒叶片中内源激素比例的影响
由表1可知:随着辣椒的生长发育,空白对照叶片中的4种激素比例也在变化,其中,IAA/ZT比值逐渐降低,而IAA/ABA、ZT/ABA和GA3/ABA比值均表现出先降低再升高的变化趋势;苯肽胺酸处理叶片中这4种激素的比例在各测定期均与空白对照有明显差异,但变化趋势与空白对照不同,且剂量效应也不明显。
就IAA/ZT比值而言,在蕾期和花期,苯肽胺酸各处理均低于空白对照,但在果期,其266.6 mg/L处理要低于空白对照,而其他2个处理均高于空白对照;芸苔素内酯处理在各期均明显低于空白对照。
对IAA/ABA比值来说,在各发育期,苯肽胺酸各处理均高于空白对照,尤其是低剂量 (133.3 mg/L) 处理较空白对照增加了18.19%~75.93%;但在果期,其266.6 mg/L处理要低于空白对照,其他2个处理均高于空白对照;芸苔素内酯处理在各期均明显低于空白对照。
就ZT/ABA比值而言,在各发育期,苯肽胺酸各处理均显著高于空白对照,尤其是其高剂量 (266.6 mg/L) 处理较空白对照增加了72.53%~180.56%;芸苔素内酯处理在蕾期和花期也明显高于空白对照,但在果期与空白对照相当。
对GA3/ABA比值来说,在各发育期,苯肽胺酸各处理均高于或与空白对照相当,而芸苔素内酯处理在蕾期与空白对照相当,在花期高于对照,但在果期低于空白对照。
|
|
表 1 苯肽胺酸对辣椒内源激素比例的影响 Table 1 Effect of phthalanilic acid on the endogenous hormone ratio of peppers |
2.2 苯肽胺酸对辣椒果实品质的影响 2.2.1 对辣椒果实外观品质的影响
测定结果 (表2) 表明:与空白对照相比,经133.3和200.0 mg/L苯肽胺酸处理后,辣椒单果质量明显增加 (较空白对照分别增加了14.75%和10.78%),且干物质含量也明显增加 (较空白对照分别提高了26.09%和22.99%),但两个剂量处理间无显著性差异;133.3和200.0 mg/L苯肽胺酸处理还可显著影响辣椒果形指数,较空白对照分别提高49.67%和35.92%,但两者间无显著性差异。对照药剂芸苔素内酯处理对辣椒果实的干物质含量和果形指数影响的结果与苯肽胺酸处理相似,但对单果质量无明显影响。
|
|
表 2 苯肽胺酸对辣椒果实外观品质的影响 Table 2 Effect of phthalanilic acid on appearance quality of peppers |
2.2.2 对辣椒果实营养风味品质的影响
用不同剂量的苯肽胺酸处理后,辣椒果实的可溶性糖、可溶性蛋白、维生素C及辣椒素等含量均有明显提高 (表3)。其中,133.3 mg/L苯肽胺酸处理辣椒果实的可溶性糖含量较空白对照增加了99.62%,较芸苔素内酯处理增加了91.76%,显著高于其余处理;266.7 mg/L苯肽胺酸处理的可溶性蛋白含量较空白对照增加了94.32%,较芸苔素内酯处理增加了19.50%,显著高于其余处理;133.3 mg/L苯肽胺酸处理的维生素C含量较空白对照增加了55.35%,较芸苔素内酯处理增加了31.28%,显著高于其余处理;200.0 mg/L苯肽胺酸处理可显著提高辣椒素的含量,比空白对照提高了31.69%,比芸苔素内酯处理增加了51.17%,显著高于其余处理。芸苔素内酯处理组辣椒果实中的可溶性蛋白和维生素C明显增加,但辣椒素含量降低,而可溶性糖含量无明显变化。
|
|
表 3 苯肽胺酸对辣椒果实营养风味品质的影响 Table 3 Effect of phthalanilic acid on nutrient and favour quality of peppers |
2.3 苯肽胺酸对辣椒产量的影响
结果 (表4) 表明:经不同剂量的苯肽胺酸处理后,辣椒总产量显著提高,其中尤以133.3 mg/L苯肽胺酸处理的增产效果最明显,较空白对照增产37.19%;芸苔素内酯处理对辣椒产量的增加也具有较好的效果,与空白对照相比产量增加了38.02%,与133.3 mg/L苯肽胺酸处理无显著差异。
|
|
表 4 苯肽胺酸对辣椒产量的影响 Table 4 Effect of phthalanilic acid on the yield of peppers |
3 讨论及结论 3.1 苯肽胺酸对辣椒生长发育的影响与其对内源激素的调控有关
IAA、ZT、GA3和ABA是植物体内比较重要的激素,通过参与细胞的分裂、伸长和分化等过程影响植物的生长发育,且一种激素水平的变化将至少影响另一种激素的水平,从而协调控制植物生长发育的各个过程[16]。El-Saeid等[17]发现,施用外源IAA可以提高豇豆内源IAA含量,从而减少花的脱落,提高坐果率;叶面喷施油菜素内酯,可通过调节青花菜体内的IAA和GA3含量及平衡状态,从而影响其花芽分化和花球形成[18]。
IAA水平升高可促进作物生长,诱导侧芽的发生与生长[19];ZT具有减少叶绿素的分解,延缓植物衰老等作用[20];ABA能加速作物的衰老和果实的成熟[21];GA3促进植物茎秆伸长效果显著,也有研究发现其与谷粒的干物质积累密切相关[22]。本研究结果表明,经苯肽胺酸处理后,相比于空白对照,在蕾期、花期和果期,辣椒叶片中的IAA、ZT含量均明显升高,ABA含量明显降低,而GA3含量仅在果期有一定增加。这些激素水平的变化所形成的生物学效应与苯肽胺酸对辣椒的生物学效应具有一致性,即表现为:株高和茎粗增加,辣椒叶片中叶绿素含量升高,且在整个生育期都能保持叶色浓绿[2, 6],辣椒干物质含量提高等。可见,苯肽胺酸对辣椒生长发育的调控作用与其对植物内源激素水平的调控有关,但具体的调节机制尚需进一步探究。
植物体内各内源激素的动态平衡及比例与作物的抗逆性和产量存在一定关联,尤其与IAA/ABA、ZR/ABA、GA/ABA比值关系较密切[23-25];在逆境条件下,IAA/ABA、ZR/ABA、GA/ABA比值均呈下降趋势[26]。当采用根际低氧胁迫猕猴桃幼苗时,耐性强的品种比耐性弱的根、叶中有着更高的IAA/ABA、ZR/ABA、GA/ABA比值[27]。另外,这些激素的比值变化也与作物产量有关,如:在大豆上施用钾肥能提高整个生育期叶片的IAA/ABA、ZR/ABA、GA/ABA比值,且产量明显增加[28];受精过程中IAA/ZR比值大的黄瓜品种的种子产量明显高于IAA/ZR比值小的品种[25]。本研究发现,133.3 mg/L苯肽胺酸处理组辣椒的IAA/ABA、ZR/ABA、GA3/ABA比值在各测定期均显著升高,且IAA/ZT比值在果期上升,而该处理辣椒的增产率达37.19%。显然,该剂量的苯肽胺酸明显改变了辣椒内源激素的比例,从而提高了辣椒的抗逆性和产量,该结果也与前期研究结果[2, 6]具有一致性。
可见,苯肽胺酸处理不但可明显影响IAA、ZT和ABA等激素含量及比例的变化,且这一变化与最终的产量增加有关,但具体的机理尚待进一步研究。
3.2 苯肽胺酸可改善果实品质目前,关于植物生长调节剂能改善果实品质的报道较多,如施用外源萘乙酸能增加辣椒果实的长度、直径和果肉厚度[29];芒果上使用2, 4-D能使Vc和可溶性糖含量升高[30]。辣椒的商业品质由单果质量、果形和果肉厚度等构成,营养品质由Vc、可溶性糖和可溶性蛋白含量等决定,而风味主要是指辣椒素类物质。但关于植物生长调节剂改善果实品质的作用机理尚无系统性研究,有报道认为外源茉莉酸甲酯改善农产品品质与其促进营养物质和次生代谢产物积累有关[31]。本研究结果表明,苯肽胺酸处理能显著提高辣椒的商业品质,改善辣椒果实的营养和风味,其中,133.3 mg/L苯肽胺酸处理组辣椒果实的可溶性糖和维生素C含量最高,200.0 mg/L组辣椒素含量明显高于其他处理,而提高可溶性蛋白含量效果最好的为266.7 mg/L苯肽胺酸处理。
3.3 苯肽胺酸与芸苔素内酯的作用效果差异芸苔素内酯是一种重要的甾醇类激素,可参与调控作物生长发育的各阶段,是目前生产实践上具有代表性的植物生长调节剂之一[32]。据文献报道,芸苔素内酯调控辣椒生长等生物学效应较为显著,且与苯肽胺酸具有类似的生物学效应[2, 6]。但经对比试验发现,苯肽胺酸和芸苔素内酯处理对辣椒叶片内源激素和果实品质影响不同,主要表现在: 从蕾期到果期,叶片中的IAA、ZT和GA3 含量变化趋势差异较大;IAA/ZT、IAA/ABA、ZT/ABA、GA3/ABA比值与空白对照相比差异较大;芸苔素内酯改善果实外观和营养风味品质的效果弱于苯肽胺酸,尤其是前者降低了辣椒的辣椒素含量。这些差异可能与苯肽胺酸和芸苔素内酯对辣椒生长发育的调控机理不同有关。另外,田间试验观察到,芸苔素内酯作用速度快,但持效期短,在生殖生长中后期会出现辣椒植株徒长和果实畸形等不良现象,而苯肽胺酸的作用却与之相反。关于苯肽胺酸与芸苔素内酯对辣椒内源激素和果实品质影响存在差异的原因还不能确定,需进行深入的探讨和验证。
综上,苯肽胺酸处理能调节辣椒叶片中内源激素的含量和维持其动态平衡,促进辣椒生长发育,提高产量,改善果实品质,其作为一种植物生长调节剂,在辣椒生产中具有良好的应用前景,田间推荐剂量为有效成分质量浓度133.3~200.0 mg/L。
| [1] |
ZHAO H H, XU J, DONG F S, et al. Determination of phthalanilic acid residue in bean, fruits and vegetables using a modified QuEChERS method and ultra-performance liquid chromatography/tandem mass spectrometry[J]. Anal Methods, 2014, 6(12): 4336-4342. DOI:10.1039/c4ay00458b |
| [2] |
张欧, 马强, 刘娜, 等. 苯肽胺酸对辣椒抗逆性及产量的影响[J]. 农药学学报, 2017, 19(4): 449-456. ZHANG O, MA Q, LIU N, et al. Effect of phthalanilic acid on stress resistance and yield of pepper[J]. Chin J Pestic Sci, 2017, 19(4): 449-456. |
| [3] |
RACSKÓ J. Effect of auxin-synergistic preparation and fertilization on fruit setting and fruit quality of apple[J]. J Agric Sci, 2004, 15: 21-26. |
| [4] |
KHADIVI-KHUB A, NOSRATI Z. Study of N-phenyl-phthalamic acid effects on fruit setting and fruit quality of sweet, sour and duke cherries
[J]. Acta Agriculturae Serbica, 2013, 17(4): 3-9. |
| [5] |
BOLLINGER F G, D'AMICO J J, HANSEN D J. Use of phthalanilic acids to regulate the growth of corn plants: US4108632[P]. 1978-08-22.
|
| [6] |
张欧, 马强, 刘娜, 等. 植物生长调节剂苯肽胺酸对辣椒生长及逆境生理指标的影响[J]. 西北农林科技大学学报(自然科学版), 2018, 46(8): 81-88. ZHANG O, MA Q, LIU N, et al. Effect of plant growth regulator phthalanilic acid on growth and stress physiology of pepper (Capsicum annuum L.) [J]. J Northwest A&F Univ (Nat Sci Ed), 2018, 46(8): 81-88. DOI:10.13207/j.cnki.jnwafu.2018.08.011 |
| [7] |
DAS S K, SARKAR D, ALAM M J, et al. Influence of plant growth regulators on yield contributing characters and yield of bell pepper (Capsicum annum) varieties
[J]. J Plant Sci, 2015, 10(2): 63-69. DOI:10.3923/jps.2015.63.69 |
| [8] |
傅腾腾, 朱建强, 张淑贞, 等. 植物生长调节剂在作物上的应用研究进展[J]. 长江大学学报(自然科学版), 2011, 8(10): 233-235. FU T T, ZHU J Q, ZHANG S Z, et al. Research progress in application of plant growth regulators on crops[J]. J Yangtze Univ (Nat Sci Ed), 2011, 8(10): 233-235. |
| [9] |
郑殿峰, 赵黎明, 冯乃杰. 植物生长调节剂对大豆叶片内源激素含量及保护酶活性的影响[J]. 作物学报, 2008, 34(7): 1233-1239. ZHENG D F, ZHAO L M, FENG N J. Effects of plant growth regulators (PGRs) on endogenous hormone contents and activities of protective enzymes in soybean leaves[J]. Acta Agronomica Sinica, 2008, 34(7): 1233-1239. |
| [10] |
张红菊, 赵怀勇, 郁继华. α-萘乙酸钠对温室辣椒产量和内源激素水平的影响
[J]. 中国沙漠, 2013, 33(5): 1390-1399. ZHANG H J, ZHAO H Y, YU J H. Effects of α-naphthalene acetic acid on yield and endogenous hormones of greenhouse grown pepper in desert area [J]. J Desert Res, 2013, 33(5): 1390-1399. |
| [11] |
张炜, 高巍, 曹振, 等. 干旱胁迫下小麦(Triticum aestivum L.)幼苗中 ABA 和 IAA 的免疫定位及定量分析
[J]. 中国农业科学, 2014, 47(15): 2940-2948. ZHANG W, GAO W, CAO Z, et al. Immunolocalization and quantitation of ABA and IAA in the organs of wheat (Triticum aestivum L.) under drought stress [J]. Scientia Agricultura Sinica, 2014, 47(15): 2940-2948. DOI:10.3864/j.issn.0578-1752.2014.15.004 |
| [12] |
眭晓蕾, 张宝玺, 何洪巨, 等. 弱光对不同基因型辣椒坐果和果实品质的影响[J]. 沈阳农业大学学报, 2006, 37(3): 356-359. SUI X L, ZHANG B X, HE H J, et al. Effects of weak light on fruit setting and quality of different genotype of capsicum[J]. J Shenyang Agric Univ, 2006, 37(3): 356-359. DOI:10.3969/j.issn.1000-1700.2006.03.023 |
| [13] |
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 137, 145-146, 163. GAO J F. Experimental guidance for plant physiology[M]. Beijing: Higher Education Press, 2006: 137, 145-146, 163. |
| [14] |
王燕, 夏延斌, 熊科, 等. 高效液相色谱法-紫外检测器测定辣椒制品中辣椒素的含量[J]. 食品科学, 2006, 27(9): 193-196. WANG Y, XIA Y B, XIONG K, et al. Determination of capsaicinoid content in capsicum products with HPLC-UVD[J]. J Food Sci Technol, 2006, 27(9): 193-196. DOI:10.3321/j.issn:1002-6630.2006.09.043 |
| [15] |
RAMESHWARAN P, TEPE A, YAZAR A, et al. The effect of saline irrigation water on the yield of pepper: experimental and modeling study[J]. Irrig Drain, 2015, 64(1): 41-49. DOI:10.1002/ird.1867 |
| [16] |
LETHAM D S, GOODWIN P B, HIGGINS T J V. Phytohormones and related compounds: a comprehensive treatise[M]. Amsterdam, New York: Elsevier/North-Holland Biomedical Press, 1978.
|
| [17] |
EL-SAEID H M, ABOU-HUSSEIN S D, EL-TOHAMY W A. Growth characters, yield and endogenous hormones of cowpea plants in response to IAA application[J]. Res J Agric Biol Sci, 2010, 6(1): 27-31. |
| [18] |
王廷芹, 杨暹. 油菜素内酯对青花菜茎尖核酸和激素含量的影响[J]. 园艺学报, 2008, 35(5): 661-666. WANG T Q, YANG X. Effects of brassinolide on contents of nucleic acid and endogenous hormones in stem apex of broccoli[J]. Acta Horticulturae Sinica, 2008, 35(5): 661-666. DOI:10.3321/j.issn:0513-353X.2008.05.007 |
| [19] |
LIU Y, DING Y F, WANG Q S, et al. Effects of nitrogen and 6-benzylaminopurine on rice tiller bud growth and changes in endogenous hormones and nitrogen[J]. Crop Sci, 2011, 51(2): 786-792. DOI:10.2135/cropsci2010.04.0217 |
| [20] |
DONG H Z, NIU Y H, KONG X Q, et al. Effects of early-fruit removal on endogenous cytokinins and abscisic acid in relation to leaf senescence in cotton[J]. Plant Growth Regul, 2009, 59(2): 93-101. DOI:10.1007/s10725-009-9392-x |
| [21] |
SOTO A, RUIZ K B, RAVAGLIA D, et al. ABA may promote or delay peach fruit ripening through modulation of ripening- and hormone-related gene expression depending on the developmental stage[J]. Plant Physiol Biochem, 2013, 64: 11-24. DOI:10.1016/j.plaphy.2012.12.011 |
| [22] |
BRENNER M L. The role of hormones in photosynthate partitioning and seed filling[M]//DAVIES P J. Plant hormones and their role in plant growth and development. Dordrecht: Springer, 1987: 649-670.
|
| [23] |
陈荣建, 熊丹, 欧静, 等. 持续干旱下杜鹃花类菌根真菌对桃叶杜鹃内源激素的影响[J]. 西南大学学报(自然科学版), 2018, 40(3): 26-33. CHEN R J, XIONG D, OU J, et al. Influences of ERM strain on endogenous hormones of Rhododendron annae Franch in continuous drought [J]. J Southwest Univ (Nat Sci Ed), 2018, 40(3): 26-33. |
| [24] |
马超, 冯雅岚, 张均, 等. 外源茉莉酸甲酯对干旱胁迫下小麦花后内源激素含量及产量形成的影响[J]. 植物生理学报, 2017, 53(6): 1051-1058. MA C, FENG Y L, ZHANG J, et al. Effects of exogenous methyl jasmonate on endogenous hormones and yield formation in wheat after anthesis under drought stress[J]. Plant Physiol J, 2017, 53(6): 1051-1058. |
| [25] |
秦智伟, 任美君, 周秀艳, 等. 黄瓜种子产量高低品系双受精过程中内源激素变化[J]. 东北农业大学学报, 2017, 48(6): 24-32. QIN Z W, REN M J, ZHOU X Y, et al. Change of cucumber seed yield lines endogenous hormone during the process of double fertilization[J]. J Northeast Agric Univ, 2017, 48(6): 24-32. DOI:10.3969/j.issn.1005-9369.2017.06.004 |
| [26] |
贾瑞丰, 杨曾奖, 徐大平, 等. 干旱胁迫对降香黄檀幼苗生长及内源激素含量的影响[J]. 生态环境学报, 2013, 22(7): 1136-1140. JIA R F, YANG Z J, XU D P, et al. Growth and endogenous hormone content of Dalbergia odorifera seedlings under drought stress [J]. Ecol Environ Sci, 2013, 22(7): 1136-1140. DOI:10.3969/j.issn.1674-5906.2013.07.008 |
| [27] |
米银法, 马锋旺, 马小卫. 根际低氧对不同抗性猕猴桃幼苗生长和内源激素的影响[J]. 园艺学报, 2009, 36(2): 163-170. MI Y F, MA F W, MA X W. Effects of root-zone hypoxia stress on growth and endogenous hormones in young kiwifruit seedlings with different resistant ability[J]. Acta Horticulturae Sinica, 2009, 36(2): 163-170. DOI:10.3321/j.issn:0513-353X.2009.02.002 |
| [28] |
涂冰洁, 刘长锴, 田博文, 等. 菜用大豆和普通大豆叶片内源激素活性对钾素营养响应的差异研究[J]. 大豆科学, 2016, 35(6): 969-974. TU B J, LIU C K, TIAN B W, et al. Study on response differences to potassium nutrition in leaf endogenous hormone dynamic changes of vegetable soybean and grain soybean[J]. Soyb Sci, 2016, 35(6): 969-974. |
| [29] |
张红菊, 赵怀勇, 郁继华, 等. 温室辣椒果实生长及内源激素含量对外施α-萘乙酸钠的响应
[J]. 中国沙漠, 2013, 33(6): 1750-1758. ZHANG H J, ZHAO H Y, YU J H, et al. Responses of fruit development and endogenous hormones content of greenhouse pepper to α-naphthalene acetic acid in desert area [J]. J Desert Res, 2013, 33(6): 1750-1758. |
| [30] |
AHMED W, TAHIR F M, RAJWANA I, et al. Comparative evaluation of plant growth regulators for preventing premature fruit drop and improving fruit quality parameters in ‘Dusehri’ mango[J]. Int J Fruit Sci, 2012, 12(4): 372-389. DOI:10.1080/15538362.2012.679175 |
| [31] |
施江, 马成英, 吕海鹏, 等. 外源茉莉酸甲酯改善农产品品质及其机理研究进展[J]. 食品工业科技, 2013, 34(13): 364-368. SHI J, MA C Y, LV H P, et al. Research progress in quality improvement of agricultural products induced by exogenous methyl jasmonate and its mechanism[J]. Sci Technol Food Ind, 2013, 34(13): 364-368. |
| [32] |
CHOUDHARY S P, YU J Q, YAMAGUCHI-SHINOZAKI K, et al. Benefits of brassinosteroid crosstalk[J]. Trends Plant Sci, 2012, 17(10): 594-605. DOI:10.1016/j.tplants.2012.05.012 |
 2018, Vol. 20
2018, Vol. 20


