2. 东北农业大学 农学院,哈尔滨 150030
2. College of Agronomy, Northeast Agricultural University, Harbin 150030, China
盐渍化土壤是一种低产土壤,目前全球有20%的灌溉土地受到不同程度的盐渍化影响[1-2]。中国受盐渍化影响的耕地面积约920万 hm2,约占全国耕地总面积的6.62%[3]。盐渍化土壤中生长的玉米会受到离子毒害、渗透胁迫和氧化胁迫[4-6]等伤害,引起玉米生理功能障碍,阻碍其生长[7-8]。解决盐渍化土壤对玉米的影响问题,除了需提高玉米自身的抗盐能力外,添加外源调控物质也能有效提高玉米的耐盐能力,如增产胺 (DCPTA)、亚精胺和冠菌素等。
γ-氨基丁酸 (GABA) 是四碳非蛋白质类氨基酸,被公认为是内源植物信号传导分子并且参与多种生理生化反应[9],同时参与信号的传导、氮代谢、渗透调节和抗氧化的应激保护等[10]。GABA会直接或间接提高植物的抗逆能力,缓解非生物胁迫对植物的损害。研究表明,GABA能调控锦鸡儿根部与过氧化氢 (H2O2) 和乙烯产生相关基因的表达[11];激活桃树体内抗氧化酶系统,清除冷胁迫引起的有害物质积累,缓解氧化损伤[12];缓解高温胁迫对水稻幼苗的伤害,提高叶片相对含水量,降低丙二醛 (MDA) 含量,提高超氧化物歧化酶 (SOD) 等抗氧化酶活性[13]。在盐胁迫下,GABA能缓解盐胁迫对玉米幼苗叶片的损伤,提高脯氨酸等渗透调节物质含量,提高抗氧化酶活性,同时外源GABA能明显提高内源GABA含量,促进玉米幼苗生长[14]。
根系不仅是水分和养分吸收的主要器官,而且可以通过调节根系构型,合成或分泌激素、有机酸和酶等物质来适应多变的土壤环境[15],因此根系生长状况对作物生长至关重要。本研究以前期研究为基础,通过水培栽培方式,研究了外源GABA对盐胁迫下玉米幼苗根系氧化损伤及内源激素的调控,旨在为GABA调控盐胁迫下玉米幼苗根系生长提供理论依据,同时也为GABA在玉米抗逆上的应用奠定基础。
1 材料与方法 1.1 供试材料供试玉米品种为郑单958,由河南省农业科学院提供,播种前进行发芽试验。γ-氨基丁酸 (GABA),购自Sigma公司。
中晶Microtek ScanMaker i800扫描仪 (上海中晶科技有限公司);雷磁DDS-307A电导率仪 (上海仪电科学仪器股份有限公司)。
1.2 试验设计水培试验于2016年在河南农业大学农学院温室进行。取大小均匀、籽粒饱满的玉米种子,用体积分数为10%的H2O2溶液消毒40 min,用蒸馏水清洗3次后在25 ℃恒温下浸泡24 h,播种于放有蛭石的直径为0.5 m、深度为7 cm的圆盘中,每盘80粒,播种后覆以厚度为2~3 cm的蛭石,每天视情况浇水。待幼苗长至两叶一心时,移至装有15 L的1/2霍格兰营养液的水槽中,置于光照培养架上,采用生物灯进行补光,光照度为400 lx,每隔2 d更换1次营养液,定期调节溶液pH值至6.5,通过通气装置24 h向水槽中通气,以保证幼苗生长的需氧量。待幼苗生长到三叶一心时进行处理和取样。
根据预试验结果,正式试验设置4个处理:清水对照 (CK),0.5 mmol/L GABA(G),150 mmol/L NaCl胁迫 (N) 和150 mmol/L NaCl胁迫下0.5 mmol/L GABA处理 (NG)。处理前更换1次霍格兰营养液,加入0 g和0.824 g GABA,使得GABA在溶液中的浓度分别达到0和0.5 mmol/L;24 h后,更换1次霍格兰营养液,加入0和131.49 g NaCl,使其最终浓度分别为0和150 mmol/L。每处理3次重复。分别于添加NaCl后12、24、36、48和60 h取样,于 –80 ℃保存,待测。
1.3 测定指标 1.3.1 根系生长指标及物质积累量的测定在盐胁迫处理60 h后,每个处理随机选取玉米幼苗6株,3株用于干物质质量测定,另外3株用于根系扫描测定。剪取根系用蒸馏水冲洗干净后,吸干表面水分,放入牛皮纸内于105 ℃下杀青30 min,80 ℃烘至质量恒定后称量。用根系扫描仪扫描根系,用WinRHIZO-2004a软件分析数据,结果均取平均值。
1.3.2 根系活力测定每处理随机选取玉米幼苗6株,采用TTC法测定根系活力[16]。
1.3.3 内源GABA含量测定每处理选取3株玉米幼苗,将根系切成0.5 cm小段,称取0.5 g,采用Saito等的方法[17]测定GABA含量。
1.3.4 氧化损伤测定取样方法同1.3.3节。MDA含量采用硫代巴比妥酸法测定[18]。超氧阴离子含量采用羟氨氧化法测定[19]。
1.3.5 相对电导率及可溶性蛋白含量测定取样方法同1.3.3节。将根系冲洗干净后用滤纸吸干表面水分,剪取长1 cm的根尖,混匀后称取0.5 g放入试管中,加入15 mL蒸馏水,浸泡10 h后测定电导率,记为R1;将试管放入沸水浴中煮沸20 min,冷却至室温,测定电导率,记为R2。根据公式R/%= R1/R2 × 100计算相对电导率 (R)。可溶性蛋白含量采用考马斯亮蓝法测定[20]。
1.3.6 抗氧化酶活性测定取样方法同1.3.3节。超氧化物歧化酶 (SOD) 活性采用氮蓝四唑 (NBT) 还原法测定[21];过氧化物酶 (POD) 活性采用愈创木酚法测定[22];过氧化氢酶 (CAT) 活性采用紫外吸收法测定[23]。
1.3.7 内源激素含量测定剪取0.5 cm长的根尖,混匀后称取0.5 g,采用酶联免疫 (ELISA) 吸附法测定内源激素含量。
1.4 数据处理与分析试验数据取平均值,采用SPSS 17.0进行方差分析,LSD最小显著性差异法进行多重比较,相关性分析及激素比例采用胁迫60 h后的数据,Microsoft Excel 2010作图。
2 结果与分析 2.1 GABA对玉米幼苗根系形态的影响如图1所示:盐胁迫可明显抑制玉米幼苗根系的生长,使根系变短、根毛减少 (图1-N);施用外源GABA可明显解除盐胁迫的抑制作用,使根系恢复生长,促进根毛的发生 (图1-NG);此外,在正常生长条件下,外源GABA能促进根系生长,特别是促进根毛的发生 (图1-G)。
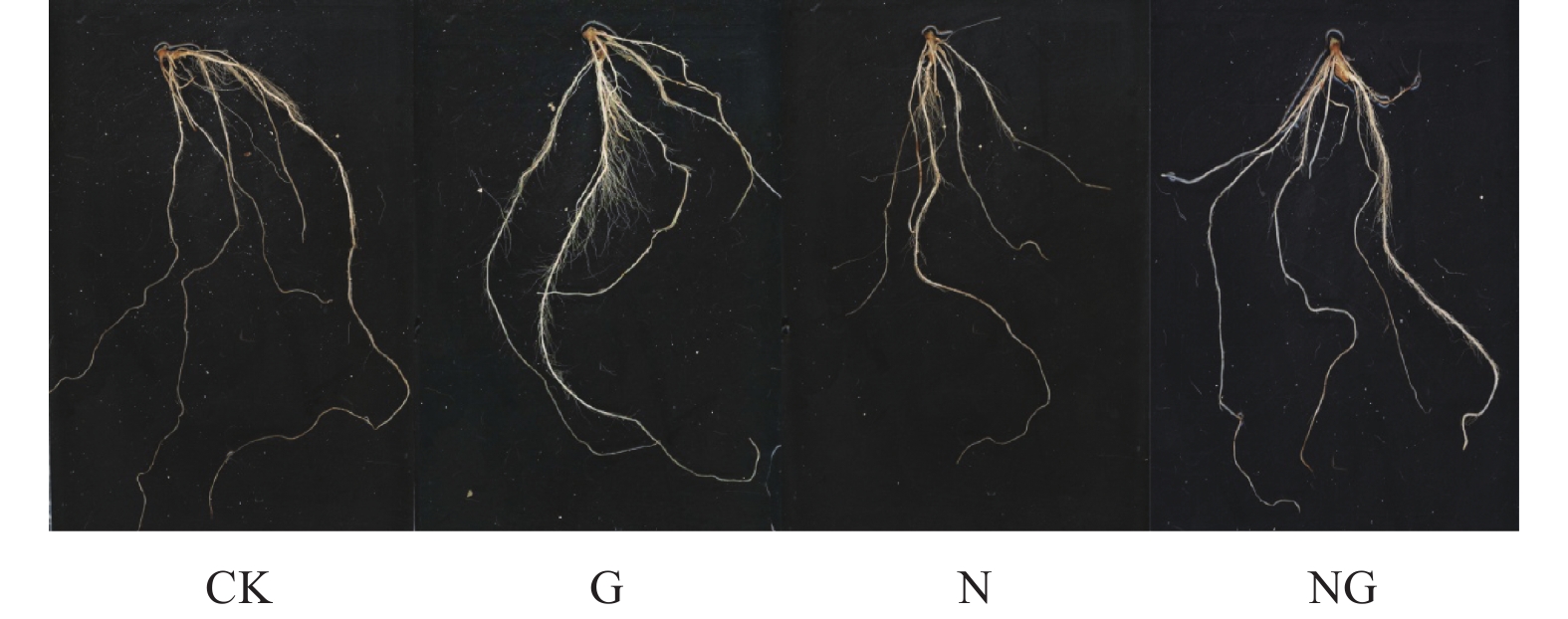
|
CK:对照,G:GABA处理,N:盐胁迫,NG:盐胁迫+GABA。 CK: Control, G: GABA treatment, N: Salt stress, NG: Salt stress+GABA. 图 1 GABA对玉米幼苗根系形态的影响 Fig. 1 Effect of GABA on the root morphology of maize seedlings |
2.2 GABA对玉米幼苗根系生长及干物质积累量的影响
根系生物量是衡量作物抗逆能力的重要指标,生物量增加说明根系的抗逆能力升高。由表1可知:盐胁迫下,玉米幼苗根长、根表面积和根体积明显下降,与空白对照相比,分别下降了26.13%、25.25%和34.67%,差异显著。外源GABA能明显缓解盐胁迫对根长、根表面积和根体积的抑制作用。盐胁迫后再经外源GABA处理组的根长、根表面积和根体积分别增加了45.41%、33.59%和31.24%,且差异显著。而正常生长环境下施用外源GABA虽能增加根长、根表面积和根体积,但与空白对照差异不显著。
与对照相比,盐胁迫的根尖数量减少了32.18%,差异显著。在正常和盐胁迫条件下,外源GABA可显著增加根尖数量,分别增加了16.95%和71.61%。盐胁迫下,根系平均直径增加,但与对照相比差异不显著。外源GABA显著降低了盐胁迫下根系的平均直径,但增加了根毛数量。
盐胁迫可显著降低根系干物质质量,与对照相比下降了25.22%。而外源GABA能明显缓解盐胁迫对根系生长的抑制作用,与盐胁迫处理相比根系干物质质量增加了30.23%,差异显著。
|
|
表 1 GABA对玉米幼苗根系生长及干物质积累量的影响 Table 1 Effect of GABA on the root growth and the dry matter accumulation of maize seedlings |
2.3 GABA对玉米幼苗根系活力及内源GABA含量的影响
GABA具有很高的生理活性,在作物逆境下,其含量会迅速升高,这与其能提高作物抗逆境能力相关。如图2-A所示,随盐胁迫时间的延长,根系内源GABA含量呈先上升后下降的趋势,并于胁迫后48 h达最高,且供试期间均显著高于对照。
根系活力代表根系的生长情况,其活力高低代表根系吸收能力的好坏。如图2-B所示,与对照相比,盐胁迫后60 h,根系活力下降了26.11%,差异显著。施用外源GABA能显著提高盐胁迫下的根系活力,如胁迫后60 h,与盐胁迫处理相比,施用外源GABA组根系活力升高了22.23%。正常生长条件下,外源施用GABA虽能提高根系活力,但效果不显著。
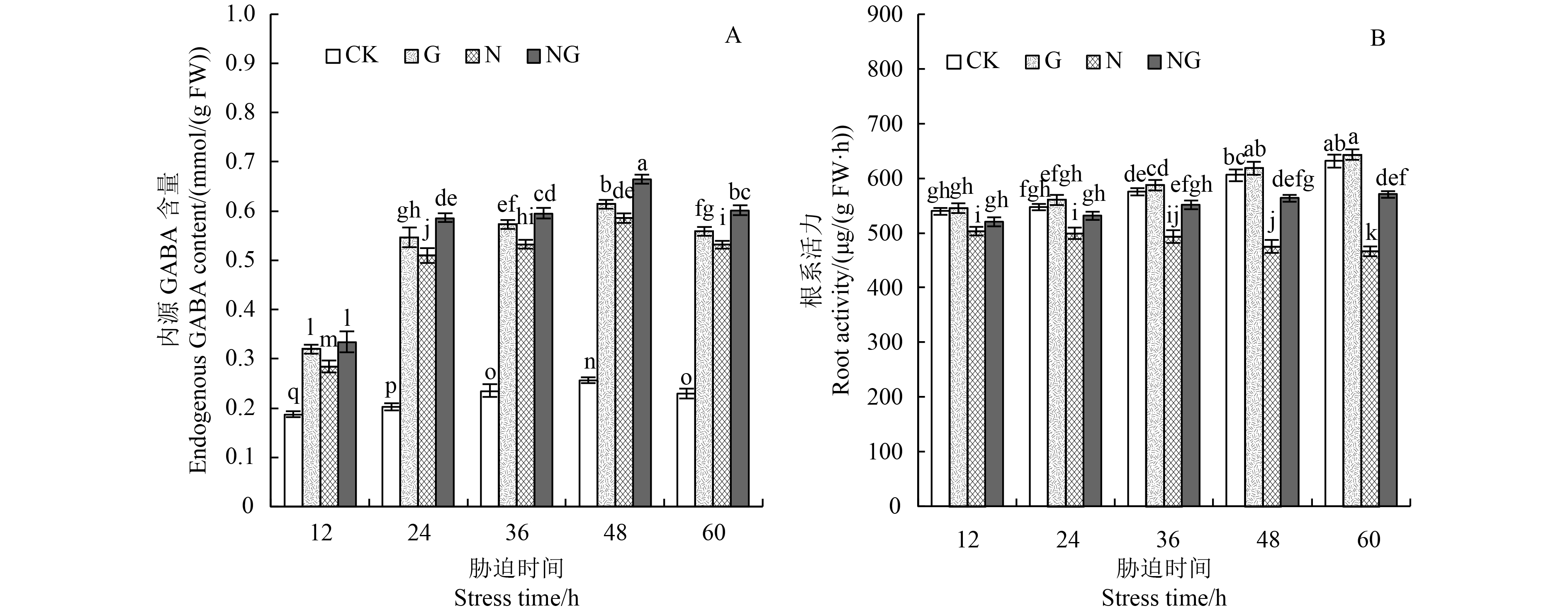
|
柱上不同小写字母表示同一胁迫时间不同处理差异达5%显著水平。CK:对照,G:GABA处理,N:盐胁迫,NG:盐胁迫+GABA。 Different small letters above the bars are significantly different among different treatments for same stress time at 5% level. CK: Control, G: GABA treatment, N: Salt stress, NG: Salt stress+GABA. 图 2 GABA对玉米幼苗根系内源GABA含量和根系活力的影响 Fig. 2 Effect of GABA on the endogenous GABA content and root activity in maize seedling roots |
2.4 GABA对玉米幼苗根系膜质氧化损伤的影响
超氧阴离子 (
MDA在作物体内过多积累会严重破坏细胞膜功能。如图3-B所示,随胁迫时间的延长,MDA含量呈先升高后下降的趋势,在胁迫后36 h,MDA含量最高。正常生长条件下,外源GABA能减少MDA的积累,但效果不明显。盐胁迫会导致根系内MDA大量积累,在胁迫后60 h其含量比对照高99.06%。而外源施用GABA能显著减少盐胁迫后MDA在根系内的积累,且随胁迫时间的延长,GABA的作用亦逐渐增强。
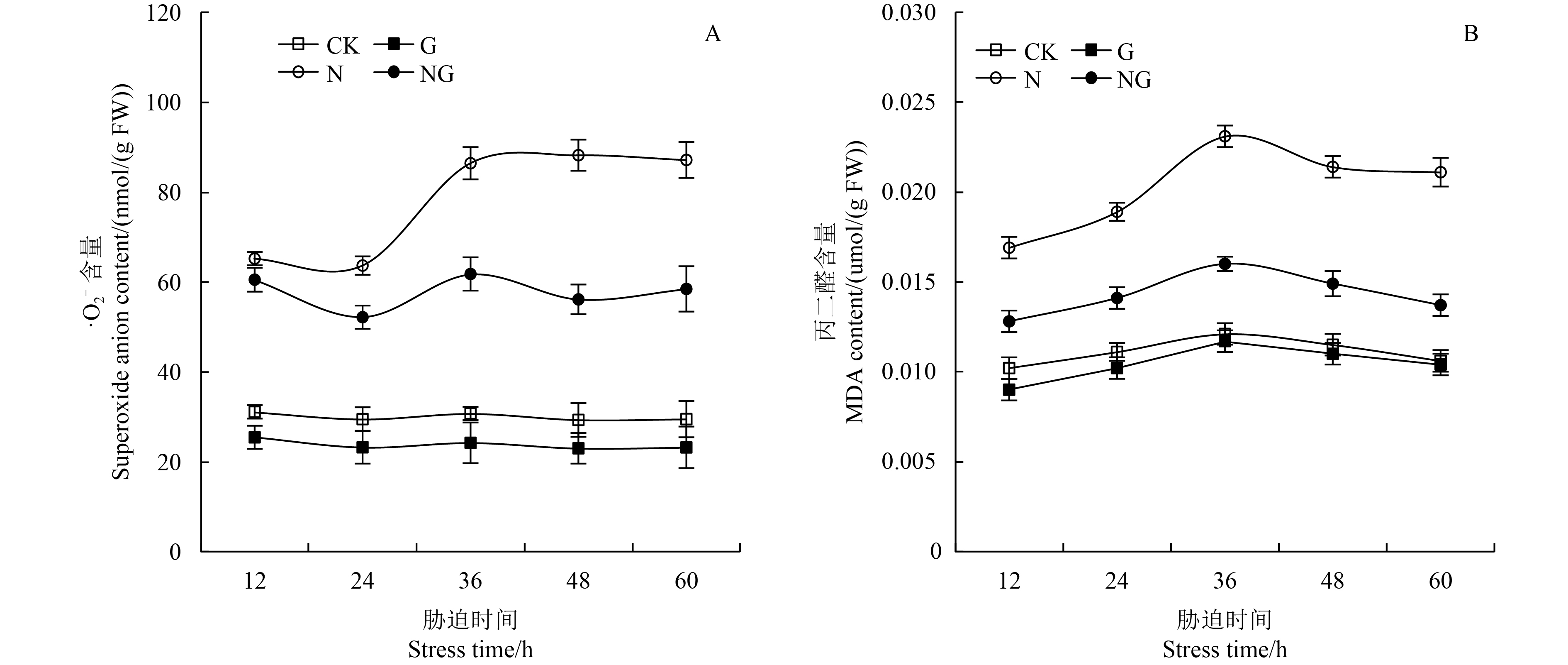
|
CK:对照,G:GABA处理,N:盐胁迫,NG:盐胁迫+GABA。 CK: Control, G: GABA treatment, N: Salt stress, NG: Salt stress+GABA. 图 3 GABA对玉米幼苗根系膜质氧化损伤的影响 Fig. 3 Effect of GABA on the cell membrane oxidative damage in maize seedling roots |
2.5 GABA对玉米幼苗根系细胞渗透调节的影响
可溶性蛋白在作物体内既可以作为一种渗透调节物质,也可以作为合成大分子蛋白质的原料。如图4-A所示,随胁迫时间的延长,根系内可溶性蛋白含量呈先升后降之后再小幅上升的趋势,在胁迫后24 h可溶性蛋白含量最高。正常生长条件下,外源施用GABA能提高根系内可溶性蛋白的含量,除胁迫后24 h外,其他时间差异显著。盐胁迫条件下,根系内可溶性蛋白含量显著降低,与对照相比,胁迫后12、24、36、48和60 h的可溶性蛋白含量分别降低了20.37%、27.69%、40.26%、27.91%和13.76%。外源施用GABA能提高盐胁迫下根系中可溶性蛋白含量,在胁迫后的12、24和36 h分别提高了20.21%、28.26%和45.16%,差异显著。这表明,盐胁迫下施用外源GABA能提高根系渗透调节物质含量,维持细胞水势。
相对电导率代表细胞内物质外渗情况,其数值越大代表细胞膜受损程度越大。如图4-B所示,随胁迫时间的延长,根系相对电导率呈逐渐上升的趋势。正常生长条件下,外源施用GABA能降低根系相对电导率,但差异不显著。盐胁迫下,根系相对电导率出现明显的升高,与对照相比,在12、24、36、48和60 h分别升高了26.49%、30.93%、32.27%、78.69%和96.69%,且升高幅度逐渐增大。外源GABA能降低盐胁迫下根系的相对电导率,在胁迫后12、24、36、48和60 h分别降低了11.19%、14.51%、13.83%、23.57%和13.93%,差异显著。这表明,盐胁迫下施用外源GABA能减少细胞渗出物质,间接说明其保护了细胞膜的完整性。
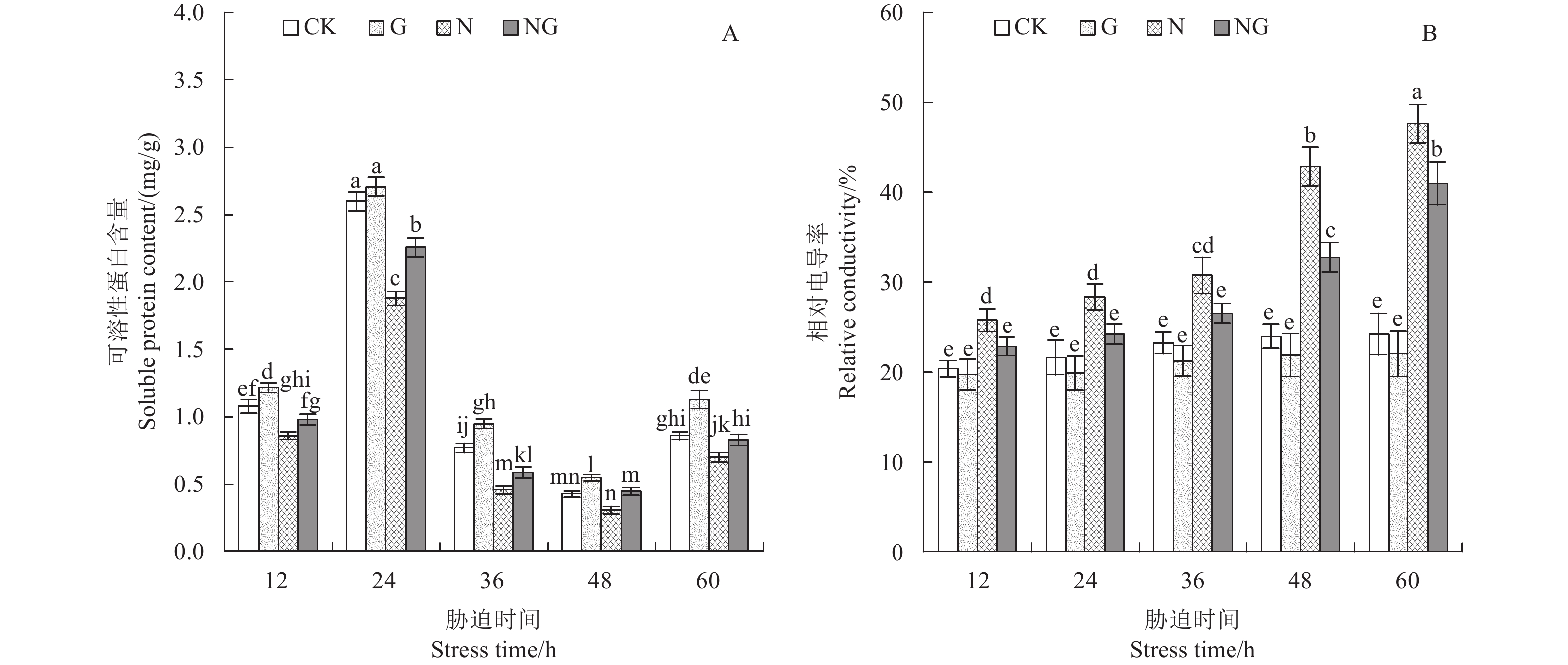
|
柱上不同小写字母表示同一胁迫时间不同处理差异达5%显著水平。CK:对照,G:GABA处理,N:盐胁迫,NG:盐胁迫+GABA。 Different small letters above the bars are significantly different among different treatments for same stress time at 5% level. CK: Control, G: GABA treatment, N: Salt stress, NG: Salt stress+GABA. 图 4 GABA对玉米幼苗根系渗透调节的影响 Fig. 4 Effect of GABA on the osmotic adjustment in maize seedling roots |
2.6 GABA对玉米幼苗根系抗氧化酶活性的影响
SOD能将
POD和CAT都能催化分解H2O2,减少其在作物体内积累。如图5-B所示,盐胁迫下,POD活性明显升高,在胁迫后24 h与对照相比提高了95.16%,而与盐胁迫处理相比,施用外源GABA后POD活性提高了24.50%,表明盐胁迫下外源GABA能提高POD活性。如图5-C所示,随胁迫时间的延长,不同处理的CAT活性虽呈不同变化趋势,但可看出盐胁迫能明显提高根系CAT活性,在胁迫后36 h比对照升高了161.81%,而外源GABA能提高盐胁迫下CAT活性,在胁迫后36 h升高了39.74%。
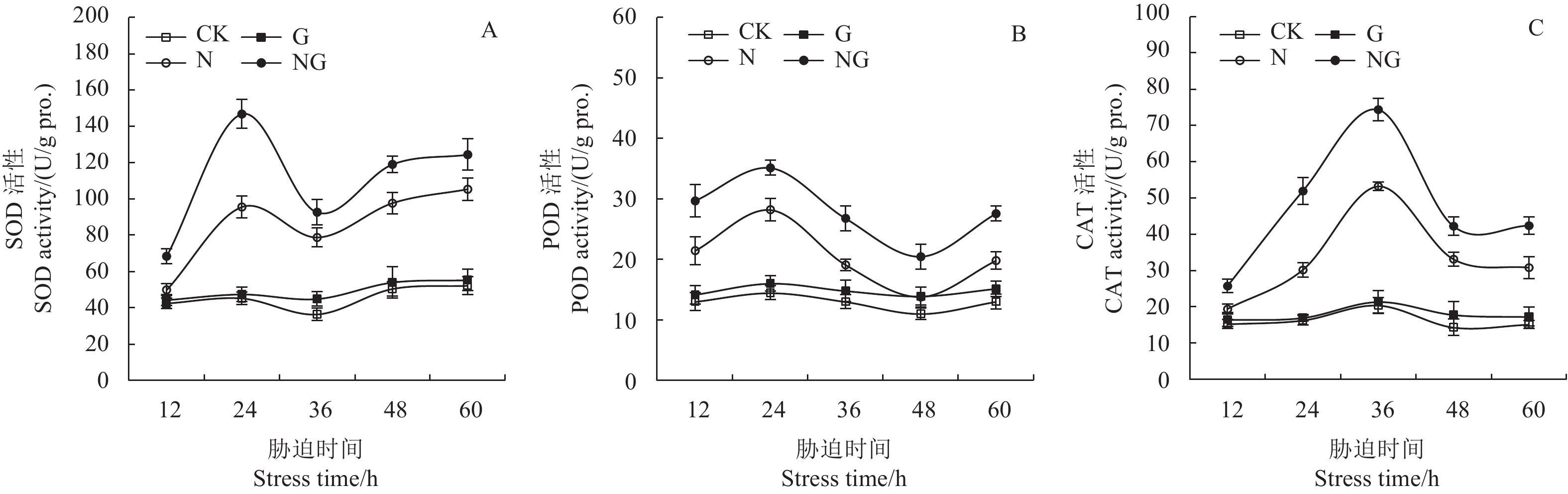
|
CK:对照,G:GABA处理,N:盐胁迫,NG:盐胁迫+GABA。 CK: Control, G: GABA treatment, N: Salt stress, NG: Salt stress+GABA. 图 5 GABA对玉米幼苗根系抗氧化酶活性的影响 Fig. 5 Effect of GABA on the antioxidant enzyme activity in maize seedling roots |
2.7 GABA对玉米幼苗根系内源激素含量的影响
植物内源激素作为信号物质负责调控植物的生长发育,生长素 (IAA) 能够促进侧根形成,玉米素核苷 (ZR) 能够促进细胞分裂,赤霉素 (GA3) 能促进细胞伸长,而脱落酸 (ABA) 能够引起气孔关闭,抑制作物生长,是一种逆境激素。由图6-A可知:随着胁迫时间的延长,根系IAA含量呈现出“V”型的变化趋势,并于盐胁迫36 h达最低值;外源GABA能提高盐胁迫下根系内IAA含量,胁迫后12、24、36、48和60 h比盐胁迫处理分别升高了12.59%、8.15%、7.83%、9.63%和7.84%,差异显著。
如图6-B所示:随着胁迫时间的延长,根系内GA3含量呈现先升高后下降的趋势;外源GABA处理能提高玉米幼苗根系内的GA3含量,但与对照相比差异不显著;盐胁迫可降低根系内GA3含量,在胁迫后60 h比对照降低了62 ng/g,下降幅度为10.84%。外源GABA处理则提高了盐胁迫下GA3的含量,胁迫后12、24、36、48和60 h分别提高了5.22%、4.32%、9.22%、9.63%和11.57%,差异显著。
如图6-C可知:随胁迫时间的延长,根系内ZR含量呈逐渐下降趋势;外源GABA能明显提高盐胁迫下的ZR含量,胁迫后的12、24、36、48和60 h分别提高13.79%、12.57%、10.37%、15.74%和15.38%,差异显著。
由图6-D可知:随着胁迫时间的延长,根系内ABA含量呈先上升后下降的趋势,盐胁迫后48 h达最高值;与对照相比,GABA处理可使根系内ABA含量降低,但只有胁迫后36 h差异显著。盐胁迫可导致根系内ABA含量升高,且与对照间差异显著。GABA能降低盐胁迫下根系内ABA含量,在胁迫后12、24、36、48和60 h分别比盐胁迫处理降低了18.57%、20.82%、18.65%、17.88%和15.16%,差异显著。
综上所述,外源施用GABA能显著提高盐胁迫下根系内促进型激素含量,降低抑制型激素含量,从而恢复根系的生长。

|
柱上不同小写字母表示同一胁迫时间不同处理差异达5%显著水平。CK:对照,G:GABA处理,N:盐胁迫,NG:盐胁迫+GABA。 Different small letters above the bars are significantly different among different treatments for same stress time at 5% level. CK: Control, G: GABA treatment, N: Salt stress, NG: Salt stress+GABA. 图 6 GABA对玉米幼苗根系内源激素含量的影响 Fig. 6 Effect of GABA on the endogenous hormones content in maize seedling roots |
2.8 GABA对玉米幼苗根系内源激素比值的影响
由表2可知:盐胁迫会降低IAA/ABA、GA3/ABA、ZR/ABA和(IAA+GA3+ZR)/ABA比值,与对照相比,分别下降了33.33%、30.39%、36.00%和32.32%;而外源施用GABA能提高上述比例,与盐胁迫处理相比分别升高了29.17%、26.76%、37.50%和28.83%。表明盐胁迫会严重影响玉米幼苗根系的激素平衡,造成生理紊乱,而外源施用GABA能提高促进型激素含量,降低抑制型激素含量,从而使根系内源激素维持相对平衡状态。
|
|
表 2 GABA对玉米幼苗根系激素比值的影响 Table 2 Effect of GABA on the hormone ratio of maize seedling roots |
2.9 相关性分析
通过对主要生理指标相关性分析 (表3) 可知:玉米幼苗根系干物质质量、根长和根尖数彼此之间呈极显著正相关;上述3个指标与MDA和
|
|
表 3 不同处理间主要指标的相关性分析 Table 3 Correlation analysis of main indicators in different treatments |
3 讨论 3.1 外源GABA对根系生长的影响
玉米幼苗根长、根系表面积以及体积的大小决定根系吸收养分范围的大小,对玉米地上部分的生长有重要作用。有研究表明,盐胁迫下玉米幼苗根系生长受到抑制,干物质积累量减少,根长、根表面积及根尖数明显下降[24-25];盐胁迫下番茄幼苗生长下降,随着GABA的施用,番茄幼苗的生长得到明显恢复,株高、茎粗、叶面积、地上部分以及地下部分的干物质质量明显高于盐胁迫下的番茄幼苗[26]。GABA能改善植物生长,可能与其增强光合酶活性,提高植株相对含水量及增加渗透调节物质含量等生理代谢机制相关[12, 27-28],而GABA促进玉米幼苗的生长可能是通过激发细胞伸长和分裂或维持植物组织内的代谢平衡。此外,在正常生长条件下,外源施用GABA能促进玉米幼苗根系生长,增加干/鲜物质质量[29]。本研究中,盐胁迫会严重抑制玉米幼苗根系生长,减少根长、根表面积、根体积、根尖数和根系干物质质量,但增加了根系平均直径。施用外源GABA会显著缓解盐胁迫带来的生长抑制,根系生长得到恢复。GABA处理后根尖数量明显增加。通过根系扫描图片观察,导致根尖数量增加的直接原因是根毛增多,根毛增加也导致根系平均直径下降。
外源GABA能改善高温胁迫下水稻幼苗的生长,增加地上和地下部分干物质质量,这可能与外源GABA增加内源GABA含量有关[13]。本研究表明,施用外源GABA会提高内源GABA含量,但是通过相关性分析可知,内源GABA含量与根系生长相关性不显著,而内源GABA含量与抗氧化酶活性 (SOD、POD和CAT) 呈显著正相关,这表明外源GABA促进盐胁迫下植株生长,可能是通过降低胁迫损伤等间接途径实现的。根系活力是反映根系发育状况的一个重要指标,根系活力越强,植株吸收养分的能力越强;而根系吸收面积是根系活力指标之一,根系吸收面积越大,说明活力越强、吸收能力越强[30]。叶面喷施GABA能有效减弱温度胁迫对黄瓜幼苗的伤害,提高根系活力,促进黄瓜幼苗的正常生长[31]。本研究中,盐胁迫会明显降低玉米幼苗根系活力,外源施用GABA能提高盐胁迫下根系活力,通过相关性分析可知,根系活力与根系干物质质量等生长量呈极显著正相关,这与前人研究结果一致。
3.2 外源GABA对根系氧化损伤的影响盐胁迫会诱导活性氧 (ROS) 的生成,从而导致细胞膜的损伤和膜脂过氧化物的积累,其中MDA含量的升高最为显著[32],因此MDA含量被看作是植株氧化损伤重要的指标之一[33]。抗氧化酶系统在清除活性氧的生理进程中起重要作用,该系统包含有很多酶和非酶类的抗氧化助剂,常用的主要有SOD、POD和CAT[34]。玉米幼苗中的SOD、POD和CAT等抗氧化酶活性在盐胁迫下会升高[35]。本研究中,盐胁迫下玉米幼苗根系内的MDA和
盐胁迫下,施用外源GABA能降低MDA和
当植物受到非生物胁迫时,体内激素水平会发生显著变化。张敏等[38]的研究表明,盐胁迫下,小麦幼苗叶片和根系的IAA和GA3含量下降,ABA和ZR含量升高,IAA/ABA和GA3/ABA比值下降。本研究也得出了类似的结论,但本研究中ZR含量在盐胁迫的植株中出现下降现象,而前人研究结果中植物在受到胁迫时ZR含量有高有低[38-39],造成这种差异的原因可能与植物对逆境反应的调节能力有关。
GABA能增加PEG模拟干旱胁迫下白三叶幼苗内的IAA和GA3含量,显著提高ABA含量[40]。本研究中,外源GABA能显著提高盐胁迫下玉米幼苗根系内的IAA、GA3和ZR含量,降低ABA含量;同时IAA/ABA、GA3/ABA和ZR/ABA均高于未经过GABA处理的玉米幼苗。前人研究中GABA处理会提高ABA含量,本研究与之有差异,这可能是因为外源GABA缓解了盐胁迫的毒害作用,从而减轻了根系胁迫,使根系内ABA含量降低。本研究中,促进型激素经过GABA处理后有所升高,而抑制型激素则相反。通过相关性分析可知,外源GABA会通过调控抗氧化酶活性来减少根系的氧化损伤,使玉米幼苗恢复正常生长,从而导致激素含量变化,但对于外源GABA在盐胁迫下调控内源激素的生理机制、途径等还未有定论。
4 结论盐胁迫下,施用外源GABA能增加根系内源GABA含量,显著提高根系活力;使SOD、POD和CAT活性显著提高,同时减少MDA和
| [1] |
KOCA H, BOR M, ÖZDEMIR F, et al. The effect of salt stress on lipid peroxidation, antioxidative enzymes and proline content of sesame cultivars[J]. Environ Exp Bot, 2007, 60(3): 344-351. DOI:10.1016/j.envexpbot.2006.12.005 |
| [2] |
NEGRÃO S, COURTOIS B, AHMADI N, et al. Recent updates on salinity stress in rice: from physiological to molecular responses[J]. Crit Rev Plant Sci, 2011, 30(4): 329-377. DOI:10.1080/07352689.2011.587725 |
| [3] |
杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报, 2008, 45(5): 837-845. YANG J S. Development and prospect of the research on salt-affected soils in China[J]. Acta Pedologica Sinica, 2008, 45(5): 837-845. DOI:10.3321/j.issn:0564-3929.2008.05.010 |
| [4] |
SÜMER A, ZÖRB C, YAN F, et al. Evidence of sodium toxicity for the vegetative growth of maize (Zea mays L.) during the first phase of salt stress
[J]. . J Appl Bot Food Qual, 2004, 78(2): 135-139. |
| [5] |
SHAHZAD M, WITZEL K, ZÖRB C, et al. Growth-related changes in subcellular ion patterns in maize leaves (Zea mays L.) under salt stress
[J]. J Agron Crop Sci, 2012, 198(1): 46-56. DOI:10.1111/jac.2011.198.issue-1 |
| [6] |
DE AZEVEDO NETO A D, PRISCO J T, ENÉAS-FILHO J, et al. Effect of salt stress on antioxidative enzymes and lipid peroxidation in leaves and roots of salt-tolerant and salt sensitive maize genotypes[J]. Environ Exp Bot, 2006, 56(1): 87-94. DOI:10.1016/j.envexpbot.2005.01.008 |
| [7] |
MENEZES-BENAVENTE L, KERNODLE S P, MARGIS-PINHEIRO M, et al. Salt-induced antioxidant metabolism defenses in maize (Zea mays L.) seedlings
[J]. Redox Rep, 2004, 9(1): 29-36. DOI:10.1179/135100004225003888 |
| [8] |
YOUNIS M E, EL-SHAHABY O A, NEMAT ALLA M N, et al. Kinetin alleviates the influence of waterlogging and salinity on growth and affects the production of plant growth regulators in Vigna sinensis and Zea mays
[J]. Agronomie, 2003, 23(4): 277-285. DOI:10.1051/agro:2003010 |
| [9] |
BREITKREUZ K E, SHELP B J. Subcellular compartmentation of the 4-aminobutyrate shunt in protoplasts from developing soybean cotyledons[J]. Plant Physiol, 1995, 108(1): 99-103. DOI:10.1104/pp.108.1.99 |
| [10] |
Sulieman S. Does GABA increase the efficiency of symbiotic N2 fixation in legumes?[J]. Plant Signal Behav, 2011, 6(1): 32-36. DOI:10.4161/psb.6.1.14318 |
| [11] |
SHI S Q, SHI Z, JIANG Z P, et al. Effects of exogenous GABA on gene expression of Caragana intermedia roots under NaCl stress: regulatory roles for H2O2 and ethylene production
[J]. Plant Cell Environ, 2010, 33(2): 149-162. DOI:10.1111/pce.2010.33.issue-2 |
| [12] |
YANG A P, CAO S F, YANG Z F, et al. γ-Aminobutyric acid treatment reduces chilling injury and activates the defence response of peach fruit
[J]. Food Chem, 2011, 129(4): 1619-1622. DOI:10.1016/j.foodchem.2011.06.018 |
| [13] |
NAYYAR H, KAUR R, KAUR S, et al. γ-Aminobutyric acid (GABA) imparts partial protection from heat stress injury to rice seedlings by improving leaf turgor and upregulating osmoprotectants and antioxidants
[J]. J Plant Growth Regul, 2014, 33(2): 408-419. DOI:10.1007/s00344-013-9389-6 |
| [14] |
WANG Y C, GU W R, MENG Y, et al. γ-Aminobutyric acid imparts partial protection from salt stress injury to maize seedlings by improving photosynthesis and upregulating osmoprotectants and antioxidants
[J]. Sci Rep, 2017, 7: 43609. DOI:10.1038/srep43609 |
| [15] |
杨建昌. 水稻根系形态生理与产量、品质形成及养分吸收利用的关系[J]. 中国农业科学, 2011, 44(1): 36-46. YANG J C. Relationships of rice root morphology and physiology with the formation of grain yield and quality and the nutrient absorption and utilization[J]. Scientia Agricultura Sinica, 2011, 44(1): 36-46. DOI:10.3864/j.issn.0578-1752.2011.01.005 |
| [16] |
熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003. XIONG Q E. Plant physiology experiment report[M]. Chengdu: Sichuan Science and Technology Press, 2003. |
| [17] |
SAITO T, MATSUKURA C, SUGIYAMA M, et al. Screening for γ-aminobutyric acid (GABA)-rich tomato varieties
[J]. J Jpn Soc Hortic Sci, 2008, 77(3): 242-250. DOI:10.2503/jjshs1.77.242 |
| [18] |
KUK Y I, SHIN J S, BURGOS N R, et al. Antioxidative enzymes offer protection from chilling damage in rice plants[J]. Crop Sci, 2003, 43(6): 2109-2117. DOI:10.2135/cropsci2003.2109 |
| [19] |
XIE Z X, DUAN L S, TIAN X L, et al. Coronatine alleviates salinity stress in cotton by improving the antioxidative defense system and radical-scavenging activity[J]. J Plant Physiol, 2008, 165(4): 375-384. DOI:10.1016/j.jplph.2007.06.001 |
| [20] |
MONREAL J A, JIMÉNEZ E T, REMESAL E, et al. Proline content of sugar beet storage roots: response to water deficit and nitrogen fertilization at field conditions[J]. Environ Exp Bot, 2007, 60(2): 257-267. DOI:10.1016/j.envexpbot.2006.11.002 |
| [21] |
GIANNOPOLITIS C N, RIES S K. Superoxide dismutases: II. Purification and quantitative relationship with water-soluble protein in seedlings[J]. Plant Physiol, 1977, 59(2): 315-318. DOI:10.1104/pp.59.2.315 |
| [22] |
GIANNOPOLITIS C N, RIES S K. Superoxide dismutases: I. Occurrence in higher plants[J]. Plant Physiol, 1977, 59(2): 309-314. DOI:10.1104/pp.59.2.309 |
| [23] |
CHANGE B, MAEHLY A C. Assay of catalases and peroxidase[J]. Methods Enzymol, 1955, 2: 764-775. DOI:10.1016/S0076-6879(55)02300-8 |
| [24] |
付长方, 张海艳. 盐胁迫对玉米种子萌发、幼苗叶绿素含量和渗透势的影响[J]. 山东农业科学, 2015, 47(5): 27-30. FU C F, ZHANG H Y. Effects of salt stress on seed germination and seedling chlorophyll content and osmotic potential of maize[J]. Shandong Agric Sci, 2015, 47(5): 27-30. |
| [25] |
张翯, 顾万荣, 王泳超, 等. DCPTA 对盐胁迫下玉米苗期根系生长、渗透调节及膜透性的影响[J]. 生态学杂志, 2015, 34(9): 2474-2481. ZHANG H, GU W R, WANG Y C, et al. Effects of DCPTA on root growth, osmotic adjustment and cell membrane permeability of maize seedlings under salt stress[J]. Chin J Ecol, 2015, 34(9): 2474-2481. |
| [26] |
罗黄颖, 高洪波, 夏庆平, 等. γ-氨基丁酸对盐胁迫下番茄活性氧代谢及叶绿素荧光参数的影响
[J]. 中国农业科学, 2011, 44(4): 753-761. LUO H Y, GAO H B, XIA Q P, et al. Effects of exogenous GABA on reactive oxygen species metabolism and chlorophyll fluorescence parameters in tomato under NaCl stress[J]. Scientia Agricultura Sinica, 2011, 44(4): 753-761. DOI:10.3864/j.issn.0578-1752.2011.04.013 |
| [27] |
DEEWATTHANAWONG R, NOCK J F, WATKINS C B. γ-Aminobutyric acid (GABA) accumulation in four strawberry cultivars in response to elevated CO2 storage
[J]. Postharvest Biol Technol, 2010, 57(2): 92-96. DOI:10.1016/j.postharvbio.2010.03.003 |
| [28] |
SHANG H T, CAO S F, YANG Z F, et al. Effect of exogenous γ-aminobutyric acid treatment on proline accumulation and chilling injury in peach fruit after long-term cold storage
[J]. J Agric Food Chem, 2011, 59(4): 1264-1268. DOI:10.1021/jf104424z |
| [29] |
WU L, LIU J H, ASHRAF U, et al. Exogenous γ-aminobutyric acid (GABA) application improved early growth, net photosynthesis, and associated physio-biochemical events in maize
[J]. Front Plant Sci, 2016, 7: 919. |
| [30] |
LIU J J, WEI Z, LI J H. Effects of copper on leaf membrane structure and root activity of maize seedling[J]. Bot Stud, 2014, 55: 47. DOI:10.1186/s40529-014-0047-5 |
| [31] |
黄娟. 外源 GABA 对温度胁迫下黄瓜生长的影响[D]. 重庆: 西南大学, 2015. HUANG J. Effects of exogenous GABA on the growth of cucumber under temperature stress[D]. Chongqing: Southwest University, 2015. |
| [32] |
MITTLER R, VANDERAUWERA S, GOLLERY M, et al. Reactive oxygen gene network of plants[J]. Trends Plant Sci, 2004, 9(10): 490-498. DOI:10.1016/j.tplants.2004.08.009 |
| [33] |
TAULAVUORI E, HELLSTRÖM E, TAULAVUORI K, et al. Comparison of two methods used to analyse lipid peroxidation from Vaccinium myrtillus (L.) during snow removal, reacclimation and cold acclimation
[J]. J Exp Bot, 2001, 52(365): 2375-2380. DOI:10.1093/jexbot/52.365.2375 |
| [34] |
QIU Z B, LI J T, ZHANG M M, et al. He-Ne laser pretreatment protects wheat seedlings against cadmium-induced oxidative stress[J]. Ecotoxicol Environ Safe, 2013, 88: 135-141. DOI:10.1016/j.ecoenv.2012.11.001 |
| [35] |
LU J, LI X N, YANG Y L, et al. Effect of hydrogen peroxide on seedling growth and antioxidants in two wheat cultivars[J]. Biol Plant, 2013, 57(3): 487-494. DOI:10.1007/s10535-013-0312-6 |
| [36] |
ZHANG Z P, MIAO M M, WANG C L. Effects of ALA on photosynthesis, antioxidant enzyme activity, and gene expression, and regulation of proline accumulation in tomato seedlings under NaCl stress[J]. J Plant Growth Regul, 2015, 34(3): 637-650. DOI:10.1007/s00344-015-9499-4 |
| [37] |
ANJUM S A, ASHRAF U, KHAN I, et al. Chromium and aluminum phytotoxicity in maize: morpho-physiological responses and metal uptake[J]. Clean-Soil Air Water, 2016, 44(8): 1075-1084. DOI:10.1002/clen.v44.8 |
| [38] |
张敏, 蔡瑞国, 李慧芝, 等. 盐胁迫环境下不同抗盐性小麦品种幼苗长势和内源激素的变化[J]. 生态学报, 2008, 28(1): 310-320. ZHANG M, CAI R G, LI H Z, et al. Responses of seedling growth and endogenous hormone contents in different wheat cultivars to salt stress[J]. Acta Ecologica Sinica, 2008, 28(1): 310-320. DOI:10.3321/j.issn:1000-0933.2008.01.036 |
| [39] |
王泳超. γ-氨基丁酸(GABA)调控盐胁迫下玉米种子萌发和幼苗生长的机制[D]. 哈尔滨: 东北农业大学, 2016. WANG Y C. Mechanism of γ-aminobutyric acid (GABA) regulating maize seed germination and seeding growth under salt stress[D]. Harbin: Northeast Agricultural University, 2016. |
| [40] |
李杰, 孙阳, 杨德翠, 等. γ-氨基丁酸对干旱胁迫下白三叶幼苗内源激素含量的影响
[J]. 青岛农业大学学报(自然科学版), 2008, 25(1): 6-9. LI J, SUN Y, YANG D C, et al. Effect of γ-aminobutyric acid on endogenous hormones contents in white clover (Trifolium repens L.) seedlings under drought stress [J]. J Qingdao Agric Univ (Nat Sci), 2008, 25(1): 6-9. DOI:10.3969/j.issn.1674-148X.2008.01.002 |
 2018, Vol. 20
2018, Vol. 20


