2. 山东农业大学 山东省蔬菜病虫生物学重点实验室,山东 泰安 271018;
3. 山东省农药检定所,济南 250100
2. Shandong Provincial Laboratory for Biology of Vegetable Diseases and Insect Pests, Shandong Agricultural University, Taian 271018, Shandong Province, China;
3. Shandong Provincial Pesticide Detection Institute, Jinan 250100, China
菌核病是十字花科蔬菜上的重要病害之一,致病菌为核盘菌Sclerotinia sclerotiorum (Lid.) de Bary。在低温高湿条件下该病菌易侵染作物的茎、叶和花[1-2],由于其特殊的抗逆结构,导致该病一旦发生,很难根除[3]。在中国,菌核病主要发生在长江流域等多雨潮湿地区,是为害油菜的3大病害之一[4-5]。随着设施蔬菜种植面积的扩大和年限延长,菌核病已逐渐成为部分蔬菜产区的重要病害。目前,药剂防治仍是控制该病的主要方法[6-7],但随着苯并咪唑类杀菌剂和二甲酰亚胺类杀菌剂的常年使用,该病原菌已对其产生不同程度的抗性[4, 8],需寻找高效安全的新型杀菌剂。
四霉素 (tetramycin) 是一种高效、低毒、广谱的农用抗生素,是不吸水链霉菌梧州亚种Streptomyces ahygroscopicus subsp. wuzhouensis的发酵代谢产物[9],目前在中国被登记用于防治杨树溃疡病、水稻立枯病、细菌性角斑病、花生根腐病、小麦赤霉病和白粉病等[10]。据报道,四霉素对稻瘟病[11-12]、番茄叶霉病[13]和黄瓜灰霉病[14]等也有很好的防治效果,且具有明显的促进伤口愈合,提高植株抗病性的作用[12, 15],然而其对蔬菜菌核病的抑制活性尚不明确。为此,本研究采用菌丝生长速率法测定了采自山东省不同蔬菜作物上的菌核病菌对该药剂的敏感性,并建立了敏感基线,同时测定了四霉素对该病原菌不同生育阶段的抑制活性,通过离体叶片接种试验明确了该药剂的作用方式,以期为四霉素在防治蔬菜菌核病上的进一步应用提供科学依据。
1 材料与方法 1.1 供试材料 1.1.1 菌株2016—2017年,从山东省不同地区 (寿光、青州、昌乐、临朐和泰安) 未施用过四霉素的西葫芦、茄子、黄瓜、芸豆、辣椒和番茄等蔬菜作物上采集菌核病样本,经单菌核分离后共获得151株蔬菜菌核病菌,在马铃薯葡萄糖琼脂 (PDA) 培养基的斜面上于4 ℃保存,备用。
1.1.2 药剂及试剂15%四霉素 (tetramycin) 母药和0.3%四霉素水剂 (AS),由辽宁微科生物工程股份有限公司提供;80%多菌灵 (carbendazim) 水分散粒剂 (WG),由山东潍坊润丰化工股份有限公司提供;500 g/L异菌脲 (iprodione) 悬浮剂 (SC),由江苏辉丰农化股份有限公司提供。
1.1.3 培养基马铃薯葡萄糖琼脂培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L。
1.2 试验方法 1.2.1 蔬菜菌核病菌对四霉素的敏感性测定采用菌丝生长速率法[16]。先用丙酮将15%四霉素母药配制成10 000 μg/mL的母液,再用含0.1%吐温-80的无菌水稀释成系列质量浓度药液[13],进而制备成质量浓度为0、0.025、0.05、0.1、0.2、0.4和0.8 μg/mL的含药PDA平板。每处理重复4次。将供试菌株在25 ℃、黑暗条件下培养3 d,在菌落边缘打取直径为5 mm的菌饼,菌丝面朝下接入含药平板中央,于25 ℃、黑暗条件下培养2 d后,采用十字交叉法测量菌落直径,按文献方法[16]计算菌丝生长抑制率,并计算有效抑制中浓度 (EC50)。
1.2.2 四霉素对菌核产量的影响随机选取来自不同蔬菜上的菌核病菌NX12和QZ5,于25 ℃、黑暗条件下培养3 d,在菌落边缘打取直径为5 mm的菌饼,倒置于含药质量浓度为0、0.05、0.2和0.8 μg/mL的PDA平板中央。每处理重复6次。于25 ℃、黑暗条件下培养30 d调查每皿菌核的数量[17]。收集菌核,于50 ℃下烘干48 h,调查每皿菌核的干重[18]。试验重复3次。
1.2.3 四霉素对菌核萌发的抑制活性参照Xu等[19]的方法。随机选取来自不同蔬菜上的菌核病菌NX12和QZ5,在PDA培养基上于25 ℃、黑暗条件下培养30 d,挑选直径为3~5 mm的菌核,经0.5%的次氯酸钠溶液消毒后,用无菌去离子水冲洗3次,随后用滤纸擦干,备用。将消毒后的菌核接入到含药质量浓度为0、0.1、0.5、1和2 μg/mL的PDA平板中。每皿接种5个菌核,每处理重复6次。于25 ℃、黑暗条件下分别培养3、4和5 d,于每天固定时间点在显微镜下观察菌核萌发后的菌丝生长情况,将菌丝长度超过2 mm的菌核视为萌发,记录萌发的菌核数量,计算各处理下菌核萌发的抑制率[19]。
1.2.4 四霉素对蔬菜菌核病的防治效果参照Kuang等[20]的离体叶片法。由于相关研究显示NX12和QZ5的致病力无明显差异,且对2个对照药剂多菌灵和异菌脲均表现敏感 (数据未发表),所以活体防效试验时选用NX12菌株用于接种。在温室内选取五叶期黄瓜 (新泰密刺) 的第3片叶,经0.5%的次氯酸钠溶液消毒和无菌水冲洗,于室温下自然晾干。将叶片置于铺有湿润滤纸、直径为9 cm的培养皿中。将0.3%四霉素AS用无菌水稀释成0、5、10、20和40 μg/mL,以20 μg/mL的80%多菌灵WG和500 g/L异菌脲SC为药剂对照,并设置清水对照。每处理重复4次,试验进行3次。为了评估四霉素对蔬菜菌核病的保护作用,将药液均匀喷施在黄瓜叶片表面,24 h后将直径为5 mm的菌核病菌菌饼接种在黄瓜叶片叶脉一侧,于培养箱 (25 ℃、相对湿度80%、L/D = 12 h/12 h) 中培养3 d后,用十字交叉法测量病斑直径 (cm),计算病斑增长面积及药剂的防治效果[20]。
为了评估四霉素对蔬菜菌核病的治疗作用,先将菌核病菌菌饼接种在黄瓜叶片上,24 h后测量初始病斑直径 (cm),然后将药液喷施在黄瓜叶片上,于培养箱 (25 ℃、相对湿度80%、L/D = 12 h/12 h) 中培养3 d后,用十字交叉法测量病斑直径 (cm),计算病斑增长面积及药剂的防治效果[20]。
1.2.5 数据分析采用DPS 7.05软件计算四霉素的EC50值,采用最小显著差异法 (LSD法) 进行差异显著性分析。
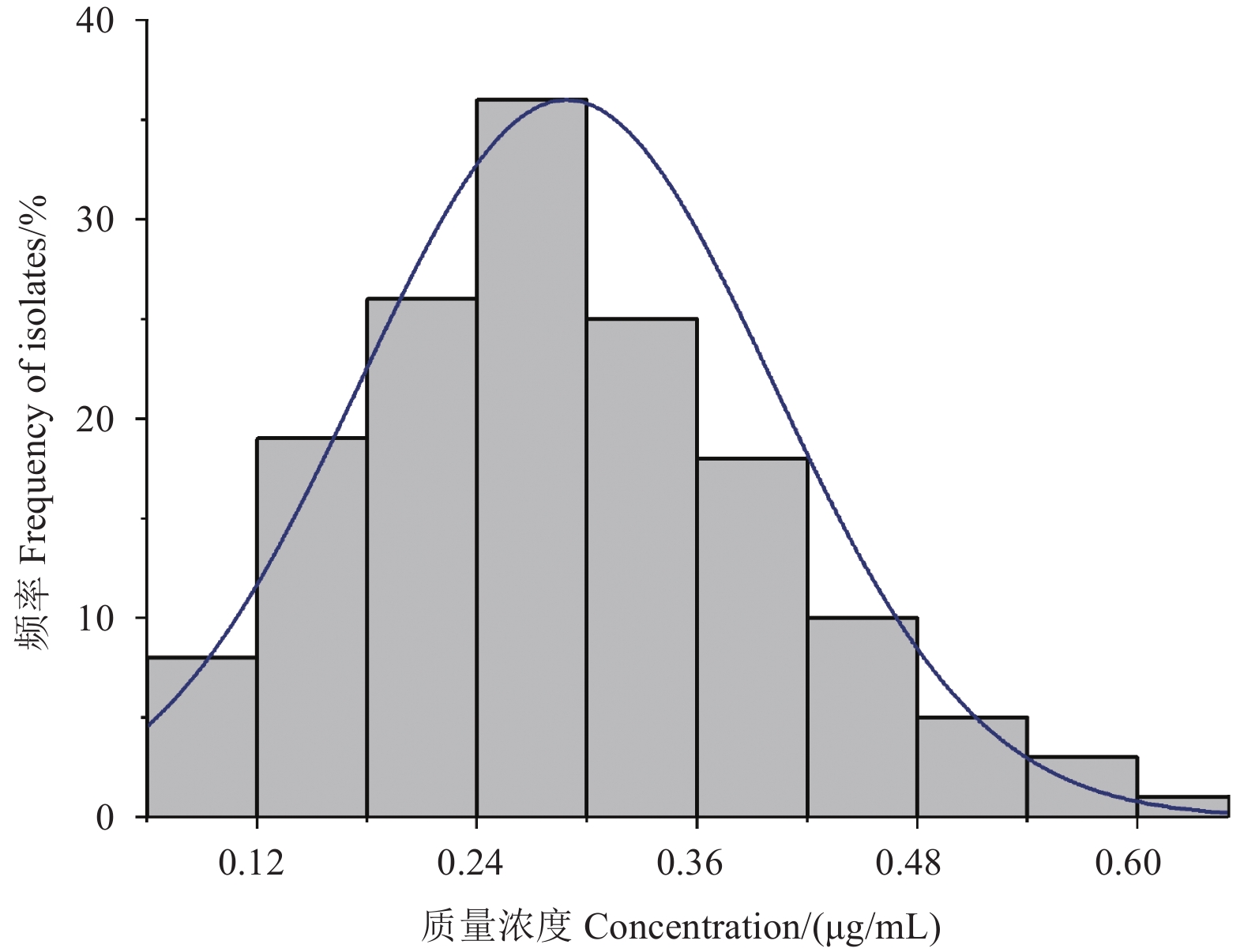
2 结果与分析 2.1 蔬菜菌核病菌对四霉素的敏感基线敏感性测定结果(表1)表明,四霉素对西葫芦、茄子、黄瓜、芸豆、辣椒和番茄上的菌核病菌的平均EC50值分别为0.27、0.30、0.27、0.31、0.30和0.28 μg/mL,差异不显著 (P > 0.05),表明其EC 50值可用来建立蔬菜菌核病菌对四霉素的敏感基线。四霉素对采自山东省不同地区6种蔬菜作物的151株菌核病菌的EC50值分布范围为0.07~0.62 μg/mL,平均值为(0.29 ± 0.01) μg/mL,变异系数为8.86,敏感性呈单峰正态分布 (图1),因此该平均EC50值可作为山东地区蔬菜菌核病菌对四霉素的敏感基线。
|
|
表 1 不同蔬菜作物上的菌核病菌对四霉素的敏感性 Table 1 Sensitivity of S. sclerotiorum isolates obtained from various vegetables to tetramycin |
|
图 1 151株蔬菜菌核病菌对四霉素的敏感性频率分布 Fig. 1 Frequency distribution of the sensitivity of 151 S. sclerotiorumisolates from various vegetables to tetramycin |
2.2 四霉素对蔬菜菌核病菌菌核产量的影响
从图2可以看出:在未经四霉素处理的条件下,2株菌核病菌NY12和QZ5的菌落形态和菌核产量均存在一定差异;经四霉素处理后,2个菌株的菌核数量和干重均被明显抑制,但随着四霉素质量浓度的提高,菌核产量的下降趋势并不显著;四霉素处理的菌核明显比对照处理的小,表明四霉素可影响菌核的发育和活力。

|
注:图柱上不同字母表示经最小显著差异法检验在P < 0.05水平差异显著。 Note: Different letters on the column indicated significant difference at P < 0.05 level by Fisher’s least significant difference. 图 2 四霉素对蔬菜菌核病菌菌核产量的影响 Fig. 2 Effect of tetramycin on sclerotial production of S. sclerotiorumfrom vegetables |
2.3 四霉素对蔬菜菌核病菌菌核萌发的抑制活性
测定结果 (表2) 表明:随着处理质量浓度的增加,四霉素对 NX12和QZ5菌株菌核萌发的抑制活性逐渐增强。连续观察3 d发现,2 μg/mL的四霉素对2个菌株菌核萌发的抑制率均为100.00%,显著高于其他处理组;但随着时间的延长,低剂量下的四霉素对菌核萌发的抑制作用逐渐降低,这可能是由于菌核对药剂的敏感性有一定差异。
|
|
表 2 四霉素对菌核病菌菌核菌丝型萌发的抑制作用 Table 2 Effect of tetramycin on myceliogenic germination of the sclerotia of S. sclerotiorum |
2.4 四霉素对蔬菜菌核病的防治效果
离体叶片法测定结果 (图3)表明:药剂处理组病菌侵染形成的病斑面积显著低于清水处理下的病斑面积,说明各药剂处理均对菌核病有一定的防效。四霉素各浓度处理下,其保护效果均高于其治疗效果,且随着质量浓度的增加,所形成的病斑面积逐渐减小,防治效果逐渐升高。在20 μg/mL处理下,四霉素对菌核病的保护效果和治疗效果分别为72.66%和61.01%,显著高于对照药剂多菌灵和异菌脲。在40 μg/mL处理下,四霉素保护效果高达100.00 %,能够完全抑制菌核病菌的菌丝生长。

|
图 3 四霉素对蔬菜菌核病的保护与治疗作用 Fig. 3 Protective and curative effects of tetramycin against S. sclerotiorumon leaves of cucumber |
3 讨论与结论
在新型杀菌剂应用之前,建立其对靶标生物的敏感基线,便于监测随后的抗药性变化,可为制定该药剂的科学使用策略提供参考[21]。本研究结果表明,采自山东省不同地区的151株蔬菜菌核病菌对四霉素均表现敏感,且来自不同作物的敏感性差异不显著,而这些作物中黄瓜和番茄相对用药频繁,这个结果预示该病菌目前对四霉素的敏感性与寄主作物的种类以及现有其他药剂的使用背景关系不大。由于敏感性频率分布图符合单峰正态分布,变异系数较小,所以其平均EC50值 (0.29 ± 0.01) μg/mL可作为敏感基线用于今后田间抗性监测。
菌核作为菌核病菌主要的抗逆结构,可在土壤中越冬或越夏,并存活数年,这也是菌核病在田间难以防治的主要原因[22]。本研究表明,经四霉素处理后,蔬菜菌核病菌的菌核产量有所下降,菌核形态明显变小,而据报道,小的菌核不易萌发产生子囊孢子[23],说明四霉素对该病的初侵染源存在一定的抑制作用。土壤中的菌核在环境适宜时还可萌发生成菌丝侵染作物的根部和老叶,导致寄主营养物质供应不足,茎秆腐烂,甚至死亡[24-25]。Xu等[19]研究表明,5 μg/mL的嘧菌酯和苯噻菌酯对菌核萌发的抑制作用可达到80%,而在本研究中,四霉素在2 μg/mL的剂量下可完全抑制菌核的萌发,表明该药剂有能力切断该病菌的菌丝侵染途径,保护作物免受侵染。
此外,菌核病在山东地区设施蔬菜上的危害高峰期为每年的3—4月及11—12月[26]。在此期间,灰霉病、叶霉病等其他病害与菌核病混合发生[27],导致田间施药量增加。四霉素对担子菌、子囊菌和半知菌等均具有很强的抑制活性[14],杀菌谱广可作为替代药剂防治多种病害,对于实现一药多防、减少常规化学农药的使用非常有利。
综合本研究结果,四霉素对菌核病菌多个生育阶段均有较高的抑制活性,且同时具有保护与治疗防病效果,在使用时期上存在一定的灵活性,效果与常规化学药剂相当或略优。因此四霉素对于防治蔬菜菌核病具有很大的应用潜力。未来还需要进一步通过田间药效试验来验证其防治效果,为该产品在菌核病防治中的登记和推广应用提供科学依据。
| [1] |
SAHARAN G S, MEHTA N. Sclerotinia diseases of crop plants: biology, ecology and disease management[M]. London: Springer, 2008: 484.
|
| [2] |
ABAWI G S, GROGAN R G. Epidemiology of diseases caused by Sclerotinia species
[J]. Phytopathology, 1979, 69(8): 899-904. DOI:10.1094/Phyto-69-899 |
| [3] |
LUMSDEN R D. Histology and physiology of pathogenesis in plant disease caused by Sclerotinia species
[J]. Phytopathology, 1979, 69(8): 890-896. DOI:10.1094/Phyto-69-890 |
| [4] |
匡静, 王建新, 周明国. 江苏省油菜菌核病菌对多菌灵和菌核净的抗药性监测[J]. 中国农学通报, 2011, 27(15): 285-291. KUANG J, WANG J X, ZHOU M G. Monitoring on carbendazim and dimethachlon-resistance of Sclerotinia sclerotiorum obtained from the blight stems of rape in Jiangsu Province [J]. Chin Agric Sci Bull, 2011, 27(15): 285-291. |
| [5] |
杨素梅, 贾变桃, 白德刚, 等. 8种杀菌剂对油菜菌核病菌室内生物活性测定[J]. 山西农业大学学报(自然科学版), 2014, 34(1): 17-19. YANG S M, JIA B T, BAI D G, et al. The laboratory bioactivity of 8 fungicides against Sclerotinia sclerotiorum (Lib.) de Bary [J]. J Shanxi Agric Univ (Nat Sci Ed), 2014, 34(1): 17-19. |
| [6] |
MIORINI T J J, RAETANO C G, EVERHART S E. Control of white mold of dry bean and residual activity of fungicides applied by chemigation[J]. Crop Prot, 2017, 94: 192-202. DOI:10.1016/j.cropro.2016.12.023 |
| [7] |
潘以楼, 朱桂梅, 郭建, 等. 油菜菌核病菌对啶酰菌胺的敏感性及对不同杀菌剂敏感性的相关分析[J]. 西南农业学报, 2012, 25(2): 507-512. PAN Y L, ZHU G M, GUO J, et al. Sensitivity of Sclerotinia sclerotiorum to boscalid and its correlation with other diverse fungicides [J]. Southwest China J Agric Sci, 2012, 25(2): 507-512. DOI:10.3969/j.issn.1001-4829.2012.02.031 |
| [8] |
潘以楼, 刘福海, 徐志平, 等. 油菜菌核病菌对多菌灵的抗药性及其治理初报[J]. 江苏农业科学, 2000(3): 39-40. PAN Y L, LIU F H, XU Z P, et al. The resistance of Sclerotinia sclerotiorum of rape to carbendazim and its management [J]. Jiangsu Agric Sci, 2000(3): 39-40. DOI:10.3969/j.issn.1002-1302.2000.03.014 |
| [9] |
黄婷娇, 倪现朴, 夏焕章. 梧宁霉素C组分高产突变株的获得和产物初步鉴定[J]. 中国抗生素杂志, 2011, 36(2): 121-124. HUANG T J, NI X P, XIA H Z. The screening of high yield strains of Wuningmeisu C and the identification of its products[J]. Chin J Antibiot, 2011, 36(2): 121-124. |
| [10] |
中华人民共和国农业部农药检定所. 农药登记数据: 有效成分-四霉素[EB/OL]. 中国农药信息网[2018-09-27]. http://www.chinapesticide.org.cn/hysj/index.jhtml. Pesticide Examination Institute of the Ministry of Agriculture, the People's Republic of China. Pesticide registration date, active ingredient, tetramycin[EB/OL]. China Pesticide Information Network [2018 -09-27]. http://www.chinapesticide.org.cn/hysj/index.jhtml. |
| [11] |
ZHONG L J, ZHAO X H, ZHANG Q H, et al. Rice resistance against blast induced by tetramycin[J]. Plant Dis Pests, 2010, 1(3): 6-8. |
| [12] |
王丽萍, 常国彬, 孟双, 等. 四霉素防治杨树溃疡病田间应用研究[J]. 微生物学杂志, 2014, 34(2): 68-70. WANG L P, CHANG G B, MENG S, et al. Study on the poplar canker disease controlled using four hygromycin in field[J]. J Microbiol, 2014, 34(2): 68-70. DOI:10.3969/j.issn.1005-7021.2014.02.014 |
| [13] |
陈乐乐, 郭贝贝, 李北兴, 等. 四霉素对番茄叶霉病菌的毒力效应及田间防治效果[J]. 农药学学报, 2017, 19(3): 324-330. CHEN L L, GUO B B, LI B X, et al. Toxicity and control efficacy of tetramycin against Passalora fulva [J]. Chin J Pestic Sci, 2017, 19(3): 324-330. |
| [14] |
SONG Y Y, HE L M, CHEN L, et al. Baseline sensitivity and control efficacy of antibiosis fungicide tetramycin against Botrytis cinerea
[J]. Eur J Plant Pathol, 2016, 146(2): 337-347. DOI:10.1007/s10658-016-0920-z |
| [15] |
钟丽娟, 赵新海, 张庆华, 等. 四霉素诱导水稻对稻瘟病的抗性研究[J]. 安徽农业科学, 2010, 38(12): 6263-6264. ZHONG L J, ZHAO X H, ZHANG Q H, et al. Studies on the rice resistance to rice blast induced by tetramycin[J]. J Anhui Agric Sci, 2010, 38(12): 6263-6264. DOI:10.3969/j.issn.0517-6611.2010.12.071 |
| [16] |
慕立义. 植物化学保护研究方法[M]. 北京: 中国农业出版社, 1994: 76-81. MU L Y. Research methods of chemical plant protection[M]. Beijing: China Agriculture Press, 1994: 76-81. |
| [17] |
XU C Y, HOU Y P, WANG J X, et al. Activity of a novel strobilurin fungicide benzothiostrobin against Sclerotinia sclerotiorum
[J]. Pestic Biochem Physol, 2014, 115: 32-38. DOI:10.1016/j.pestbp.2014.08.001 |
| [18] |
LU X M, ZHU Z Q, DI Y L, et al. Baseline sensitivity and toxic action of flusilazole to Sclerotinia sclerotiorum
[J]. Crop Prot, 2015, 78: 92-98. DOI:10.1016/j.cropro.2015.08.022 |
| [19] |
XU C Y, LIANG X Y, HOU Y P, et al. Effects of the novel fungicide benzothiostrobin on Sclerotinia sclerotiorum in the laboratory and on Sclerotinia stem rot in rape fields
[J]. Plant Dis, 2015, 99(7): 969-975. DOI:10.1094/PDIS-09-14-0983-RE |
| [20] |
KUANG J, HOU Y P, WANG J X, et al. Sensitivity of Sclerotinia sclerotiorum to fludioxonil: in vitro determination of baseline sensitivity and resistance risk
[J]. Crop Prot, 2011, 30(7): 876-882. DOI:10.1016/j.cropro.2011.02.029 |
| [21] |
VILLANI S M, AYER K, COX K D. Molecular characterization of the sdhB gene and baseline sensitivity to penthiopyrad, fluopyram, and benzovindiflupyr in Venturia inaequalis
[J]. Plant Dis, 2016, 100(8): 1706-1709. DOI:10.1094/PDIS-12-15-1512-RE |
| [22] |
PATTERSON C L, GROGAN R G. Differences in epidemiology and control of lettuce drop caused by Sclerotinia minorand Sclerotinia sclerotiorum
[J]. Plant Dis, 1985, 69(9): 766-770. DOI:10.1094/PD-69-766 |
| [23] |
DILLARD H R, LUDWIG J W, HUNTER J E. Conditioning sclerotia of Sclerotinia sclerotiorum for carpogenic germination
[J]. Plant Dis, 1995, 79(4): 411-415. DOI:10.1094/PD-79-0411 |
| [24] |
HUANG H C, DUECK J. Wilt of sunflower from infection by mycelial-germinating sclerotia of Sclerotinia sclerotiorum
[J]. Can J Plant Pathol, 1980, 2(2): 47-52. DOI:10.1080/07060668009501437 |
| [25] |
母红岩, 郑露, 刘浩, 等. 油菜菌核病病原菌核的菌丝型萌发特性[J]. 中国油料作物学报, 2017, 39(2): 228-233. MU H Y, ZHENG L, LIU H, et al. Myceliogenic germination of sclerotia of Sclerotinia sclerotiorum on rapeseed [J]. Chin J Oil Crop Sci, 2017, 39(2): 228-233. |
| [26] |
刘春艳, 王勇, 郝永娟, 等. 保护地蔬菜菌核病的发生及防治[J]. 安徽农业科学, 2008, 36(3): 976-977. LIU C Y, WANG Y, HAO Y J, et al. Occurrence of vegetable Sclerotium disease in the protected field and its prevention technology [J]. J Anhui Agric Sci, 2008, 36(3): 976-977. DOI:10.3969/j.issn.0517-6611.2008.03.060 |
| [27] |
徐志英, 关晓燕, 时春喜, 等. 保护地蔬菜灰霉病发生规律及防治技术研究[J]. 中国农学通报, 2005, 21(8): 339-342. XU Z Y, GUAN X Y, SHI C X, et al. Occurrence regularity and controlling technique of vegetable grey mound in protected ground[J]. Chin Agric Sci Bull, 2005, 21(8): 339-342. DOI:10.3969/j.issn.1000-6850.2005.08.096 |
 2018, Vol. 20
2018, Vol. 20


