多杀菌素类杀虫剂——多杀菌素 (spinosad) 和乙基多杀菌素 (spinetoram) 作为重要的生物源杀虫剂,既对靶标害虫具有快速、高效的触杀和胃毒活性,又具有对非靶标生物安全、环境友好的特点,在害虫综合防治中应用广泛。
多杀菌素是从土壤中分离出的细菌刺糖多孢菌Saccharopolyspora spinosa的发酵产物[1-2],属大环内酯类杀虫剂,于1997年被商品化,广泛用于棉花等超过150种作物上的鳞翅目和双翅目以及叶蝉、蜘蛛螨、跳蚤和虱子等害虫防治,尤其对鳞翅目害虫的防治效果好[2-3]。乙基多杀菌素是以多杀菌素类杀虫剂为原料开发的一种半合成的杀虫剂[4]。与多杀菌素相比,乙基多杀菌素具有更好的杀虫活性、更广的杀虫谱及更好的环境兼容性,其于2007年上市,已被登记用于多种农作物上的鳞翅目、双翅目和蓟马等害虫的防治[3-4]。
杜顺堂等对于多杀菌素的发酵生产工艺及分析检测方法进行了综述[5],华乃震对多杀菌素及乙基多杀菌素的作用机理、作用特点、产品剂型和应用效果进行了综述[6],但截至目前,尚未见到有关多杀菌素类杀虫剂的环境降解及抗性机制方面的系统论述。掌握多杀菌素类杀虫剂的环境降解行为,对其环境安全及食品安全评价、合理使用十分必要;弄清多杀菌素类杀虫剂的抗性机制,可为有效进行害虫的抗药性治理提供参考。鉴于此,本文对多杀菌素类杀虫剂的环境降解及抗性机制研究进展做一综述。
1 多杀菌素环境降解及抗性机制研究进展 1.1 多杀菌素的结构多杀菌素 (spinosad) 是大环内酯类化合物,含有一个独特的大环内酯四环 (macrolide tetracycle),其上连接福莫胺糖 (forosamine sugar) 和甲基鼠李糖 (methylrhamnose sugar) 2个糖分子[2, 4]。商品化的多杀菌素是由多杀菌素A(spinosyn A) 和多杀菌素D(spinosyn D) 2种活性成分以质量分数85% : 15%的比例组成的混合物 (图式1)[2]。
多杀菌素主要的作用靶标是昆虫的烟碱型乙酰胆碱受体 (nAChR),次要靶标是GABA-门控氯离子通道[1, 3, 7]。nAChR由5个亚基组成,每个亚基由4个跨膜区及1个胞外N-端组成,在胞外区上有1个乙酰胆碱的键合位点。大多数昆虫的基因组中包含10~12个编码了nAChR亚基的基因[1]。多杀菌素作用于nAChR α6亚基上,造成受体构型改变,导致离子通道打开,引起神经冲动,导致昆虫颤抖、麻痹及死亡[1-2]。

|
图式1 多杀菌素A和D及其主要代谢物的分子结构 Scheme1 The structural formula of spinosyn A and D and their major metabolites |
1.2 多杀菌素的环境降解研究进展
多杀菌素在水中比较稳定,其水解半衰期大于200 d[2, 8];同时,其淋溶性及挥发性均很弱,因而不会对地下水和大气造成污染,环境安全性较高[2, 9]。
多杀菌素的环境降解主要包括光降解和土壤微生物降解,其中,光降解是多杀菌素在水、植物以及土壤表面的主要降解途径[2, 8-11],是影响多杀菌素环境持久性的主要因素。多杀菌素在土壤中的光解半衰期为9~10 d,在水中的光解半衰期少于1 d,在叶面上的光解半衰期为1.6~16 d不等[2, 9]。在无光照条件下,多杀菌素在有氧土壤中的半衰期是9~17 d[6, 9]。可见,多杀菌素光解速度很快、环境持久性风险低。
多杀菌素的降解产物主要是其脱甲基化代谢物——N-脱甲基-多杀菌素A和N-脱甲基-多杀菌素D(图式1)[9-10]。Liu等研究表明,多杀菌素A和D在光解过程中,除了形成脱甲基化代谢物外,质谱分析还分别检测到m/z 750和m/z 764的2个分子离子峰,表明还存在多杀菌素A和D的羟基化代谢物,但羟基化的位置及具体结构尚未确定[10]。基于14C标记的多杀菌素A和D在土壤和水中可分别被降解转化为N-脱甲基-多杀菌素A和N-脱甲基-多杀菌素D,West通过同时测定土壤、水和沉积物中这2种化合物及其代谢物的残留,表征了多杀菌素的环境残留性[12]。Thompson等研究发现,多杀菌素在混合针叶林的落叶和土壤中可迅速降解,且未发生淋溶,同时多杀菌素的脱甲基代谢物也可通过较快的光解而消除[9]。Cleveland等研究了多杀菌素在水体系中的扩散和降解行为,发现多杀菌素在水中的光降解路径主要是断裂失去福莫胺糖及还原大环内酯环上13,14-键,此外,多杀菌素还可以通过生物和非生物降解形成几种其他的代谢物[8]。可见,多杀菌素在环境中可以通过迅速转化为各种代谢物而消除。
综上所述,多杀菌素在田间的环境持久性风险很低。但有研究发现,多杀菌素在温室中的降解速率比在田间要慢很多[13]。因此,有关其在温室环境中的持久性问题值得关注。
1.3 多杀菌素的抗性机制随着多杀菌素的广泛使用,室内及田间害虫对多杀菌素均已产生抗性[7]。在鳞翅目的棉铃虫Helicoverpa armigera[14]、小菜蛾Plutella xylostella[15],双翅目的家蝇Musca domestica[16]、橄榄果实蝇Bactrocera oleae[17],缨翅目的西花蓟马Frankliniella occidentalis[18-19]和膜翅目的絨茧蜂Catesia plutellae[20]等多种昆虫中均发现了对多杀菌素的抗性。对多杀菌素的抗性机制研究表明,一些昆虫对多杀菌素的抗性与细胞色素P450s (CYP450s)介导的代谢增强有关[7],而在另一些昆虫中,多杀菌素的抗性是靶标抗性机制[1]。下面分别综述昆虫对多杀菌素的主要抗性机制——代谢抗性及靶标抗性方面的研究进展。
1.3.1 代谢抗性CYP450s作为重要的代谢酶,参与了昆虫对外源及内源物质的代谢。CYP450s表达水平和催化活性的改变,可导致解毒代谢作用增加,从而导致代谢抗性的产生[21-24]。研究发现,在一些昆虫中,CYP450s参与了对多杀菌素的代谢抗性。CYP450s抑制剂胡椒基丁醚 (piperonyl butoxide, PBO) 对多杀菌素的甜菜夜蛾Spodoptera exigua毒力具有增效作用,表明CYP450s单加氧酶参与了甜菜夜蛾对多杀菌素的抗性[14, 25-26]。在抗多杀菌素的棉铃虫中,CYP450s单加氧酶活性显著升高[14, 27]。斜纹夜蛾Spodoptera litura对多杀菌素的抗性也与CYP450s有关[28]。在抗多杀菌素的番茄潜叶蛾Tuta absoluta的智利种群中,多功能氧化酶 (MFO) 的活性增强,并且发现增加的MFO参与了一些番茄潜叶蛾田间种群对多杀菌素抗性的产生[1, 29]。可见,在甜菜夜蛾、棉铃虫、斜纹夜蛾以及一些番茄潜叶蛾种群中,CYP450s介导的解毒代谢增强是其对多杀菌素产生代谢抗性的机制。
研究发现,CYP450s也参与了家蝇对多杀菌素抗性的产生。在1个采自丹麦的家蝇多抗品系中,增效试验结果表明,其对多杀菌素的抗性与CYP450s增强有关[7];该研究还发现,多个CYP450s基因在多杀菌素抗性的田间家蝇种群中高表达,表明CYP450s参与了家蝇对多杀菌素抗性[7]。在家蝇中还发现了其对多杀菌素的抗性与性别有关[30-31]。从田间多抗种群筛选获得的多杀菌素抗性家蝇品系791spin,其雌性显示了对多杀菌素的高抗性,而雄性仍处于敏感阶段;同时,基因表达研究表明,在791spin中,与雄性相比,雌性家蝇的CYP4G2基因显示了高表达,表明CYP4G2可能参与了雌性家蝇对多杀菌素的高抗性[7]。
虽然CYP450s单加氧酶介导的解毒代谢增强是导致一些家蝇种群产生对多杀菌素抗性的主要因素[30],但也发现了不同的抗性机制。在1个由室内筛选获得的已对多杀菌素产生高抗的家蝇品系中,使用CYP450s抑制剂并未影响该家蝇品系对多杀菌素的抗性水平,表明其抗性与CYP450s无关[7];在1个采自中国的家蝇种群研究中也得到了类似的结果[32];研究发现,采自美国和巴基斯坦的2个家蝇种群,其对多杀菌素的抗性机制属于靶标抗性,而并非代谢抗性[16, 33]。可见,在不同的多杀菌素抗性家蝇种群中,分别有代谢抗性和靶标抗性2种不同的抗性机制。
非特异性酯酶对酯键具有水解能力,而且酯酶还可以通过与杀虫剂的结合而将杀虫剂封存钝化,因此,酯酶参与的解毒代谢也是昆虫对多种杀虫剂产生抗性的机制[23]。目前,还没有酯酶参与多杀菌素抗性机制的研究报道,但在节瓜蓟马Thrips palmi对多杀菌素抗性机制研究中发现,虽然PBO增效试验结果表明,CYP450s参与了节瓜蓟马对多杀菌素的抗性,但由于PBO也可抑制非特异性酯酶,因而研究者认为非特异性酯酶也可能参与了节瓜蓟马对多杀菌素的抗性[21]。因此,对于酯酶在昆虫对多杀菌素抗性中的作用,还需进一步研究。
1.3.2 靶标抗性虽然在一些昆虫中发现了由CYP450s增强介导的多杀菌素代谢抗性,但在西花蓟马、小菜蛾、番茄潜叶蛾及黑腹果蝇Drosophila melanogaster等昆虫中,发现其对多杀菌素的抗性主要是靶标抗性,几乎没有代谢抗性。例如,采自西班牙东南部地区的西花蓟马田间种群,对多杀菌素的抗性已高达13 500倍以上,使用解毒酶抑制剂进行的增效试验结果表明,代谢增强并不是其对多杀菌素的抗性机制[21, 34]。在小菜蛾和一些家蝇种群中,羧酸酯酶抑制剂1,2,4-三丁基三硫磷酸酯 (S,S,S-tributylphosphorotrithioate, DEF) 和CYP450s酶抑制剂PBO,均对多杀菌素没有增效作用,表明羧酸酯酶和CYP450s均没有参与这些昆虫对多杀菌素的抗性[15]。
研究发现,西花蓟马、小菜蛾、黑腹果蝇以及一些家蝇品系对多杀菌素的抗性主要是由靶标抗性导致的,与多杀菌素的作用靶标nAChR α6亚基的突变有关[1, 7, 35]。把黑腹果蝇nAChR的Dα6基因敲除,黑腹果蝇则显示出对多杀菌素的高抗性,表明黑腹果蝇对多杀菌素的抗性与Dα6突变有关[1]。对黑腹果蝇进行化学诱变,产生的多杀菌素抗性等位基因也在α6上发现了突变,同时,化学诱变也使黑腹果蝇获得了对多杀菌素A、多杀菌素D及乙基多杀菌素的抗性,而且与其他杀虫剂之间无交互抗性[36-37]。表明nAChR Dα6亚基是多杀菌素的作用靶标,化学诱变导致的昆虫对多杀菌素的抗性属靶标抗性[36]。
在对多杀菌素产生抗性的黑腹果蝇和桔小实蝇Bactrocera dorsalis中,发现了与多杀菌素抗性有关的由nAChR α6亚基突变所导致的截短转录 (truncated transcripts)[1]。在对多杀菌素抗性的小菜蛾中,也发现了由α6亚基突变所导致的截短的nAChR α6亚基序列[1]。这个α6亚基上的突变导致在第3个跨膜区 (TM3) 之后就产生了终止密码子,最终导致小菜蛾对多杀菌素的抗性。除截短转录相关的抗性机制外,对多杀菌素产生940倍抗性、对乙基多杀菌素产生1 060倍交互抗性的小菜蛾种群,在nAChR α6第4跨膜区 (TM4) 上有3个氨基酸的缺失,也与小菜蛾对多杀菌素的靶标抗性有关[38]。可见,小菜蛾对多杀菌素的靶标抗性也是由多种机制导致的。
在多杀菌素产生抗性的西花蓟马和节瓜蓟马中,发现其抗性与α6亚基上的1个单核苷酸突变有关,该突变导致nAChR在位于跨膜区TM3顶部保守区上275位的甘氨酸 (GGG) 突变为抗性昆虫中的谷氨酸 (GAG),从而导致了对多杀菌素的抗性[1]。在抗多杀菌素的番茄潜叶蛾的nAChR基因序列上,也发现了在编码α6亚基上存在1个基因突变,导致在位于第3个α-螺旋跨膜结构域上出现了1个氨基酸突变G275E。通过在非洲爪蟾Xenopus tropicalis卵母细胞中表达类似的人nAChR α7亚基的A275E突变,发现该突变导致了其对多杀菌素的调节作用不再产生响应,但对其天然配体——乙酰胆碱的激活作用却没有影响,从而验证了该突变具有导致对多杀菌素产生抗性的功能[1]。在采自巴西田间的17个番茄潜叶蛾种群中也存在G275E突变,其突变频率与诊断剂量下的生物测定死亡率具有显著相关性。表明G275E突变是番茄潜叶蛾对多杀菌素产生抗性的重要机制,可被用于田间抗性诊断[1]。但是,在采自智利的1个番茄潜叶蛾种群中,却发现其对多杀菌素的抗性与CYP450s单加氧酶增加有关,而与靶标抗性无关。可见,不同的番茄潜叶蛾种群对多杀菌素具有不同的抗性机制。有研究认为,这与这些种群具有不同的多杀菌素抗性水平有关,其中,对多杀菌素的高水平抗性与nAChR α6亚基的G275E突变有关,而低水平抗性则与代谢增强有关[1]。
在西花蓟马对多杀菌素的抗性机制研究中,除已报道的由nAChR α6亚基的G275E突变所导致的抗性外,还发现了nAChR α6亚基序列Foccα6的截短突变,而且在室内及田间均发现,截短的Foccα6与西花蓟马对多杀菌素的抗性水平成正相关,因而可用此截短的Foccα6的出现频率作为检测田间西花蓟马对多杀菌素产生抗性水平的分子检测工具[19]。
对多杀菌素具有1 068倍抗性倍数的烟青虫Heliothis virescens品系,使用20-O-甲基[14C]标记的多杀菌素A,系统研究了表皮穿透及代谢能力对多杀菌素产生抗性的贡献。结果发现在抗性烟青虫中,表皮穿透以及代谢能力均未发生显著变化,因此认为,穿透变异及代谢改变均不是烟青虫对多杀菌素产生抗性的主要机制。电生理研究发现,抗性烟青虫对多杀菌素A的敏感度显著降低,表明烟青虫对多杀菌素的抗性与靶标不敏感有关[39]。
1.3.3 其他抗性机制虽然一些昆虫对多杀菌素的抗性源于nAChR α6亚基的突变,而另一些昆虫对多杀菌素的抗性源于CYP450s介导的代谢增强,但也有研究表明,有些昆虫对多杀菌素的抗性是上述2种因素共同导致的。如在日本采集的2种节瓜蓟马品系中,虽然发现TPα6亚基的G275E突变导致了其对多杀菌素的抗性,但是使用增效剂PBO进行的增效试验结果也表明,CYP450s与节瓜蓟马对多杀菌素的抗性也有关,代谢抗性也是其对多杀菌素产生抗性的机制之一[21]。
此外,一些昆虫对多杀菌素的抗性是由除靶标抗性和代谢抗性之外的其他因素导致的。虽然nAChR Dɑ6亚基突变是番茄潜叶蛾对多杀菌素产生抗性的重要机制,但是对一些已对多杀菌素产生抗性的番茄潜叶蛾种群,G275E突变并不能完全解释其对多杀菌素产生抗性的原因,同时增效试验结果也表明不存在代谢抗性,表明可能还存在其他抗性机制[1]。因而,针对表皮穿透能力变化以及其他代谢系统对番茄潜叶蛾的多杀菌素抗性的贡献,还需要深入研究明确。对多杀菌素抗性及敏感的橄榄果实蝇的转录组进行比较分析,发现了在nAChR α6亚基上的核苷酸变化,但这不能解释其对多杀菌素产生抗性,而在抗性昆虫中出现的与免疫及能量代谢相关的一些基因表达显著增加,表明能量代谢参与了其对多杀菌素的抗性[25]。
1.3.4 对多杀菌素的抗性与交互抗性交互抗性研究表明,昆虫对多杀菌素的抗性与其对甲氨基阿维菌素苯甲酸盐、茚虫威、氯菊酯和丙溴磷等不同种类、不同作用机制的多种杀虫剂均没有交互抗性[3, 39],并且那些已对其他种类的杀虫剂产生了抗性的昆虫种群,对多杀菌素也没有或仅有极低水平的交互抗性[3]。这也表明昆虫对多杀菌素的抗性与表皮穿透力和代谢抗性等多种杀虫剂共有的抗性机制无关。然而,昆虫对多杀菌素的抗性与具有相同作用机制的乙基多杀菌素具有交互抗性[1],表明昆虫对多杀菌素的抗性机制是靶标位点突变机制。
对均作用于nAChR的多杀菌素与新烟碱类杀虫剂进行交互抗性研究表明,在对新烟碱类杀虫剂具有抗性的黑腹果蝇品系中,对多杀菌素产生了负交互抗性;反之,对多杀菌素具有抗性的黑腹果蝇,对新烟碱类杀虫剂却没有交互抗性[37]。说明虽然新烟碱类杀虫剂和多杀菌素均作用于昆虫的nAChR,但昆虫对新烟碱类杀虫剂的抗性主要是由于Dα1和Dβ2亚基突变引起的,而对多杀菌素的抗性主要是由于Dα6亚基突变导致的,因而新烟碱类杀虫剂与多杀菌素之间没有交互抗性[37]。然而,有研究发现,新烟碱类杀虫剂噻虫嗪和噻虫胺对多杀菌素抗性的西花蓟马具有显著的增效作用,而且西花蓟马对多杀菌素的抗性越高,增效作用越强[40]。说明多杀菌素的作用靶标——烟碱型乙酰胆碱受体 (nAChR) 的改变,不仅导致了其对多杀菌素的抗性,也有可能影响了同样键合于此受体上的其他化合物的敏感度,因此,在多杀菌素与新烟碱类杀虫剂的靶标位点之间,可能会产生一定程度的相互影响作用,而导致微弱的负交互抗性。
基于多杀菌素与多种其他作用机制的杀虫剂之间基本没有交互抗性,因此,可以通过轮用不同作用机制的杀虫剂而有效延缓害虫对多杀菌素的抗性发展。此外,研究发现,家蝇、小菜蛾等昆虫对多杀菌素的抗性是常染色体隐性遗传[38],且不稳定[16, 38],这些对害虫的多杀菌素抗性治理均十分有利。
2 乙基多杀菌素环境降解及抗性机制研究进展 2.1 乙基多杀菌素的开发乙基多杀菌素 (spinetoram) 是以多杀菌素的活性成分spinosyns为原料开发的多杀菌素类杀虫剂[4, 39]。多杀菌素化学结构中的大环内酯四环、福莫胺糖及鼠李糖等部分,均可作为潜在的修饰靶标。为了开发更高效、更广谱及具有更长持效期的多杀菌素衍生物,在研究明确多杀菌素生物合成的中间体及合成路径后,通过使用基因工程技术筛选了可生物合成多种新的多杀菌素类物质的菌株,并通过对发酵获得的多杀菌素进行化学结构的合成修饰等,进行了多杀菌素类新物质的开发。其中,通过筛选菌株获得了多种新的多杀菌素类新物质,如杀虫活性较好的21-丁烯基多杀菌素 (21-butenylspinosyns);此外,通过将聚酮化合物的合成酶路径 (polyketide synthase machinery) 进行基因工程改造,尤其是在发酵培养基中分别加入多种不同的酸作为前体,也获得了多种新的多杀菌素类物质。使用人工神经网络对这些多杀菌素类新物质及其生物活性进行定量-构效关系分析 (quantitative structure-activity relationship, QSAR),发现对多杀菌素中鼠李糖-3′-O-乙基化进行改造,是导致其生物活性提高的主要因素。因此,将鼠李糖-3′-O-乙基化对提高生物活性的关键作用与传统构效分析发现的结果——多杀菌素5,6-双键的氢化对生物活性的增效作用进行组合,最终成功设计研发出了主要成分为3′-O-乙基-5,6-二氢多杀菌素J的乙基多杀菌素[4]。
为了制备乙基多杀菌素,首先需去除多杀菌素A和D中的3′-O-甲基,然后进行鼠李糖-3′-O-乙基化。通过高通量筛选,发现了可以产生鼠李糖-3′-O-脱甲基的多杀菌素J及L的突变菌株。这些突变体在编码相应的3′-O-甲基转移酶的基因spnK上显示了点突变,导致引入终止密码子、错义突变等,从而导致了鼠李糖-3′-O-脱甲基的多杀菌素J和L的产生。进一步通过化学合成获得了鼠李糖-3′-O-乙基化多杀菌素J和L,并在鼠李糖-3′-O-乙基化多杀菌素J上成功完成了5,6-双键的还原,最终合成了乙基多杀菌素J,但由于邻位甲基的位阻作用,阻断了鼠李糖-3′-O-乙基化多杀菌素L的5,6-二氢还原的进行,因此,鼠李糖-3′-O-乙基化多杀菌素L成为乙基多杀菌素的另一个主要成分。通过这些半合成修饰最终获得了乙基多杀菌素,其是由3′-O-乙基-5,6-二氢多杀菌素J(3′-O-ethyl-5,6-dihydro spinosyn J)(XDE-175-J) 与3′-O-乙基多杀菌素L(3′-O-ethyl spinosyn L)(XDE-175-L) 组成的混合物,质量比为3:1(图式2和图式3)[4, 41-42]。可见,在乙基多杀菌素的开发过程中,生物合成路径调控、计算建模和化学合成等方法的联合应用发挥了重要作用。这些结构上的修饰使得乙基多杀菌素比多杀菌素具有更强的杀虫活性、更宽的杀虫谱及更持久的害虫控制能力,同时,还保持了对哺乳动物和环境安全友好的特点。
乙基多杀菌素的杀虫作用机制与多杀菌素相同,也是通过对昆虫神经系统nAChR 和γ-氨基丁酸 (GABA) 受体产生独特的干扰作用而杀死昆虫的[4, 43]。乙基多杀菌素对稻纵卷叶螟Choristoneura rosaceana及缨翅目西花蓟马等多种昆虫具有很长的持效期,而对作物以及对有益昆虫的影响很小[3-4]。乙基多杀菌素具有选择性,已被广泛用于控制多种作物上的鳞翅目、双翅目和蓟马等害虫[44]。
2.2 乙基多杀菌素的环境降解FAO报道了乙基多杀菌素的环境降解行为[45]。乙基多杀菌素在有氧的土壤中降解很快,且XDE-175-L比XDE-175-J降解得快。在25 ℃下,XDE-175-L和XDE-175-J在土壤中降解半衰期分别为13 d和21 d。乙基多杀菌素在土壤中的主要降解产物是N-脱甲基-175-J和N-脱甲基-175-L (图式2和图式3),次要代谢物是N-脱甲基-N-亚硝基-175-J/L和N-琥珀酰基-175-J/L,并且这些代谢物也会很快降解。
光降解是乙基多杀菌素的主要降解途径。虽然在黑暗条件下没有观察到乙基多杀菌素的降解,但对乙基多杀菌素在水中的光降解研究发现,在模拟太阳光的氙灯下,XDE-175-J和XDE-175-L在pH 7、25 ℃的水中会很快降解,其降解半衰期分别是0.5 d和0.3 d,其中N-脱甲基-175-L是XDE-175-L的主要的光解代谢物。
乙基多杀菌素的水解研究表明,XDE-175-J和XDE-175-L在pH 5和pH 7的水中很稳定,不会发生水解;在pH 9的水中,30 d时仅形成了微量的N-脱甲基-175-J和N-脱甲基-175-L,其中乙基多杀菌素XDE-175-L的半衰期是154 d [45]。
通过对乙基多杀菌素在农田环境中的降解研究发现,乙基多杀菌素在稻田水、土壤及稻秆中的半衰期分别为0.35、6.8及1.1 d,表明其在土壤中的降解速率比在稻秆和水中要慢很多[42]。乙基多杀菌素在番茄中的半衰期是2.6 d[46],而在甘蓝和土壤中的半衰期分别是2.83~3.39 d和1.80~2.98 d[47]。与多杀菌素在甘蓝上的半衰期为1.5 d相比,乙基多杀菌素的半衰期较长,表明乙基多杀菌素比多杀菌素具有更长的持效期。此外,乙基多杀菌素在稻秆中的半衰期为1.1 d,比其在甘蓝中的降解快,这可能与水稻的生长较快有关[47]。
由于乙基多杀菌素在植物中除了主要形成N-脱甲基和N-甲酰基化的代谢物 (图式2和图式3) 外,还有3-O-脱乙基-175-J、C9-假酮基-175-J(C9-pseudosglycone-175-J) 和大环内酯的环裂解产物[41, 45]。因此,乙基多杀菌素XDE-175-J和XDE-175-L及其相应的N-脱甲基、N-甲酰基化代谢物的总量,通常被推荐用于乙基多杀菌素的膳食摄入风险评估[41]。Park等建立了高效液相色谱-串联质谱 (HPLC-ESI-MS/MS) 测定乙基多杀菌素 (XDE-175-J和XDE-175-L) 及其代谢物N-脱甲基-175-J/L和N-甲酰基-175-J/L的方法,测定并评估了乙基多杀菌素在苋菜和芹菜中残留量及蔬菜风险[41]。傅强等采用液相色谱-串联质谱 (LC-MS/MS) 技术检测了水稻植株、谷壳和糙米中乙基多杀菌素及其代谢物N-脱甲基-175-J和N-甲酰基-175-J残留[48]。风险评估结果表明,虽然乙基多杀菌素的残效期略长于多杀菌素,但与多杀菌素类似,乙基多杀菌素环境及膳食风险也很低。
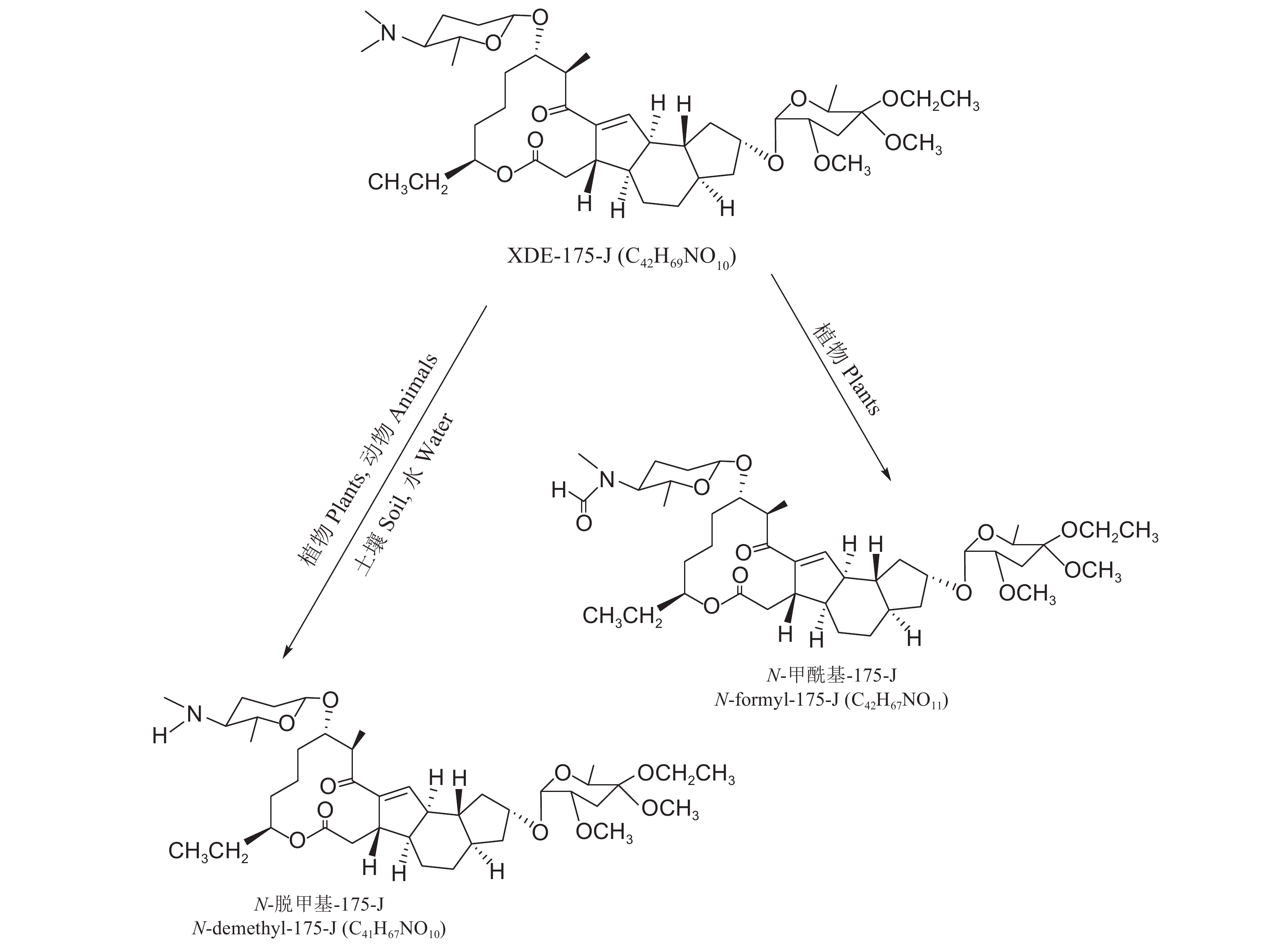
|
图式2 乙基多杀菌素XDE-175-J及其主要代谢物的结构 Scheme2 The structural formula of spinetoram XDE-175-J and its major metabolites |
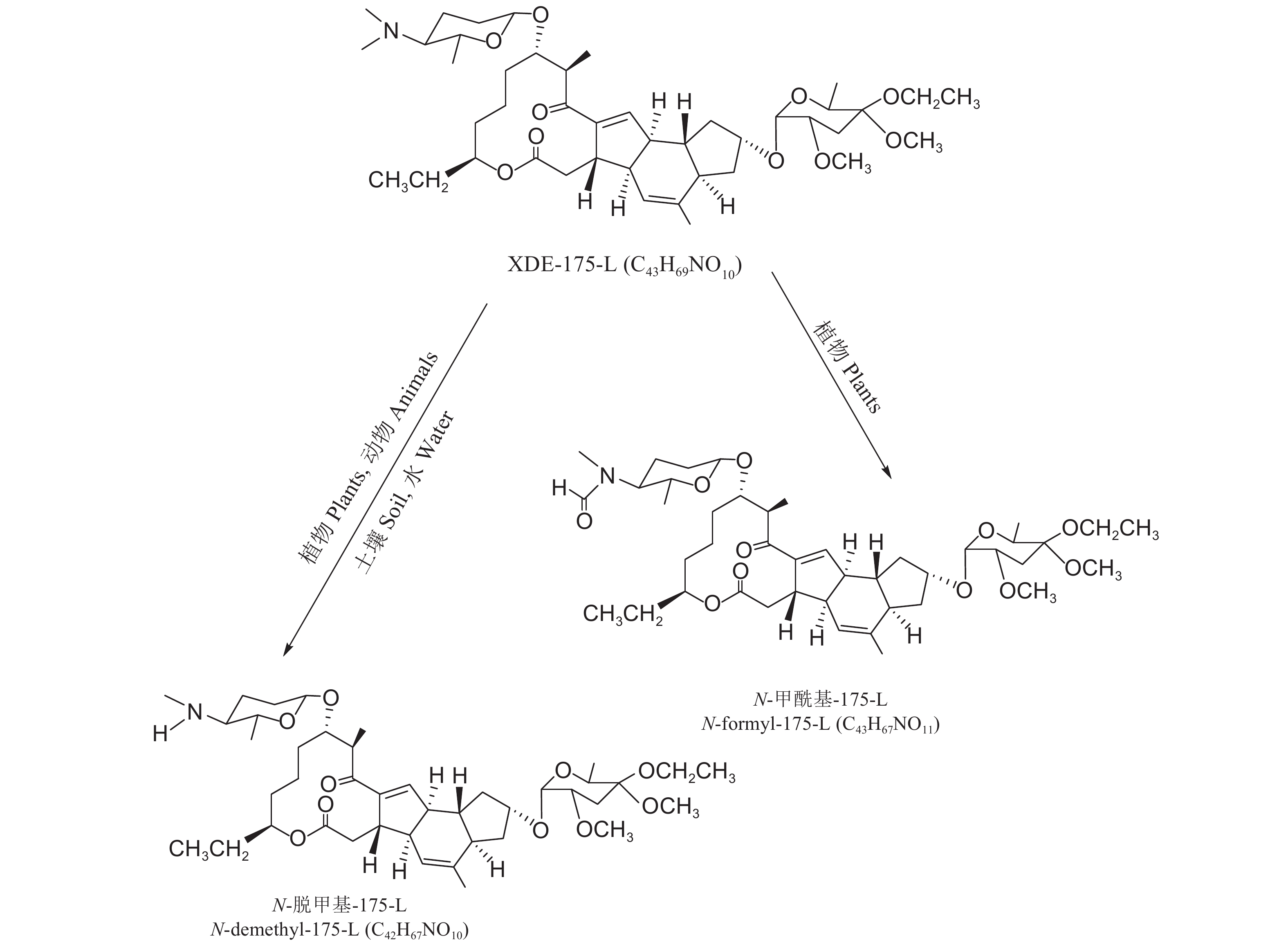
|
图式3 乙基多杀菌素XDE-175-L及其主要代谢物的结构 Scheme3 The structural formula of spinetoram XDE-175-L and its major metabolites |
2.3 乙基多杀菌素的抗性机制
自乙基多杀菌素被广泛应用以来,在室内筛选的和田间采集的多种昆虫,如黑腹果蝇、玫瑰色卷叶蛾Choristoneura rosaceana[43]、小菜蛾[49-50]和西花蓟马[51]等中,均发现其对乙基多杀菌素已产生抗性。
多杀菌素类杀虫剂作为防治蓟马的有效药剂被广泛应用[44]。目前,西花蓟马对多杀菌素类杀虫剂已普遍存在抗性。2015年采自山东寿光的西花蓟马种群对多杀菌素与乙基多杀菌素已分别产生15.64倍和17.29倍的抗性[52-53],而采自北京的西花蓟马田间种群对多杀菌素和乙基多杀菌素已产生了高水平抗性,其中对多杀菌素的抗性倍数达到80~150,对乙基多杀菌素抗性倍数高达7 730[51]。
目前,有关昆虫对乙基多杀菌素产生抗性的机制研究报道还相对较少。已有的研究结果表明,不同的昆虫种群对乙基多杀菌素具有不同的抗性机制。通过室内筛选获得了对乙基多杀菌素具有5倍抗性的玫瑰色卷叶蛾幼虫,发现在此抗性种群中,CYP450s酶活性显著升高,表明CYP450s酶介导了其对乙基多杀菌素的代谢抗性[43]。Yin等通过室内筛选获得了对乙基多杀菌素具有441.18倍抗性的小菜蛾种群,用蛋白组学的方法比较研究了乙基多杀菌素抗性与敏感小菜蛾的差异表达蛋白,发现有5个差异表达的蛋白与抗性相关,表明对乙基多杀菌素的抗性导致了小菜蛾中的蛋白表达差异,为进一步研究明确小菜蛾的乙基多杀菌素抗性机制奠定了基础[49]。尹飞等比较研究了乙基多杀菌素抗性小菜蛾的解毒代谢酶活性,发现谷胱甘肽-S-转移酶、羧酸酯酶和乙酰胆碱酯酶的活性均随小菜蛾对乙基多杀菌素的抗性增强而增强,而多功能氧化酶的活性在抗性种群与敏感种群间差异不显著,表明小菜蛾对乙基多杀菌素的抗性与谷胱甘肽-S-转移酶、羧酸酯酶和乙酰胆碱酯酶的活性变化具有一定关系,而与多功能氧化酶无关[50]。然而,对室内筛选获得的对乙基多杀菌素具有103.56倍抗性的黄胸蓟马Thrips hawaiiensis(Thysanoptera: Thripidae) 种群进行增效试验的结果表明,代谢并不是其对乙基多杀菌素产生抗性的机制[54]。因此,为明确乙基多杀菌素的抗性机制,还需要对多种昆虫的抗性机制进行广泛而深入的研究。
2.4 乙基多杀菌素的交互抗性害虫对多杀菌素与乙基多杀菌素的交互性抗性是广泛存在的。很多研究表明,昆虫对多杀菌素的抗性也导致了其对乙基多杀菌素的交互抗性。反之亦然。一些田间的卷叶蛾种群在对乙基多杀菌素产生低水平抗性的同时,对多杀菌素也产生了交互抗性[43]。Fu等通过室内筛选20代,获得了对乙基多杀菌素具有103.56倍抗性的黄胸蓟马抗性种群,该种群对多杀菌素也产生了7.18倍的交互抗性[54]。可见,多杀菌素与乙基多杀菌素之间的交互抗性是广泛存在的,这与2个化合物具有相同的作用机制,且昆虫对多杀菌素和乙基多杀菌素的抗性机制也主要是靶标抗性有关。交互抗性研究表明,抗乙基多杀菌素的黄胸蓟马种群,除了对多杀菌素产生了中等水平的交互抗性外,对有机磷酸酯类、拟除虫菊酯类、新烟碱类类、阿维菌素、氨基甲酸酯类及双酰胺类等杀虫剂均没有产生交互抗性[54],这对于通过轮用不同作用机制的杀虫剂进行乙基多杀菌素的抗性治理十分有利。
随着乙基多杀菌素的广泛应用,同时鉴于昆虫对乙基多杀菌素和多杀菌素交互抗性的广泛存在,昆虫具有对乙基多杀菌素产生抗性的风险。但也有研究发现,黄胸蓟马抗性种群对乙基多杀菌素的抗性不稳定,并且显示了与抗性相关的适合度代价,加之在多杀菌素类杀虫剂与其他作用机制的杀虫剂之间基本不存在交互抗性[54],这些均对延缓害虫的乙基多杀菌素抗性十分有利。
3 小结与展望多杀菌素类杀虫剂——多杀菌素和乙基多杀菌素兼具生物农药的安全性和化学农药的速效性,作为高效低毒、环境友好的绿色杀虫剂在害虫综合防治中具有很好的应用前景。多杀菌素与乙基多杀菌素均可较快地通过光和土壤微生物降解,因而不会造成环境风险;此外,其在植物中也可较快地代谢降解,因此其膳食残留风险也较低。对多杀菌素及乙基多杀菌素的抗性机制研究表明,不同的昆虫种群分别显示了代谢抗性或靶标抗性2种不同的抗性机制。在乙基多杀菌素开发中,计算建模、生物路径调控及化学合成等多学科和手段的联合应用发挥了重要作用,这为开发其他天然产物衍生物杀虫剂提供了范例。
目前,虽然对于多杀菌素类杀虫剂的环境降解行为已有一些研究,但对其生物代谢及其机制的研究尚不充分。此外,对于多杀菌素的代谢抗性机制的报道也仅限于在抗性昆虫中解毒酶活性的变化及CYP450s基因表达量的变化,对于解毒酶参与的多杀菌素代谢抗性还缺乏体内及体外的代谢研究证据,对代谢抗性的调控机制研究仍是空白。因此,使用现代分离分析手段如LC-MS/MS,结合基因干扰、基因表达等生物学手段,深入研究多杀菌素的代谢抗性机制具有重要意义。对于多杀菌素类杀虫剂,不同的昆虫种群分别显示有代谢抗性或靶标抗性2种不同的抗性机制,对其根本原因尚需要进一步研究明确。
与多杀菌素相比,乙基多杀菌素具有更好的杀虫活性、更广的杀虫谱及更好的环境兼容性,是多杀菌素的良好补充,但鉴于多杀菌素与乙基多杀菌素彼此之间存在交互抗性,需要在抗性治理中避免两者的轮用,以延缓抗药性的发生。
| [1] |
SILVA W M, BERGER M, BASS C, et al. Mutation (G275E) of the nicotinic acetylcholine receptor α6 subunit is associated with high levels of resistance to spinosyns in Tuta absoluta (Meyrick) (Lepidoptera: Gelechiidae)
[J]. Pestic Biochem Physiol, 2016, 131: 1-8. DOI:10.1016/j.pestbp.2016.02.006 |
| [2] |
THOMPSON G D, DUTTON R, SPARKS T C. Spinosad-a case study: an example from a natural products discovery programme[J]. Pest Manag Sci, 2000, 56(8): 696-702. DOI:10.1002/(ISSN)1526-4998 |
| [3] |
SPARKS T C, DRIPPS J E, WATSON G B, et al. Resistance and cross-resistance to the spinosyns : a review and analysis[J]. Pestic Biochem Physiol, 2012, 102(1): 1-10. DOI:10.1016/j.pestbp.2011.11.004 |
| [4] |
GALM U, SPARKS T C. Natural product derived insecticides: discovery and development of spinetoram[J]. J Ind Microbiol Biotechnol, 2016, 43(2-3): 185-193. DOI:10.1007/s10295-015-1710-x |
| [5] |
杜顺堂, 朱明军, 梁世中. 生物农药多杀菌素的研究进展[J]. 农药, 2005, 44(10): 441-444. DU S T, ZHU M J, LIANG S Z. Research progress on the biopesticide spinosad[J]. Chin J Pestic, 2005, 44(10): 441-444. DOI:10.3969/j.issn.1006-0413.2005.10.003 |
| [6] |
华乃震. 绿色环保生物杀虫剂多杀霉素和乙基多杀菌素的述评[J]. 农药, 2015, 54(1): 1-5. HUA N Z. A review of green biological insecticide spinosad and spinetoram[J]. Agrochemicals, 2015, 54(1): 1-5. DOI:10.3969/j.issn.1008-7303.2015.01.01 |
| [7] |
HØJLAND D H, JENSEN K M, KRISTENSEN M. Expression of xenobiotic metabolizing cytochrome P450 genes in a spinosad-resistant Musca domestica L. strain
[J]. PLoS One, 2014, 9(8): e103689. DOI:10.1371/journal.pone.0103689 |
| [8] |
CLEVELAND C B, BORMETT G A, SAUNDERS D G, et al. Environmental fate of spinosad. 1. Dissipation and degradation in aqueous systems[J]. J Agric Food Chem, 2002, 50(11): 3244-3256. DOI:10.1021/jf011663i |
| [9] |
THOMPSON D G, HARRIS B J, LANTEIGNE L J, et al. Fate of spinosad in litter and soils of a mixed conifer stand in the acadian forest region of New Brunswick[J]. J Agric Food Chem, 2002, 50(4): 790-795. DOI:10.1021/jf011319l |
| [10] |
LIU S Z, LI Q X. Photolysis of spinosyns in seawater, stream water and various aqueous solutions[J]. Chemosphere, 2004, 56(11): 1121-1127. DOI:10.1016/j.chemosphere.2004.04.055 |
| [11] |
THOMPSON D G, HARRIS B J, BUSCARINI T M, et al. Fate of spinosad in litter and soils of a white spruce plantation in central Ontario[J]. Pest Manag Sci, 2002, 58(4): 397-404. DOI:10.1002/(ISSN)1526-4998 |
| [12] |
WEST S D. Determination of the naturally derived insect control agent spinosad and its metabolites in soil, sediment, and water by HPLC with UV detection[J]. J Agric Food Chem, 1997, 45(8): 3107-3113. DOI:10.1021/jf9701648 |
| [13] |
SÁNTIS E L, HERNÁNDEZ L A, MARTÍNEZ A M, et al. Long-term foliar persistence and efficacy of spinosad against beet armyworm under greenhouse conditions[J]. Pest Manag Sci, 2012, 68(6): 914-921. DOI:10.1002/ps.v68.6 |
| [14] |
WANG D, QIU X H, REN X X, et al. Effects of spinosad on Helicoverpa armigera (Lepidoptera: Noctuidae) from China: tolerance status, synergism and enzymatic responses
[J]. Pest Manag Sci, 2009, 65(9): 1040-1046. DOI:10.1002/ps.v65:9 |
| [15] |
ZHAO J Z, LI Y X, COLLINS H L, et al. Monitoring and characterization of diamondback moth (Lepidoptera: Plutellidae) resistance to spinosad[J]. J Econ Entomol, 2002, 95(2): 430-436. DOI:10.1603/0022-0493-95.2.430 |
| [16] |
SHONO T, SCOTT J G. Spinosad resistance in the housefly, Musca domestica, is due to a recessive factor on autosome 1
[J]. Pestic Biochem Physiol, 2003, 75(1-2): 1-7. DOI:10.1016/S0048-3575(03)00011-7 |
| [17] |
KAKANI E G, ZYGOURIDIS N E, TSOUMANI K T, et al. Spinosad resistance development in wild olive fruit fly Bactrocera oleae (Diptera: Tephritidae) populations in California
[J]. Pest Manag Sci, 2010, 66(4): 447-453. |
| [18] |
LOUGHNER R L, WARNOCK D F, CLOYD R A. Resistance of greenhouse, laboratory, and native populations of western flower thrips to spinosad[J]. HortScience, 2005, 40(1): 146-149. |
| [19] |
WAN Y R, YUAN G D, HE B Q, et al. Foccα6, a truncated nAChR subunit, positively correlates with spinosad resistance in the western flower thrips, Frankliniella occidentalis (Pergande)
[J]. Insect Biochem Mol Biol, 2018, 99: 1-10. DOI:10.1016/j.ibmb.2018.05.002 |
| [20] |
LIU S S, LI Z M, LIU Y Q, et al. Promoting selection of resistance to spinosad in the parasitoid Cotesia plutellae by integrating resistance of hosts to the insecticide into the selection process
[J]. Biol Control, 2007, 41(2): 246-255. DOI:10.1016/j.biocontrol.2007.01.013 |
| [21] |
BAO W X, NARAI Y, NAKANO A, et al. Spinosad resistance of melon thrips, Thrips palmi, is conferred by G275E mutation in α6 subunit of nicotinic acetylcholine receptor and cytochrome P450 detoxification
[J]. Pestic Biochem Physiol, 2014, 112: 51-55. DOI:10.1016/j.pestbp.2014.04.013 |
| [22] |
CHEN C Y, HAN P, YAN W Y, et al. Uptake of quercetin reduces larval sensitivity to lambda-cyhalothrin in Helicoverpa armigera
[J]. J Pest Sci, 2017, 91(2): 919-926. |
| [23] |
陈澄宇, 史雪岩, 高希武. 昆虫对拟除虫菊酯类杀虫剂的代谢抗性机制研究进展[J]. 农药学学报, 2016, 18(5): 545-555. CHEN C Y, SHI X Y, GAO X W. Mechanism of insect metabolic resistance to pyrethroid insecticides[J]. Chin J Pestic Sci, 2016, 18(5): 545-555. |
| [24] |
范银君, 史雪岩, 高希武. 新烟碱类杀虫剂吡虫啉和噻虫嗪的代谢研究进展[J]. 农药学学报, 2012, 14(6): 587-596. FAN Y J, SHI X Y, GAO X W. Research progresses on the metabolism of neonicotinoids imidacloprid and thiamethoxam[J]. Chin J Pestic Sci, 2012, 14(6): 587-596. DOI:10.3969/j.issn.1008-7303.2012.06.01 |
| [25] |
SAGRI E, RECZKO M, GREGORIOU M E, et al. Olive fly transcriptomics analysis implicates energy metabolism genes in spinosad resistance[J]. BMC Genomics, 2014, 15: 714. DOI:10.1186/1471-2164-15-714 |
| [26] |
WANG W, MO J C, CHENG J A, et al. Selection and characterization of spinosad resistance in Spodoptera exigua (Hübner) (Lepidoptera: Noctuidae)
[J]. Pestic Biochem Physiol, 2006, 84(3): 180-187. DOI:10.1016/j.pestbp.2005.07.002 |
| [27] |
WANG D, QIU X H, REN X X, et al. Resistance selection and biochemical characterization of spinosad resistance in Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae)
[J]. Pestic Biochem Physiol, 2009, 95(2): 90-94. DOI:10.1016/j.pestbp.2009.07.003 |
| [28] |
REHAN A, FREED S. Selection, mechanism, cross resistance and stability of spinosad resistance in Spodoptera litura (Fabricius) (Lepidoptera: Noctuidae)
[J]. Crop Prot, 2014, 56: 10-15. DOI:10.1016/j.cropro.2013.10.013 |
| [29] |
REYES M, ROCHA K, ALARCÓN L, et al. Metabolic mechanisms involved in the resistance of field populations of Tuta absoluta (Meyrick) (Lepidoptera: Gelechiidae) to spinosad
[J]. Pestic Biochem Physiol, 2012, 102(1): 45-50. DOI:10.1016/j.pestbp.2011.10.008 |
| [30] |
MARKUSSEN M D K, KRISTENSEN M. Spinosad resistance in female Musca domestica L. from a field-derived population
[J]. Pest Manag Sci, 2012, 68(1): 75-82. DOI:10.1002/ps.v68.1 |
| [31] |
HØJLAND D H, SCOTT J G, JENSEN K M V, et al. Autosomal male determination in a spinosad-resistant housefly strain from Denmark[J]. Pest Manag Sci, 2014, 70(7): 1114-1117. DOI:10.1002/ps.2014.70.issue-7 |
| [32] |
SHI J, ZHANG L, GAO X W. Characterisation of spinosad resistance in the housefly Musca domestica (Diptera: Muscidae)
[J]. Pest Manag Sci, 2011, 67(3): 335-340. DOI:10.1002/ps.v67.3 |
| [33] |
KHAN H A A, AKRAM W, SHAD S A. Genetics, cross-resistance and mechanism of resistance to spinosad in a field strain of Musca domestica L. (Diptera: Muscidae)
[J]. Acta Tropica, 2014, 130: 148-154. DOI:10.1016/j.actatropica.2013.11.006 |
| [34] |
BIELZA P, QUINTO V, CONTRERAS J, et al. Resistance to spinosad in the western flower thrips, Frankliniella occidentalis (Pergande), in greenhouses of south-eastern Spain
[J]. Pest Manag Sci, 2007, 63(7): 682-687. DOI:10.1002/(ISSN)1526-4998 |
| [35] |
ZHANG S Y, KONO S, MURAI T, et al. Mechanisms of resistance to spinosad in the western flower thrip, Frankliniella occidentalis (Pergande) (Thysanoptera: Thripidae)
[J]. Insect Sci, 2008, 15(2): 125-132. DOI:10.1111/j.1744-7917.2008.00192.x |
| [36] |
WATSON G B, CHOUINARD S W, COOK K R, et al. A spinosyn-sensitive Drosophila melanogaster nicotinic acetylcholine receptor identified through chemically induced target site resistance, resistance gene identification, and heterologous expression
[J]. Insect Biochem Mol Biol, 2010, 40(5): 376-384. DOI:10.1016/j.ibmb.2009.11.004 |
| [37] |
PERRY T, CHAN J Q, BATTERHAM P, et al. Effects of mutations in Drosophila nicotinic acetylcholine receptor subunits on sensitivity to insecticides targeting nicotinic acetylcholine receptors
[J]. Pestic Biochem Physiol, 2012, 102(1): 56-60. DOI:10.1016/j.pestbp.2011.10.010 |
| [38] |
WANG J, WANG X L, LANSDELL S J, et al. A three amino acid deletion in the transmembrane domain of the nicotinic acetylcholine receptor α6 subunit confers high-level resistance to spinosad in Plutella xylostella
[J]. Insect Biochem Mol Biol, 2016, 71: 29-36. DOI:10.1016/j.ibmb.2016.02.001 |
| [39] |
ROE R M, YOUNG H P, IWASA T, et al. Mechanism of resistance to spinosyn in the tobacco budworm, Heliothis virescens
[J]. Pestic Biochem Physiol, 2010, 96(1): 8-13. DOI:10.1016/j.pestbp.2009.08.009 |
| [40] |
GUILLÉN J, BIELZA P. Thiamethoxam acts as a target-site synergist of spinosad in resistant strains of Frankliniella occidentalis
[J]. Pest Manag Sci, 2013, 69(2): 188-194. DOI:10.1002/ps.2013.69.issue-2 |
| [41] |
PARK K H, CHOI J H, ABD EL-ATY A M, et al. Determination of spinetoram and its metabolites in amaranth and parsley using QuEChERS-based extraction and liquid chromatography-tandem mass spectrometry[J]. Food Chem, 2012, 134(4): 2552-2559. DOI:10.1016/j.foodchem.2012.04.066 |
| [42] |
ZHAO L, CHEN G, ZHAO J, et al. Degradation kinetics of the insecticide spinetoram in a rice field ecosystem[J]. Chemosphere, 2015, 119: 1185-1191. DOI:10.1016/j.chemosphere.2014.10.026 |
| [43] |
SIAL A A, BRUNNER J F, GARCZYNSKI S F. Biochemical characterization of chlorantraniliprole and spinetoram resistance in laboratory-selected obliquebanded leafroller, Choristoneura rosaceana (Harris) (Lepidoptera: Tortricidae)
[J]. Pestic Biochem Physiol, 2011, 99(3): 274-279. DOI:10.1016/j.pestbp.2011.01.006 |
| [44] |
MOUDEN S, SARMIENTO K F, KLINKHAMER P G L, et al. Integrated pest management in western flower thrips: past, present and future[J]. Pest Manag Sci, 2017, 73(5): 813-822. DOI:10.1002/ps.2017.73.issue-5 |
| [45] |
FAO. Spinetoram (233)[EB/OL]. [2018-04-01]. http://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/JMPR/Evaluation08/Spinetoram.pdf.
|
| [46] |
MALHAT F M. Simultaneous determination of spinetoram residues in tomato by high performance liquid chromatography combined with QuEChERS method[J]. Bull Environ Contam Toxicol, 2013, 90(2): 222-226. DOI:10.1007/s00128-012-0885-3 |
| [47] |
赵瑶瑶, 秦旭, 秦冬梅, 等. XDE-175及其代谢物在甘蓝和土壤中的残留动态研究[J]. 农业环境科学学报, 2009, 28(5): 1032-1036. ZHAO Y Y, QIN X, QIN D M, et al. Residue dynamics of XDE-175 and its metabolites in cabbage and soil[J]. J Agro-Environ Sci, 2009, 28(5): 1032-1036. DOI:10.3321/j.issn:1672-2043.2009.05.030 |
| [48] |
傅强, 黄颖婕, 付启明, 等. 液相色谱-串联质谱同时检测水稻样品中乙基多杀菌素及其代谢物残留[J]. 农药学学报, 2017, 19(5): 631-637. FU Q, HUANG Y J, FU Q M, et al. Simultaneous determination of spinetoram and its metabolites in rice using liquid chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2017, 19(5): 631-637. |
| [49] |
YIN F, LIN Q S, FENG X, et al. Analysis of differentially expressed proteins between the spinetoram-susceptible and -resistant strains of Plutella xylostella (L.)
[J]. J Asia-Pac Entomol, 2017, 20(1): 119-124. DOI:10.1016/j.aspen.2016.11.003 |
| [50] |
尹飞, 陈焕瑜, 冯夏, 等. 乙基多杀菌素抗性小菜蛾代谢解毒酶酶活性研究[J]. 应用昆虫学报, 2016, 53(2): 314-319. YIN F, CHEN H Y, FENG X, et al. The role of detoxifying enzymes in the resistance of Plutella xylostella to spinetoram [J]. Chin J Appl Entomol, 2016, 53(2): 314-319. |
| [51] |
万岩然, 何秉青, 苑广迪, 等. 北京和云南地区西花蓟马对多杀菌素类药剂产生抗药性[J]. 应用昆虫学报, 2016, 53(2): 396-402. WAN Y R, HE B Q, YUAN G D, et al. Development of resistance to spinosyns in populations of western flower thrips in Beijing and Yunnan[J]. Chin J Appl Entomol, 2016, 53(2): 396-402. |
| [52] |
WANG Z H, GONG Y J, JIN G H, et al. Field-evolved resistance to insecticides in the invasive western flower thrips Frankliniella occidentalis (Pergande) (Thysanoptera: Thripidae) in China
[J]. Pest Manag Sci, 2016, 72(7): 1440-1444. DOI:10.1002/ps.2016.72.issue-7 |
| [53] |
LI D G, SHANG X Y, REITZ S, et al. Field resistance to spinosad in western flower thrips Frankliniella occidentalis (Thysanoptera: Thripidae)
[J]. J Integr Agric, 2016, 15(12): 2803-2808. DOI:10.1016/S2095-3119(16)61478-8 |
| [54] |
FU B L, LI Q, QIU H Y, et al. Resistance development, stability, cross-resistance potential, biological fitness and biochemical mechanisms of spinetoram resistance in Thrips hawaiiensis (Thysanoptera: Thripidae)
[J]. Pest Manag Sci, 2018, 74(7): 1564-1574. DOI:10.1002/ps.2018.74.issue-7 |
 2018, Vol. 20
2018, Vol. 20

