2. 中国农业大学 理学院,北京 100193
2. College of Science, China Agricultural University, Beijing 100193, China
细胞器线粒体起源于原核生物,同时也广泛存在于真核细胞中。线粒体的呼吸链位于线粒体内膜上,由4个分子质量很大的跨膜蛋白复合体 (I~IV) 组成,是真核细胞进行呼吸作用、产生主要能量的场所[1]。复合物II又叫琥珀酸脱氢酶 (SDH) 或琥珀酸-泛醌氧化还原酶 (SQR),是三羧酸循环中的关键膜复合物,其可与琥珀酸和延胡索酸相互转化中转移的电子进行偶联,进而将电子直接转移到醌库[1]。基于复合物II的呼吸系统抑制剂被广泛用于世界范围内的真菌病害,该类抑制剂通过与复合物II的泛醌还原位点结合而抑制真菌的呼吸,作用方式独特,与其他类别的杀菌剂如苯并咪唑类、strobilurins类、氨基吡啶类均无交互抗性,因此成为改善杀菌剂抗性和提高病害控制的优秀候选品种[2]。国际杀菌剂抗性行动委员会 (Fungicide Resistance Action Committee,FRAC)[3]将通过抑制复合物II的活性而破坏三羧酸循环的抑制剂归为琥珀酸脱氢酶抑制剂 (succinate dehydrogenase inhibitor,SDHIs),也就是复合物II抑制剂。目前已经开发出20多个品种,全球销售额接近20亿美元,且逐年持续增长[4]。因此该类杀菌剂也成为新型高效杀菌剂发展热点方向之一。本文拟对以复合物II为靶标的抑制剂结构类型和作用机制进行综述,并对该类抑制剂的最新研究进展做简要介绍。
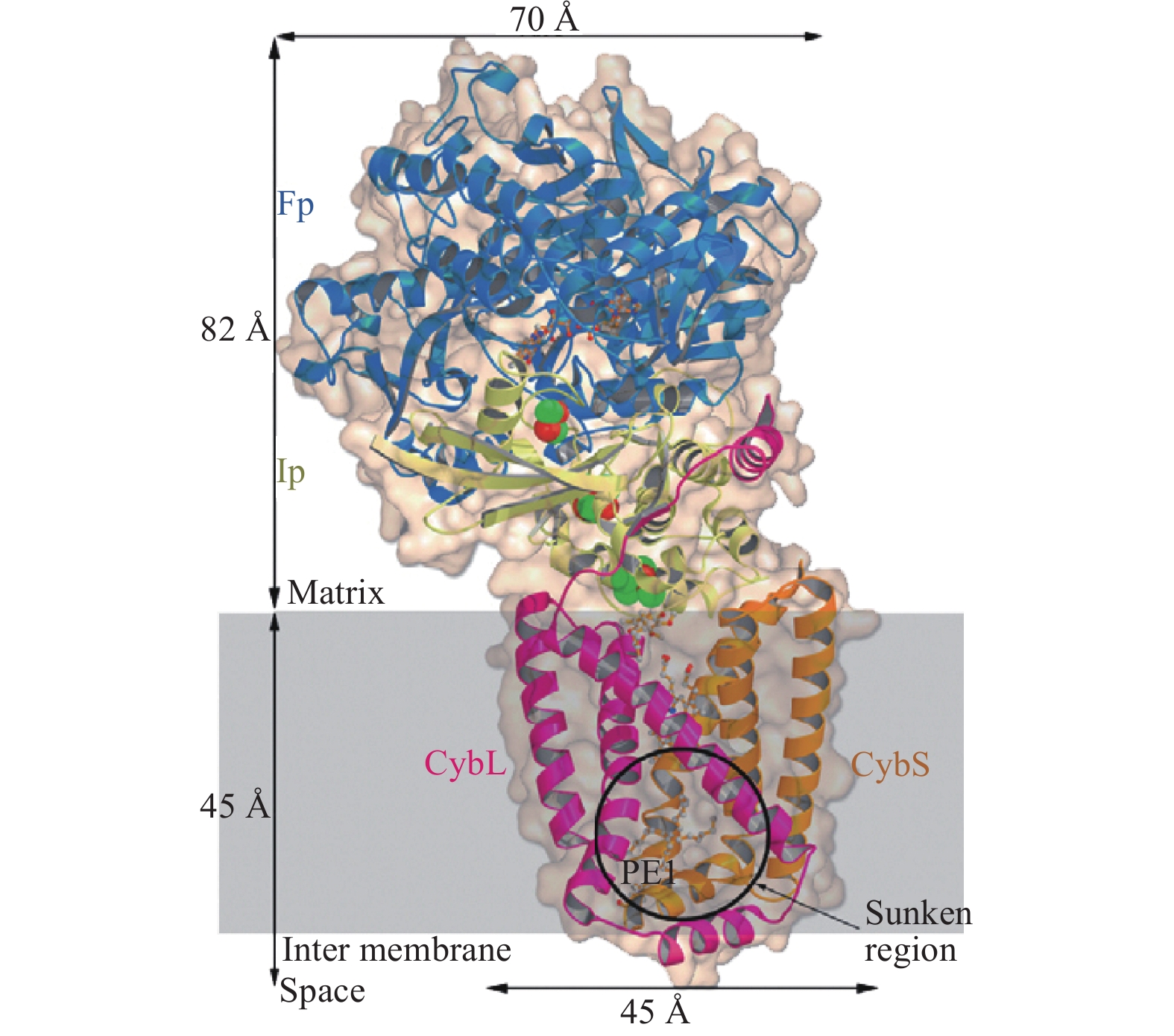
1 复合物II的结构和功能 1.1 复合物II的结构目前已经从大肠杆菌[5]、猪心[6]和鸡心[7]里分离纯化得到复合物II晶体,并通过X-衍射得到了高分辨率的结构。复合物II蛋白的外形酷似一个小写字母“q”,主要是由一个水溶性的具有催化活性的异二聚体头和一个完整的膜区域组成的尾构成[6],如图1所示。
该蛋白单体由4条氨基酸链组成,分别是黄素蛋白 (flavoprotein (Fp),SDH A)、铁硫簇蛋白 (Iron-sulfur protein (Ip),SDH B,包括[2Fe-2S]、[4Fe-4S]和[3Fe-4S])、膜锚定蛋白SDH C (CybL) 及膜锚定蛋白SDH D (CybS),其中SDH A与SDH B组成了水溶性的异二聚体。黄素蛋白和铁硫簇蛋白亚基的主要基因序列源自共同的祖先基因,二者高度同源并共同作用表现出复合物II的蛋白活性。SDH C (CybL) 和SDH D (CybS) 各由3个疏水的跨膜螺旋组成,将整个复合物锚定在线粒体内膜上[6]。
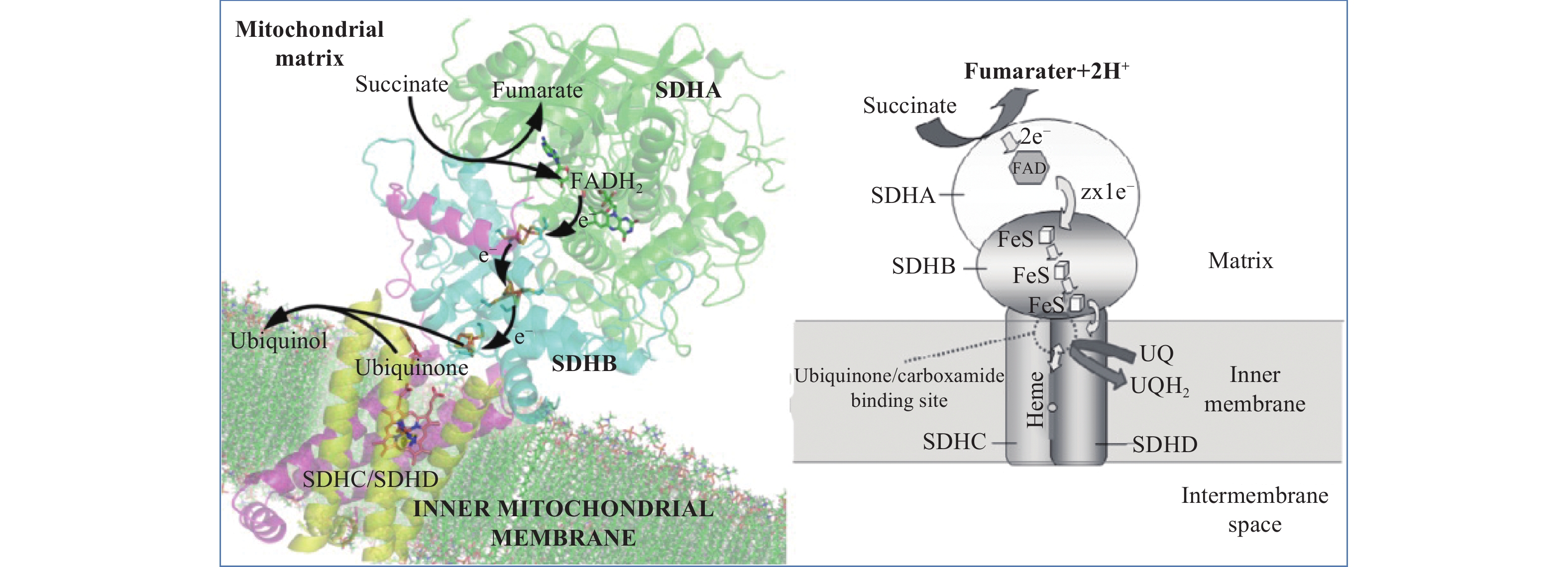
1.2 复合物II的功能电子在复合物II中的传递途径如图2所示。SDH A内含有辅酶因子黄素腺嘌呤二核苷酸 (flavin adenine dinucleotide,FAD),其作用是催化琥珀酸 (succinate) 被氧化成富马酸 (fumarate)[8-9]。
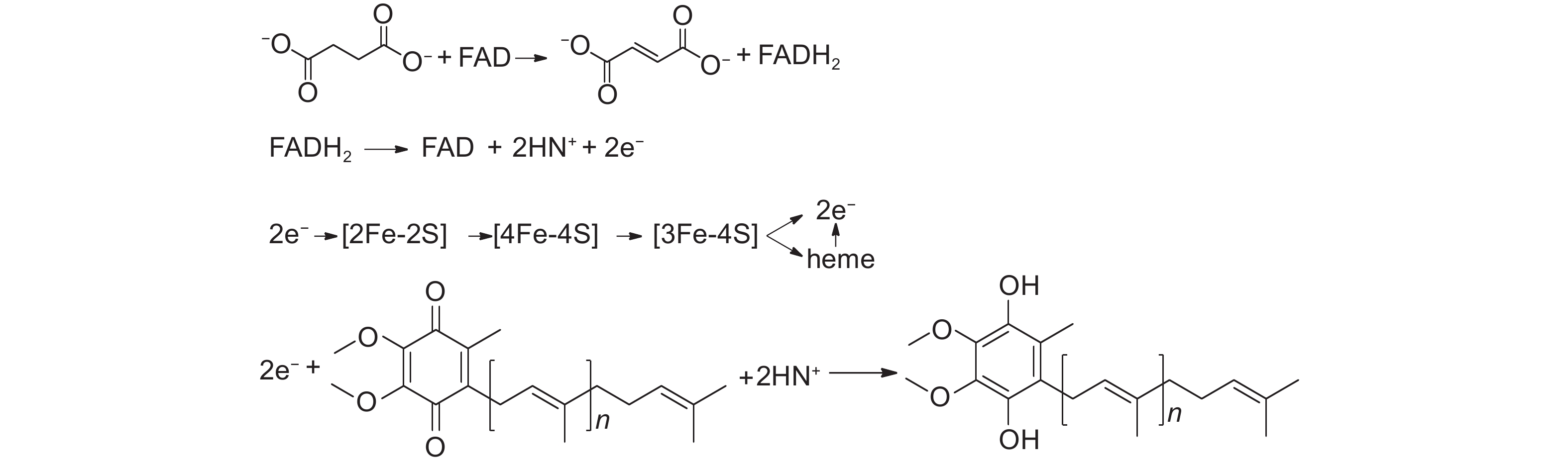
铁硫簇蛋白SDH B负责将电子从还原态的FAD琥珀酸传递至泛醌,携带血红素b的膜锚定蛋白SDH C和SDH D在电子向泛醌传递的过程中起着重要作用[10]。泛醌结合位点Qp的疏水口袋由亚基B、C和D的氨基酸残基形成,是一个高度保守的生物体范围[11],在此位点醌被还原为氢醌。电子传递经由[2Fe-2S]、[4Fe-4S]和[3Fe-4S],在[3Fe-4S]处产生分支,直接传递给泛醌或经由血红素b后再传递给泛醌。由于[3Fe-4S]簇距泛醌和血红素b的距离分别为0.76和1.14 nm,同时泛醌的氧化还原电位高于血红素b,因此,电子可优先直接传递给泛醌[12],传递方程式见图式1。
发生在泛醌结合位点 (Q点) 的泛醌的还原是一个复杂过程,目前已发现的复合物II类杀菌剂都是其与Q点结合的。杀菌剂抑制了生物体内电子与泛醌的结合,从而抑制了线粒体呼吸。因此解析Q点结构、研究泛醌还原机制以及新功能分子的设计尤为关键。研究人员已运用生物化学、诱变、抑制剂结合、电子顺磁共振及傅里叶变换红外光谱等多种手段来解析Q点结构。
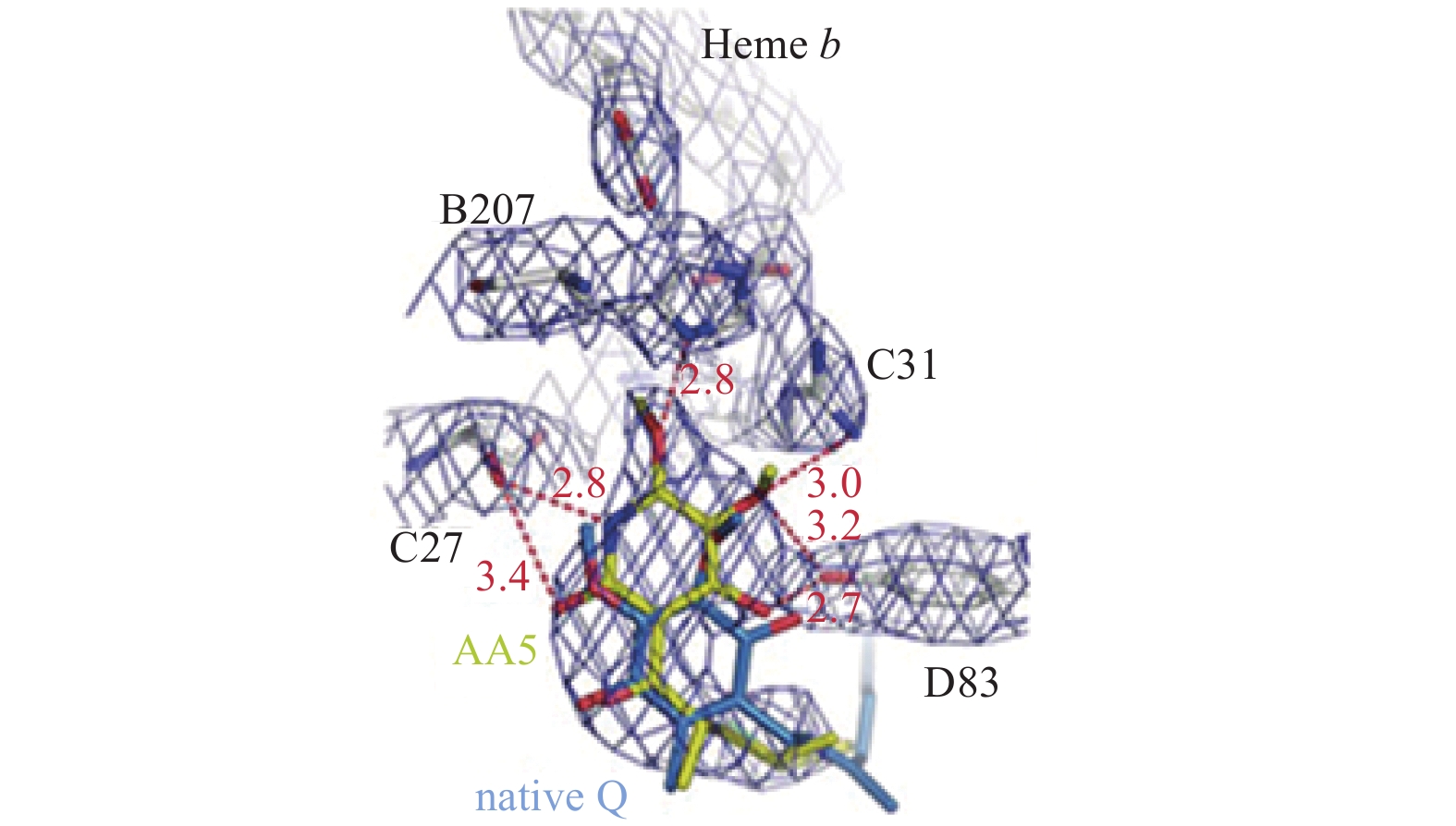
在复合物II的X-衍射晶体结构被解析出来前,复合物II与泛醌的结合是通过电子顺磁共振手段证实的[13-14]。1999年,Iverson等[15]通过大肠杆菌QFR与甲基萘醌的共结晶试验,证实了甲基萘醌是结合在QFR的Frd C和Frd D两个跨膜区的周边。多点突变证实,大肠杆菌及其同源模式物种中的QFR可能存在2个醌结合位点[16]。2003年,Yankovskaya等[5]发现,泛醌结合在复合物II的SDH B、SDH C和SDH D残基组成的裂口中,紧邻[3Fe-4S]簇 (图3),泛醌的O1原子直接与复合物II的侧链Tyr D83和Trp B164产生共价作用,Tyr D83与Arg C31形成1个氢键。
2 复合物II抑制剂及作用机理 2.1 取代丙酸及其类似物
Scallet等[17]发现,3-硝基丙酸与复合物II通过共价和不可逆地结合可使其活性位点失活。Saad等[18]研究发现,甲基丙二酸和丙氨酸均可以作为复合物II抑制剂。Valenti等[19]发现,3-溴丙酮酸 (3-BP) 除了具有抗肿瘤作用外,还对真菌线粒体呼吸链复合物I~V均有抑制作用。
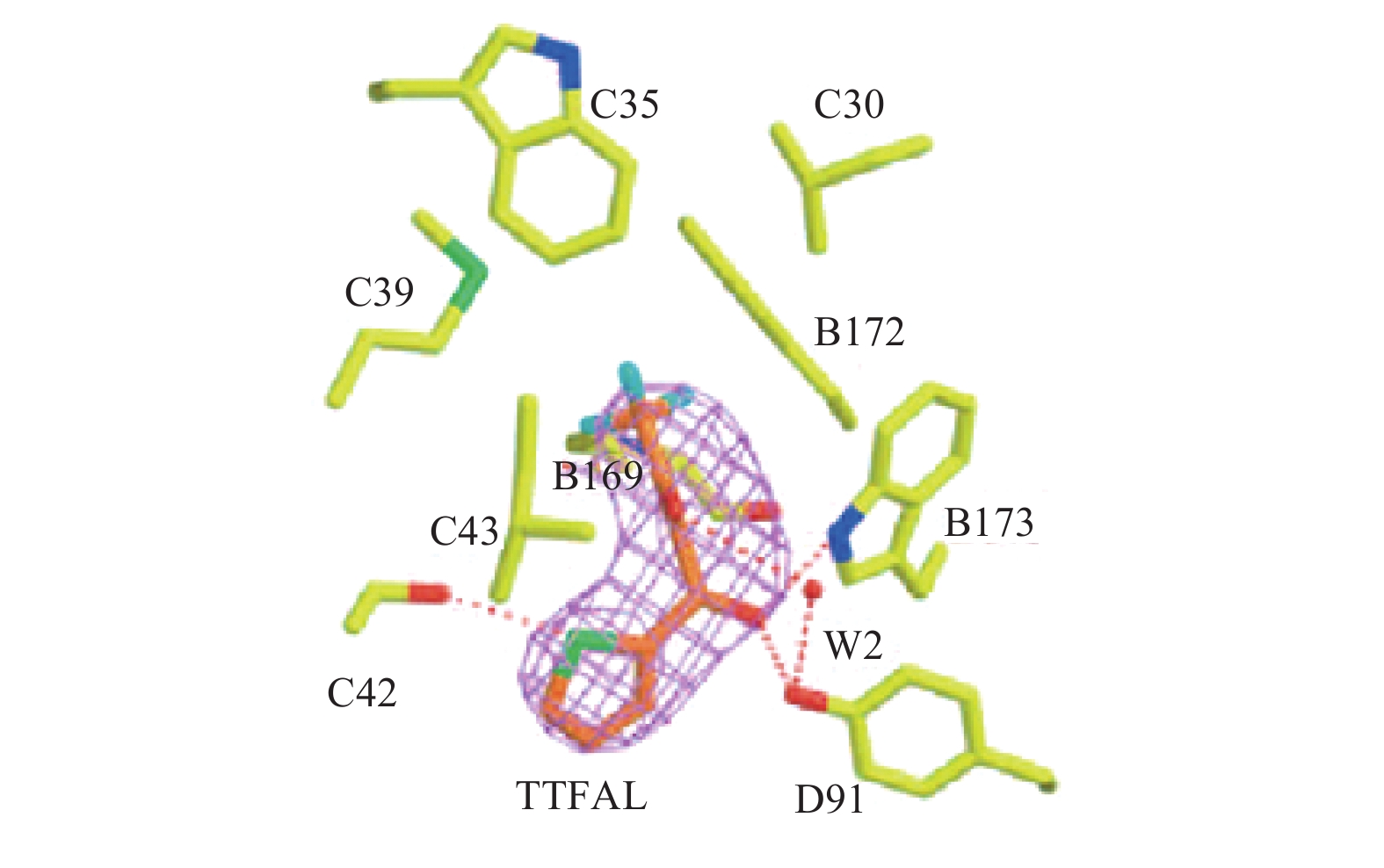
2.2 2-噻吩甲酰基三氟丙酮 (TTFA)Sun等[6]解析了2-噻吩甲酰三氟丙酮 (TTFA) 与猪心的复合物II的共结晶物 (图4),发现噻吩甲酰基中的氧原子与复合物II中的Trp-B173和Tyr-D91的侧链形成了2个氢键,另一个氧原子经由水分子 (W2) 与Tyr-D91形成了氢键。
2.3 泛醇类似物
泛醇类似物Atpenins是从土壤中分离出的青霉菌经发酵得到的对丝状真菌,尤其对廯菌属具有很好活性的化合物,分别命名为Atpenin B (1)、Atpenin A4 (2) 和Atpenin A5 (3)[20]。
Atpenins对哺乳动物和真菌的复合物II具有高度的抑制活性,但对农业领域几种重要的病原菌仅表现出一定的体内抑制活性,对复合物I和III也有微弱的抑制活性[20]。2006年,Horsefield等[21]制备了大肠杆菌的复合物II与Atpenin A5的晶体 (图5),解析结果表明,与泛醌一样,Atpenin A5也是结合在复合物II的疏水残基构成的裂口处,不同的是,其结合在Q点的更深处。
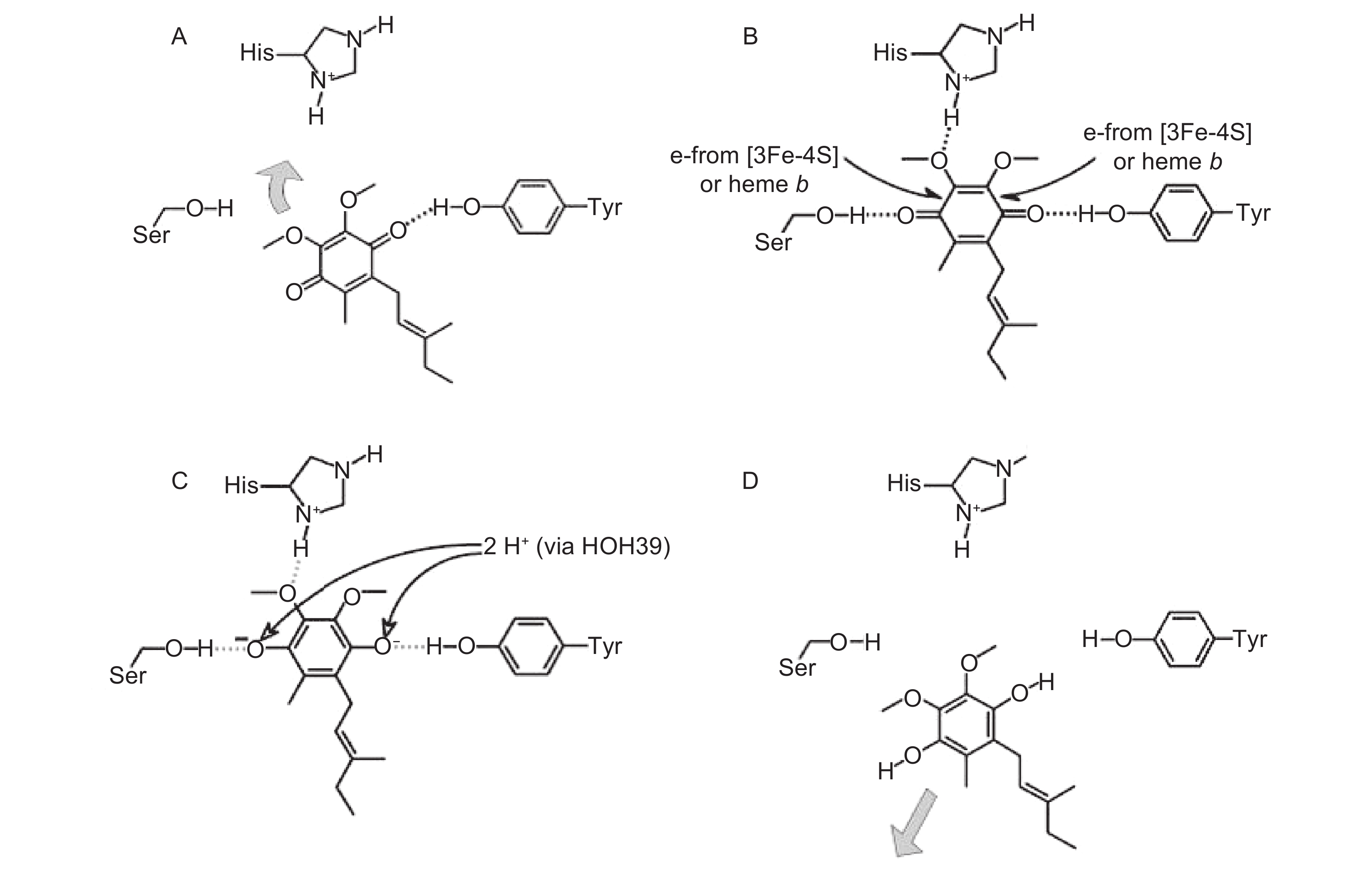
Horsefield等[21]还提出了泛醌在大肠杆菌中复合物II Q点的还原反应机制 (图6)。在催化还原反应之前,泛醌与Q点入口处即Q1位点相结合 (图6A),因此醌的结合不是限速步骤,泛醌羰基O1原子与复合物II的Tyr D83和Trp B164以氢键相结合,然后琥珀酸氧化产生的电子诱导泛醌移动到Q2位点 (图6B),此时泛醌羰基O4原子与Ser-C27,泛醌甲氧基O3原子与His-B207分别形成了氢键,这些氢键增加了泛醌结合的稳定性。His-B207侧链的空间结构可能是由[3Fe-4S]的氧化还原电势决定的,并最终诱导泛醌与Q2位点结合。当Q2位点被泛醌占据后,His-B207中的N原子向醌中的甲氧基靠近。His-B207上的电荷可能促进了Ser-C27与泛醌的另一个反应中心羰基氧之间形成氢键,这说明His-B207在电子从复合物II的[3Fe-4S]或从血红素b传递到醌的过程中可能具有“门控”作用。受半醌自由基寿命的限制,第2个电子几乎同时也沿着同样的路径完成传递;接着泛醌被双质子化 (图6C),质子化后,泛醌与Tyr D83、Ser-C27和His-B207之间的氢键断开,被彻底还原的泛醌随后离开Q位点。
鉴于对复合物II生物靶标的高度兴趣,人们试图开发一系列Atpenin类似物,以提高其生物活性,尤其是对真菌酶的活性。2010年,Selby等[22]合成了一系列Atpenin类似物,并研究了其对哺乳动物牛心脏和真菌小麦颖枯病菌Septoria nodorumBerk.的抑制活性,发现化合物4具有比Atpenin A5更高的活性。2017年,Wang等[23]制备了16个Atpenin A5类似物,以评估吡啶环上侧链种类和长度对其生物活性的影响。酶活性测试结果表明,酮羰基和亲脂性的长碳链是其具有抑制活性的重要结构特征,其中化合物5对复合物II的IC50值为3.3 nmol/L。这些化合物在常氧和缺氧条件下,在多种人类前列腺癌细胞系中都具有有效的选择性抗增殖活性,可起抑制线粒体电子传递的作用。
Ito等[24]发现:对羟基苯甲酸烷基酯 (6和7) 除了可用作化妆品、食品和药品中的抗菌防腐剂外,还对植物病原真菌有抑制作用,且其抑菌活性与烷基链长短有关;其抗真菌活性来源于其对线粒体复合物II的抑制作用。
2.4 酰胺类化合物人们对于复合物II抑制剂的作用机制研究已有几十年的历史。最初研究发现,萎锈灵和氧化萎锈灵是通过阻断真菌线粒体内复合物II电子从[3Fe-4S]转移到泛醌,从而抑制其呼吸[25]。光标试验证实,萎锈灵和氧化萎锈灵可与复合物II的SDH C和SDH D结合,因此推测复合物II可能是其作用靶标[25]。近年来,关于复合物II抑制剂作用靶表标的研究,主要是采用共结晶和docking技术。2006年,Huang等[7]培养出萎锈灵与鸡心复合物II的共结晶晶体,对晶体结构进行解析后发现,萎锈灵的羰基氧可与SDH D的Tyr58和SDHB的Trp173形成氢键。Horsefield等[21]进而提出了萎锈灵抑制复合物II的理论模型。2011年,Glättli等[26]做了基于复合物II抑制剂结构相似性的分析和docking试验,提出不同的复合物II抑制剂具有相同的结合模式,它们都是通过中心的酰胺分子与高度保守的SDH B和SDH C形成氢键,结合位点都较醌的深一些,羧酸堆积区都直接与活性口袋附近的组氨酸相互作用。Fraaije等[27]和Scalliet等[28]完成了常见复合物II抑制剂对小麦病原菌Mycosphaerella graminicola的对接试验 (图7)。结果表明,萎锈灵所处的位置与Huang等[7]所得的晶体结果一致,并且不同的抑制剂均以类似的结合方式与复合物II相作用。

|
图 7 萎锈灵 (A)、联苯吡菌胺 (B)、啶酰菌胺 (C)、吡唑萘菌胺 (D)、吡噻菌胺 (E) 和氟吡菌胺 (F) 与复合物II的分子对接[28] Fig. 7 Molecular docking of carboxin (A), bixafen (B), boscalid (C), isopyrazam (D), penthiopyrad (E) and fluopyram (F) with complex II[28] |
2.5 6-苯甲酰胺基嘌呤
Chauveau等[29]用马铃薯块茎线粒体膜进行研究,发现6-苯甲酰氨基嘌呤 (BOAP) 和2-噻吩甲酰三氟丙酮 (TTFA) 均有抑制线粒体呼吸链中复合物II的作用。在有氧条件下,TTFA可降低复合物II中Fe-S中心S-3的EPR信号高度,并修改信号的频谱,而BOAP仅是减弱了S-3信号;在厌氧条件下,BOAP可使复合物II中铁硫蛋白S-1中心信号强度大幅降低,而TTFA可使S-1中心信号强度略有降低。
2.6 二苯酮双鏻盐Luque-Ortega等[30]合成了一系列二苯甲酮衍生的双鏻盐,发现双磷鎓盐8可作为杀螨剂,其作用靶标也是通过抑制线粒体呼吸链上的复合物II。复合体II是呼吸链代谢摄入的主要门户,所以这些双鏻盐作为新型复合物II抑制剂的开发很有吸引力。
2.7 其他吡啶吲哚 (咔啉) 是相对常见的吲哚生物碱。Janetzky等[31]发现了一类具有神经毒性的含有卤原子的四氢-β-咔啉 (9和10),其可抑制线粒体呼吸链,可作为复合物I的强抑制剂和复合物II的部分抑制剂。它们对原代细胞培养中的多巴胺神经元也具有神经毒性。
丙氨酸是蛋白质的组成成分。Rech等[32]研究发现,丙氨酸给药后,大鼠大脑皮质中的琥珀酸脱氢酶活性降低。丙氨酸可通过与烟酰胺腺嘌呤二核苷酸的还原态竞争而抑制复合物II的体外活性。Petruzzelli等[33]发现,人富组蛋白 (histatin-5) 具有强大的抗真菌活性,可抑制线粒体呼吸作用,histatin-5对复合物II的IC50值为2.5 mmol/L。Via等[34]评价了几个肉桂酰氧基化合物的抗炎和抗增殖活性,发现化合物11和12具有抑制呼吸链中复合物II的活性。
3 复合物II抑制剂在农药中的应用复合物II抑制剂在农药中的应用主要集中在杀菌剂方面,也有部分杀螨剂产品问世。本节主要介绍以复合物II为靶标的商品化抑制剂。
3.1 商品化复合物II杀菌剂的开发进程1966年,Schmeling等[35]报道1,4-氧硫杂环己二烯类衍生物能控制黑白斑豆和大麦种子的锈病、黑粉病等病原真菌,继而有利来路公司推出了对担子菌类及土传病害丝核菌病有特异抑制作用的杀菌剂萎锈灵 (carboxin,13)[36];1975年该公司又推出了其亚磺酸体氧化萎锈灵 (oxycarboxin,14)作为园艺用杀菌剂而产业化。作用机制研究表明,化合物13和14均为复合物II抑制剂。1973年,Shell公司推出了复合物II抑制剂甲呋酰胺 (fenfuram,15)[37]。
1981年,BASF公司研发了含有异丙氧基基团的灭锈胺 (mepronil,16) 并商品化,其药效比邻酰胺有很大提高[38]。研究人员将萎锈灵中的1,4-氧硫杂环用苯环、呋喃环或其他杂环替代,发现替代后的化合物对担子菌都呈现了抗菌活性[39]。1982年BASF公司又研发出了种子消毒剂麦锈灵 (benodanil,17),此后,通过以水稻纹枯病为防治目标进行的酰胺类杀菌剂构效关系的探索,提出了芳酰胺类杀菌剂具有高效活性的模式分子,并对其取代基类型进行了筛选,发现三氟甲基效果最佳,同时参照灭锈胺对于苯胺部分的结构进行改造,研发出了氟酰胺 (flutolanil,18)[40]。1997年日本住友化学公司在氟酰胺成功商品化的基础上,根据杀虫剂残杀威的异丙氧基经闭环合成克百威的成功范例,将灭锈胺的2,3-位进行闭环,成功开发了呋吡酰胺 (furametpyr,19),并于1997年商品化[41];同年美国孟山都公司研发的噻呋菌胺 (thifluzamide,20) 商品化[42]。
2003年,BASF公司用吡啶环代替1,4-氧硫杂环己二烯,同时在2′位引入芳香环,进而开发出了广谱性杀菌剂啶酰菌胺 (boscalid,21),杀菌谱得到了扩展[43]。上市仅用2年就步入上亿美元产品之列,成为复合物II杀菌剂发展史上的重要里程碑,此后该类杀菌剂受到行业的特别关注。
2009—2014年,一大批结构新颖的复合物II杀菌剂被商品化,其中多数是用吡唑取代吡啶后的化合物。如2009年的吡噻菌胺 (penthiopyrad,22)[44],2010年的吡唑萘菌胺 (isopyrazam,23)[45],2011年的氟唑菌酰胺 (fluxapyroxad,24)[46]、联苯吡菌胺 (bixafen,25)[26]和氟唑环菌胺 (sedaxane,26)[45],2012年的氟唑菌苯胺 (penflufen,27)[46],2013年的苯并烯氟菌唑 (benzovindiflupyr,28)[47]以及2014年的异丙噻菌胺 (isofetamid,29)[48]等。
近5年来,又有一大批新型复合物II抑制剂发布并获得了登记,主要有:BASF公司的氟吡菌酰胺 (fluopyram,30)[46];山东省联合农药工业有限公司与山东农业大学合作研发的新型含氟苯甲酰胺类杀菌剂氟醚菌酰胺 (fluopimomide,31)[49];先正达最新开发的吡唑酰胺类杀菌剂pydiflumetofen (32),对叶斑病和白粉病有非常好的抑制作用[50];由意赛格和富美实公司共同开发的fluindapyr (33)可以高效防治大豆锈病[51];由华中师范大学研制的复合物II抑制剂氟苯醚酰胺 (34),对水稻纹枯病、白粉病和马铃薯晚疫病有卓越防效[52];日本农药株式会社开发的pyraziflumid (35),预计将于近年上市[53]。
3.2 正在开发中的复合物II杀菌剂目前,复合物II抑制剂开发进程走上了快车道,世界各大农药巨头和科研机构纷纷开展相关工作,新产品层出不穷。通过总结相关文献报道可以看出,复合物II抑制剂虽然结构不断新颖化,但均是在保留核心基团酰胺键的基础上进行了结构修饰。
2014年,Ye等[54]设计并合成了38个烟酰胺衍生物,大多数化合物对立枯丝核菌Rhizoctonia solani和核盘菌Sclerotinia sclerotiorum表现出中等活性,其中化合物36对2种病原菌的IC50值分别为15.8 μmol/L和20.3 μmol/L,与商品化的啶酰菌胺和多菌灵相当。
2014年,Wang等[55]设计并合成了一系列含有1,2,3-三唑的新型复合物II抑制剂,并对三唑环上1位N上的基团进行了修饰。结果表明:大多数新合成的1,2,3-三唑-4-羧酰胺类化合物对核盘菌表现出良好的杀真菌活性,其中1位N上的氢被邻氯苯取代生成的化合物37对核盘菌的EC50值为1.3 μg/mL,活性远高于百菌清 (chlorothalonil,EC50=1.3 μg/mL);另外,个别化合物对淡色库蚊Culex pipiens pallens具有良好的杀虫活性。
2015年,Du等[56]在保持吡唑羧酸部分不变的情况下,通过3种不同的方式在酰胺的N-芳环上引入了含氮原子的取代基,活性测试结果表明,在苯环的2位引入吲唑基团有助于提高化合物的活性,如引入5-溴吲唑后的化合物38具有同啶酰菌胺 (boscalid) 一样广谱的杀菌活性,对炭疽病菌Colletotrichum orbiculare、串珠镰刀菌Fusarium moniliforme Sheld和苹果轮纹病Botryosphaeria berengeriana的EC50值均低于啶酰菌胺。
2016年,Wang等[57]将1,2,3-三唑环上1位N上的基团更换为丙基和苄基,得到的化合物39和40,对核盘菌S. sclerotiorum、灰霉菌Botrytis cinerea、落花生尾孢Cercospora arachidicola Hori和辣椒疫霉Phytophthora capsici有良好的杀菌活性,其中,化合物40对落花生尾孢的EC50值远低于百菌清。可见,这些1,2,3-三唑-4-羧基酰胺类化合物可以作为一种新型复合物II抑制剂的候选苗头化合物。
2016年,Li等[58]根据手性化合物中不同对映异构体对应不同活性的理念,设计合成了一系列带有手性的烟酰胺类复合物II抑制剂,其中化合物41对立枯丝核菌R. solani、灰葡萄孢B. cinerea和核盘菌S. sclerotiorum的EC50值分别为0.58、0.42和2.10 mg/L;分子对接研究结果表明,该化合物与复合物II的氨基酸残基的结合位点具有不同的手性效应。
2017年,Lv等[59]设计合成了一系列含有吡啶的烟酰胺衍生物,生物活性测定显示,化合物42的抑菌效果最好,对玉米小斑病菌Helminthosporium maydis和小麦纹枯病Rhizoctonia cerealis的EC50值分别为33.5 μmol/L和21.4 μmol/L;同时42对复合物II表现出非常好的抑制能力 (IC50 = 20.2 μmol/L)。
2016年,Xiong等[60]使用药效团连接片段虚拟筛选的方法设计合成了一批新化合物,其中化合物43对复合物II的IC50值为0.09 μmol/L,抑制活性远高于商品化对照药吡噻菌胺 (IC50值1.32 μmol/L)。进一步的抑制动力学研究揭示,该化合物是一种针对底物的非竞争性复合物II抑制剂。另外,化合物44和45对立枯丝核菌R. Solani还表现出良好的体内预防效果。
2016年,Wang等[61]和Wen等[62]设计合成了2类呋喃酰胺类复合物II抑制剂,其中化合物46对番茄腐霉菌表现出很强的抗菌活性,其EC50值为0.037 mg/L,抑制活性远高于啶酰菌胺 (EC50=1.71 mg/L)。化合物47对葡萄痂圆孢菌Sphaceloma ampelimum表现出极大的抑制作用,EC50=0.020 mg/L,优于啶酰菌胺 (EC50=0.74 mg/L),可以作为优选的复合物II抑制剂的先导化合物。
2016年,Xue等[63]设计合成了一系列具有硫醚基的噻唑-5-甲酰苯胺。初步研究结果显示,化合物48对立枯丝核菌R. Solani显示出很强的抑制效果,其EC50值为1.28 mg/L,与噻呋酰胺 (thifluzamide) 相当。构效关系分析结果表明,噻呋酰胺中噻唑环的2位上的甲硫基对提高化合物的杀真菌活性起到一定的促进作用。
2017年,Yao等[64-65]发现,在正在开发的复合物II抑制剂中,酰胺的羰基部分对化合物的结合亲和力起重要作用。因此,将研究工作重点放到了发现新的羧基“核心”上,通过固定氨基部分,对16个候选羧基进行筛选,从中发现了几种对生物活性起到促进作用的羧基,结合计算机辅助药物设计和高度特异性的基于酰胺特征的药效团模型,设计出一系列具有开发价值的复合物II抑制剂。其中化合物49对复合物II的IC50=1.07 μmol/L,对立枯丝核菌R. solani和核盘菌S. sclerotiorum的EC50值分别为11.0和5.5 μmol/L,活性高于噻呋酰胺。另外3个化合物50、51和52对核盘菌和立枯丝核菌也表现出优越的抑制活性,与噻呋酰胺相当。
3.3 以复合物II为靶酶的杀螨剂一些杀螨剂也是以复合物II为靶酶,如2007年上市的α-氰基酮类丁氟螨酯 (cyflumetofen,53),其通过接触进入螨虫体后,可在虫体内代谢产生能够抑制螨虫线粒体复合物II的物质,从而起到杀螨作用[66]。丁氟螨酯的烯醇代谢物2-三氟甲基苯取代物在非常低的浓度下即可对二斑叶螨Tetranychus urticaeKoch (IC50 = 6.65 nmol/L) 和苹果全爪螨Panonychus ulmi (Koch) (IC50 = 2.71 nmol/L) 的线粒体复合体Ⅱ有很强的抑制作用[66]。
β-氰基酮类腈吡螨酯 (cyenopyrafen,54) 是日产化学公司于2009年推出的杀螨剂,其可通过代谢转化成氰基化合物,从而作用于螨虫线粒体呼吸系统的电子传递链,通过扰乱琥珀酸脱氢酶而抑制线粒体正常的功能达到杀螨效果[67]。
pyflubumide (55) 是由日本农药株式会社发现并开发的一种新型甲酰苯胺类杀螨剂,其在4′-位上具有独特的含有6个氟原子的异丙基,是目前惟一具有甲酰苯胺结构的杀螨剂,属于呼吸链线粒体复合物Ⅱ抑制剂[68]。
4 小结与展望随着对复合物II结构和功能的不断认识,以及对其抑制作用机理的深入了解,一些结构更新颖、活性更突出的抑制剂不断被开发出来。与初期的复合物II抑制剂相比,新的抑制剂展示了更广泛的生物活性谱。通过对比结构可以发现,绝大多数商品化的复合物II抑制剂都含有共同的酰胺结构片段,说明从一个核心结构单元出发,能开发出具有更多新功能的分子。该类抑制剂的活性主要是由其与线粒体中复合物II亲合性的强弱决定的,但由于各种病原菌之间的跨膜区保守性不高,无法实现同一种抑制剂抑制所有病原菌或螨虫,因此今后要更有针对性的开发新产品。
酰胺类杀菌剂是最古老的杀菌剂之一,随着分子生物学、计算机辅助药物设计等新兴技术广泛应用,将来必然会有更新颖、更安全高效的抑制剂被开发出来。
| [1] |
SARASTE M. Oxidative phosphorylation at the fin de siècle
[J]. Science, 1999, 283(5407): 1488-1493. DOI:10.1126/science.283.5407.1488 |
| [2] |
STAMMLER G, BENZINGER G, SPEAKMAN J. A rapid and reliable method for monitoring the sensitivity of Sclerotinia sclerotiorum to boscalid
[J]. J Phytopathol, 2007, 155(11-12): 746-748. DOI:10.1111/jph.2007.155.issue-11-12 |
| [3] |
RUSSELL P E. Fungicide resistance action committee (FRAC): a resistance activity update[J]. Outlooks Pest Manag, 2009, 20(3): 122-125. DOI:10.1564/20jun08 |
| [4] |
柏亚罗, 顾林玲. 新近登记或上市的13个杀菌剂农药品种详解[J]. 农药市场信息, 2018(6): 30-33. BAI Y L, GU L L. Detailed description of 13 biocide pesticides newly registered or listed[J]. Pesticide Market Information, 2018(6): 30-33. |
| [5] |
YANKOVSKAYA V, HORSEFIELD R, TÖRNROTH S, et al. Architecture of succinate dehydrogenase and reactive oxygen species generation[J]. Science, 2003, 299(5607): 700-704. DOI:10.1126/science.1079605 |
| [6] |
SUN F, HUO X, ZHAI Y J, et al. Crystal structure of mitochondrial respiratory membrane protein complex II[J]. Cell, 2005, 121(7): 1043-1057. DOI:10.1016/j.cell.2005.05.025 |
| [7] |
HUANG L S, SUN G, COBESSI D, et al. 3-Nitropropionic acid is a suicide inhibitor of mitochondrial respiration that, upon oxidation by complex II, forms a covalent adduct with a catalytic base arginine in the active site of the enzyme[J]. J Biol Chem, 2006, 281(9): 5965-5972. DOI:10.1074/jbc.M511270200 |
| [8] |
DEHNE H W, DEISING B, FRAAIJE U, et al. Modern fungicides and antifungal compounds VII[C]//Proceedings of the 17th international reinhardsbrunn symposium. Friedrichroda, Germany: Deutsche Phytomedizinische Gesellschaft e.V. Verlag, 2014.
|
| [9] |
DEHNE H W, DEISING H B, GISI U, et al. Modern fungicides and antifungal compounds VI[C]//16th International reinhards burn symposium. 2010, 10.
|
| [10] |
RALPH S J, MORENO-SáNCHEZ R, NEUZIL J, et al. Inhibitors of succinate: quinone reductase/complex II regulate production of mitochondrial reactive oxygen species and protect normal cells from ischemic damage but induce specific cancer cell death[J]. Pharm Res, 2011, 28(11): 2695-2730. DOI:10.1007/s11095-011-0566-7 |
| [11] |
MATSSON M, HEDERSTEDT L. The carboxin-binding site on paracoccus denitrificans succinate: quinone reductase identified by mutations[J]. J Bioenerg Biomembr, 2001, 33(2): 99-105. DOI:10.1023/A:1010744330092 |
| [12] |
SILKIN Y, OYEDOTUN K S, LEMIRE B D. The role of Sdh4p Tyr-89 in ubiquinone reduction by the Saccharomyces cerevisiae succinate dehydrogenase
[J]. Biochim Biophys Acta, 2007, 1767(2): 143-150. DOI:10.1016/j.bbabio.2006.11.017 |
| [13] |
RUZICKA F J, BEINERT H. A new membrane iron-sulfur flavoprotein of the mitochondrial electron transfer system the entrance point of the fatty acyl dehydrogenation pathway?[J]. Biochem Biophys Res Commun, 1975, 66(2): 622-631. DOI:10.1016/0006-291X(75)90555-0 |
| [14] |
SALERNO J C, OHNISHI T. Studies on the stabilized ubisemiquinone species in the succinate-cytochrome c reductase segment of the intact mitochondrial membrane system
[J]. Biochem J, 1980, 192(3): 769-781. DOI:10.1042/bj1920769 |
| [15] |
IVERSON T M, LUNA-CHAVEZ C, CECCHINI G, et al. Structure of the Escherichia coli fumarate reductase respiratory complex
[J]. Science, 1999, 284(5422): 1961-1966. DOI:10.1126/science.284.5422.1961 |
| [16] |
OYEDOTUN K S, LEMIRE B D. The quaternary structure of the Saccharomyces cerevisiae succinate dehydrogenase. Homology modeling, cofactor docking, and molecular dynamics simulation studies
[J]. J Biol Chem, 2004, 279(10): 9424-9431. DOI:10.1074/jbc.M311876200 |
| [17] |
SCALLET A C, HALEY R L, SCALLET D M, et al. 3-Nitropropionic acid inhibition of succinate dehydrogenase (complex II) activity in cultured Chinese hamster ovary cells: antagonism by L-carnitine
[J]. Ann N Y Acad Sci, 2010, 993(1): 305-312. |
| [18] |
SAAD L O, MIRANDOLA S R, MACIEL E N, et al. Lactate dehydrogenase activity is inhibited by methylmalonate in vitro
[J]. Neurochem Res, 2006, 31(4): 541-548. DOI:10.1007/s11064-006-9054-6 |
| [19] |
VALENTI D, VACCA R A, DE BARI L. 3-Bromopyruvate induces rapid human prostate cancer cell death by affecting cell energy metabolism, GSH pool and the glyoxalase system[J]. J Bioenerg Biomembr, 2015, 47(6): 493-506. DOI:10.1007/s10863-015-9631-y |
| [20] |
KUMAGAI H, NISHIDA H, IMAMURA N, et al. Kumagai, H. et al. The structures of atpenins A4, A5 and B, new antifungal antibiotics produced by Penicillium sp.
[J]. J Antibiot (Tokyo), 1990, 43(12): 1553-1558. DOI:10.7164/antibiotics.43.1553 |
| [21] |
HORSEFIELD R, YANKOVSKAYA V, SEXTON G, et al. Structural and computational analysis of the quinone-binding site of complex II (succinate-ubiquinone oxidoreductase): a mechanism of electron transfer and proton conduction during ubiquinone reduction[J]. J Biol Chem, 2006, 281(11): 7309-7316. DOI:10.1074/jbc.M508173200 |
| [22] |
SELBY T P, HUGHES K A, RAUH J J, et al. Synthetic atpenin analogs: potent mitochondrial inhibitors of mammalian and fungal succinate-ubiquinone oxidoreductase[J]. Bioorg Med Chem Lett, 2010, 20(5): 1665-1668. DOI:10.1016/j.bmcl.2010.01.066 |
| [23] |
WANG H Z, HUWAIMEL B, VERMA K, et al. Synthesis and antineoplastic evaluation of mitochondrial complex II (succinate dehydrogenase) inhibitors derived from atpenin A5[J]. ChemMedChem, 2017, 12(13): 1033-1044. DOI:10.1002/cmdc.v12.13 |
| [24] |
ITO S, YAZAWA S, NAKAGAWA Y, et al. Effects of alkyl parabens on plant pathogenic fungi[J]. Bioorg Med Chem Lett, 2015, 25(8): 1774-1777. DOI:10.1016/j.bmcl.2015.02.049 |
| [25] |
MAGUIRE J J, KAGAN V, ACKRELL B A, et al. Succinate-ubiquinone reductase linked recycling of α-tocopherol in reconstituted systems and mitochondria: requirement for reduced ubiquinone[J]. Arch Biochem Biophys, 1992, 292(1): 47-53. DOI:10.1016/0003-9861(92)90049-3 |
| [26] |
GLÄTTLI A, GROTE T, STAMMLER G. SDH-inhibitors: history, biological performance and molecular mode of action[C]//Modern fungicides and antifungal compounds VI. 16th International reinhardsbrunn symposium. Friedrichroda, Germany: Deutsche Phytomedizinische Gesellschaft e.V. Selbstverlag, 2011: 159-169.
|
| [27] |
FRAAIJE B A, BAYON C, ATKINS S, et al. Risk assessment studies on succinate dehydrogenase inhibitors, the new weapons in the battle to control septoria leaf blotch in wheat[J]. Mol Plant Pathol, 2012, 13(3): 263-275. DOI:10.1111/mpp.2012.13.issue-3 |
| [28] |
SCALLIET G, BOWLER J, LUKSCH T, et al. Mutagenesis and functional studies with succinate dehydrogenase inhibitors in the wheat pathogen Mycosphaerella graminicola
[J]. PLoS One, 2012, 7(4): e35429. DOI:10.1371/journal.pone.0035429 |
| [29] |
CHAUVEAU M, ROUSSAUX J. EPR studies on 6-benzoylaminopurine and thenoyltrifluoroacetone inhibition sites of succinate dehydrogenase in plant mitochondria[J]. Plant Cell Physiol, 1996, 37(7): 914-921. DOI:10.1093/oxfordjournals.pcp.a029039 |
| [30] |
LUQUE-ORTEGA J, REUTHER P, RIVAS L, et al. New benzophenone-derived bisphosphonium salts as leishmanicidal leads targeting mitochondria through inhibition of respiratory complex II[J]. J Med Chem, 2010, 53(4): 1788-1798. DOI:10.1021/jm901677h |
| [31] |
JANETZKY B, GILLE G, ABDEL-MOHSEN M, et al. Effect of highly halogenated β-carbolines on dopaminergic cells in culture and on mitochondrial respiration
[J]. Drug Dev Res, 1999, 46(1): 51-56. DOI:10.1002/(ISSN)1098-2299 |
| [32] |
RECH V C, FEKSA L R, DUTRA-FILHO C S, et al. Inhibition of the mitochondrial respiratory chain by phenylalanine in rat cerebral cortex[J]. Neurochem Res, 2002, 27(5): 353-357. DOI:10.1023/A:1015529511664 |
| [33] |
PETRUZZELLI R, CLEMENTI M E, MARINI S, et al. Respiratory inhibition of isolated mammalian mitochondria by salivary antifungal peptide histatin-5[J]. Biochem Biophys Res Commun, 2003, 311(4): 1034-1040. DOI:10.1016/j.bbrc.2003.10.104 |
| [34] |
VIA L D, MEJIA M, GARCíA-ARGáEZ A N, et al. Anti-inflammatory and antiproliferative evaluation of 4β-cinnamoyloxy, 1β, 3α-dihydroxyeudesm-7, 8-ene from Verbesina persicifolia and derivatives
[J]. Bioorg Med Chem, 2015, 23(17): 5816-5828. DOI:10.1016/j.bmc.2015.07.002 |
| [35] |
SCHMELING B V, KULKA M. Systemic fungicidal activity of 1, 4-oxathiin derivatives[J]. Science, 1966, 152(3722): 659-660. DOI:10.1126/science.152.3722.659 |
| [36] |
WHITE G A. Substituted benzanilides: Structural variation and inhibition of complex II activity in mitochondria from a wild-type strain and a carboxin-selected mutant strain of Ustilago maydis[J]. Pestic Biochem Phys, 1987, 27(3): 249-260. DOI:10.1016/0048-3575(87)90054-X |
| [37] |
COOKE L R, CLIFFORD D R, DEAS A H R, et al. Control of potato late blight using controlled-release granules containing ofurace[J]. Pestic Sci, 1982, 13(6): 686-692. DOI:10.1002/ps.v13:6 |
| [38] |
SHIMIZU T, NAKAO T, SUDA Y, et al. Mechanism of action and selectivity of a fungicide, mepronil[J]. J Pestic Sci, 1992, 17(1): 39-46. DOI:10.1584/jpestics.17.39 |
| [39] |
KATARIA H R, HUGELSHOFER U, GISI U. Sensitivity of rhizoctonia species to different fungicides[J]. Plant Pathol, 1991, 40(2): 203-211. DOI:10.1111/ppa.1991.40.issue-2 |
| [40] |
ARAKI F. Moncut (flutolanil) , a new systemic fungicide[J]. Japan Pestic Inf, 1985, 47: 23-25. |
| [41] |
OGURI Y. Limber-(Furametpyr, S-658): a new systemic fungicide[J]. Agrochem Jpn, 1997, 70: 15-16. |
| [42] |
REJEB S B, CLéROUX C, LAWRENCE J F, et al. Development and characterization of immunoaffinity columns for the selective extraction of a new developmental pesticide: thifluzamide, from peanuts[J]. Analytica Chimica Acta, 2001, 432(2): 193-200. DOI:10.1016/S0003-2670(00)01376-3 |
| [43] |
AVENOT H F, MICHAILIDES T J. Resistance to boscalid fungicide in Alternaria alternata isolates from pistachio in California
[J]. Plant Dis, 2007, 91(10): 1345-1350. DOI:10.1094/PDIS-91-10-1345 |
| [44] |
ISHII H, MIYAMOTO T, USHIO S, et al. Lack of cross-resistance to a novel succinate dehydrogenase inhibitor, fluopyram, in highly boscalid-resistant isolates of Corynespora cassiicola and Podosphaera xanthii
[J]. Pest Manag Sci, 2011, 67(4): 474-482. DOI:10.1002/ps.v67.4 |
| [45] |
WALTER H, TOBLER H, GRIBKOV D, et al. Sedaxane, Isopyrazam and SOLATENOLTM: novel broad-spectrum fungicides inhibiting succinate dehydrogenase (SDH)-synthesis challenges and biological aspects
[J]. CHIMIA Int J Chem, 2015, 69(7-8): 425-434. |
| [46] |
AMIRI A, HEATH S M, PERES N A. Resistance to fluopyram, fluxapyroxad, and penthiopyrad in Botrytis cinerea from strawberry
[J]. Plant Dis, 2014, 98(4): 532-539. DOI:10.1094/PDIS-07-13-0753-RE |
| [47] |
ISHII H, ZHEN F, HU M J, et al. Efficacy of SDHI fungicides, including benzovindiflupyr, against Colletotrichum species
[J]. Pest Manag Sci, 2016, 72(10): 1844-1853. DOI:10.1002/ps.2016.72.issue-10 |
| [48] |
TSUKUDA S. Developing trend of SDHI fungicide and studies on a novel fungicide, isofetamid[J]. Jpn J Pestic Sci, 2014, 39(1): 89-95. DOI:10.1584/jpestics.W13-35 |
| [49] |
BURRISS A, EDMUNDS A J F, EMERY D, et al. The importance of trifluoromethyl pyridines in crop protection[J]. Pest Manag Sci, 2018, 74(6): 1228-1238. DOI:10.1002/ps.2018.74.issue-6 |
| [50] |
SUN H, LI W, DENG Y, et al. Efficacy of SDHI fungicide, pydiflumetofen, against Fusarium gramminearum[C]// Phytopathology. USA: Amer Phytopathological Soc, 2017, 107 (12): 35-35.
|
| [51] |
LOY B A, RIGOLI J W, SAM B, et al. Picolinamides as fungicides: US 2018/0186743A1[P/OL]. 2018-07-05[2018-09-21]. http://www.freepatentsonline.com/y2018/0186743.html.
|
| [52] |
杨光富, 熊力, 陈琼, 等. 含二苯醚的吡唑酰胺类化合物及其应用和农药组合物: CN 104557709 A[P/OL]. 2015-04-29[2018-09-21]. http://www.soopat.com/Patent/201310502473. YANG G F, XIONG L, CHEN Q, et al. Pyrazole amide compound containing diphenyl ether and application thereof and pesticide composition: CN 104557709 A[P/OL]. 2015-04-29[2018-09-21]. http://www.soopat.com/Patent/201310502473. |
| [53] |
JEANMART S, EDMUNDS A J F, LAMBERTH C, et al. Synthetic approaches to the 2010-2014 new agrochemicals[J]. Bioorgan Med Chem, 2016, 24(3): 317-341. DOI:10.1016/j.bmc.2015.12.014 |
| [54] |
YE Y H, MA L, DAI Z C, et al. Synthesis and antifungal activity of nicotinamide derivatives as succinate dehydrogenase inhibitors[J]. J Agric Food Chem, 2014, 62(18): 4063-4071. DOI:10.1021/jf405437k |
| [55] |
WANG Z J, GAO Y, HOU Y L, et al. Design, synthesis, and fungicidal evaluation of a series of novel 5-methyl-1H-1, 2, 3-trizole-4-carboxyl amide and ester analogues
[J]. Eur J Med Chem, 2014, 86: 87-94. DOI:10.1016/j.ejmech.2014.08.029 |
| [56] |
DU S J, TIAN Z M, YANG D Y, et al. Synthesis, antifungal activity and structure-activity relationships of novel 3-(difluoromethyl)-1-methyl-1H-pyrazole-4-carboxylic acid amides
[J]. Molecules, 2015, 20(5): 8395-8408. DOI:10.3390/molecules20058395 |
| [57] |
WANG Z J, YANG H H, TIAN L, et al. Design, synthesis, and fungicidal activities of novel 5-methyl-1H-1, 2, 3-trizole-4-carboxyl amide analogues
[J]. Med Chem, 2016, 12(3): 290-295. DOI:10.2174/1573406412666151112125006 |
| [58] |
LI S K, LI D D, XIAO T F, et al. Design, synthesis, fungicidal activity, and unexpected docking model of the first chiral boscalid analogues containing oxazolines[J]. J Agric Food Chem, 2016, 64(46): 8927-8934. DOI:10.1021/acs.jafc.6b03464 |
| [59] |
LV X H, REN Z L, LIU P, et al. Design, synthesis and biological evaluation of novel nicotinamide derivatives bearing a substituted pyrazole moiety as potential SDH inhibitors[J]. Pest Manag Sci, 2017, 73(8): 1585-1592. DOI:10.1002/ps.2017.73.issue-8 |
| [60] |
XIONG L, ZHU X L, GAO H W, et al. Discovery of potent succinate-ubiquinone oxidoreductase inhibitors via pharmacophore-linked fragment virtual screening approach[J]. J Agric Food Chem, 2016, 64(24): 4830-4837. DOI:10.1021/acs.jafc.6b00325 |
| [61] |
WANG H Y, GAO X H, ZHANG X X, et al. Design, synthesis and antifungal activity of a fenfuram-diarylamine hybrid[J]. Bioorg Med Chem Lett, 2016, 27(1): 90-93. |
| [62] |
WEN F, JIN H, TAO K, et al. Design, synthesis and antifungal activity of novel furancarboxamide derivatives[J]. Eur J Med Chem, 2016, 120: 244-251. DOI:10.1016/j.ejmech.2016.04.060 |
| [63] |
XUE H S, LIU A P, LIU W D, et al. Syntheses and fungicidal activities of thiazole-5- carboxanilides bearing thioether group[J]. Chem Res Chin Univ, 2016, 32(5): 781-785. DOI:10.1007/s40242-016-6153-z |
| [64] |
YAO T T, XIAO D X, LI Z S, et al. Design, synthesis, and fungicidal evaluation of novel pyrazole-furan and pyrazole-pyrrole carboxamide as succinate dehydrogenase inhibitors[J]. J Agric Food Chem, 2017, 65(26): 5397-5403. DOI:10.1021/acs.jafc.7b01251 |
| [65] |
YAO T T, FANG S W, LI Z S, et al. Discovery of novel succinate dehydrogenase inhibitors by the integration of in silico library design and pharmacophore mapping[J]. J Agric Food Chem, 2017, 65(15): 3204-3211. DOI:10.1021/acs.jafc.7b00249 |
| [66] |
HAYASHI N, SASAMA Y, TAKAHASHI N, et al. Cyflumetofen, a novel acaricide-its mode of action and selectivity[J]. Pest Manag Sci, 2013, 69(9): 1080-1084. DOI:10.1002/ps.2013.69.issue-9 |
| [67] |
KHALIGHI M, TIRRY L, VAN LEEUWEN T. Cross-resistance risk of the novel complex II inhibitors cyenopyrafen and cyflumetofen in resistant strains of the two-spotted spider mite Tetranychus urticae
[J]. Pest Manag Sci, 2014, 70(3): 365-368. DOI:10.1002/ps.3641 |
| [68] |
NAKANO M, YASOKAWA N, SUWA A, et al. Mode of action of novel acaricide pyflubumide: Effects on the mitochondrial respiratory chain[J]. J Pestic Sci, 2015, 40(1): 19-24. DOI:10.1584/jpestics.D14-086 |
 2018, Vol. 20
2018, Vol. 20