2. 上海市农业技术推广服务中心,上海 201103
2. Shanghai Agriculture Technology Extension & Service Center, Shanghai 201103, China
由灰葡萄孢Botrytis cinerea Pers.导致的灰霉病 (gray mold disease) 是草莓生产和储藏过程最重要的病害之一[1],草莓极易感染该病,严重时可导致全果腐烂,造成大规模减产[2-3]。化学防治是目前防治草莓灰霉病最常见的措施之一[4]。
啶酰菌胺属烟酰胺类内吸性杀菌剂,对多种植物病害高效,且低毒[5]。已有研究表明,啶酰菌胺对B. cinerea抑制活性高,对草莓灰霉病的田间防治效果可达90%以上[6],现已有50多个啶酰菌胺单剂产品被登记用于防治灰霉病[7]。啶酰菌胺在上海市作为草莓灰霉病的推荐防治药剂,近10年来已在各区县草莓种植地被广泛使用。由于B. cinerea 繁殖速度快、孢子数量大且较易产生遗传变异,属易对药剂产生抗性的一类植物病原真菌[8]。同时,啶酰菌胺作用位点单一,病原菌基因组的单核苷酸突变就可能对其产生抗性,已被国际杀菌剂抗性委员会 (FRAC) 认定为产生抗性风险较高的杀菌剂[8-9],B. cinerea-啶酰菌胺也被FRAC认定为是具有高度抗性风险的病原菌-杀菌剂组合[8]。美国、德国等国家均已出现田间B. cinerea对啶酰菌胺产生抗性的报道[1, 10-11]。啶酰菌胺作用位点为琥珀酸脱氢酶 (SDH),该酶为线粒体呼吸链电子传递体系的蛋白复合体Ⅱ,具有4个亚基,其中SdhA为黄素蛋白,SdhB为3个铁硫蛋白簇,SdhC和SdhD为膜结合蛋白[12]。据报道,B. cinerea对啶酰菌胺抗性的产生与SdhB亚基225、230、272位点及SdhD亚基132位点的氨基酸发生突变有关,但各研究报道中的突变类型均有不同,分别涉及SdhB上的P225L/F/T、N230I和H272Y/R/L,以及SdhD上的H132R等[10-11, 13]。
目前有关上海地区草莓灰霉病菌对啶酰菌胺的敏感性现状及抗性突变机制等均尚不明确。为此,本研究采用菌丝生长速率法和孢子萌发法,分别测定了采自上海市6个草莓种植区 (县) 13个基地的195株单孢B. cinerea菌株不同生长阶段对啶酰菌胺的敏感性,同时,随机选取20株抗性水平不同的菌株,检测并分析了病原菌与抗性发生相关的突变位点及其与抗性水平的关系,以期为啶酰菌胺在草莓灰霉防治中的合理使用,以及其抗性监测及治理提供理论依据。
1 材料与方法 1.1 供试菌株于2017年2—4月,从上海市崇明县、奉贤区、嘉定区、金山区、浦东新区及青浦区的共计13个草莓生产基地,采集具典型症状的灰霉病病果,通过孢子液稀释分离法[1]分离获得单孢菌株。将单孢菌株接种于PDA培养基上,24 ℃下培养,通过形态学特征[3]鉴定,保留与B. cinerea形态相符的菌株。来源于同一病果的病原菌保留1株,每个采样点保留15株,共获得195株单孢菌株。将单孢菌株转接至PDA试管斜面,24 ℃培养2 d后,于4 ℃保存,待用。
1.2 药剂、试剂及培养基98%啶酰菌胺 (boscalid) 原药购自上海悦联化工有限公司;分析纯丙酮购自国药集团化学试剂有限公司。马铃薯葡萄糖琼脂培养基 (PDA) 购自美国BD公司,用于菌株培养及菌丝生长抑制试验;水琼脂培养基 (WA):琼脂15 g、无菌水1 000 mL,用于病原菌孢子萌发抑制试验。PCR SuperMix Easy Taq酶、pEASY-T1载体及大肠杆菌感受态 (Trans-T1),购自北京全式金生物技术有限公司,用于目的基因克隆。
1.3 菌丝生长抑制试验采用菌丝生长速率法[14]测定。将啶酰菌胺原药溶于丙酮,配成50 mg/mL的母液。根据预试验结果,再用丙酮将母液梯度稀释,配成药剂最终质量浓度分别为0.1、0.2、0.5、1、2及5 μg/mL的含药PDA平板,用于敏感菌株测定;配制2、5、20、50及110 μg/mL的含药PDA平板,用于抗性菌株测定 (因浓度过高药剂易从培养基中析出,因此最高质量浓度设为110 μg/mL)。除110 μg/mL培养基平板中丙酮的添加量为体积分数0.22% 外,其余处理丙酮的添加量均为0.1%,因此分别以添加0.22%和0.1%丙酮的PDA平板作为空白对照。在24 ℃下培养5 d的菌落边缘打取直径5 mm的菌饼,接种到上述系列浓度的含药平板中央,24 ℃黑暗倒置培养3 d后,用十字交叉法测量菌落直径,每个菌株、每个浓度重复3次。以Zhang等[15]报道的2004—2006年中国浙江及江苏省黄瓜、番茄等温室蔬菜上从未接触过啶酰菌胺的B. cinerea群体的敏感性基线 (1.07 ± 0.11 μg/mL) 作为参照标准,计算抗性水平(R):抗性水平=菌株EC50/1.07 μg/mL。抗性分级标准[16]:R <10为敏感 (S);10 ≤ R < 50为低抗 (LR);50 ≤ R < 100为中抗 (MR);R ≥ 100为高抗 (HR)。
1.4 孢子萌发抑制试验采用孢子萌发法[17],按病原菌菌丝生长抑制试验中所得抗性分级比例,随机选取40株敏感菌株 (S)、3株低抗菌株 (LR)、3株中抗菌株 (MR) 及12株高抗菌株 (HR) 进行测定。将啶酰菌胺母液用丙酮稀释后配成药剂最终质量浓度分别为0.1、0.2、0.4、0.8、1.6、5及50 μg/mL的含药WA平板 (为避免药剂在培养基中析出而影响对孢子萌发的观察,最高质量浓度设为50 μg/mL),空白对照加等量丙酮。从培养皿上刮取新鲜的分生孢子于无菌水中,调节浓度至每1 mL约106个。取100 μL孢子悬浮液均匀涂布于含药WA平板上,24 ℃黑暗条件下倒置培养18 h后,在光学显微镜下记录萌发的孢子数及观察孢子总数,以芽管长度超过孢子宽度视为萌发。每菌株每个浓度重复3次,每个重复观察孢子总数不低于200个。
1.5 琥珀酸脱氢酶基因序列测定及比对从敏感性不同 (S、LR、MR和HR) 的菌株中各随机选择5株,对其琥珀酸脱氢酶 (SDH) 的4条亚基编码基因SdhA、SdhB、SdhC与SdhD序列进行测定。菌丝预处理及总DNA提取参考Harju等[18]报道的方法。SdhA、SdhB、SdhC与SdhD基因扩增引物分别为:SdhA-F:ATGTCTTCATTTGCTATGCG,SdhA-R:CTATCCATTTTCATCTTTA;SdhB-F:TCGAACCTACTCGCCCTATCCAATT,SdhB-R:GACTTCTTAGAAAGCCATTTCCTTC;SdhC-F:ATGTTTTCACAGAGAGCAA,SdhC-R:CTACAAGAAAGCAACCAACG;SdhD-F:ATGGCTTCATTCATCAAACCATCCG,SdhD-R:TTATGCGCGCCAAATTCTTTTGATA。由生工生物工程 (上海) 公司对扩增产物进行测序。采用NCBI网站 (https://www.ncbi.nlm.nih.gov) 的BLAST n工具对敏感及抗性菌株的SDH亚基序列进行比对,并以NCBI数据库中相关序列作为参考。参考序列GenBank序号分别为:KR705916.1 (BcSdhA)、KR866382.1 (BcSdhB)、KR705923.1 (BcSdhC) 和KR705930.1 (BcSdhD)。
1.6 数据处理应用SPSS 19.0统计软件对试验数据进行分析,采用该软件描述统计模块进行Shapiro-Wilk法 (W法) 正态性检验;通过probit模块计算药剂抑制病原菌菌丝生长及孢子萌发的EC50值;根据抗性分级标准,将抑制病原菌孢子萌发及菌丝生长的EC50值转化为有序分类变量;将SdhB基因突变与否及突变类型分别转化为分类变量,用Kendall’s tau-b法,分别对病原菌孢子萌发与菌丝生长对药剂的敏感性、病原菌敏感性与突变的发生以及病原菌敏感性与突变类型的相关性进行分析。用Office Excel软件绘制频率分布直方图及正态分布曲线。
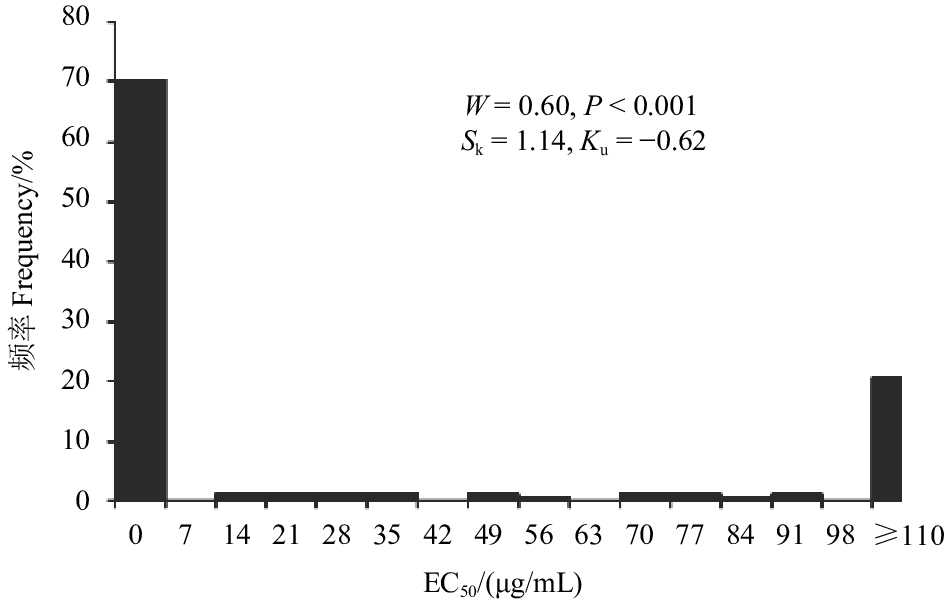
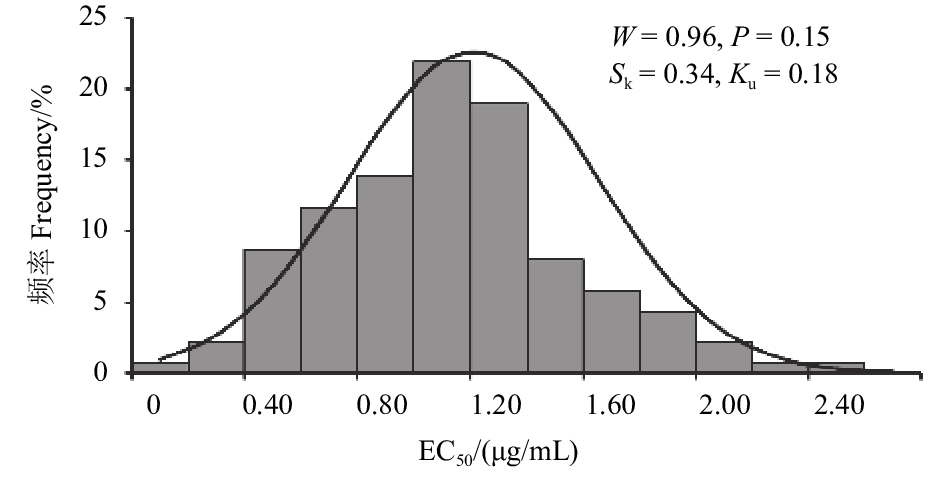
2 结果与分析 2.1 灰霉病菌菌丝生长与孢子萌发对啶酰菌胺的敏感性菌丝生长抑制试验表明:上海地区草莓灰霉病菌对啶酰菌胺的敏感性差异较大,195株菌株中,抑制菌丝生长的EC50最小值为0.15 μg/mL,最大值大于110 μg/mL。经W法正态性检验,195株菌株菌丝生长的EC50值频次分布W=0.60,P < 0.001,呈非连续性分布 ( 图1),表明病原菌自然群体对啶酰菌胺的敏感性存在一定分化,部分菌株已产生抗药性。其中,58株菌株的EC50值 ≥ 16.58 μg/mL,呈非连续性分布 (图1);其余137株菌株的EC50值介于0.15~2.45 μg/mL之间,呈连续性正态分布,其W=0.96,P = 0.15 > 0.05( 图2)。
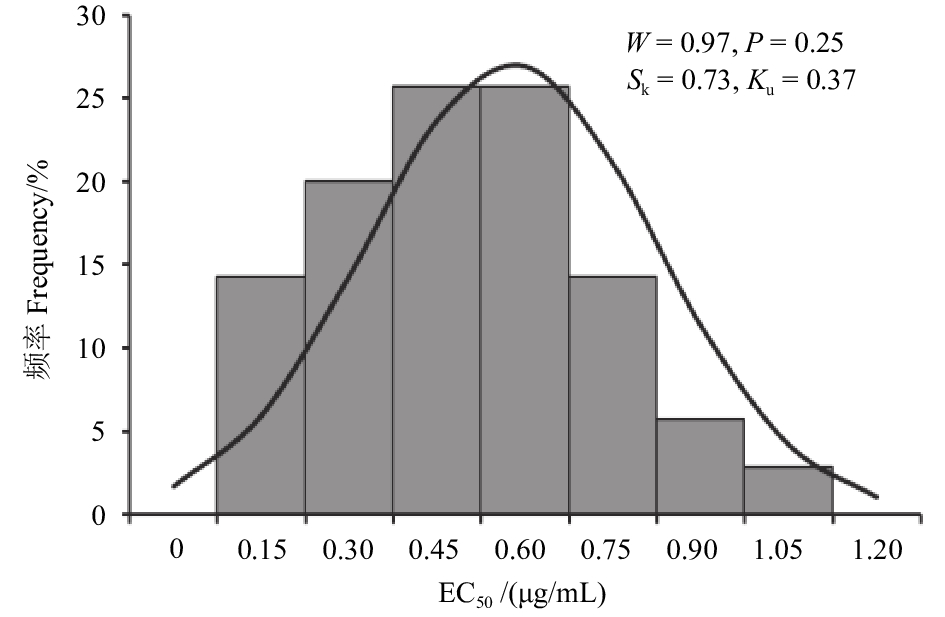
分生孢子萌发抑制试验表明:啶酰菌胺对40株敏感菌株孢子萌发的EC50值为0.19~1.21 μg/mL,经W法正态性检验,呈连续性正态分布,EC50均值为0.58 μg/mL(图3),而18株抗性菌株的EC50值均大于50 μg/mL(表1)。经非参数检验,58株菌株孢子萌发与菌丝生长阶段对啶酰菌胺的抗性表现呈强正相关性 (Kendall’s tau-b = 0.948,P < 0.001)。
|
图 1 供试195株菌株菌丝生长EC50值频率分布 Fig. 1 Frequency distribution of EC50 values for the mycelial growth of 195 B. cinerea isolates |
|
图 2 啶酰菌胺对137株敏感菌株菌丝生长EC50值频率分布 Fig. 2 Frequency distribution of EC50 values for the mycelial growth of 137 sensitive isolates of B. cinerea |
|
|
表 1 草莓灰霉病菌分生孢子萌发对啶酰菌胺的敏感性 Table 1 Sensitivity of the conidial germination of B. cinerea from strawberry to boscalid |
|
图 3 啶酰菌胺对40株敏感菌株孢子萌发EC50值频率分布 Fig. 3 Frequency distribution of EC50 values for the conidial germination of 40 sensitive isolates of B. cinerea |
2.2 2017年上海地区草莓灰霉病菌对啶酰菌胺的抗性情况
菌丝生长抑制试验 (表2) 表明:2017年从上海各区 (县) 草莓生产基地采集的灰霉病菌对啶酰菌胺的抗性水平较高,其EC50最大值大于110 μg/mL,最高抗性水平大于100,且抗性频率较高,总体抗性频率为29.74%,高抗频率为20.51%。各区 (县) 中,病原菌抗性频率较高的地区为浦东新区与嘉定区,分别达46.67%和40.00%;来源于崇明县的病原菌抗性频率较低,其90%的菌株均仍对啶酰菌胺敏感。
|
|
表 2 上海市各区 (县) 草莓灰霉病菌菌丝生长对啶酰菌胺的敏感性水平及频率 Table 2 Sensitivity and resistance frequency of the mycelial growth of B. cinerea from strawberry in different districts in Shanghai |
2.3 抗性突变位点
菌株SdhA、SdhB、SdhC与SdhD基因序列比对分析结果表明,20株不同敏感性菌株的SdhA、SdhC与SdhD 3个基因均未发生突变;5株敏感菌株的SdhB基因未发生突变而15株抗性菌株的SdhB亚基均发生了单氨基酸突变。经非参数检验,突变的发生与抗性产生之间存在较显著的正相关性 (Kendall’s tau-b = 0.60,P = 0.02 < 0.05)。
所检测的15株抗性菌株中,有13株菌株的SdhB亚基272位组氨酸突变为精氨酸 (H272R,CAC突变为CGC),2株菌株的225位脯氨酸突变为苯丙氨酸 (P225F,CCC突变为TTC),且突变类型与抗性水平之间不存在相关性 (Kendall’s tau-b = ± 0.45,P = 0.13)。其中H272R突变在上海草莓灰霉病菌中发生最普遍,处于优势地位,低抗 (LR)、中抗 (MR) 及高抗 (HR) 菌株中均检测到了该突变;而P225F突变发生较少,仅在高抗性病原菌中被检测到 (表3)。
|
|
表 3 20株草莓灰霉病菌对啶酰菌胺的抗性及SdhB亚基突变类型 Table 3 Resistance to boscalid and mutation types in SdhB subunit of 20 B. cinerea isolates |
3 小结与讨论
病原菌对杀菌剂的敏感性检测是制定病害科学防控策略的重要基础工作[19]。本研究表明,上海地区6个草莓主产区的灰霉病菌对啶酰菌胺的敏感性已出现一定分化,抗性频率达29.74%。其中,啶酰菌胺对20.51%的菌株菌丝生长的EC50值 > 110 μg/mL,且对随机选取的18株抗性菌株孢子萌发的EC 50值均大于50 μg/mL,表明啶酰菌胺已几乎丧失对这部分菌株的抑制效果。因此,对于抗性菌株频率较高的浦东新区、嘉定等地区的草莓种植基地,应及时调整施药方案,减少啶酰菌胺的用药频次,可轮换使用其他负交互抗性的药剂种类,并密切监测病原菌对啶酰菌胺的敏感性变化动态,以避免防治失败。
本研究中,啶酰菌胺对符合正态分布的137株病原菌菌丝生长的EC50均值为 (1.11 ± 0.44) μg/mL,对40株敏感菌株孢子萌发的EC50均值为 (0.58 ± 0.25) μg/mL。与Zhang等针对中国浙江和江苏番茄、黄瓜等温室蔬菜上灰霉病菌建立的菌丝生长和孢子萌发敏感基线 [(1.07 ± 0.11) 和 (0.42 ± 0.05) μg/mL] 较为接近[15],而与Myresiotis等针对希腊克里特岛番茄、茄子等蔬菜上灰霉病菌建立的敏感基线 (2.09 和2.14 μg/mL) 有一定差别[20],其差异可能由不同病原菌种群的不同地理位置和寄主条件等所造成[21]。本研究获得的啶酰菌胺对草莓灰霉病菌敏感群体菌丝生长和孢子萌发的EC50均值及频率分布,可作为上海及附近地区草莓灰霉病菌种群对啶酰菌胺抗性监测的参考数据之一。
本研究中,病原菌孢子萌发与菌丝生长对啶酰菌胺的抗性表现一致,且孢子萌发对啶酰菌胺的抑制更为敏感 (敏感菌株EC50值 < 1.21 μg/mL,抗性菌株EC 50值 > 50 μg/mL)。参照Fernández-ortuño等 [1]将在50 μg/mL啶酰菌胺下孢子能正常萌发的菌株归为抗性菌株这一观点,笔者认为,孢子萌发抑制法 (含50 μg/mL啶酰菌胺的WA培养基) 更适用于B. cinerea对啶酰菌胺抗性的快速检测。
目前,美国、意大利、德国等多个国家田间已发现B. cinerea对啶酰菌胺的抗性突变菌株[1, 11, 22]。据现有研究报道,多数情况下病原菌对啶酰菌胺的抗性与其线粒体上琥珀酸脱氢酶SdhB亚基氨基酸链上225及272等位点的氨基酸发生突变有关,包括P225L/F/T和H272Y/R/L[10, 13],其中H272Y与 H272R突变较为常见[11]。本研究中对20株菌株SdhB序列的比对结果显示,H272R突变在上海草莓灰霉病菌中发生最普遍,另有少数菌株发生了P225F突变。突变发生 (H272R或P225F) 与抗性产生有强相关性,而抗性水平与突变类型无显著相关性。除了靶标位点基因发生突变外,Kretschmer等[23]与Leroux等[11]研究发现,膜转运蛋白基因的过表达同样会导致B. cinerea对包括啶酰菌胺在内的多种氧化呼吸链抑制剂产生低到中等水平抗性,例如,调控ABC (ATP-binding cassette) 家族AtrB转运蛋白的转录因子 (Mrr1) 发生突变,以及编码MFS (major facilitator superfamily) 家族膜转运蛋白基因mfsM2的启动子区因转座子插入而激活表达等。这种机制或许能够解释本研究中13株抗性菌株虽然均有H272R突变发生,但却表现出不同抗性水平的现象。关于本研究中的抗性菌株是否存在两种抗药机制的叠加作用等仍有待进一步研究。
| [1] |
FERNÁNDEZ-ORTUÑO D, CHEN F P, SCHNABEL G. Resistance to pyraclostrobin and boscalid in Botrytis cinerea isolates from strawberry fields in the Carolinas
[J]. Plant Dis, 2012, 96(8): 1198-1203. DOI:10.1094/PDIS-12-11-1049-RE |
| [2] |
王春艳. 草莓灰霉病发生危害及防治研究初报[J]. 植物保护, 1997, 23(3): 32-33. WANG C Y. Study on the damage and prevention of strawberry grey mould[J]. Plant Prot, 1997, 23(3): 32-33. |
| [3] |
WILLIAMSON B, TUDZYNSKI B, TUDZYNSKI P, et al. Botrytis cinerea: the cause of grey mould disease
[J]. Mol Plant Pathol, 2007, 8(5): 561-580. DOI:10.1111/mpp.2007.8.issue-5 |
| [4] |
曹婷婷, 高吉良, 陆丹, 等. 草莓灰霉病发病规律及综合防治技术研究进展[J]. 浙江农业科学, 2016, 57(12): 2045-2047. CAO T T, GAO J L, LU D, et al. Research progress on the pathogenesis and comprehensive control of strawberry grey mould[J]. J Zhejiang Agric Sci, 2016, 57(12): 2045-2047. |
| [5] |
颜范勇, 刘冬青, 司马利锋, 等. 新型烟酰胺类杀菌剂——啶酰菌胺[J]. 农药, 2008, 47(2): 132-135. YAN F Y, LIU D Q, SIMA L F, et al. Boscalid, a novel carboxamide aka anilide class of fungicides[J]. Agrochemicals, 2008, 47(2): 132-135. |
| [6] |
张颂函, 陈秀, 赵莉, 等. 6 种杀菌剂防治草莓灰霉病的田间药效评价[J]. 世界农药, 2015, 37(5): 47-49. ZHANG S H, CHEN X, ZHAO L, et al. Evaluation of control efficacy of six fungicides against gray mold rot of strawberry[J]. World Pestic, 2015, 37(5): 47-49. |
| [7] |
中华人民共和国农业部农药检定所. 农药登记数据: 有效成分——啶酰菌胺[EB/OL].[2018-04-03]. http://www.icama.org.cn/hysj/index.jhtml. Pesticide Examination Institute of the Ministry of Agriculture, the People’s Republic of China. Pesticide registration date, active ingredient, boscalid[EB/OL].[2018-04-03]. http://www.icama.org.cn/hysj/index.jhtml. |
| [8] |
Fungicide Resistance Action Committee (FRAC). Publications: pathogen risk list[EB/OL]. [2018-04-03]. http://www.frac.info/publications.
|
| [9] |
Fungicide Resistance Action Committee (FRAC). Publications: list of resistant plant pathogens[EB/OL]. [2018-04-03]. http://www.frac.info/publications.
|
| [10] |
YIN Y N, KIM Y K, XIAO C L. Molecular characterization of boscalid resistance in field isolates of Botrytis cinerea from apple
[J]. Phytopathology, 2011, 101(8): 986-995. DOI:10.1094/PHYTO-01-11-0016 |
| [11] |
LEROUX P, GREDT M, LEROCH M, et al. Exploring mechanisms of resistance to respiratory inhibitors in field strains of Botrytis cinerea, the causal agent of gray mold
[J]. Appl Environ Microbiol, 2010, 76(19): 6615-6630. DOI:10.1128/AEM.00931-10 |
| [12] |
HORSEFIELD R, YANKOVSKAYA V, SEXTON G, et al. Structural and computational analysis of the quinone-binding site of complex II (succinate-ubiquinone oxidoreductase) a mechanism of electron transfer and proton conduction during ubiquinone reduction[J]. J Biol Chem, 2006, 281(11): 7309-7316. DOI:10.1074/jbc.M508173200 |
| [13] |
DE MICCOLIS ANGELINI R M, HABIB W, ROTOLO C, et al. Selection, characterization and genetic analysis of laboratory mutants of Botryotinia fuckeliana (Botrytis cinerea) resistant to the fungicide boscalid
[J]. Eur J Plant Pathol, 2010, 128(2): 185-199. DOI:10.1007/s10658-010-9643-8 |
| [14] |
农药室内生物测定试验准则 杀菌剂第 2 部分: 抑制病原真菌菌丝生长试验 平皿法: NY/T 1156.2—2006[S]. 北京: 中国农业出版社, 2006. Pesticides guidelines for laboratory bioactivity tests part 2: petri plate test for determining fungicide inhibition of mycelial growth: NY/T 1156.2—2006[S]. Beijing: China Agriculture Press, 2006. |
| [15] |
ZHANG C Q, YUAN S K, SUN H Y, et al. Sensitivity of Botrytis cinerea from vegetable greenhouses to boscalid
[J]. Plant Pathol, 2007, 56(4): 646-653. DOI:10.1111/ppa.2007.56.issue-4 |
| [16] |
赵建江, 路粉, 吴杰, 等. 河北省设施番茄灰霉病菌对啶酰菌胺和咯菌腈的敏感性[J/OL]. 植物病理学报, 2017, doi: 10.13926/j.cnki.apps.000135. ZHAO J J, LU F, WU J, et al. Sensitivity of Botrytis cinerea from greenhouses in Hebei Province to boscalid and fludioxonil[J/OL]. Acta Phytopathologica Sinica, 2017, doi: 10.13926/j.cnki.apps.000135. |
| [17] |
农药室内生物测定试验准则 杀菌剂第 1 部分: 抑制病原真菌孢子萌发试验 凹玻片法: NY/T 1156.1—2006[S]. 北京: 中国农业出版社, 2006. Pesticides guidelines for laboratory bioactivity tests part 1: determining fungicide inhibition of pathogen spore germination on concave slides: NY/T 1156.1—2006[S]. Beijing: China Agriculture Press, 2006. |
| [18] |
HARJU S, FEDOSYUK H, PETERSON K R. Rapid isolation of yeast genomic DNA: Bust n' Grab[J]. BMC Biotechnol, 2004, 4: 8. DOI:10.1186/1472-6750-4-8 |
| [19] |
Fungicide Resistance Action Committee (FRAC). Publications: sensitivity baselines in fungicide resistance research and management[EB/OL]. [2018-04-03]. http://www.frac.info/publications.
|
| [20] |
MYRESIOTIS C K, BARDAS G A, KARAOGLANIDIS G S. Baseline sensitivity of Botrytis cinerea to pyraclostrobin and boscalid and control of anilinopyrimidine- and benzimidazole-resistant strains by these fungicides
[J]. Plant Dis, 2008, 92(10): 1427-1431. DOI:10.1094/PDIS-92-10-1427 |
| [21] |
郭建国, 杨凤珍, 杜蕙, 等. 甘肃玉米大斑病菌对嘧菌酯的敏感基线与抗药性监测[J]. 植物保护学报, 2015, 42(6): 1044-1049. GUO J G, YANG F Z, DU H, et al. Monitoring of resistance and baseline sensitivity of Setosphaeria turcica to azoxystrobin in Gansu [J]. J Plant Prot, 2015, 42(6): 1044-1049. |
| [22] |
PANEBIANCO A, CASTELLO I, CIRVILLERI G, et al. Detection of Botrytis cinerea field isolates with multiple fungicide resistance from table grape in Sicily
[J]. Crop Prot, 2015, 77: 65-73. DOI:10.1016/j.cropro.2015.07.010 |
| [23] |
KRETSCHMER M, LEROCH M, MOSBACH A, et al. Fungicide-driven evolution and molecular basis of multidrug resistance in field populations of the grey mould fungus Botrytis cinerea
[J]. PLoS Pathog, 2009, 5(12): e1000696. DOI:10.1371/journal.ppat.1000696 |
 2018, Vol. 20
2018, Vol. 20


