2. 中国农业科学院 棉花研究所,河南 安阳 455000
2. Institute of Cotton Research of Chinese Academy of Agricultural Sciences, Anyang 455000, Henan Province, China
1959年西德化学家Butenandt首次从家蚕Bombyx mori雌虫中分离并鉴定出其性信息素,其结构为 (E,Z)-8,10-十六碳二烯-1-醇 (8E,10Z-16: OH)[1],此后对昆虫性信息素的研究迅速展开,50多年来已有大量的昆虫性信息素被分离和鉴定。昆虫性信息素的研究为害虫防治提供了新的策略,为部分替代化学农药提供了可能[2]。昆虫性信息素可以干扰昆虫的化学通讯,选择性地控制害虫,比如大量诱捕 (mass trapping)、虫情监测 (monitoring) 以及干扰交配 (mating disruption) 等[3]。研究发现,昆虫性信息素类似物也能有效干扰昆虫的化学通讯[4],除其本身可能对昆虫具有引诱活性外,还能影响昆虫自然释放的性信息素的活性[5-6]。利用昆虫性信息素调控昆虫行为也符合有害生物综合治理 (integrated pest management) 中的推-拉策略 (pull-push strategies)[7]。1965年,Wright提出了一种干扰昆虫交配行为的猜想:将一种特别的气味 (如性引诱剂) 充分地弥漫在环境中,使雄虫不能察觉雌虫在释放性信息素方面的微小增量,且昆虫的感受器长时间接受一种气味会产生疲劳,在短时间内会停止识别气味信号,从而起到干扰昆虫交配行为的作用[4]。此后,大量学者对性信息素干扰昆虫交配行为的机理进行了研究,但目前对该机理仍没有定论。本文拟对昆虫性信息素及其类似物在干扰昆虫行为的机理和应用等方面的研究进展进行简要综述,旨在为使用性信息素及其类似物干扰昆虫化学通讯,进行害虫防治提供参考。
1 性信息素及其类似物干扰昆虫行为的机理研究昆虫嗅觉假说认为,亲脂性的性信息素分子穿过昆虫嗅觉感受器表皮上的毛孔,进入雄虫的触角感受器,与性信息素受体蛋白结合并在亲水性的管腔中溶解。性信息素分子通过感受腔传输到附着在感受器神经元树突膜的接收蛋白上,随即产生反应电位,后经神经元的轴突传递到位于中枢神经系统的嗅小球上,使得雄虫产生各种复杂的行为反应。然后,性信息素分子从感受器中被除去,并被性信息素代谢酶分解,感受器准备接收新的性信息素分子。雄虫通过不断接收和分解雌虫释放的性信息素分子来确定雌虫的位置,并飞向待交配的雌虫[8-13]。Liljefors等[14-15]利用单细胞测定和分子力学计算方法,对黄地老虎Agrotis segetum性信息素的结构-活性关系进行了研究,提出性信息素-受体模型假说,阐释了性信息素与结合蛋白相互作用的机理。他们认为,受体上存在3种尖齿状的结合位点:一是与性信息素的极性官能团以氢键作用结合的位点;二是与性信息素上的双键以静电力的相互作用对接的位点;三是与性信息素端基的烷烃基团以极弱的色散力结合的位点。
自1982年以来,对干扰昆虫交配行为机理的研究一直是科学家关注和争论的热点[16-18]。针对这一昆虫嗅觉机制中的复杂生理生化过程,结合众多干扰昆虫交配的试验,Bartell总结了性信息素干扰昆虫交配行为的5种机制[19]:一是直接神经生理学效应,相对稳定、高剂量的昆虫性信息素氛围使得雄虫性信息素受体和中枢神经产生嗅觉适应;二是大量错误的嗅觉信号使雄虫响应混乱,不能对雌虫释放的性信息素产生正确的响应;三是雄虫不能从雌虫释放的性信息素和高浓度的外源性信息素气味中辨别出雌虫信号;四是大量单一的性信息素组分扰乱了雌虫所释放性信息素的组分和比例,从而产生不平衡的嗅觉信号输入,使雄虫不能正确识别雌虫性信息素;五是特定性信息素组分 (性信息素拮抗剂) 干扰了雄虫对雌虫所释放性信息素组分的响应。Miller等利用生物化学动力学手段,在平行分析酶的动力学和性信息素与受体的竞争动力学后,证明了商业化的苹果蠹蛾Cydia pomonella迷向剂的作用机理是竞争性吸引雄虫,而非雄虫不能在弥漫的性信息素氛围中辨别雌虫性信息素,从而使得苹果蠹蛾C. pomonella的交配行为受到干扰,进而起到控制害虫的作用 (图1)[20]。
上述干扰昆虫交配的机制存在很多不足,因此,为了获得较好的干扰昆虫交配的效果,人们通常采取以下3种基本方法 (图2、图3)[21]:一是将人工合成的性信息素组分或混合物弥散到环境中,干扰雄虫定位未交配雌虫的能力;二是利用近源种昆虫释放的性信息素干扰昆虫的种内识别,降低种内吸引;三是利用拟性信息素不可逆地定量阻塞触角受体蛋白结合位点,或利用性信息素拮抗剂专一地抑制性信息素代谢酶的活性,破坏雄虫触角对性信息素的识别和代谢功能[22-25]。
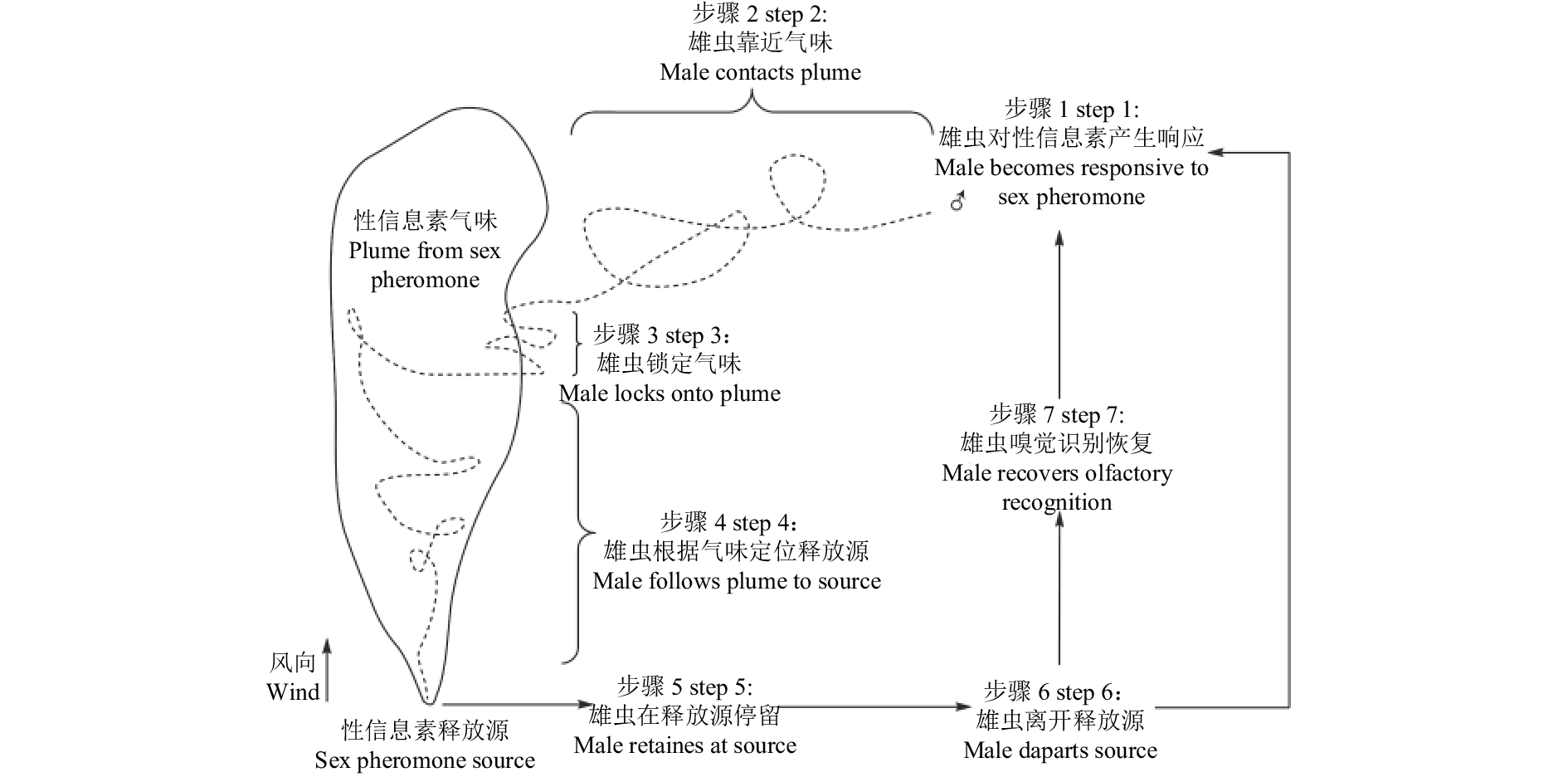
|
图 1 苹果蠹蛾雄虫靠近性信息素源的连续步骤 (♂, 雄虫飞行起点) Fig. 1 Progressive steps leading a codling moth male to sex pheromone source (♂, starting point of male moth) |
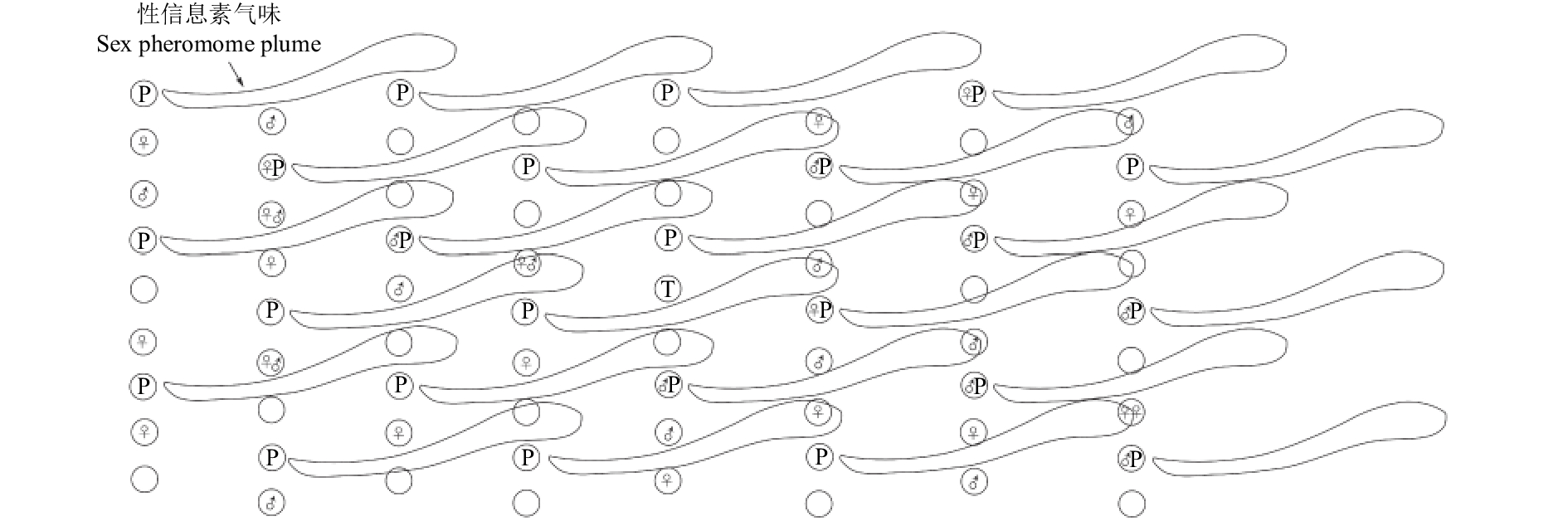
|
注:图式为1个0.3 hm2的果树试验小区:72棵树 (○),24个均匀分布性信息素散发器 (P),20只随机分布的雄蛾 (♂),20只随机分布的雌蛾 (♀) 和1个小区中间的监测诱捕器 (T)。风向自左向右。 Notes: Diagram of a 0.3-hm2 orchard plot of 72 trees (○), containing 24 evenly distributed pheromone dispensers (P), 20 randomly distributed male moths (♂), 20 randomly distributed female moths (♀), and one centrally located monitoring trap (T). Wind originates from left to right. 图 2 果园中利用性信息素干扰苹果蠹蛾交配的示意图 Fig. 2 Sketch map of mating disruption of codling moth by sex pheromone in orchard |
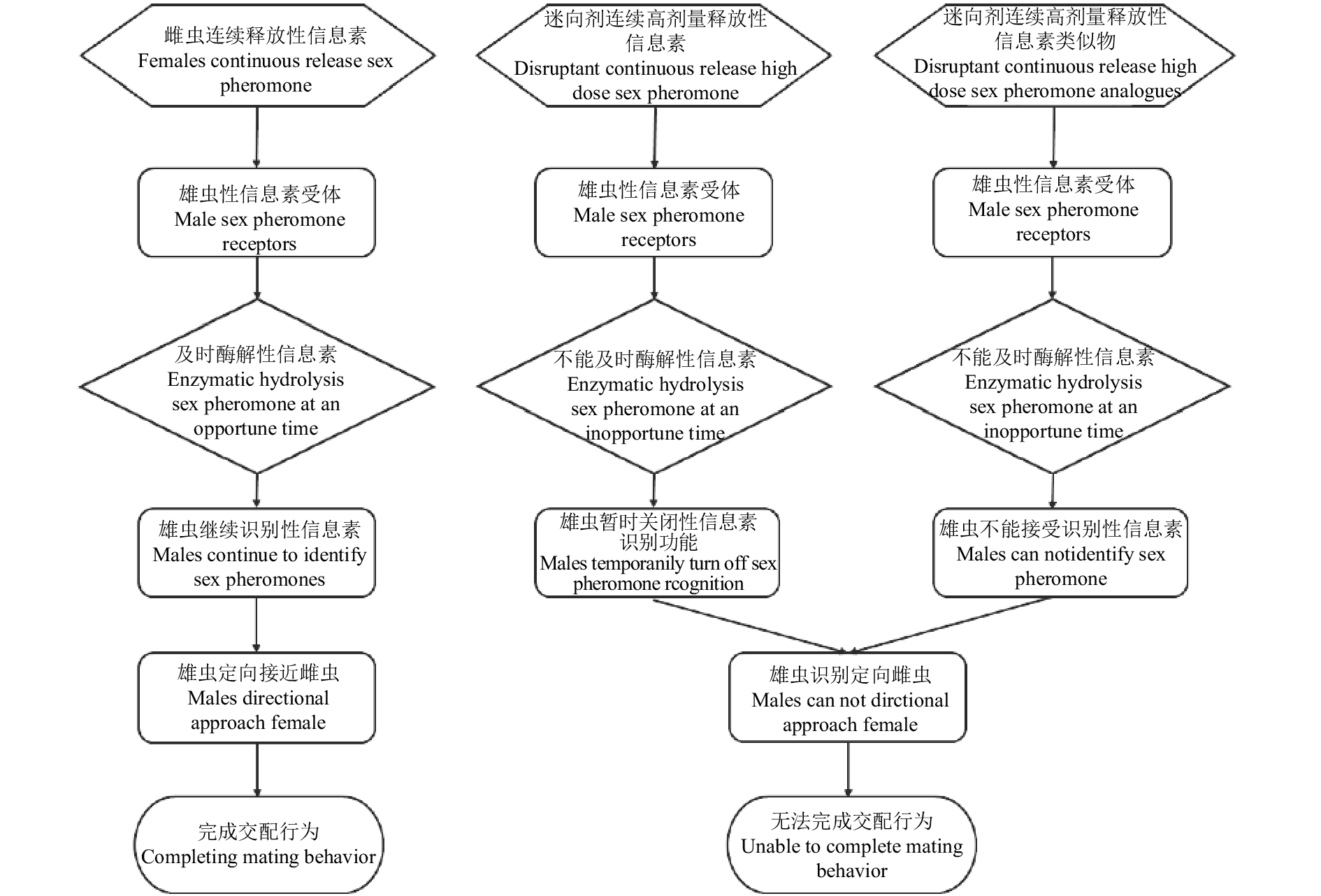
|
图 3 迷向剂干扰交配原理示意图 Fig. 3 Mechanisms of mating disruption by disruptant |
2 性信息素及其类似物干扰昆虫行为的应用
性信息素是昆虫个体与同种其他成员进行通讯的化学信号物质[26]。大部分昆虫依靠化学气味来识别或定位异性,从而完成交配,因此性信息素对于昆虫的繁殖具有至关重要的作用。进入21世纪以来,应用干扰昆虫交配策略治理害虫的面积几乎以几何级数的速率增长[27-28]。然而,人们发现,长期单一使用某些性信息素组分可能导致害虫产生抗性[29-30]。此后,科学家发现,人工合成的、在自然界中不存在但在结构上与天然性信息素组分相似的性信息素类似物,同样能以某种方式影响昆虫生理或行为,继而影响昆虫化学通讯[31]。
2.1 性信息素干扰昆虫行为的应用现状自1959年人类发现第一种昆虫性信息素后,已有上百种昆虫性信息素成功商品化,并在害虫的综合防治中占有越来越重的位置。随着性信息素干扰昆虫化学通讯研究的进一步发展,科学家已逐渐从对性信息素组分和比例的研究转向了缓释材料、施用剂量和密度等方面的研究。
2.1.1 缓释材料应用现状随着干扰昆虫行为机理研究的深入,学者开发出了大量用于干扰昆虫行为的缓释剂型,并发现缓释材料对性信息素的有效释放非常重要。早期用于干扰昆虫行为的缓释材料多为复合橡胶、聚氯乙烯、聚乙烯和石蜡油等,利用这些材料可制成橡胶头、毛细管、塑料瓶和迷向丝等。这些缓释材料在一定程度上减少了性信息素在田间的分解速率,能在一定时期内将性信息素的释放剂量控制在适宜的范围,但是其田间有效使用期限仍然有限。
近年来,微囊作为一种新型材料逐渐被应用于农业各个领域。微囊技术可使诱芯内部与周围环境隔绝,使内部化学物质免受阳光、空气、湿度和pH值等的影响,从而减缓了有效成分分解和氧化变质的速度,最大限度保持其理化性质,有效延长活性物质的挥发时间,因而在性信息素的田间使用领域具有极高的应用价值。高分子成膜材料包裹活性液体或固体形成微小粒子的过程被称为微囊化,根据粒径的不同,微粒由大到小分别称为微球、微粒、微囊和纳米胶囊[32-33]。近年来学者对可喷施的性信息素微囊产品的研究越来越多,该种剂型使用成本较低,可在果园里与杀虫剂和寄主植物挥发物混用,也可以大规模地利用飞机喷施[34-38]。
将核桃果峰斑螟Acrobasis nuxvorella的性信息素组分 (E,Z)-9,11-十二碳二烯醛 (E9, Z11-12: Ald) 制备成5%的微囊喷雾剂,以有效成分6~10 g/hm2的密度喷施在胡桃田中,同时用装有性信息素的诱捕器来监测害虫数量。试验发现,喷施过性信息素微囊的胡桃田中,诱捕器引诱到的虫数与对照田相比减少了89.6%,干扰交配效果显著[39]。在澳大利亚的桃园和梨园中,以125 mL/hm2的剂量喷施性信息素微囊剂来防治梨小食心虫Grapholitha molesta,通过调查果园中果树茎尖和果实受害率发现,喷施性信息素微囊的防治效果优于喷洒标准广谱杀虫剂,且干扰交配率为96%~99%[40]。
Alan等发现,喷施高氰戊菊酯、啶虫脒和苹果蠹蛾性信息素微囊剂混合物的果园中,果实受害率显著低于仅喷施性信息素微囊剂的处理[41]。同理,Orkun等将梨酯和性信息素 (E,E)-8,10-十二碳二烯醇 (E8, E10-12: OH) 制成微囊剂喷洒在苹果园中,发现同时喷洒梨酯和性信息素的果园中苹果蠹蛾量比空白对照果园降低了85%,蛀果率降低了85%~93%,说明同时喷施梨酯能增强性信息素对苹果蠹蛾的干扰效果[35]。
性信息素纳米制剂也已成为研究热点。性信息素纳米凝胶在室外条件下通常具有很好的稳定性,且可以降低性信息素的释放速率,使得性信息素产品的储存和运输变得更加容易,如以聚合物纳米纤维为载体的梨小食心虫G. molesta性信息素在田间可实现连续3周的有效释放[42]。最近的研究表明,用静电纺丝技术可以生产纳米级别的信息素缓释剂型。通过不同时间的雄虫EAG试验和触杀/诱杀死亡率试验,室内评估了含有氯氰菊酯和梨小食心虫性信息素或仅含有性信息素的非编织纳米纤维的活性。结果表明,不同暴露时间下雄虫的EAG响应在各处理间没有显著性差异。通过对同时含有性信息素和氯氰菊酯的纳米纤维与仅含性信息素的纳米纤维进行比较,发现二者的EAG响应基本相同。在含有氯氰菊酯和性信息素的纳米纤维中暴露84 d后,试虫的触杀死亡率高于87%。在诱杀试验中,死亡率为26%~56%。该试验结果说明在纳米纤维中引入氯氰菊酯不会干扰性信息素的引诱作用,且新型的纳米纤维具有使性信息素和化学农药能够长时间缓慢释放的优良性能[43]。
2.1.2 施用剂量及密度研究现状早期的研究认为,高密度且高剂量地释放性信息素可以使环境具备有效的性信息素氛围,以起到干扰昆虫行为的作用,进而开发出水悬浮微囊、中空纤维管等。后来研究发现,低密度、高剂量释放性信息素及其类似物也能起到干扰昆虫行为的作用[6, 20]。不同剂量的诱芯适用于不同辐射半径的大量诱捕区域和干扰交配区域,因此研究性信息素的施用剂量和密度有助于明确对不同害虫进行虫情监测、大量诱捕和干扰交配时的田间施用参数,使害虫防治更具有目的性和针对性。此外,随着学者对性诱剂田间应用研究的深入,诱捕器的悬挂高度也成为了研究方向之一[44]。
新西兰草地蛴螬Costelytra zealandica是一种常见的危害牧草生态系统的害虫。Harper等将其性信息素组分苯酚用于田间诱捕试验中,发现在1~100 mg剂量范围内引诱到的虫量并没有显著性差异,但在1~100 μg剂量范围内引诱到的虫量显著减少。由于苯酚具有一定的毒性,因此认为诱芯中含有1 mg性信息素组分是保证有效防治效果的最佳剂量[45]。
2016年Yan等经过气相色谱-质谱 (GC-MS) 分析、气相色谱-触角电位联用(GC-EAD)检测和田间诱捕试验后发现,二点委夜蛾Athetis lepigone的性信息素组分为 (Z)-7-十二碳烯乙酸酯 (Z7-12: Ac) 和 (Z)-9-十四碳烯乙酸酯 (Z9-14: Ac),且当诱芯中含有0.25~0.50 mg性信息素组分时对雄虫的诱捕效果最好,该结论为制定有效策略以监测和防治二点委夜蛾提供了参考[46]。金纹小潜细蛾Phyllonarycter ringoniella是一种重要的苹果树害虫,在中国、日本、韩国等东亚国家广泛存在。Li等在苹果园设置了150 traps/hm2的性信息素诱捕处理,使得该果园中的害虫种群密度大幅下降[47]。
与大量诱捕相比,用于害虫虫情监测的性诱剂通常具有更高的灵敏性,并且在田间可以大面积、零散式分布。在欧洲北部和中部地区,Haplodiplosis marginata是一种为害谷类的农业昆虫。Rowley等将室内筛选出的具有引诱活性的性信息素化合物 (R)-2-壬基丁酸酯用于田间试验,发现性信息素剂量与平均诱捕数量呈对数-线性关系。使用过高剂量的诱芯进行田间监测会使诱捕器内部空间迅速饱和,增加人工劳动强度;使用剂量过低则达不到监测目的。因此,使用含有0.5 mg (R)-2-壬基丁酸酯的聚乙烯塑料瓶来监测其种群数量时敏感度最高[48]。
Rao等将含有不同剂量柑橘潜叶蛾Phyllocnistis citrella性信息素的诱捕器悬挂在果园中莱蒙树冠层高度及其1/2高的位置,统计2年的雄虫诱捕数量后发现,含量为5 mg的诱芯的引诱效果显著高于8 mg的诱芯,悬挂于作物冠层高度1/2位置处理的诱捕效果显著高于冠层高度的处理。为了进一步评估诱芯含量和放置密度对监测效果的影响,研究人员设置了10 mg (2 traps/0.3 hm2)、15 mg (3 traps/0.3 hm2) 和20 mg (4 traps/0.3 hm2) 3个处理的田间监测试验,发现20 mg (4 traps/0.3 hm2) 处理的监测效果最好,平均引诱量是10 mg (2 traps/0.3 hm2) 的2.75倍[49]。
将大量的性信息素成分释放到被害虫危害的作物田中,雄虫在性信息素过度饱和的环境中其化学通讯系统受到干扰,从而影响交配行为。与大量诱捕技术相比,用于迷向的性信息素在田间的分布密度通常更高且剂量更大。在生长季早期靶标害虫种群数量较低时,利用迷向策略大面积的使用性信息素来防治害虫效果较佳[50]。这是由于生长季早期气温较低,性信息素挥发速度较慢,持效期较长,同时也可以较好地控制早期害虫。此外,大规模使用性信息素还可以降低未防治区已交配雌虫的迁入和边界性信息素浓度较低造成迷向失败的风险。因此,成本效益过高成为迷向技术在许多分散的农作物和水果生产田中应用的主要障碍[51]。
Tcheslavskaia等在美国弗吉尼亚州野外的森林中,利用含有不同剂量外消旋环氧十九烷的塑料膜片进行舞毒蛾Lymantria dispar的干扰交配试验,发现昆虫的交配干扰率与性信息素使用剂量呈很强的正相关性,当有效剂量高于15 g/hm2时,林间雌虫的交配成功率与对照区域相比降低了近99%。进一步的研究表明,根据林间监测诱捕器的诱捕数量灵活调整施药剂量,既能获得较好的防治效果,还可以降低防治成本[34]。
2014—2016年,Chen等在中国东北地区开展了亚洲玉米螟Ostrinia furnacalis性信息素干扰交配的田间试验。研究人员设置了只含有 (Z)-12-十四碳烯乙酸酯 (Z12-14: Ac) 或 (E)-12-十四碳烯乙酸酯 (E12-14: Ac) 以及两者质量比为1 : 1的混合物诱芯,分别进行田间迷向后,发现采用含有0.2 mg混合物的诱芯,当施用密度范围为200~400 points/hm2时迷向率可达到85%,干扰效果较好。此外,该处理组作物叶片和穗花保护率与空白处理相比也均有显著提高[52]。
Vogt等将葡萄卷叶蛾Eupoecifia ambiguella性信息素主要组分 (Z)-9-十二碳烯乙酸酯 (Z9-12: Ac) 作为迷向剂,在葡萄园中连续试验2年后发现,每公顷施用500个诱芯 (每个诱芯含100 mg性信息素组分),干扰交配率高达83%,显著降低了葡萄园中一代和二代害虫数量,并且该迷向技术于1986年在德国取得了农药登记[53]。Varner等在意大利葡萄园中对葡萄花翅小卷蛾L. reliquana进行了连续9年的干扰交配研究,同样取得了很好的控制效果,特别是对二代小卷蛾的控制效果非常显著[8]。
为防治苹果褐卷蛾Epiphyas postvittana,Suckling和Shaw利用性信息素在新西兰纳尔逊的苹果园中开展了大规模的迷向试验,发现2 000 dispensers/hm2的高剂量处理区中果实受害率显著低于1 000 dispensers/hm2标准剂量处理区,且极大地减少了甲基谷硫磷等高毒农药的用量,降低了农药在苹果中残留的风险,提高了果实品质[54]。此外,在美国加利福尼亚州,为了治理肆虐的苹果褐卷蛾,应用性信息素对果园进行迷向处理,显著降低了成虫的交配率[17]。苹果蠹蛾C. pomonella作为苹果园的主要害虫之一,已对多种杀虫剂产生抗性,防治难度大。为提高果实品质、降低农药残留,利用性信息素 (E,E)-8,10-十二碳二烯醇 (8E, 10E-12: OH) 和 (E,E)-8,10-十二碳二烯乙酸酯 (8E, 10E-12: Ac) 进行迷向处理的策略成为了治理该虫的最佳选择,以100 g/hm2的剂量施用合成性信息素,可在整个生长季内有效地控制其种群大小[55]。
2002年,Kovanci等进行了梨小食心虫微囊迷向剂试验[56]。试验设置低剂量、中剂量和高剂量3个处理,所有处理均先用化学农药防治第1代成虫。结果表明:中剂量和高剂量迷向剂处理可成功地将第2、3和4代成虫控制在较低水平;性信息素迷向处理组诱捕到的虫量显著低于无性信息素对照;低剂量性信息素处理组诱捕到的虫数显著高于其他2个处理;收获时性信息素迷向处理组蛀果率均小于1%,且处理组间没有显著差异;在虫量较低的情况下,低剂量、低频率地使用性信息素微囊剂是防治该虫的有效方法,随着虫量的增加防治效果逐渐下降。因此使用迷向剂期间应注意监测田间害虫种群数量,在田间虫量较高的情况下提高迷向剂的使用剂量,以更加科学合理地使用迷向剂和有效地控制害虫种群。
Wu等在甘蓝田中进行的干扰交配试验也印证了性信息素使用剂量与交配干扰率的相关性[57]。在167 MD dispensers/hm2的剂量下,小菜蛾Plutella xylostella种群数量相对于常规防治区降低了近50%,甘蓝叶片上的幼虫量和卵量也均有下降。同时该研究表明,利用性信息素迷向法防治对多种化学农药产生抗性的害虫是一种很有前景的植物保护策略。
以质量比9:1的比例,定时、定量地释放甜菜夜蛾Spodoptera exigua性信息素的2种成分 (Z,E)-9,12-十四碳二烯乙酸酯 (9Z, 12E-14: Ac) 和 (Z)-9-十四碳烯醇 (Z9-14: OH) 进行害虫迷向试验,发现在46 mg/(hm2·d) 剂量下,处理区与对照区相比干扰交配率高达99%,产卵量降低了76%[58]。
利用质量比为10:1的 (Z,E)-9,11-十四碳二烯乙酸酯 (9Z, 11E-14: Ac) 和 (Z,E)-9,12-十四碳二烯乙酸酯 (9Z, 12E-14: Ac),以有效成分50 mg/hm2的剂量对花生田中的斜纹夜蛾Spodoptera litura进行迷向法防治,发现处理区的卵量和幼虫数量明显低于对照区,说明迷向剂可干扰害虫交配,进而降低田间下一代的害虫数量[59]。
利用化学性信息素定量释放器 (MSTRSTM),以约0.6 μg/min和0.2 μg/min的速率分别释放印度谷螟Plodia interpunctella性信息素组分 (Z,E)-9,12-十四碳烯乙酸酯 (Z9, E12-14: Ac) 和麦蛾Sitotroga cerealella性信息素组分 (Z,E)-7,11-十六碳烯乙酸酯 (Z7, E11-16: Ac) 进行仓储害虫的迷向试验,发现印度谷螟和麦蛾雄虫定位雌虫性信息素的干扰率分别为70%和40%,雌虫的交配率分别降低约40%和30%,说明干扰交配策略可以在一定程度上降低仓储害虫的危害,且性信息素的释放速率对干扰效果有较大影响[60]。
2.2 性信息素与其他挥发性物质混合应用现状寄主植物挥发物不仅能被昆虫用来寻找寄主植物,也可被这些昆虫的天敌用来寻找猎物。越来越多的证据表明,寄主植物挥发物具有和性信息素一样的帮助昆虫寻找可交配异性的功能。因此,寄主植物挥发物对昆虫的取食、交配、产卵和栖息等行为也具有诱导作用。寄主植物的花、果实和叶片常常是昆虫聚集的地点,将寄主植物挥发物与性信息素联合使用可有效引诱昆虫到达有食物和“配偶”的地点[61]。此外,将寄主植物挥发物和性信息素混合制成引诱剂,可同时诱杀雌、雄性昆虫[62]。许多研究证实,将寄主植物挥发物与性信息素混合的诱芯对昆虫的引诱效果显著高于仅含有性信息素的诱芯[63-68],因此能进一步提高对昆虫行为的干扰效果。
Sans等[69]的最新研究发现,将葡萄花翅小卷蛾Lobesia reliquana性信息素与寄主植物挥发物以质量比为1 : 102、1 : 103和1 : 104的比例混合,在风洞试验中,添加了寄主植物挥发物的3个处理中雄虫起飞和成功着陆的百分比均显著地高于仅含有性信息素的处理;此外,在添加了寄主植物挥发物的3个处理中,雄虫起飞、定向飞行和成功着陆所需时间均少于仅含有性信息素的处理。由此可见,植物挥发物对葡萄花翅小卷蛾性信息素的引诱效果有增效作用[69]。
随着对化学调控昆虫行为研究的深入,Pyke等在1987年首次提出了推-拉策略[70],他们通过串联设置驱避和引诱的刺激来调控棉铃虫Helicoverpa armigera在棉花田的分布,从而降低了对已产生抗性的化学农药的依赖度。随后该策略的概念被Miller和Cowles在不使用化学农药防治葱地种蝇Delia antigua的试验中正式定义和完善[71]。推-拉策略通过视觉干扰、非寄主植物挥发气味、抗聚集信息素、报警信息素、产卵抑制剂和拒食剂来调控害虫行为,使害虫远离目标作物,同时使用视觉刺激、寄主植物挥发气味、聚集信息素、性信息素、产卵信息素和嗅觉兴奋剂来吸引害虫,将其集中诱捕到引诱区域中杀灭。推-拉策略通过化学调控昆虫行为以影响其种群分布和数量,使害虫防治效果和作物产量最大化,同时把对环境的负面影响降到最低。目前发表的利用推-拉策略已成功控制的害虫种类包括农业、园艺、林业、兽医、医疗和城市害虫等[69]。例如:Borden等利用性信息素、反性信息素、寄主挥发物及非寄主挥发物等通过推-拉策略干扰危害针叶林的中欧山松大小蠹Dendroctonus ponderosae的行为,在一定程度上治理了害虫,保护了森林植被,进而减少了经济损失[72]。此外,联合使用昆虫的各种化学信息素也是害虫防治中的一种技术创新[73]。
2.3 性信息素类似物干扰昆虫行为的应用现状大量干扰化学通讯的试验都是利用昆虫性信息素或性信息素的单一组分进行的,而利用性信息素类似物干扰昆虫行为的研究应用较少。根据作用效果不同,昆虫性信息素类似物可分为拟性信息素、增效剂和拮抗剂;根据性信息素分子结构中修饰位点的不同,则可分为碳链修饰的性信息素类似物和极性基团修饰的性信息素类似物。
2.3.1 碳链修饰的性信息素类似物应用现状碳链修饰包括昆虫性信息素分子中非极性部分碳链的链长、不饱和键的数量和位置及顺反异构的改变,碳链上的氢被其他基团取代以及烯烃的环氧类似物等。澳大利亚果园害虫番石榴蛾Coscinoptycha improbana性信息素组分为 (Z)-11-十八碳烯-8-酮 (Z11-18: 8- Kt)(图式1,化合物1) 和 (Z)-12-十九碳烯-9-酮 (Z12-19: 9- Kt)(2),利用其碳链延长类似物 (Z)-13-二十碳烯-10-酮 (Z13-20:10- Kt)(3) 进行干扰交配试验,发现其对成虫交配的干扰率高于86%,而Z13-20:10- Kt是鳞翅目蛀果害虫桃小食心虫Carposina niponensis性信息素的主要成分[74]。表明一种昆虫的性信息素或单一组分有可能是另一种昆虫的交配干扰剂。

|
图式1 番石榴蛾性信息素组分以及类似物 Scheme1 Structural formula of sex pheromone of Coscinoptycha improbana and analogue |
Burger对苹果异形小卷蛾Laspeyresia pomonella的研究发现,其性信息素 (Z)-8-十二碳烯乙酸酯 (Z8-12: Ac)(图式2,4) 和 (E)-8-十二碳烯乙酸酯 (E8-12: Ac)(5) 在合成过程中的副产物7-乙烯基癸烷乙酸酯 (6) 可有效地干扰未交配雌虫或性信息素诱芯对雄虫的吸引,因而其可用于该种害虫的交配干扰[75]。
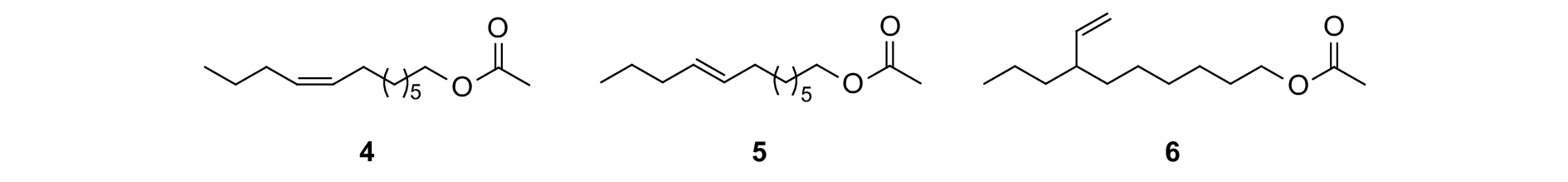
|
图式2 苹果异形小卷蛾性信息素组分以及类似物 Scheme2 Structural formula of sex pheromone of Laspeyresia pomonella and analogue |
白蜡窄吉丁Agrilus planipennis对于白腊树是一种具有毁灭性的入侵害虫,在对其性信息素的研究后发现,相对于合成成本高、反应步骤多且产率较低的 (Z)-3-十二碳烯-12-内酯 (图式3,7),其性信息素双键饱和类似物 (8) 的合成更加方便,成本更低,且可用于该种害虫的交配干扰[50]。
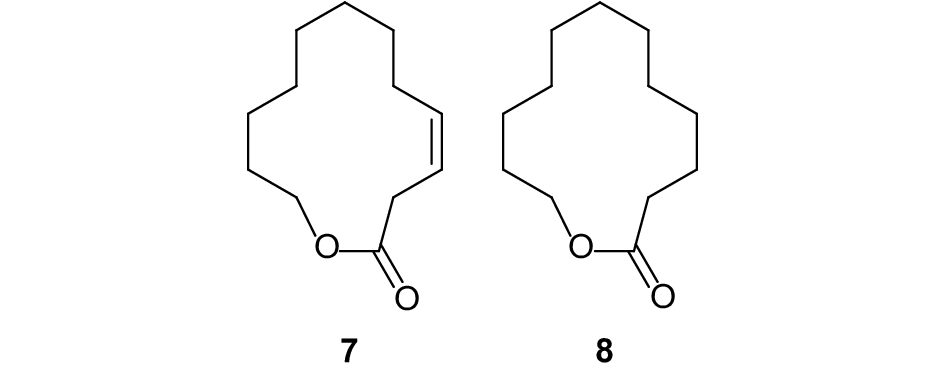
|
图式3 白蜡窄吉丁性信息素组分以及类似物 Scheme3 Structural formula of sex pheromone of Agrilus planipennis and analogue |
采用豌豆小卷蛾Cydia nigricana的性信息素 (E,E)-8,10-十二碳二烯乙酸酯 (E8, E10-12: Ac) (图式4,9) 及其同分异构体E8, Z10-12: Ac (10) 和Z8, E10-12: Ac (11) 在田间进行干扰交配试验,同样取得了良好的效果,放置了含100 μg性信息素的诱捕器在对照区可引诱到大量雄虫,但是在干扰交配处理区则几乎引诱不到雄虫[76]。
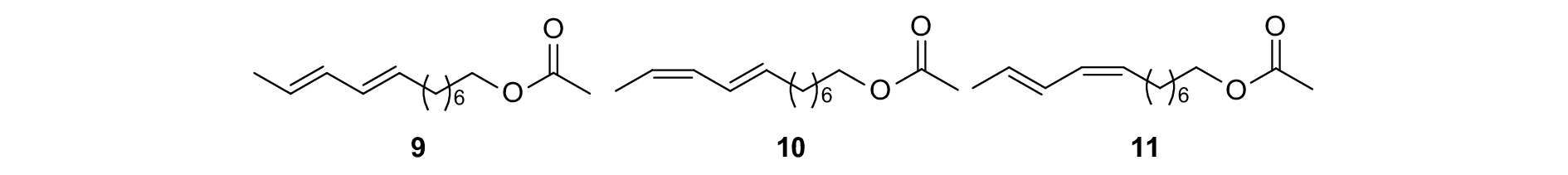
|
图式4 豌豆小卷蛾性信息素组分以及类似物 Scheme4 Structural formula of sex pheromone of Cydia nigricana and analogues |
Francisco等设计并合成了一系列的松异舟蛾Thaumetopoea pityocampa性信息素 (Z)-13-十六碳烯-11-炔基乙酸酯 (图式5,12) 的类似物,并用其进行了3年的田间干扰交配试验,发现将其单氟取代双键氢的类似物 (13) 与性信息素以质量比为3 : 1混合时,对成虫的迷向率为50%;其烯烃的饱和环氧类似物 (14) 以不同质量比与性信息素混合,均能表现出显著的增效作用,而其丙酸酯类似物 (15) 则表现出抑制作用;其中由极性基团修饰得到的 (Z)-13-十六碳烯-11-炔基醛 (16) 与性信息素以质量比为1 : 10混合时,对成虫的诱捕量显著增加,然而以质量比为10 : 1混合时,诱捕量却显著降低[77]。由此可见,同一性信息素组分的不同类似物可能表现出不同的干扰效果,而同一类似物与性信息素以不同质量比混合时也可能表现出截然相反的生物活性。
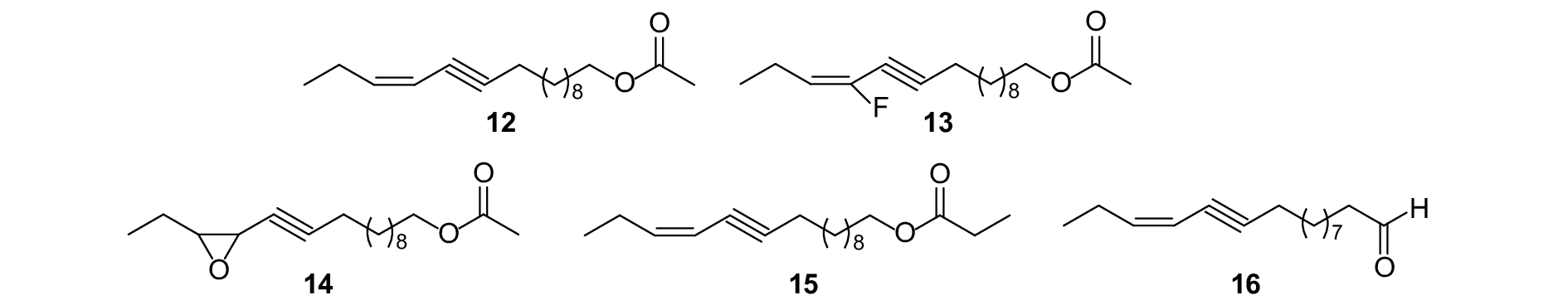
|
图式5 松异舟蛾性信息素组分以及类似物 Scheme5 Structural formula of sex pheromone of Thaumetopoea pityocampa and analogues |
2.3.2 极性基团修饰的性信息素类似物应用现状
昆虫性信息素常见的化合物种类为长链的醇、醛、酯、酮和酸,其极性基团修饰包括醇羟基、醛基、酯基、酮基和羧基等极性基团的相互转换,以及乙酸酯的甲酸酯、丙酸酯和卤代烷酯类似物等。
烟芽夜蛾Heliothis virescens的性信息素中含有 (Z)-11-十六碳烯醛 (Z11-16: Ald) (图式6,17) 和 (Z)-9-十四碳烯醛 (Z9-14: Ald)(18)。Klun等在烟芽夜蛾性信息素中添加0.3%~2%的性信息素类似物 (Z)-9-十六碳烯醇 (Z9-16: Ald)(19) 后,在田间对雄虫的诱捕量增加了1倍,诱芯的引诱效果显著提高[78]。而Z9-16: Ald也是美洲棉铃虫Heliothis zea性信息素的组分,其二烯类似物 (Z)-1,12-十七碳二烯 (20) 在田间能显著干扰美洲棉铃虫雄虫的交配行为,且这种新的二烯类似物合成简便、稳定性高,可用于提高害虫防治效果[79]。
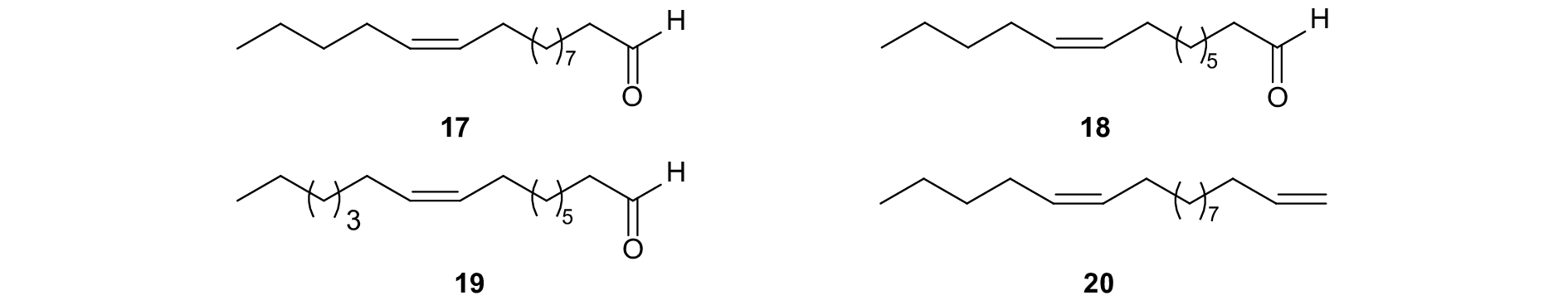
|
图式6 烟蚜夜蛾和美洲棉铃虫性信息素组分以及类似物 Scheme6 Structural formula of sex pheromone of Heliothis virescensandHeliothis zea and analogues |
Zhang等发现,仅由盲蝽科雄虫分泌的丁酸己酯 (图式7,22) 和 (E)-2-己烯丁酸酯 (23) 等性信息素类似物能抑制雄虫对雌虫性信息素的识别,起到干扰交配的作用[80]。张涛将丁酸己酯添加到绿盲蝽Apolygus lucorum性信息素中(21),田间试验发现,丁酸己酯对该虫交配的干扰作用与添加剂量呈正相关关系;将丁酸己酯与性信息素以质量比1 : 10混合,则诱芯基本失去引诱活性[81]。
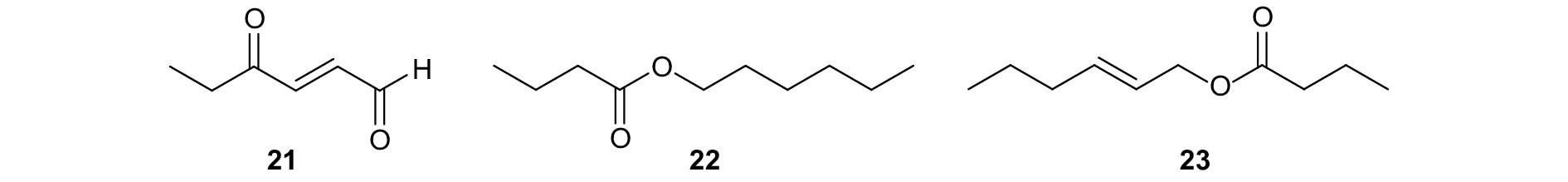
|
图式7 绿盲蝽性信息素组分以及类似物 Scheme7 Structural formula of sex pheromone of Apolygus lucorum and analogues |
由于卤素的特性,卤代烷酯类似物,特别是氟代烷酯类似物是干扰昆虫行为研究的一大热点。氟原子可以模拟氢原子在昆虫性信息素受体位点的空间结构要求,同时具备极强的电负性,使得类似物分子具有极性和非极性的双重特性;同时脂溶性增强,使类似物能更加有效地被昆虫嗅觉受体识别以及转化成电位信号进行传导[31]。
Carmen等设计合成了一系列蛀茎夜蛾Sesamia nonagrioides的卤代烷酯性信息素类似物,在EAG试验中均能显著降低雄虫对性信息素的响应。将类似物与性信息素以质量比为1:10混合时,三氟乙酸酯 (图式8,25)、单氟乙酸酯 (26) 和单溴乙酸酯 (27) 均能显著地干扰雄虫对雌虫性信息素的识别及定位[82]。
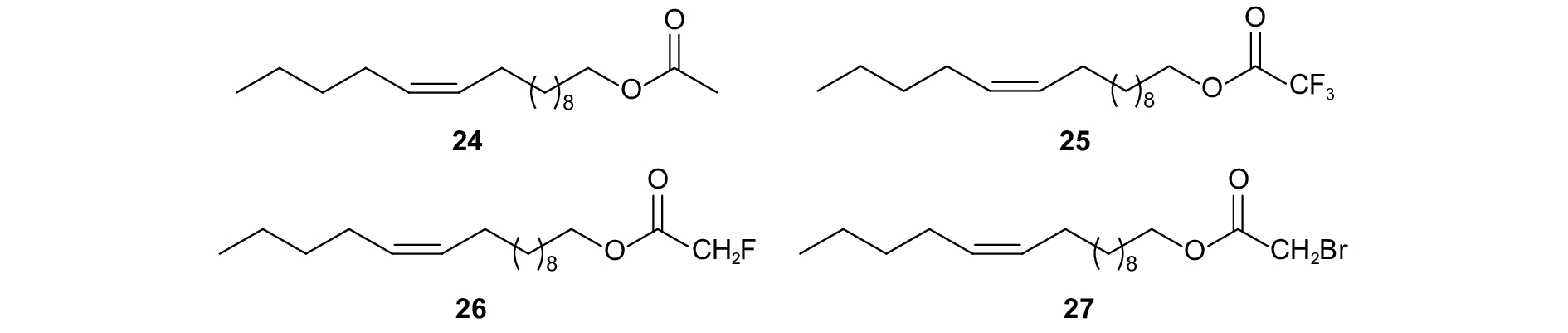
|
图式8 蛀茎夜蛾性信息素组分以及类似物 Scheme8 Structural formula of sex pheromone of Sesamia nonagrioides and analogues |
梨小食心虫性信息素 (Z)-8-十二碳烯乙酸酯 (Z8-12: Ac) 的氯甲酸酯 (图式9,29) 和内酯类似物 (30)虽然对雄虫的远距离迁飞无影响,但可以降低其近距离的交配率[83]。若将这些类似物与影响其远距离飞行的气味配合使用,将有望成为一种更能有效控制此类害虫的方法。

|
图式9 梨小食心虫性信息素组分以及类似物 Scheme9 Structural formula of sex pheromone of Grapholitha molesta and analogues |
Koshihara等发现,在小菜蛾P. xylostella性信息素中添加微量的 (Z)-11-十六碳烯醇 (Z11-16: OH)(图式10,31) 有增效作用[84]。近年,董梦雅以 (Z)-11-十六碳烯乙酸酯 (Z11-16: Ac)(32) 为母体结构,设计合成了多种小菜蛾性信息素类似物,并进行了室内活性测定。在100 μg剂量下,用 (Z)-11-十六碳烯醇-2,2,2-三氟乙酸酯 (33)、(Z)-11-十六碳烯醇-2,2,3,3,3-五氟丙酸酯 (34) 或 (Z)-11-十六碳烯醇-2,2,2-三氟甲磺酸酯 (35) 预处理后,雄虫对性信息素的电生理响应抑制率分别为75.2%、76.5%和72.9%;在150 μmol/L浓度下,这3种类似物对触角酯酶水解性信息素组分Z11-16: Ac的抑制率均在90%以上;在罩笼和风洞试验中,这3种类似物分别与性信息素以不同质量比混合后均能干扰雄虫对诱芯的定位[85]。随后,张开心将这3种类似物分别与性信息素以不同质量比混合进行田间迷向试验,发现化合物33和34分别与性信息素以质量比10:1混合后对该虫的迷向率均在92%以上,说明这2种类似物具有干扰小菜蛾交配的活性[86]。
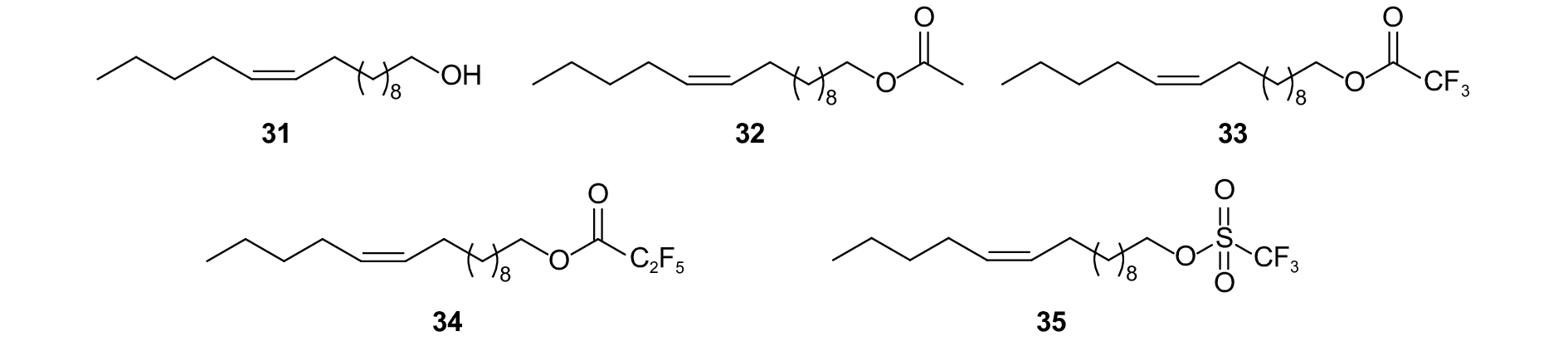
|
图式10 小菜蛾性信息素组分以及类似物 Scheme10 Structural formula of sex pheromone of Plutella xylostella and analogues |
番茄斑潜蝇Tuta absoluta的性信息素由质量比为90 : 10的 (E,Z,Z)-3,8,11-十四碳三烯乙酸酯 (E3, Z8, Z11-14: Ac)(图式11,36) 和 (E,Z)-3,8-十四碳二烯乙酸酯 (E3, Z8-14: Ac)(37) 构成。Aroa等合成了这2种组分的甲基酮类似物 (E,Z,Z)-5,10,13-十六碳三烯-2-酮 (E5,Z10,Z13-16:2-Kt) (38)、(E,Z)-5,10-十六碳二烯-2-酮 (E5,Z10-16:2- Kt)(39) 和三氟甲基酮类似物 (E,Z,Z)-5,10,13-十六碳三烯-1,1,1-三氟-2-酮 (E5,Z10,Z13-16:trifluoromethyl ketone (TFMK))(40)、(E,Z)-5,10-十六碳二烯-1,1,1-三氟-2-酮 (E5,Z10-16:2-TFMK)(41)。电生理试验发现,雄虫对甲基酮类似物和三氟甲基酮类似物均有反应;将雄虫置于充满类似物挥发气味的环境中5 min后,雄虫对性信息素的电生理响应受到明显的抑制。除化合物40外,其他类似物都能抑制雄虫触角酯酶分解性信息素分子的能力。田间试验中类似物与性信息素以不同质量比例混合对雄虫均有迷向作用,尤其是化合物38与性信息素以质量比为1 : 1和10 : 1混合时,能显著减少雄虫的诱捕数量,说明该类似物是一个能抑制性信息素对番茄潜叶蝇引诱作用的行为拮抗剂 (图式11) [87]。
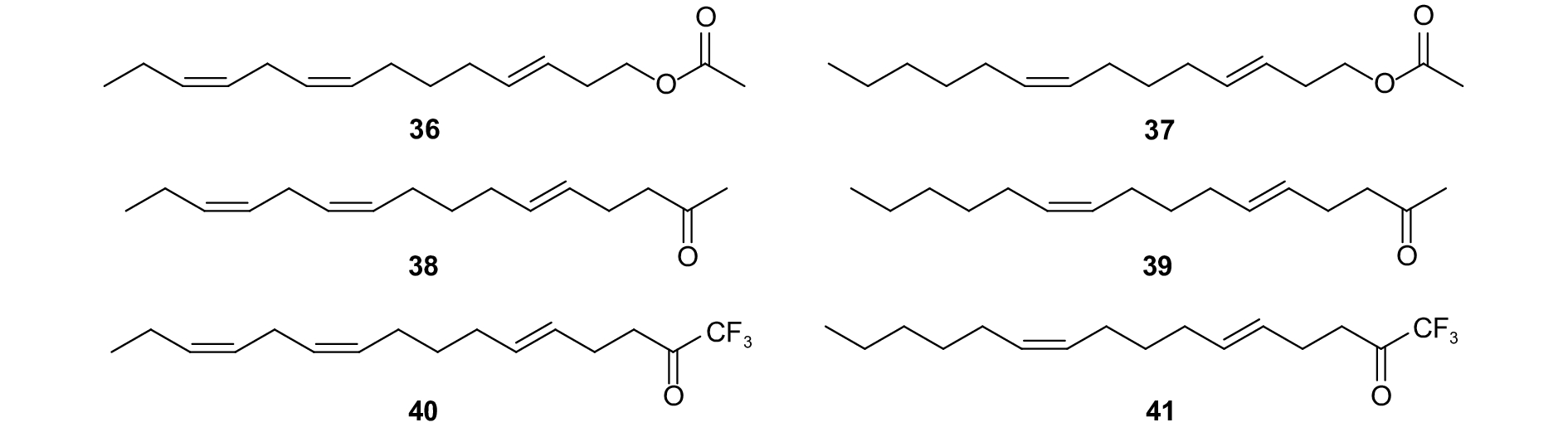
|
图式11 番茄斑潜蝇性信息素组分以及类似物 Scheme11 Structural formula of sex pheromone of Tuta absoluta and analogues |
Edi等合成了草地夜蛾Spodoptera frugiperda性信息素主要成分 (Z)-9-十四碳烯乙酸酯 (Z9-14: Ac)(图式12,42) 的三氟甲基酮类似物 (Z)-9-十四碳烯-1,1,1-三氟-2-酮 (Z9-14: TFMK)(43)。该类似物能影响雄虫的电生理反应参数、振幅和复极时间,且具有较强的剂量-效应关系。100 μg 化合物43的EAG响应值显著低于同剂量性信息素的响应值,复极时间是性信息素的1.66倍。田间试验发现,仅含有类似物诱芯的诱捕量是仅含有性信息素的15%;当类似物与性信息素以质量比为1 : 1和10 : 1混合时,诱捕数量显著地低于性信息素的诱捕数量。说明Z9-14: TFMK是一个较好的能干扰草地夜蛾交配的性信息素类似物[88]。
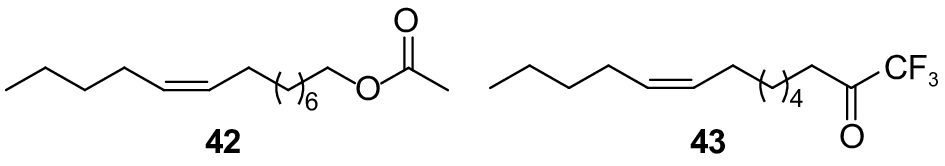
|
图式12 草地夜蛾性信息素组分以及类似物 Scheme12 Structural formula of sex pheromone of Spodoptera frugiperda and analogue |
三氟甲基酮类似物中的氟原子具有和氢原子相似的空间结构和极强的电负性,能在水溶液中形成稳定的水合物,进而可与酶的活性部位结合形成四面体加合物,对昆虫触角酯酶的降解有抑制作用[89-90]。触角酯酶在昆虫化学通讯中起着至关重要的作用,因此三氟甲基酮类似物被认为是优秀的昆虫化学通讯干扰剂。
3 展望干扰交配是利用人工合成性信息素或其类似物干扰昆虫交配和繁殖行为的防治方法,是一种环境友好型的植物保护策略。随着越来越多的昆虫性信息素被成功鉴定以及经济高效的昆虫性信息素合成技术的发展,干扰交配策略的应用也越来越广泛。性信息素及其类似物可以抑制昆虫交配行为的各个环节,尤其是在视觉或触觉不如嗅觉重要时。性信息素及其类似物对交配行为的抑制是一种合理的行为控制方法,但由于远距离的化学通讯干扰效果依赖于昆虫的密度,所以最有效的干扰害虫交配的方法应该是能够同时干扰远距离和近距离的化学通讯[91]。尽管现在对性信息素及其类似物干扰昆虫行为的机理还没有定论,但干扰交配的害虫防治策略在农业各个领域发挥的作用已不容忽视。进行更广泛的干扰交配基础理论研究和长期的田间试验,有助于阐明性信息素及其类似物干扰昆虫行为的机理,可以为更加合理地利用该策略治理害虫提供依据,也可以为减少化学农药的使用提供新的途径。但随着干扰交配技术的大量使用,昆虫对性信息素的抗性问题也开始受到研究者的重视[29-30, 92],如何治理昆虫对性信息素的抗性风险也可能成为未来性信息素的重要研究方向。
| [1] |
BUTENANDT A, BECKMANN R, STAMM D, et al. Uber den sexuallockstoff des seidenspinnersBombyx mori
[J]. Z Naturforsch, 1959, 14: 283-284. |
| [2] |
WRIGHT R H. After pesticides—what?[J]. Nature, 1964, 204(4954): 121-125. DOI:10.1038/204121a0 |
| [3] |
WRIGHT R H. 'Metarchon': A new term for a class of non-toxic pest control agents[J]. Nature, 1964, 204(4958): 603-604. |
| [4] |
WRIGHT R H. Finding metarchons for pest control[J]. Nature, 1965, 207(4992): 103-104. DOI:10.1038/207103a0 |
| [5] |
ROELOFS W L, COMEAU A. Sex pheromone perception[J]. Nature, 1968, 200(5167): 600-601. |
| [6] |
MITCHELL E R, JACOBSON M, BAUMHOVER A H. Heliothis spp.: Disruption of pheromonal communication with (Z)-9-tetradecen-1-ol formate
[J]. Environ Entomol, 1975, 4(4): 577-579. DOI:10.1093/ee/4.4.577 |
| [7] |
COOK S M, KHAN Z R, PICKETT J A. The use of push-pull strategies in integrated pest management[J]. Annu RevEntomol, 2007, 52: 375-400. |
| [8] |
VOGT R G, PRESTWICH G D, LERNER M R. Odorant-binding-protein subfamilies associate with distinct classes of olfactory receptor neurons in insects[J]. J Neurobiol, 1991, 22(1): 74-84. DOI:10.1002/(ISSN)1097-4695 |
| [9] |
HANSSON B S, LJUNGBERG H, HÅLLBERG E, et al. Functional specialization of olfactory glomeruli in a moth[J]. Science, 1992, 256(5061): 1313-1315. DOI:10.1126/science.1598574 |
| [10] |
KLUN J A, SCHWARZ M, UEBEL E C. Biological activity andin vivo degradation of tritiated female sex pheromone in the male European corn borer
[J]. J Chem Ecol, 1992, 18(3): 283-298. DOI:10.1007/BF00994232 |
| [11] |
PRESTWICH D G D. Chemical studies of pheromone receptors in insects[J]. Arch Insect Biochem Physiol, 1993, 22(1-2): 75-86. DOI:10.1002/(ISSN)1520-6327 |
| [12] |
DU G H, NG C S, PRESTWICH G D. Odorant binding by a pheromone binding protein: active site mapping by photoaffinity labeling[J]. Biochemistry, 1994, 33(16): 4812-4819. DOI:10.1021/bi00182a009 |
| [13] |
LUCAS P, RENOU M. Responses to pheromone compounds in Mamestra suasa (Lepidoptera: Noctuidae) olfactory neurones
[J]. J Insect Physiol, 1989, 35(11): 837-845. DOI:10.1016/0022-1910(89)90099-1 |
| [14] |
LILJEFORS T, THELIN B, VAN DER PERS J N C, et al. Chain-elongated analogues of a pheromone component of the turnip moth, Agrotis segetum. A structure-activity study using molecular mechanics
[J]. J Chem Soc, Perkin Trans 2, 1985(12): 1957-1962. |
| [15] |
LILJEFORS T, ENGTSSON M, HANSSON B S. Effects of double-bond configuration on interaction between a moth sex pheromone component and its receptor[J]. J Chem Ecol, 1987, 13(10): 2023-2040. DOI:10.1007/BF01041729 |
| [16] |
MILLER J R, GUT L J, de LAME F M, et al. Differentiation of competitive vs. non-competitive mechanisms mediating disruption of moth sexual communication by point sources of sex pheromone (part 2): case studies[J]. J Chem Ecol, 2006, 32(10): 2115-2143. DOI:10.1007/s10886-006-9136-6 |
| [17] |
WITZGALL P, STELINSKI L, GUT L, et al. Codling moth management and chemical ecology[J]. Ann Rev Entomol, 2008, 53(1): 503-522. DOI:10.1146/annurev.ento.53.103106.093323 |
| [18] |
MILLER J R, GUT L J, De LAME F M, et al. Differentiation of competitive vs. non-competitive mechanisms mediating disruption of moth sexual communication by point sources of sex pheromone (part I): theory[J]. J Chem Ecol, 2006, 32(10): 2089-2114. DOI:10.1007/s10886-006-9134-8 |
| [19] |
BARTELL R J. Mechanisms of communication disruption by pheromone in the control of Lepidoptera: a review[J]. Physiol Entomol, 1982, 7(4): 353-364. DOI:10.1111/j.1365-3032.1982.tb00310.x |
| [20] |
MILLER J R, MCGHEE P S, SIEGERT P Y, et al. General principles of attraction and competitive attraction as revealed by large-cage studies of moths responding to sex pheromone[J]. Proc Nati Acad Sci USA, 2010, 107(1): 22-27. DOI:10.1073/pnas.0908453107 |
| [21] |
CARDÉR T, MINKS A K. Control of moth pests by mating disruption: successes and constraints[J]. Annu Rev Entomol, 1995, 40: 559-585. DOI:10.1146/annurev.en.40.010195.003015 |
| [22] |
PARRILLA A, GUERRERO A. Trifluoromethyl ketones as inhibitors of the processionary moth sex pheromone[J]. Chem Senses, 1994, 19(1): 1-10. |
| [23] |
VOGT R G, RIDDIFORD L M, PRESTWICH G D. Kinetic properties of a sex pheromone-degrading enzyme: the sensillar esterase of Antheraea polyphemus
[J]. Proc Nati Acad Sci USA, 1985, 82(24): 8827-8831. DOI:10.1073/pnas.82.24.8827 |
| [24] |
DURÁN I, PARRILLA A, FEIXAS J, et al. Inhibition of antennal esterases of the Egyptian armyworm Spodoptera littoralis by trifluoromethyl ketones
[J]. Bioorg Med Chem Lett, 1993, 3(12): 2593-2598. DOI:10.1016/S0960-894X(01)80722-8 |
| [25] |
PRESTWICH G D, STREINZ L. Haloacetate analogs of pheromones: Effects on catabolism and electrophysiology in Plutella xylostella
[J]. J Chem Ecol, 1988, 14(3): 1003-1021. DOI:10.1007/BF01018789 |
| [26] |
YEW J Y, CHUNG H. Insect pheromones: An overview of function, form, and discovery[J]. Prog Lipid Res, 2015, 59: 88-105. DOI:10.1016/j.plipres.2015.06.001 |
| [27] |
BRUNNER J, WELTER S, CALKINS C, et al. Mating disruption of codling moth: a perspective from the Western United States[J]. IOBC WPRS Bull, 2002, 25(9): 11-19. |
| [28] |
IORIATTI C, LUCCHI A, BAGNOLI B. Grape areawide pest management in Italy[M]//KOUL O, CUPERUS G, ELLIOTT G.Areawide pest managements: Theory and Implementation. Wallingford: CAB International, 2008: 208-225.
|
| [29] |
MOCHIZUKI F, FUKUMOTO T, NOGUCHI H, et al. Resistance to a mating disruptant composed of (Z)-11-tetradecenyl acetate in the smaller tea tortrix, Adoxophyes honmai (Yasuda) (Lepidoptera: Tortricidae)
[J]. Appl Entomol Zool, 2002, 37: 299-304. DOI:10.1303/aez.2002.299 |
| [30] |
TABATA J, NOGUCHI H, KAINOH Y, et al. Behavioral response to sex pheromone-component blends in the mating disruption-resistant strain of the smaller tea tortrix, Adoxophyes honmai Yasuda (Lepidoptera: Tortricidae), and its mode of inheritance
[J]. Appl Entomol Zool, 2007, 42(4): 675-683. DOI:10.1303/aez.2007.675 |
| [31] |
RENOU M, GUERRERO A. Insect parapheromones in olfaction research and semiochemical-based pest control strategies[J]. Annu Rev Entomol, 2000, 45(1): 605-630. DOI:10.1146/annurev.ento.45.1.605 |
| [32] |
孙渐盛, 魏辉, 林硕, 等. 昆虫性信息素人工合成与微胶囊制剂化的研究进展[J]. 福建农业学报, 2014, 29(7): 707-716. SUN J S, WEI H, LIN S, et al. Synthesis and microencapsulation of insect sex pheromones[J]. Fujian J Agric Sci, 2014, 29(7): 707-716. |
| [33] |
陈增良, 张钟宁. 昆虫性信息素微胶囊的研究进展[J]. 昆虫知识, 2008, 45(3): 362-367. CHEN Z L, ZHANG Z N. Development of microencapsulated sex pheromone formulations for insects[J]. Chin Bull Entomol, 2008, 45(3): 362-367. DOI:10.7679/j.issn.2095-1353.2008.079 |
| [34] |
TCHESLAVSKAIA K S, THORPE K W, BREWSTER C C, et al. Optimization of pheromone dosage for gypsy moth mating disruption[J]. Entomol Expe Appl, 2005, 115(3): 355-361. DOI:10.1111/eea.2005.115.issue-3 |
| [35] |
KOVANCI O B. Co-application of microencapsulated pear ester and codlemone for mating disruption of Cydia pomonella
[J]. J of Pest S, 2015, 88(2): 311-319. DOI:10.1007/s10340-014-0619-x |
| [36] |
陈增良, 方宇凌, 张钟宁. 小菜蛾性信息素微胶囊的合成及其田间诱捕和迷向活性研究[J]. 科学通报, 2007, 52(7): 797-802. CHEN Z L, FANG Y L, ZHANG Z Y. Synthesis and assessment of attractiveness and mating disruption efficacy of sex pheromone microcapsules for the diamondback moth, Plutella xylostella (L.) [J]. Chin Sci Bull, 2007, 52(7): 797-802. |
| [37] |
STELINSKI L L, MCGHEE P, HAAS M, et al. Sprayable microencapsulated sex pheromone formulations for mating disruption of four tortricid species: effects of application height, rate, frequency, and sticker adjuvant[J]. J Econ Entomol, 2007, 100(4): 1360-1369. DOI:10.1093/jee/100.4.1360 |
| [38] |
杨兴翠, 马涛, 易思雨, 等. 性信息素微胶囊迷向防治梨小食心虫田间试验[J]. 中国生物防治学报, 2015, 31(3): 410-415. YANG X C, MA T, YI S Y, et al. Mating disruption control of Grapholitha molesta using sex pheromone microcapsle emulsion [J]. Chin J Biol Control, 2015, 31(3): 410-415. |
| [39] |
MUEGGE M A, KNUTSON A E. Mating disruption of pecan nut casebearer, Acrobasis nuxvorella Neuzig, in pecans
[J]. Southwest Entomol, 2012, 37(3): 315-324. DOI:10.3958/059.037.0307 |
| [40] |
IL'ICHEV A L, STELINSKI L L, WILLIAMS D G, et al. Sprayable microencapsulated sex pheromone formulation for mating disruption of oriental fruit moth (Lepidoptera: Tortricidae) in Australian peach and pear orchards[J]. J Econ Entomol, 2006, 99(6): 2048-2054. DOI:10.1093/jee/99.6.2048 |
| [41] |
KNIGHT A L. Targeting Cydia pomonella (L.) (Lepidoptera: Tortricidae) adults with low-volume applications of insecticides alone and in combination with sex pheromone
[J]. Pest Manag Sci, 2010, 66(7): 709-717. DOI:10.1002/ps.v66:7 |
| [42] |
BISOTTO-DE-OLIVEIRA R, MORAIS R M, ROGGIA I, et al. Polymers nanofibers as vehicles for the release of the synthetic sex pheromone of Grapholita molesta (Lepidoptera, Tortricidae)
[J]. Rev Colomb Entomol, 2015, 41(2): 262-269. |
| [43] |
SEO S M, LEE J M, LEE H Y, et al. Synthesis of nanoporous materials to dispense pheromone for trapping agricultural pests[J]. J Porous Mater, 2016, 23(2): 557-562. DOI:10.1007/s10934-015-0109-4 |
| [44] |
LIBURD O E, RAZZE J M, NYOIKE T W. Relative captures of grape root borer, Vitacea polistiformis (Lepidoptera: Sesiidae) in pheromone traps within vineyards and adjacent woodlands
[J]. Crop Prot, 2018, 105: 35-40. DOI:10.1016/j.cropro.2017.11.002 |
| [45] |
HARPER A R, UNELIUS C R, TOWNSEND R J, et al. Dose reduction and alternatives to the phenol pheromone in monitoring and management of the grass grub Costelytra zealandica
[J]. Pest Manage Sci, 2017, 73(11): 2252-2258. DOI:10.1002/ps.2017.73.issue-11 |
| [46] |
YAN Q, ZHENG M Y, XU J W, et al. Female sex pheromone of Athetis lepigone (Lepidoptera: Noctuidae): Identification and field evaluation
[J]. J Appl Entomol, 2018, 142(1-2): 125-130. DOI:10.1111/jen.2018.142.issue-1pt2 |
| [47] |
LI X L, GENG S B, CHEN H J, et al. Mass trapping of apple leafminer, Phyllonorycter ringoniella with sex pheromone traps in apple orchards
[J]. J Asia Pac Entomol, 2017, 20(1): 43-46. DOI:10.1016/j.aspen.2016.11.015 |
| [48] |
ROWLEY C, POPE T W, CHERRILL A, et al. Development and optimisation of a sex pheromone lure for monitoring populations of saddle gall midge, Haplodiplosis marginata
[J]. Entomol Exp Appl, 2017, 163(1): 82-92. DOI:10.1111/eea.2017.163.issue-1 |
| [49] |
RAO C N, GEORGE A, PRASAD A R, et al. Field testing of indigenously synthesized sex pheromone for the management of Phyllocnistis citrella Stainton under central Indian conditions
[J]. Curr Sci, 2017, 113(12): 2298-2304. DOI:10.18520/cs/v113/i12/2298-2304 |
| [50] |
SILK P J, RYALL K, MAYO P, et al. A biologically active analog of the sex pheromone of the emerald ash borer, Agrilus planipennis
[J]. J Chem Ecol, 2015, 41(3): 294-302. DOI:10.1007/s10886-015-0562-1 |
| [51] |
CUI G Z, ZHU J J. Pheromone-based pest management in China: past, present, and future prospects[J]. J Chem Ecol, 2016, 42(7): 557-570. DOI:10.1007/s10886-016-0731-x |
| [52] |
CHEN R Z, JOW C K, KLEIN M G, et al. Sex pheromone dosages and release point densities for mating disruption of Ostrinia furnacalis (Lepidoptera: Crambidae) in NE China corn fields
[J]. Environ Entomol, 2017, 46(4): 916-925. DOI:10.1093/ee/nvx098 |
| [53] |
VOGT H, SCHROPP A, NEUMANN U, et al. Befallsregulierung des Einbindigen Traubenwicklers Eupoecilia ambiguella Hbn. durch Paarungsstörung mit synthetischem Pheromon
[J]. J Appl Entomol, 1993, 115(1-5): 217-232. DOI:10.1111/jen.1993.115.issue-1-5 |
| [54] |
SUCKLING D M, SHAW P W. Large‐scale trials of mating disruption of lightbrown apple moth in Nelson, New Zealand[J]. New Zealand Journal of Crop and Horticultural Science, 1995, 23(2): 127-137. DOI:10.1080/01140671.1995.9513879 |
| [55] |
WITZGALL P, BÄCKMAN A C, SVENSSON M, et al. Behavioral observations of codling moth, Cydia pomonella, in orchards permeated with synthetic pheromone
[J]. Biocontrol, 1999, 44(2): 211-237. DOI:10.1023/A:1009976600272 |
| [56] |
KOVANCI O B, WALGENBACH J F , KENNEDY G G, et al. Effects of application rate and interval on the efficacy of sprayable pheromone for mating disruption of the oriental fruit moth Grapholita molesta
[J]. J Phytoparasitica, 2005, 33(4): 334-342. DOI:10.1007/BF02981299 |
| [57] |
WU Q J, ZHANG S F, YAO J L, et al. Management of diamondback moth, Plutella xylostella (Lepidoptera: Plutellidae) by mating disruption
[J]. Insect Sci, 2012, 19(6): 643-648. DOI:10.1111/ins.2012.19.issue-6 |
| [58] |
SHOREY H H, GERBER R G. Disruption of pheromone communication through the use of puffers for control of beet army-worm (Lepidoptera: Noctuidae) in tomatoes[J]. Environ Entomol, 1996, 25(6): 1401-1405. DOI:10.1093/ee/25.6.1401 |
| [59] |
SRINIVAS K, RAO P A. Management of Spodoptera litura (F.) infesting groundnut by mating disruption technique with synthetic sex pheromone
[J]. J Entomol Re, 1999, 23(2): 115-119. |
| [60] |
FADAMIRO H Y, BAKER T C. Pheromone puffs suppress mating by Plodia interpunctella and Sitotroga cerealella in an infested corn store
[J]. Entomol Exp Appl, 2002, 102(3): 239-251. DOI:10.1046/j.1570-7458.2002.00945.x |
| [61] |
XU H, TURLINGS T C J. Plant volatiles as mate-finding cues for insects[J]. Trends Plant Sci, 2018, 23(2): 100-111. DOI:10.1016/j.tplants.2017.11.004 |
| [62] |
GREGG P C, DEL SOCORRO A P, LANDOLT P J. Advances in attract-and-kill for agricultural pests: Beyond pheromones[J]. Annu Rev Entomol, 2018, 63(1): 453-470. DOI:10.1146/annurev-ento-031616-035040 |
| [63] |
KNIGHT A L, HILTON R, LIGHT D M. Monitoring codling moth (Lepidoptera: Tortricidae) in apple with blends of ethyl (E, Z)-2,4-decadienoate and codlemone
[J]. Environ Entomol, 2005, 34(3): 598-603. DOI:10.1603/0046-225X-34.3.598 |
| [64] |
LADD T L, KLEIN M G, TUMLINSON J H. Phenethyl propionate + eugenol + geraniol (3:7:3) and japonilure: a highly effective joint lure for Japanese beetles[J]. J Econ Entomol, 1981, 74(6): 665-667. DOI:10.1093/jee/74.6.665 |
| [65] |
JU Q, GUO X Q, LI X, et al. Plant volatiles increase sex pheromone attraction of Holotrichia parallela (Coleoptera: Scarabaeoidea)
[J]. J Chem Ecol, 2017, 43(3): 236-242. DOI:10.1007/s10886-017-0823-2 |
| [66] |
REDDY G V P, GUERRERO A. Behavioral responses of the diamondback moth, Plutella xylostella, to green leaf volatiles of Brassica oleracea Subsp. capitata
[J]. J Agric Food Chem, 2000, 48(12): 6025-6029. DOI:10.1021/jf0008689 |
| [67] |
VAN TOL R W H M, HELSEN H H M, GRIEPINK F C, et al. Female-induced increase of host-plant volatiles enhance specific attraction of aphid male Dysaphis plantaginea (Homoptera: Aphididae) to the sex pheromone
[J]. Bull Entomol Res, 2009, 99(6): 593-602. DOI:10.1017/S0007485309006634 |
| [68] |
PIÑERO J C, PROKOPY R J. Field evaluation of plant odor and pheromonal combinations for attracting plum curculios[J]. J Chem Ecol, 2003, 29(12): 2735-2748. DOI:10.1023/B:JOEC.0000008017.16911.aa |
| [69] |
SANS A, MORÁN M, RIBA M, et al. Plant volatiles challenge inhibition by structural analogs of the sex pheromone in Lobesia botrana (Lepidoptera: Tortricidae)
[J]. Eur J Entomol, 2016, 113: 579-586. DOI:10.14411/eje.2016.078 |
| [70] |
PYKE B, RICE M, SABINE B, et al. The push-pull strategy—behavioural control of Heliothis[J/OL]. Cotton Grow, 1987(8): 7-9.[2018-01-10]. https://scholar.google.com/scholar?hl=zh-CN&as_sdt=0%2C5&q=PYKE+B%2C+RICE+M%2C+SABINE+B%2C+et+al.+The+push-pull+strategy%E2%80%94behavioural+control+of+Heliothis&btnG=
|
| [71] |
MILLER J R, COWLES R S. Stimulo-deterrent diversion: A concept and its possible application to onion maggot control[J]. J Chem Ecol, 1990, 16(11): 3197-3212. DOI:10.1007/BF00979619 |
| [72] |
BORDEN J H, BIRMINGHAM A L, BURLEIGH J S. Evaluation of the push-pull tactic against the mountain pine beetle using verbenone and non-host volatiles in combination with pheromone-baited trees[J]. For Chronicle, 2006, 82(4): 579-590. |
| [73] |
SEYBOLD S J, HUBER D P W, LEE J C, et al. Pine monoterpenes and pine bark beetles: a marriage of convenience for defense and chemical communication[J]. Phytochem Rev, 2006, 5(1): 143-178. DOI:10.1007/s11101-006-9002-8 |
| [74] |
SUCKLING D M, DYMOCK J J, PARK K C, et al. Communication disruption of guava moth (Coscinoptycha improbana) using a pheromone analog based on chain length
[J]. J Chem Ecol, 2013, 39(9): 1161-1168. DOI:10.1007/s10886-013-0339-3 |
| [75] |
BURGER B V, LE ROUX M, MACKENROTH W M, et al. 7-Vinyldecyl acetate, novel inhibitor of pheromonal attraction in the false codling moth, Cryptophlebia leucotreta
[J]. Tetrahedron Lett, 1990, 31(40): 5771-5772. DOI:10.1016/S0040-4039(00)97954-1 |
| [76] |
BENGTSSON M, KARG G, KIRSCH P A, et al. Mating disruption of pea moth Cydia nigricana F. (lepidoptera: Tortricidae) by a repellent blend of sex pheromone and attraction inhibitors
[J]. J Chem Ecol, 1994, 20(4): 871-887. DOI:10.1007/BF02059584 |
| [77] |
CAMPS F, FABRIÀS G, GASOL V, et al. Analogs of sex pheromone of processionary moth, Thaumetopoea pityocampa: Synthesis and biological activity
[J]. J Chem Ecol, 1988, 14(5): 1331-1346. DOI:10.1007/BF01020138 |
| [78] |
KLUN J A, BIERL-LEONHARDT B A, PLIMMER J R, et al. Sex pheromone chemistry of the female tobacco budworm moth, Heliothis virescens
[J]. J Chem Ecol, 1980, 6(1): 177-183. DOI:10.1007/BF00987536 |
| [79] |
CARLSON D A, MCLAUGHLIN J R. Diolefin analog of a sex pheromone component of Heliothis zea active in disrupting mating communication
[J]. Experientia, 1982, 38(3): 309-310. DOI:10.1007/BF01949359 |
| [80] |
ZHANG Q H, ALDRICH J R. Male-produced anti-sex pheromone in a plant bug[J]. Naturwissenschaften, 2003, 90(11): 505-508. DOI:10.1007/s00114-003-0466-8 |
| [81] |
张涛. 绿盲蝽(Apolygus lucorum)性信息素的提取鉴定及应用研究[D]. 北京: 中国农业科学院, 2011. ZHANG T. The study of the extraction, identification and application of sex pheromone produced by Apolygus lucorum[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011. |
| [82] |
RIBA M, EIZAGUIRRE M, SANS A, et al. Inhibition of pheromone action in Sesamia nonagrioides by haloacetate analogues
[J]. Pestic Sci, 1994, 41(2): 97-103. DOI:10.1002/ps.v41:2 |
| [83] |
HOSKOVEC M, HOVORKA O, KALINOVÁ B, et al. New mimics of the acetate function in pheromone-based attraction[J]. Bioorg Med Chem, 1996, 4(3): 479-488. DOI:10.1016/0968-0896(96)00029-6 |
| [84] |
KOSHIHARA T, YAMADA H. Attractant activity of the female sex pheromone of diamondback moth, Plutella xylostella (L.), and analogue[J/OL]. Jan J Appl Entomol Zool, 1980, 1(24): 6-12. [2018-01-10]. https://www.cabdirect.org/cabdirect/abstract/19800575364
|
| [85] |
董梦雅. 小菜蛾性信息素拮抗剂的合成及活性研究[D]. 北京: 中国农业科学院, 2016. DONG M Y. Synthesis and activity evaluation of sex pheromone antagonist of Plutell axylostella[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. |
| [86] |
张开心. 小菜蛾信息素类似物的合成与活性研究[D]. 北京: 中国农业科学院, 2017. ZHANG K X. Synthesis and bioactivity study of pheromone analogs of diamond back moth Plutella xylostella[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. |
| [87] |
DOMINGUEZ A, PUIGMARTÍ M, BOSCH M P, et al. Synthesis, functional assays, electrophysiological activity, and field tests of pheromone antagonists of the tomato leafminer, Tuta absoluta
[J]. J Agric Food Chem, 2016, 64(18): 3523-3532. DOI:10.1021/acs.jafc.6b00674 |
| [88] |
MALO E A, ROJAS J C, GAGO R, et al. Inhibition of the responses to sex pheromone of the fall armyworm, Spodoptera frugiperda
[J]. J Insect Sci, 2013, 13: 134. |
| [89] |
ROSELL G, HERRERO S, GUERRERO A. New trifluoromethyl ketones as potent inhibitors of esterases: 19F NMR spectroscopy of transition state analog complexes and structure-activity relationships
[J]. Biochem Biophys Res Commun, 1996, 226(1): 287-292. DOI:10.1006/bbrc.1996.1347 |
| [90] |
QUERO C, ROSELL G, JIMÉNEZ O, et al. New fluorinated derivatives as esterase inhibitors. Synthesis, hydration and crossed specificity studies[J]. Bioorg Med Chem, 2003, 11(6): 1047-1055. DOI:10.1016/S0968-0896(02)00467-4 |
| [91] |
KLUN J A, CHAPMAN O L, MATTES K C, et al. European corn borer and redbanded leafroller: disruption of reproduction behavior[J]. Environ Entomol, 1975, 14: 871-876. |
| [92] |
TABATA J, NOGUCHI H, KAINOH Y, et al. Sex pheromone production and perception in the mating disruption-resistant strain of the smaller tea leafroller moth, Adoxophyes honmai
[J]. Entomol Exp Appl, 2007, 122(2): 145-153. DOI:10.1111/eea.2007.122.issue-2 |
 2018, Vol. 20
2018, Vol. 20


