腐霉利 (procymidone,图式 1) 是二甲酰亚胺类新型低毒杀菌剂,作用机理是抑制菌体内甘油三酯的合成,对葡萄孢属和核盘菌属真菌有特效,主要用于防治果树、蔬菜作物上的灰霉病及菌核病,因具有安全、廉价、防效好等特性而被广泛使用[1–2]。
对农药光解和水解特性的研究有助于了解农药在环境中的消解转化规律,为其合理使用及环境安全性评价提供参考[3-5]。目前,对腐霉利的研究大多集中于其在作物和土壤中残留的检测方法方面,且多采用气相色谱法。危玲等建立了腐霉利在桑椹中残留的气相色谱检测方法[6];胡瑞兰等建立了腐霉利在番茄及土壤中残留的气相色谱检测方法[7];杨莉等建立了三七中腐霉利残留的气相色谱检测法[8];樊晓青等建立了生菜和土壤中腐霉利残留的气相色谱检测法[9]。尚未见有关腐霉利在油菜植株中残留检测方法的报道,此外,有关腐霉利环境行为的研究也较少。李娟等研究了腐霉利水溶液在高压汞灯下的光解[10],但未涉及其水解部分;Villedieu等研究了阴离子表面活性剂十二烷基磺酸钠 (SDS) 和阳离子表面活性剂十六烷基三甲基溴化铵 (CTAB) 对腐霉利水解的影响[11];Schwack等采用气相色谱-质谱联用 (GC-MS) 方法鉴定了腐霉利在异丙醇溶液中的光解产物[12];Rifai等对腐霉利水溶液在紫外灯下的光解产物进行了结构表征并研究了其潜在的毒性[13]。但目前尚未见有关腐霉利光解和水解特性的系统研究报道。
为此,笔者建立了腐霉利在油菜叶片中残留量的气相色谱-电子捕获检测器 (GC-ECD) 检测方法,并在室内模拟条件下,研究了腐霉利在油菜叶片表面的光解行为,同时采用高效液相色谱仪 (HPLC) 系统研究了初始浓度、溶液pH值,以及环境影响因子NO3–、NO2–、Fe2+ 和Fe3+ 对腐霉利在紫外灯下消解速率的影响,并通过气相色谱-电子轰击电离源质谱仪 (GC-EIMS) 鉴定了腐霉利在甲醇、丙酮和乙腈溶液中的光解产物,同时研究了不同pH值缓冲液和阴、阳离子表面活性剂对腐霉利水解特性的影响,旨在为其合理应用及其环境安全性评价提供参考。
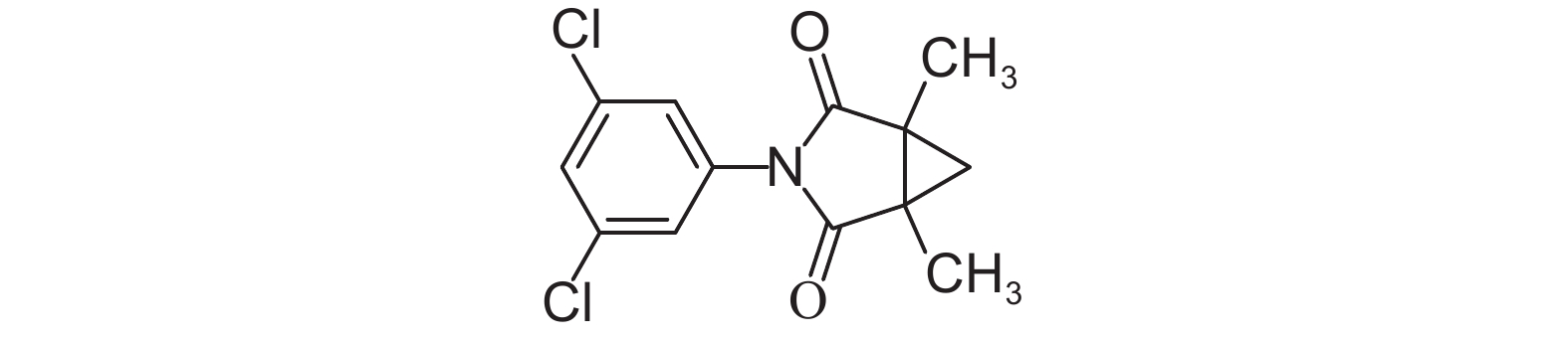
|
图式1 腐霉利结构式 Scheme1 The structural formula of procymidone |
1 材料与方法 1.1 主要仪器与试剂
Agilent 1260 型高效液相色谱-紫外检测器 (HPLC-UV)、Agilent 7890A型气相色谱-电子捕获检测器 (GC-ECD) 及Agilent 6890N型气相色谱-电子轰击电离源质谱仪 (GC-EIMS) (美国Agilent科技有限公司);XT5409 型光稳定性试验箱 (杭州雪中炭恒温技术有限公司)。
99.5%腐霉利 (procymidone) 标准品 (北京合利顺科技有限公司);50%腐霉利可湿性粉剂 (WP) [住友化学 (上海) 有限公司];FeCl3·6H2O、FeSO4·7H2O、NaNO3及NaNO2 (分析纯,国药集团化学试剂有限公司);十二烷基磺酸钠 (SDS)、十六烷基三甲基溴化铵 (CTAB) (≥ 99.0%,北京索莱宝科技有限公司);乙腈、正己烷、甲醇 (色谱纯,美国TEDIA试剂公司);丙酮 (色谱纯,上海凌锋化学试剂有限公司);Clark-Lubs缓冲溶液按标准方法[12]现配现用。
1.2 仪器分析条件HPLC分析条件:Eclipse Plus C18色谱柱 (4.6 mm × 150 mm,4.0 μm),柱温30 ℃;流速1 mL/min;进样量20 μL;流动相为V (乙腈) : V (水) = 60:40;检测波长208 nm。在此条件下,腐霉利保留时间为6.4 min。
GC分析条件,参考文献[8]方法并进行了改进:色谱柱为DB-1701毛细管柱 (30 m × 0.25 mm,0.25 μm);进样口温度270 ℃;检测器温度300 ℃;载气 (N2) 1.5 mL/min;分流进样,分流比5:1;进样量1.0 μL;柱升温程序为初始温度100 ℃,保持1 min,25 ℃/min升至270 ℃,保持3 min;尾吹 (N2) 40 mL/min。此条件下腐霉利的保留时间为8.4 min。
GC-MS分析条件。MS条件[14]:电子轰击电离源 (EI),70 eV;离子源温度230 ℃;GC-EIMS接口温度280 ℃;溶剂延迟为6 min;扫描范围 m/z = 50~500。GC条件:色谱柱为DB-1701毛细管柱 (30 m × 0.25 mm, 0.25 μm);进样口温度290 ℃;载气 (N2) 1.2 mL/min;不分流进样,进样量1.0 μL;柱升温程序为初始温度100 ℃,保持1 min,20 ℃/min升至270 ℃,保持2 min。在此条件下腐霉利的保留时间为9.8 min。
1.3 标准曲线绘制HPLC法:准确称取0.010 1 g 99.5%的腐霉利标准品于10 mL容量瓶中,用乙腈溶解并定容,配制成1 000 mg/L的腐霉利标准品母液,再用 V (乙腈) : V (水) = 60:40 的混合溶剂梯度稀释,配得10.0、5.0、1.0、0.1及0.05 mg/L的系列标准工作溶液,在1.2节HPLC条件下,采用外标法定量测定,以腐霉利进样质量浓度为横坐标 (x),色谱峰面积为纵坐标 (y),绘制标准曲线。
GC法:用丙酮配制1 000 mg/L的腐霉利标准品母液,再用正己烷梯度稀释配成12.0、5.0、1.0、0.5、0.1及0.05 mg/L的系列标准工作溶液,在1.2节GC条件下,采用外标法定量测定,以腐霉利质量浓度为横坐标 (x),相应的色谱峰面积为纵坐标 (y),绘制标准曲线。
1.4 光解试验 1.4.1 室内模拟油菜叶片表面光解试验将50%腐霉利可湿性粉剂用超纯水稀释为0.1 g/L,均匀喷洒于用棉花保湿的油菜叶片表面,3 h后将叶片放置在距紫外灯下30 cm处,紫外光强度为5.2 mW/cm2。分别在0、0.5、1、1.5、2、3及4 h取样,进行提取、净化及检测。每处理3个重复,以喷洒相同量的超纯水作为空白对照。
样品前处理方法。提取:称取20.0 g粉碎匀浆2 min后的油菜叶片样品于250 mL三角瓶中,加入10 mL去离子水及50 mL乙腈,振荡提取1 h,抽滤后将滤液倒入盛有5 g NaCl的100 mL具塞量筒中,振荡5 min,静置30 min。取1/2体积的有机相过无水硫酸钠后置于150 mL平底烧瓶中,旋蒸浓缩至干,待净化。净化:先用7 mL正己烷活化弗罗里硅土柱 (500 mg/6 mL),再用8 mL正己烷分两次 (4 mL × 2) 溶解样品后进样;用10 mL V (正己烷) : V (丙酮) = 99 : 1的混合溶剂分两次洗脱并收集流出液于150 mL平底烧瓶中,旋转蒸发至干;用2 mL正己烷溶解,过0.22 μm有机滤膜,按 1.2节GC条件检测样品中腐霉利的残留量。
添加回收试验:在空白油菜叶片样品中分别添加0.05、0.2、2及12 mg/kg的腐霉利标准工作溶液,采用1.2节方法检测其添加回收率,计算相对标准偏差 (RSD)。每个添加水平重复 5 次,同时设空白对照。
1.4.2 影响腐霉利光解速率的因素在紫外灯照射下,按照文献[15]方法,分别研究不同初始质量浓度腐霉利在水溶液中的光解;质量浓度为5 mg/L的腐霉利在pH值分别为4、7和9的Clark-Lubs缓冲溶液中的光解;在质量浓度为5 mg/L的腐霉利水溶液中分别添加不同浓度的FeCl3·6H2O、FeSO4·7H2O、NaNO3及NaNO2,研究环境因子Fe2+、Fe3+、NO3- 和NO2- 对腐霉利光解速率的影响。同时设置黑暗对照,每处理3次重复。紫外灯光强度为 3.00 mW/cm2,额定功率为 8 W × 2,石英管距光源10 cm,温度保持25 ℃ ± 0.5 ℃。光照不同时间后分别取样,按 1.2节的HPLC条件检测样品中腐霉利的残留量。
1.4.3 腐霉利的光解产物研究分别用有机溶剂甲醇、丙酮和乙腈配制质量浓度为50 mg/L的腐霉利标准溶液,同1.4.2节紫外光照条件进行光解产物研究,分别取光照前0 h及光照24 h后的样品2 mL,氮气吹干后用丙酮定容,按照1.2节GC-MS条件检测,分析腐霉利在不同溶剂中的光解产物。
1.5 水解试验水解试验方法参照“化学农药环境安全评价试验准则 第2部分”[16],研究不同pH值和表面活性剂对腐霉利水解的影响。分别在棕色容量瓶中用pH值为4、7、9的Clark-Lubs缓冲溶液将质量浓度为1 000 mg/L的腐霉利标准品母液稀释为5 mg/L,置于35 ℃恒温培养箱中避光反应。在腐霉利质量浓度为5 mg/L、pH 7的缓冲溶液中分别添加100、300和500 mg/L的阴离子表面活性剂SDS和阳离子表面活性剂CTAB,超声混匀,同时设置未添加表面活性剂的空白对照,于35 ℃恒温培养箱中避光反应。定期取样,按1.2 节HPLC条件检测腐霉利的残留量,研究表面活性剂对其水解的影响。预试验结果表明,pH 9时消解速率较快,因此设置pH 9的处理在0、0.25、0.5、1、1.5、2、3和5 h时取样,其他处理均分别于0、1、3、5、7、14、21 和 60 d取样。
1.6 数据处理腐霉利在溶液中的光解和水解均可按一级动力学方程描述。分别按 (1) 和 (2) 式计算腐霉利在不同条件下的消解动态方程及半衰期 (t1/2,min或d)。
| ${C_t} = {C_0}{{\rm{e}}^{ - kt}}$ | (1) |
| ${t_{1/2}} = \ln 2/k = 0.693/k$ | (2) |
式中,Ct为 t时刻腐霉利的残留量 (mg/L);C0为腐霉利的初始质量浓度 (mg/L);k为速率常数 (min–1)。
2 结果与讨论 2.1 标准曲线结果表明:在1.2节HPLC条件下,0.05~10.0 mg/L范围内,腐霉利进样质量浓度与色谱峰面积间呈良好的线性关系,回归方程为y = 196.5x + 3.040,相关系数为0.999;GC条件下,在0.05~12.0 mg/L范围内,腐霉利进样质量浓度与色谱峰面积间呈良好线性关系,回归方程为y = 15 602x – 792,相关系数为0.999;均满足定量分析要求。
2.2 室内模拟腐霉利在油菜叶片表面的光解当油菜叶片中腐霉利的添加水平分别为0.05、0.2、2及12 mg/kg时,回收率为80%~101%,RSD为2.3%~7.8%,方法的准确性和精密度均符合残留检测要求[17]。按照1.2节方法检测腐霉利在油菜叶片中的残留量,结果表明,其在油菜叶片表面的消解动态符合一级动力学方程,Ct = 12.05e–0.674 3t,R2 = 0.971 0,紫外灯下的消解半衰期为1.03 h (图1)。
室内模拟试验可预测农药在大田条件下消解速率的快慢及其影响因素,指导农药的科学合理施用。关于农药在土壤表面消解的模拟试验报道较多。蔡晓明等室内模拟了氙灯光照下炔草酯 (propynyl) 在土壤表面的光解,其消解半衰期为136 h,通过黑暗对照表明了炔草酯在砂土表面的消解与光照无关[18];席培宇等以氙灯为光源,研究了噻虫嗪 (thiamethoxam) 在土壤表面的光解,其消解半衰期为288.8 h[19]。但有关室内模拟农药在作物表面光解的研究尚未见报道。本研究结果显示,腐霉利在油菜叶面易光解,因此建议应避免在强日照时间段进行施药。
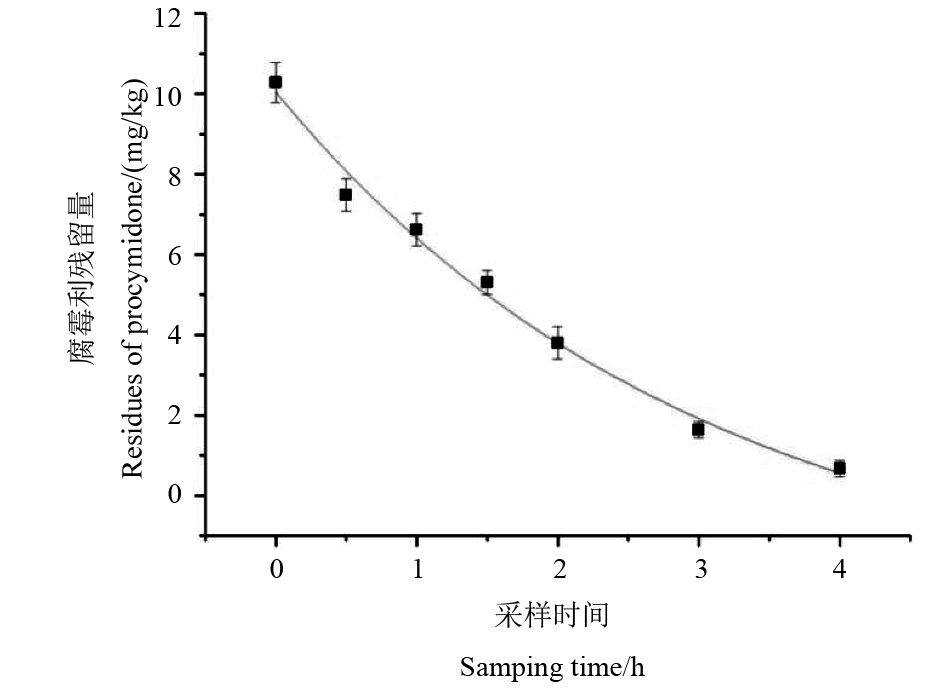
|
图 1 腐霉利在油菜叶片中的消解动态 Fig. 1 Dissipation dynamic of procymidone in rape leave samples |
2.3 影响腐霉利在水溶液中光解速率的因素 2.3.1 初始质量浓度的影响
不同初始质量浓度下,腐霉利在水溶液中的光解均符合一级动力学方程,且随其初始浓度升高,消解速率减慢,半衰期延长 (表1),这与李娟等有关高压汞灯下不同初始浓度腐霉利光解的研究结果一致[10]。说明在一定的光照强度下,浓度越高,单位腐霉利分子接收到的光能越少,消解越慢。
|
|
表 1 不同初始质量浓度下腐霉利的光解动力学参数 (n = 3) Table 1 The photolysis kinetic parameters of procymidone at different initial concentrations (n = 3) |
2.3.2 溶液pH值的影响
结果 (表2) 表明,5 mg/L的腐霉利在不同pH值缓冲液中的光解速率差异显著,其在碱性条件 (pH 9) 下光解较中性和酸性条件下快,分别是中性和酸性条件下的2.8和401倍。其原因可能是由于碱性条件下存在的大量OH– 可促使腐霉利发生羟基化反应,从而导致其消解加快。程功等的研究表明,碱性条件下OH– 的存在可促进丙炔氟草胺 (flumioxazin) 的羟基化反应[20];刘义青等在双氯芬酸 (diclofenac) 水解的研究中也得到了相似的结果。此外,碱性条件下的脱氯反应也是重要的消解途径之一,而酸性条件下大量的H+ 可抑制腐霉利的羟基化反应,从而使反应速率降低[21]。
|
|
表 2 腐霉利在不同pH值缓冲液中的光解动力学参数 (n = 3) Table 2 The photolysis kinetic parameters of procymidone in the different pH buffer (n = 3) |
2.3.3 Fe2+、Fe3+、NO3–及NO2– 的影响
添加不同浓度的Fe2+、Fe3+、NO3– 和NO2–后,对水溶液中腐霉利的光解均表现为光猝灭效应 (图2)。综合对比图2A和2B可以看出,所添加Fe2+ 和Fe3+ 的质量浓度在0.5~10 mg/L、NO3– 和NO2– 的质量浓度在0.5~50 mg/L时,对腐霉利光解的抑制作用呈先增大后减小的趋势,且较低浓度下离子的光猝灭效果较好。具体猝灭机理还有待进一步研究。
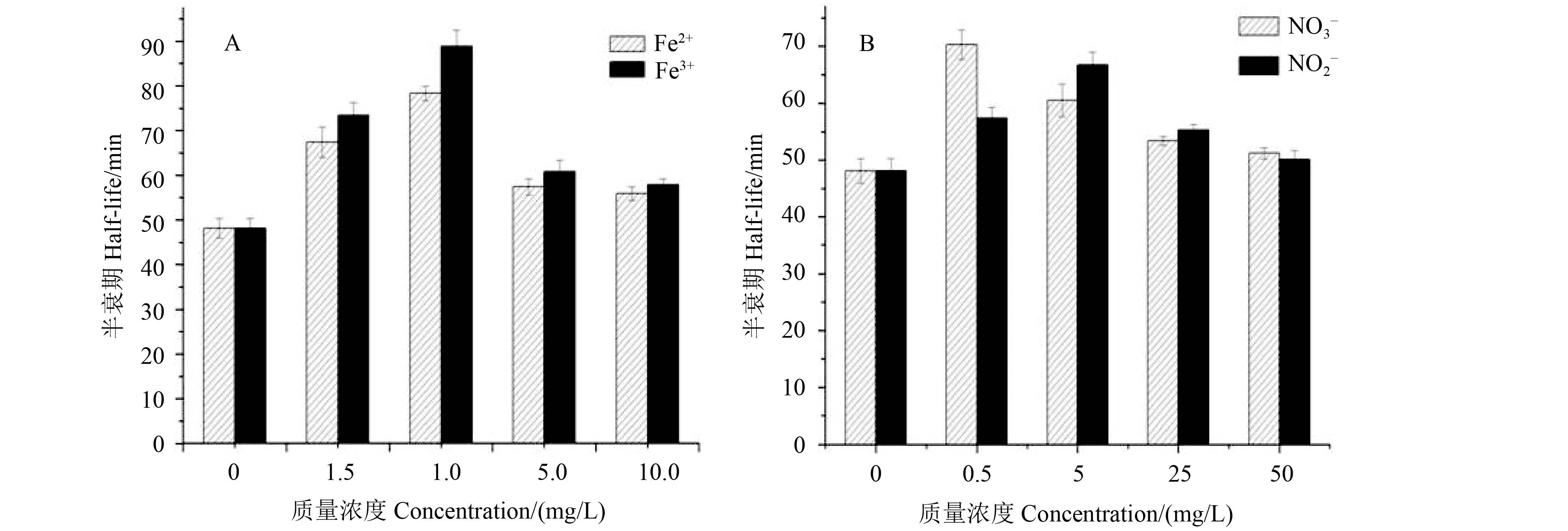
|
图 2 Fe2+、Fe3+ (A) 及NO3–、NO2– (B) 对水溶液中腐霉利光解的影响 Fig. 2 Effects of Fe2+, Fe3+ (A), NO3– and NO2– (B) on the photolysis of procymidone in aqueous solution |
2.4 光解产物分析
腐霉利在甲醇溶液中经紫外光照0 及24 h后,其在气-质联用仪上的总离子流图及质谱图见图3。比较图3A和3B可知,保留时间为9.832 min的腐霉利甲醇溶液在紫外光照24 h后减少,分别在9.338和9.533 min处出现了两个新的色谱峰m和n,其m/z分别为249和269,根据腐霉利的化学结构式推断,m为其单脱氯产物C13H12ClNO2,n为其脱甲基化的产物C12H9Cl2NO2 (图3C-3E)。Schwack等[12]采用GC-MS鉴定得腐霉利在异丙醇溶液中的光解产物为单脱氯产物,本研究中所得产物m与其一致。此外,在丙酮和乙腈溶液中均检测到了m/z = 249和m/z = 269的腐霉利光解产物,由此推测腐霉利在甲醇、丙酮和乙腈溶液中的光解产物相同。

|
A. 腐霉利甲醇溶液光照0 h的总离子流图; B. 腐霉利甲醇溶液光照24 h的总离子流图; C. 腐霉利的质谱图; D. 腐霉利单脱氯产物m的质谱图; E. 腐霉利脱甲基化产物n的质谱图。 A. Total ion chromatogram of procymidone in methanol solution 0 h after light treatment; B. Total ion chromatogram of procymidone in methanol solution 24 h after light treatment; C. The mass spectrum of procymidone; D. The mass spectrum of procymidone dechlorination product m; E. The mass spectrum of procymidone demethylation product n. 图 3 腐霉利甲醇溶液的总离子流图及光解产物质谱图 Fig. 3 Total ion chromatogram of procymidone and the mass spectrum of photoproducts |
2.5 影响腐霉利水解速率的因素 2.5.1 pH值的影响
由表3可知:在黑暗及35 ℃恒温条件下,腐霉利在pH值分别为4、7、9的缓冲液中的水解速率差异显著 (P < 0.01),其消解半衰期分别为35.4、9.3及0.04 d,即腐霉利在碱性条件下极易水解,在酸性条件下相对比较稳定。
腐霉利在不同pH值缓冲液中的水解特性与光解行为一致,说明无论在有无光照的情况下,碱性溶液中的OH– 均能促使其消解。
|
|
表 3 腐霉利在不同pH值缓冲液中的水解动力学参数 (n = 3) Table 3 Hydrolysis kinetics parameters in different pH buffers (n = 3) |
2.5.2 阴离子及阳离子表面活性剂的影响
结果 (表4) 表明:阴离子表面活性剂SDS对腐霉利的水解没有影响;而阳离子表面活性剂CTAB可促进其水解,这与Villedieu等研究所得CTAB对腐霉利水解具有促进作用的结果一致[11],但随着CTAB浓度升高,其促进腐霉利水解的效果增强并不显著。
|
|
表 4 表面活性剂对腐霉利水解的影响 Table 4 The effect of surfactant on the hydrolysis of procymidone |
3 结论
室内模拟光解试验结果表明,腐霉利在油菜叶片上易消解[15];其在碱性条件下易光解和水解,在酸性条件下较稳定;腐霉利在有机溶剂 (甲醇、丙酮和乙腈) 中的光解产物均为其单脱氯产物C13H12ClNO2和脱甲基化产物C12H9Cl2NO2;阴离子表面活性剂SDS对腐霉利的水解没有影响,而阳离子表面活性剂CTAB则可促进其水解。因此建议:1) 应避免在强日照下施用腐霉利;2) 应避免与碱性药剂、肥料等混用;3) SDS可用作为腐霉利制剂中的表面活性剂。
| [1] |
刘长令. 世界农药大全: 杀菌剂卷[M]. 北京: 化学工业出版社, 2005: 116. LIU C L. World pesticide: fungicide volume[M]. Beijing: Chemical Industry Press, 2005: 116. |
| [2] |
宋晰, 肖露, 林东, 等. 番茄灰霉病菌对腐霉利的抗药性检测及生物学性状研究[J]. 农药学学报, 2013, 15(4): 398-404. SONG X, XIAO L, LIN D, et al. Detection of procymidone resistance and investigation of biological characteristics in Botrytis cinerea [J]. Chin J Pestic Sci, 2013, 15(4): 398-404. |
| [3] |
亓育杰, 杨昱, 郑张瑜, 等. 噻呋酰胺的光解和水解特性研究[J]. 农药学学报, 2016, 18(4): 540-544. QI Y H, YANG Y, ZHENG Z Y, et al. Study on the photolysis and hydrolysis properties of thifluzamide[J]. Chin J Pestic Sci, 2016, 18(4): 540-544. |
| [4] |
张晓清, 石利利, 单正军. 农药在液相中的光解研究进展[J]. 农药科学与管理, 2007, 28(7): 41-46. ZHANG X Q, SHI L L, SHAN Z J. Studies on the photochemical degradation of pesticides in liquid solution[J]. Pestic Sci Adm, 2007, 28(7): 41-46. |
| [5] |
田芹, 周志强, 任丽萍, 等. 农药在水体中光化学消解研究进展[J]. 农药, 2005, 44(6): 247-250. TIAN Q, ZHOU Z Q, REN L P, et al. Research development of pesticides photodegradation in water[J]. Chin J Pestic, 2005, 44(6): 247-250. |
| [6] |
危玲, 黄盖群, 李文学, 等. 大田条件下桑树喷施 3 种杀菌剂后药剂在桑椹中的消解动态及残留检测[J]. 蚕业科学, 2016, 42(4): 591-597. WEI L, HUANG G Q, LI W X, et al. Degradation dynamics and residue detection of three fungicides in mulberry fruits under field conditions[J]. Acta Sericologica Sinica, 2016, 42(4): 591-597. |
| [7] |
胡瑞兰, 龚道新, 李佳, 等. 腐霉利在番茄及其土壤中的残留动态研究[J]. 农药研究与应用, 2010, 14(1): 21-24. HU R L, GONG D X, LI J, et al. Residue dynamics of procymidone in tomato and soil[J]. Agrochem Res Appl, 2010, 14(1): 21-24. |
| [8] |
杨莉, 冯光泉, 曾鸿超, 等. 三七中腐霉利残留的气相色谱法检测[J]. 人参研究, 2016, 28(5): 28-30. YANG L, FENG G Q, ZENG H C, et al. Residual analysis of procymidone in notoginseng by gas chromatography[J]. Ginseng Res, 2016, 28(5): 28-30. |
| [9] |
樊晓青, 陆贻通, 汪传炳. 腐霉利在生菜和土壤中的残留动态研究[J]. 上海交通大学学报(农业科学版), 2007, 25(6): 570-573. FAN X Q, LU Y T, WANG C B, et al. Residue dynamics of procymidone in lettuce and soil[J]. J Shanghai Jiaotong Univ: Agri Sci, 2007, 25(6): 570-573. |
| [10] |
李娟, 花日茂, 艾琼. 腐霉利在水溶液中的光化学消解研究[J]. 安徽农业大学学报, 2012, 39(1): 102-106. LI J, HUA R M, AI Q, et al. Photochemical degradation of procymidone in aqueous solution[J]. J Anhui Agric Univ, 2012, 39(1): 102-106. |
| [11] |
VILLEDIEU J C, DE SAVIGNAC A, CALMON J P. Kinetics and mechanisms of hydrolysis of dicarboximide fungicides in micellar media[J]. J Agric Food Chem, 1995, 43(7): 1948-1953. DOI:10.1021/jf00055a035 |
| [12] |
SCHWACK W, BOURGEOIS B. Fungicides and photochemistry: iprodione, procymidone, vinclozolin 1. Photodehalogenation[J]. Z Lebensm Unters Forsch, 1989, 188(4): 346-347. DOI:10.1007/BF01352395 |
| [13] |
RIFAI A, SOUISSI Y, GENTY C, et al. Ultraviolet degradation of procymidone-structural characterization by gas chromatography coupled with mass spectrometry and potential toxicity of photoproducts using in silico tests
[J]. Rapid Commun Mass Spectrom, 2013, 27(13): 1505-1516. DOI:10.1002/rcm.6598 |
| [14] |
食品安全国家标准 水果和蔬菜中 500 种农药及相关化学品残留量的测定 气相色谱-质谱法: GB 23200.8—2016[S]. 北京: 中国标准出版社, 2017. National food safety standards-determination of 500 pesticides and related chemicals residues in fruits and vegetables gas chromatography-mass spectrometry: GB 23200.8—2016[S]. Beijing: Standards Press of China, 2017. |
| [15] |
化学农药环境安全评价试验准则 第 3 部分 光解试验: GB/T 31270.3—2014[S]. 北京: 中国标准出版社, 2015. Test guidelines on environmental safety assessment for chemical pesticides-part 3, phototransformation: GB/T 31270.3—2014[S]. Beijing: Standards Press of China, 2015. |
| [16] |
化学农药环境安全评价试验准则 第 2 部分 水解试验: GB/T 31270.2—2014[S]. 北京: 中国标准出版社, 2015. Test guidelines on environmental safety assessment for chemical pesticides-part 2, hydrolysis: GB/T 31270.2—2014[S]. Beijing: Standards Press of China, 2015. |
| [17] |
中华人民共和国农业行业标准 NY/T 788—2004 农药残留试验准则[J]. 农业质量标准, 2004(4): 29-33. PRC standards for agricultural residues NY/T 788—2004 test criteria for pesticide residues[J]. Agric Qual Standard, 2004(4): 29-33. |
| [18] |
蔡晓明, 何红梅, 丁亚慧, 等. 炔草酯土表光解、土壤厌氧消解和水-沉积物系统消解特性[J]. 农药, 2011, 50(9): 677-679. CAI X M, HE H M, DING Y H, et al. Environmental fates including soil surface photolysis, anaerobic soil degradation, and water-sediment degradation of clodinafop-propargyl[J]. Chin J Pestic, 2011, 50(9): 677-679. |
| [19] |
席培宇, 李景壮, 段亚玲, 等. 噻虫嗪在土壤表面及水中的光解特性[J]. 农药, 2014, 53(10): 726-728. XI P Y, LI J Z, DUAN Y L, et al. The photolysis characteristics of thiamethoxam in the water and soil surface[J]. Chin J Pestic, 2014, 53(10): 726-728. |
| [20] |
程功, 田宏哲, 刘娜, 等. 丙炔氟草胺的水解及光解特性研究[J]. 农药学学报, 2017, 19(5): 583-588. CHENG G, TIAN H Z, LI N, et al. Study on the photolytic and hydrolytic properties of flumioxazin[J]. Chin J Pestic Sci, 2017, 19(5): 583-588. |
| [21] |
刘义青, 史鸿乐, 付永胜. UV254 消解水中双氯芬酸的动力学及机理研究
[J]. 环境科学学报, 2018, 38(3): 947-953. LIU Y Q, SHI H L, FU Y S. The photolysis kinetics and mechanism of diclofenac under UV254 irradiation [J]. Acta Scientiae Circumstantiae, 2018, 38(3): 947-953. |
 2018, Vol. 20
2018, Vol. 20


