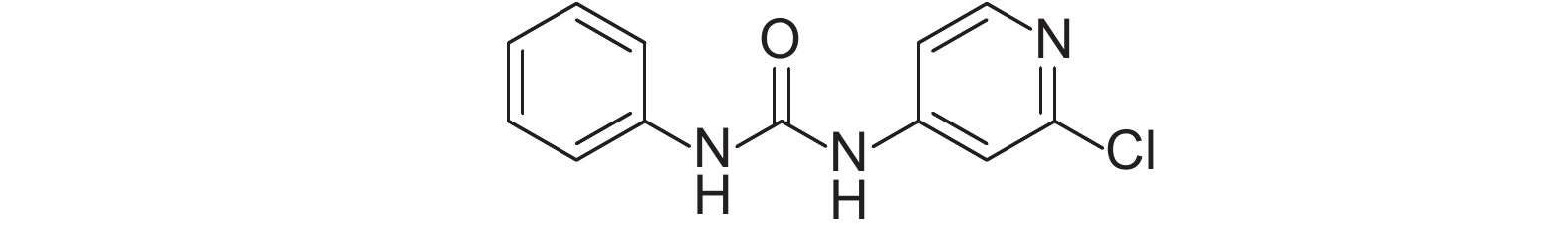
氯吡脲 (forchlorfenuron) 是一种新型高效的植物生长调节剂[1-2],俗称膨大剂或膨大素,化学名称为1-(2-氯-4-吡啶)-3-苯基脲,结构式见图式1。其属于苯脲类细胞分裂素,主要作用机制是促进细胞分裂和扩大细胞体积[3]。
|
图式1 氯吡脲的化学结构式 Scheme1 Stuctural formula of forchlorfenuron |
氯吡脲广泛应用于果树、蔬菜及粮食作物等,目前主要用于猕猴桃、甜瓜等作物上,且其使用范围有进一步扩大的趋势[4-5]。张静等[6]研究证明,氯吡脲能有效延长夏黑葡萄果实的快速生长期,并且其不同浓度处理均可降低葡萄中可溶性固形物含量,提高可滴定酸含量。郭叶等[7]在以不同浓度氯吡脲处理“徐香”猕猴桃时发现,在该试验浓度范围内,氯吡脲浓度越高,对猕猴桃的增重效果越好。Huitrón等[8]的研究表明,在一定范围内,氯吡脲的浓度与无籽西瓜的产量呈正相关。
但近年来滥用氯吡脲的现象时有发生,出现了诸如乒乓球葡萄、体形硕大却淡而无味的猕猴桃等[3],使得民众对氯吡脲等植物生长调节剂潜在的安全性问题表现出了极大的疑虑。此外,对此类具有膨大作用的药剂,主要使用方式是涂、抹、刷及喷雾等人工操作模式,如果欠缺安全保护意识,药剂有可能直接通过皮肤、眼睛粘膜、呼吸道及口腔粘膜等途径被施药者吸收,容易出现中毒现象,严重危害施药者身体健康[9-11]。但目前尚未见系统的相关医学研究报道。
目前有关氯吡脲毒性的研究报道也甚少。林利美等[12]关于氯吡脲对小鼠的急性毒性和致突变性作用研究表明,其对雌性小鼠的LD50值为568 mg/kg,对雄性小鼠的LD50值为421 mg/kg,在安全剂量下,未表现出致突变作用。而美国环境保护署 (EPA) 关于氯吡脲的农药说明书显示,其对大鼠的急性毒性LD50值 > 1 500 mg/kg。氯吡脲的毒理学研究也表明,其对大鼠的急性毒性为低毒 [1]。此外,有文献显示,长期食用使用过膨大剂的果实,可能对人体,尤其是对孕妇和儿童等特殊人群的肾脏造成潜在危害[13-14]。因此,本研究拟通过观察SD大鼠经连续4周灌胃给予氯吡脲后的毒性反应,初步确定其主要毒性靶器官及毒性反应性质、程度,旨在为氯吡脲毒性的准确评价及其安全合理用药,保护环境和人类健康提供科学依据。
1 材料与方法 1.1 试验材料 1.1.1 药剂和试剂99% 氯吡脲 (forchlorfenuron) 原药由加拿大Bio Basic Inc公司提供 (批号:20121103),使用前用0.5%的羧甲基纤维素钠 (CMC-Na) 溶液配制成15、30及60 mg/mL的氯吡脲混悬液;CMC-Na购自国药集团化学试剂有限公司 (批号:F20110211);生化试剂盒购自德国罗氏诊断有限公司;凝血试剂盒购自德国西门子医学诊断产品有限公司;全血细胞计数试剂包购自北京西门子医疗诊断设备有限公司;肝素钠 (> 99%) 购自中国BioSharp公司;甲醛 (37.0%~40.0%) 购自上海申翔化学试剂有限公司;二甲苯 (≥ 99.0%) 购自上海申翔化学试剂有限公司。
1.1.2 主要仪器设备Cobas C311全自动生化仪 (德国罗氏公司);CA-550全自动血凝分析仪 (日本Sysmex医用电子有限公司);ADVIA 2120全自动五分类血细胞分析仪 (德国Siemens医疗系统集团);5424离心机 (德国Eppendorf股份公司);AL104电子天平 (上海Metler Toledo仪器有限公司);EG1150H石蜡包埋机、RM2235组织切片机、ASP300组织脱水机和DM4000电子显微镜 (德国Leica仪器有限公司)。
1.1.3 供试大鼠SPF (specific pathogen free) 级SD (Sprague Dawley) 大鼠,80只,雌、雄各半,体质量160~180 g,由北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK (京) 2016-0011,动物质量合格证号:11400700218906。在20~26 ℃、相对湿度40%~70%、12 h/12 h明暗交替 (8:00‒20:00)、换气次数 ≥ 15次/h条件下雌、雄分开饲养,自由摄食和饮水[15]。
1.2 试验方法 1.2.1 分组及给药选取6~8周龄的SD大鼠80只,按体质量随机分为4组,分别作为溶剂对照组及氯吡脲150、300和600 mg/kg药剂处理组,每组20只,雌、雄各半。药剂处理组每日上午灌胃给予氯吡脲,给药量为10 mL/kg体质量,每天1次,连续4周;溶剂对照组给予同等体积的0.5% CMC-Na溶液[15]。试验期间未见有大鼠死亡。于停药第1天和第15天,各组分别取10只大鼠 (雌、雄各半) 进行解剖。
1.2.2 给药期间对大鼠的观察给药期间每日对大鼠的体征、饮食、粪便、呼吸及自发活动等一般状况进行观察,每7 d称量、记录1次体质量和摄食量。
1.2.3 血常规、血清生化和凝血功能检查于停药后第1天和第15天,各组大鼠禁食12 h后,分别取部分大鼠,雌、雄各半,用10%水合氯醛麻醉后于腹主动脉采血,进行血常规、血液生化和凝血功能检测。
1.2.4 脏器系数计算和病理组织学检查于停药后第1天和第15天分别取大鼠进行解剖,称量心、肝、脾、肺和肾等主要脏器质量,按 (1) 式计算其脏器系数。将各脏器用10%中性甲醛溶液固定,进行常规病理取材、制片和HE染色 (苏木精-伊红染色法,hematoxylin-eosin staining),显微镜下进行病理组织学检查。
| ${\text{脏器系数}}= ({\text{脏器质量}}/{\text{体质量}})\times 100$ | (1) |
实验结果数据均以“平均数 ± 标准差”表示。采用SPSS 11.5 软件进行统计分析,组间比较采用t检验。
2 结果与分析 2.1 氯吡脲对大鼠活动状况的影响从灌胃给药第4天开始,笼旁观察发现,氯吡脲高剂量 (600 mg/kg) 处理组雌性大鼠出现轻微至轻度的自发运动减少,至给药第15天上述症状可恢复。其余剂量处理组均无明显异常反应。
2.2 氯吡脲对大鼠体质量和摄食量的影响灌胃给药期间,各药剂处理组大鼠的体质量持续增长,且与溶剂对照组比较均无显著性变化 (P > 0.05)( 表1)。连续给药4周后,各剂量处理组大鼠摄食量和饮水量数据虽然有一定波动,但变化幅度较小且未见明显剂量依赖关系 (表2)。因此判断上述变化与氯吡脲给药不相关,即氯吡脲对大鼠体质量和摄食量无明显影响。
|
|
表 1 氯吡脲对大鼠体质量的影响 Table 1 Effect of forchlorfenuron on body mass of rats |
|
|
表 2 氯吡脲对大鼠摄食量的影响 Table 2 Effect of forchlorfenuron on food intake in rats |
2.3 氯吡脲对大鼠血常规指标的影响
结果表明:停药第1天 (表3) 和第15天 (表4),雌、雄性大鼠的白细胞 (WBC)、血小板 (PLT)、血红蛋白 (HGB) 等血常规指标与溶剂对照组比较均无显著性差异 (P > 0.05),即氯吡脲对大鼠血常规无明显影响。
|
|
表 3 停药第1天氯吡脲对大鼠血常规指标的影响 Table 3 Effect of forchlorfenuron on blood routine index in rats on 1st day after drug withdrawal |
|
|
表 4 停药第15天氯吡脲对大鼠血常规指标的影响 Table 4 Effect of forchlorfenuron on blood routine index in rats on 15th day after drug withdrawal |
2.4 氯吡脲对大鼠血清生化指标的影响
停药后第1天,与溶剂对照组比较,氯吡脲300 mg/kg及以上剂量处理组雄性大鼠的尿素氮和肌酐含量明显升高 (P < 0.05),其中,600 mg/kg剂量组肌酐含量极显著升高 ( P < 0.001),且该组血糖也明显升高 ( P < 0.05),其他生化指标则与溶剂对照组无显著性差异 ( 表5)。停药后第15天,与溶剂对照组比较,氯吡脲150~300 mg/kg处理组雄性大鼠肌酸磷酸激酶升高 (P < 0.05),但变化幅度较小。其余各项指标则均有不同程度的恢复,与溶剂对照组比较无显著性差异 ( 表6)。
|
|
表 5 停药后第1天氯吡脲对大鼠血清生化指标的影响 Table 5 Effect of forchlorfenuron on parameters of blood biochemistry index in rats on 1st day after drug withdrawal |
|
|
表 6 停药后第15天氯吡脲对大鼠血清生化指标的影响 Table 6 Effect of forchlorfenuron on parameters of blood biochemistry index in rats on 15th after drug withdrawal |
2.5 氯吡脲对大鼠凝血指标的影响
结果见表7。停药后第1天和第15天,雌、雄性大鼠活化部分凝血活酶时间 (APTT) 及凝血酶原时间 (PT) 等血凝指标与溶剂对照组比较均无显著性差异 (P > 0.05)。
|
|
表 7 停药后第1天和第15天氯吡脲对大鼠凝血指标的影响 Table 7 Effect of forchlorfenuron on parameters of blood coagulation of rats on 1st and 15th day after drug withdrawal |
2.6 氯吡脲对大鼠脏器系数的影响
停药后第1天,与溶剂对照组比较,氯吡脲300 mg/kg及以上剂量组大鼠的肾脏系数明显升高 (P < 0.05),其中,600 mg/kg剂量组雌性大鼠肾脏系数极显著升高 ( P < 0.001);氯吡脲 300 mg/kg及以上剂量组雌性大鼠肝脏系数显著升高 ( P < 0.01)( 表8)。停药第15天,氯吡脲600 mg/kg剂量组雌性大鼠肾脏系数明显升高 (P < 0.05),其余脏器系数与溶剂对照组无明显差异 ( 表9)。
|
|
表 8 停药后第1天氯吡脲对大鼠脏器系数的影响 Table 8 Effect of forchlorfenuron on organ index on 1st day after drug withdrawal |
|
|
表 9 停药后第15天氯吡脲对大鼠脏器系数的影响 Table 9 Effect of forchlorfenuron on organ index on 15th day after drug withdrawal |
2.7 氯吡脲对大鼠脏器病理组织学的影响
经氯吡脲连续灌胃给药4周后,高剂量 (600 mg/kg) 组6只大鼠 (6/10,3只雄性,3只雌性) 均出现了明显的肾脏病理组织学改变,主要表现为明显的白细胞管型、透明管型、间质炎性细胞浸润及肾小管扩张,该组大鼠其余各组织器官均未见明显病理改变 (图1);中剂量 (300 mg/kg) 组4只大鼠 (4/10,2只雄性,2只雌性) 均出现轻度肾管萎缩,其余各组织器官也未见明显病理学改变;低剂量 (150 mg/kg) 组未见明显病理学改变。其余各组织器官均未见明显病理学及与药物相关的病理组织学改变。停药恢复15 d后,氯吡脲中剂量处理组大鼠肾脏基本恢复,高剂量组大鼠肾脏部分恢复,总体上SD大鼠重要脏器未见明显损害性改变。

|
注:采用苏木精-伊红染色法 (HE染色)。溶剂对照组给予10 mL/kg CMC-Na,药剂处理组分别给予150、300和600 mg/kg的氯吡脲,每日1次,连续给药4周,停药后第1天处死大鼠。绿色箭头表示肾脏中的肾小管萎缩,黑色箭头表示可见的白色管型,黄色箭头表示透明管型,蓝色箭头表示肾小管中的间质炎性细胞浸润等病变。 Note:Hematoxylin-eosin staining (HE staining). Rats in solvent control group were ig given CMC-Na 10 mL/kg,and rats in treatment groups were ig given forchlorfenuron 150, 300 and 600 mg/kg, once daily for 4 weeks.The rats were sacrificed on the 1st day after drug withdrawal.The green arrow refers to a small amount of atrophy of the renal tubules in kidney, the black arrow refers to visible white tube type, the yellow arrow refers to transparent tube type and the blue arrow refers to interstitial inflammatory cell infiltration in renal tubular and other pathological changes. 图 1 氯吡脲对大鼠肾脏病理组织学的影响 Fig. 1 Effect of forchlorfenuron on kidney histopathological changes in rats |
3 结论与讨论
本研究采用SD大鼠,经连续4周灌胃给予氯吡脲,考察了大鼠对氯吡脲的毒性反应。结果显示,药剂处理组雌性大鼠肝脏脏器系数均较溶剂对照组有所升高,且300 mg/kg及以上剂量组与溶剂对照组比较差异显著 (P < 0.01)。而与肝功能相关的生化指标ALT和AST水平则与溶剂对照组接近,无统计学差异,病理组织学检查也未见明显肝脏功能性损伤。其肝脏脏器系数的改变仅存在于停药第1天的雌性大鼠,停药后第15天,药剂处理组雌性大鼠肝脏脏器系数与溶剂对照组相比即未见统计学差异,且病理学指标也未见与给药相关的病变。因此,不排除氯吡脲对动物肝脏可能存在影响,但其对雌、雄性大鼠肝脏的具体毒性作用以及肝脏毒性作用的性别差异等还有待进一步研究。
本研究中,300 mg/kg及以上剂量氯吡脲处理组大鼠肾脏脏器系数均显著高于溶剂对照组 (P < 0.05)。病理组织学检查可见肾脏的改变,且其病变程度及发生概率与给药剂量之间存在一定相关性,据此推测大鼠肾脏的病理学改变应与氯吡脲给药有关。虽然氯吡脲对雌、雄性大鼠肾脏组织的影响无明显性别间差异,但鉴于雄性大鼠肾功能相关的生化指标尿素氮 (Bun) 和肌酐 (CREA) 水平与溶剂对照组比较存在统计学差异,因此,氯吡脲对雌、雄性大鼠肾脏毒性性别差异的作用机制还有待进一步研究。
张志恒等[16]采用规范残留试验数据进行的膳食风险评估结果表明:氯吡脲对中国各类人群的国家估计每日摄入量在0.117~0.318 μg/kg/d之间,只占其每日允许摄入量 (ADI) 的0.17%~0.45%;其国家估计短期摄入量在0.06~1.33 μg/kg/d之间,只占急性参考剂量 (ARfD) 的0.01%~0.13%。根据GB 2763‒2016《食品安全国家标准 食品中农药最大残留限量》规定,氯吡脲的最大允许残留限量 (MRL) 值为0.05 mg/kg,该残留限量标准对消费者具有较高的保护水平。依据本研究结果,氯吡脲属于低毒性,SD大鼠经连续4周灌胃给予,其毒性反应剂量为300 mg/kg,且毒性反应较轻微,150 mg/kg剂量为无明显毒性反应剂量。综上可见,在严格控制使用剂量和使用方法情况下,氯吡脲的残留量较低,较为安全,不易对环境和人体产生不良影响。但若高浓度、不合理滥用,仍可能会影响人体健康,并推测其主要毒性靶器官可能是肾脏。更多毒理作用机制等有待进一步研究。
| [1] |
US Environmental Protection Agency, Office of Prevention, Pesticides and Toxic Substances. Pesticide fact sheet[EB/OL]. U.S. EPA, 2004. (2004–09) (2015-09-16) [2017-10-20]. https://www3.epa.gov/pesticides/chem_search/reg_actions/registration/fs_PC-128819_01-Sep-04.pdf
|
| [2] |
ZENG Z, YANG W H, LU C Z, et al. Effect of CPPU on carbohydrate and endogenous hormone levels in young macadamia fruit[J]. PLoS One, 2016, 11(7): e0158705. DOI:10.1371/journal.pone.0158705 |
| [3] |
白冰, 赵莉, 宋卫国, 等. 西瓜中氯吡脲残留的 LC-MS/MS 检测方法研究[J]. 上海农业科学, 2016, 32(3): 60-62. BAI B, ZHAO L, SONG W G, et al. Determination of forchlorfenuron residue in watermelon by LC-MS/MS[J]. Acta Agriculturae Shanghai, 2016, 32(3): 60-62. |
| [4] |
王楠, 胡坪, 国欣. QuEChERS-HPLC 法快速检测猕猴桃中氯吡脲残留[J]. 食品工业, 2014, 35(5): 234-237. WANG N, HU P, GUO X. Application of the QuEChERS-HPLC method for the determination of forchlorfenuron residues in kiwi fruit[J]. J Toxicol, 2014, 35(5): 234-237. |
| [5] |
CHEN W J, JIAO B N, SU X S, et al. Dissipation and residue of forchlorfenuron in citrus fruits[J]. Bull Environ Contamat Toxicol, 2013, 90(6): 756-760. DOI:10.1007/s00128-013-0979-6 |
| [6] |
张静, 任俊鹏, 杨庆文, 等. CPPU 对夏黑葡萄果实生长的影响[J]. 中国南方果树, 2013, 42(2): 22-25. ZHANG J, REN J P, YANG Q W, et al. Effect of CPPU treatments on fruit growth of " Summer Black” grape[J]. South China Fruits, 2013, 42(2): 22-25. |
| [7] |
郭叶, 王亚萍, 费学谦, 等. 不同浓度 CPPU 处理对 " 徐香” 猕猴桃贮藏生理和品质的影响[J]. 食品工业科技, 2012, 33(20): 324-327. GUO Y, WANG Y P, FEI X Q, et al. Effect of different concentrations of CPPU on physiological and nutritional quality of " Xuxiang” kiwifruit[J]. Sci Technol Food Ind, 2012, 33(20): 324-327. |
| [8] |
HUITRÓN M V, DIAZ M, DIÁNEZ F, et al. Effect of 2, 4-D and CPPU on triploid watermelon production and quality[J]. HortScience, 2007, 42(3): 559-564. |
| [9] |
郑先福, 文雨婷, 郑昊, 等. 植物生长调节剂使用过程中存在的主要问题和解决方法[J]. 现代农药, 2014, 13(5): 16-19. ZHENG X F, WEN Y T, ZHENG H, et al. Main problems and solutions of plant growth regulators in use[J]. Modern Agrochemicals, 2014, 13(5): 16-19. |
| [10] |
ZHANG Z W, GUO K Q, BAI Y B, et al. Identification, synthesis, and safety assessment of forchlorfenuron (1-(2-Chloro-4-pyridyl)-3-phenylurea) and its metabolites in kiwifruits[J]. J Agric Food Chem, 2015, 63(11): 3059-3066. DOI:10.1021/acs.jafc.5b01100 |
| [11] |
ZHANG R J, CUI B, HUANG S B. Degradation of forchlorfenuron by nitrification and denitrification reactions in the gut and shell biofilm of Limnoperna fortunei
[J]. Ecotoxicology, 2015, 24(2): 381-390. DOI:10.1007/s10646-014-1386-4 |
| [12] |
林利美, 黄大伟, 郭娇娇, 等. 氯吡脲对小鼠的毒性实验研究[J]. 食品工业科技, 2012, 33(14): 360-364. LIN L M, HUANG D W, GUO J J, et al. Study on toxicity test of forchlorfenuron in mice[J]. Sci Technol Food Ind, 2012, 33(14): 360-364. |
| [13] |
颜欢, 葛荣, 程薇波, 等. 氯吡脲对雄性 SD 大鼠青春期发育的影响[J]. 现代预防医学, 2015, 42(14): 2604-2607. YAN H, GE R, CHENG W B, et al. The effects of forchlorfenuron on the development of pubertal male SD-rats[J]. Mod Prevent Med, 2015, 42(14): 2604-2607. |
| [14] |
HU Q C, NELSON W J, SPILIOTIS E T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics[J]. J Biol Chem, 2008, 283(43): 29563-29571. DOI:10.1074/jbc.M804962200 |
| [15] |
陈雁虹, 盖仁华, 吴洪海. 全反式维 A 酸给药 4 周对大鼠的毒性作用[J]. 中国药理学与毒理学杂志, 2013, 27(2): 248-255. CHEN Y H, GAI R H, WU H H. Toxicity of all-trans retinoic acid for four-week oral administration in SD rats[J]. Chin J Pharmacol Toxicol, 2013, 27(2): 248-255. |
| [16] |
张志恒, 汤涛, 徐浩, 等. 果蔬中氯吡脲残留的膳食摄入风险评估[J]. 中国农业科学, 2012, 45(10): 1982-1991. ZHANG Z H, TANG T, XU H, et al. Dietary intake risk assessment of forchlorfenuron residue in fruits and vegetables[J]. Scientia Agricultura Sinica, 2012, 45(10): 1982-1991. DOI:10.3864/j.issn.0578-1752.2012.10.011 |
 2018, Vol. 20
2018, Vol. 20


