固体化学物质存在“多晶型现象”[1],直接导致其理化性质不同,如溶解度、溶出速率、熔点、密度、硬度、晶体形状、光学性质、电学性质甚至药效等[2-4]。优势药物晶型是指在同一药物的多晶型中,可以实现最佳临床治疗效果的晶型[5]。研究和控制药物晶型,可以提高药物的质量,保证药物的临床治疗作用[5]。在医药领域,对药物晶型的研究如火如荼[5],但在农药领域相对较少[6]。为了提高农药有效利用率,减少环境污染,亟待加强对农药晶型的研究及优势晶型的选择。
农药的优势晶型具有更好的物理化学性质,可以提高固体制剂的应用效果[7]。尤其是在微观状态下原药以固体形式分散存在的制剂,比如悬浮剂、水分散颗粒剂等。农药多晶型研究越来越受到重视,不同晶型的农药其生物活性差异明显,如:嘧菌酯存在晶型A、晶型B及无定型形式,且其无定型形式为活性最优形态[8];吡唑嘧菌酯以4种不同的互变晶型I-IV存在,其中晶型IV是热力学上最稳定的晶型,可以很好地加工为悬浮剂[9-10]。Aguilar等[11]通过调节pH值可以控制甲基磺草酮热力学稳定的1型和动力学稳定的2型的不同形式。程春生等[12]采用新的制备方法得到了咪草烟新晶型II,克服了原有晶型I不稳定、颗粒小、不容易过滤的缺点。禹凯等[13]采用不同有机碱用量的试验条件获得了啶酰菌胺晶型I和晶型II。赵金浩等[14]公开了茚虫威新晶型A和无定型的制备方法,但生物活性数据没有详细对比研究。
茚虫威 (indoxacarb) 属二嗪类化合物[15],登记号为DPX-JW062(CAS:144171-61-9),其中市售产品是其S-异构体 (DPX-KN128) 与R-异构体 (DPX-KN127) 质量比为75 : 25的混合物,但只有其S-异构体 (CAS号:173584-44-6) 具有杀虫活性,化学名称为 (S)-7-氯-2,5-二氢-[[(甲氧羰基)[4-(三氟甲氧基)-苯基]氨基]羰基]茚并[1,2-e][1,3,4]二嗪-4a(3H)-羧酸甲酯[16],结构式见图式 1。
|
图式1 S-茚虫威的化学结构式 Scheme1 The chemical structural formula of S-indoxacarb |
茚虫威具有结构新颖、作用机理独特以及与其他农药无交互抗性等优点,与环境相容性好,对几乎所有鳞翅目害虫有特效,主要用于防治粮、棉、水果及蔬菜等作物上的多种害虫,是替代有机磷杀虫剂的理想品种之一[17-18],且符合现代绿色农药的要求,其常规剂型有悬浮剂、乳油等[19]。
目前,有关农药晶型的研究在中国尚处于初期阶段,随着对农药高效应用、减量应用、低残留及环境友好的要求越来越高,对现有农药品种的优势晶型进行研究越来越重要。茚虫威是绿色环保的杀虫剂,相关研究很多,但尚未见有关其晶型的研究报道。为了提高茚虫威的有效利用率,笔者对S-茚虫威的晶型进行了初步研究,获得了一种新型S-茚虫威的晶型A和无定型形式,并分别配制了悬浮剂,比较了其杀虫活性的差异,旨在为茚虫威优势晶型状态选择提供科学研究基础数据。
1 材料与方法 1.1 主要试剂与仪器S-茚虫威 (S-indoxacarb,纯度98.93%) 由浙江大学农药与环境毒理研究所自行制备 (白色针状晶体,ee值为99.8%);15%安打悬浮剂 (Vatar,有效成分为m (S-茚虫威) : m (R-茚虫威) = 3 : 1,市售);试剂均为分析纯,由国药集团化学试剂有限公司提供。
D/Max-2550PC X射线粉末衍射仪;Rigaku R-AXIS-RAPIDX射线单晶衍射仪;DSC Q100差示扫描量热仪;SDT Q600综合热分析仪;React IRTM1000傅里叶变换红外 (FTIR) 分光光度计;Leica DMLB&DMIL光学显微镜,DF-101Z集热式恒温加热磁力搅拌器。
1.2 不同晶型S-茚虫威的制备 1.2.1 晶型A及其单晶的制备 1.2.1.1 晶型A制备方法1称取1.0 g S-茚虫威溶于5 mL异丙醇中,磁力搅拌下回流30 min,自然冷却至室温,搅拌析出晶体,抽滤,异丙醇洗涤,40 ℃下真空干燥,得无色透明粒状晶体,命名为S-茚虫威晶型A,收率为72%。熔点95~98 ℃。
1.2.1.2 晶型A制备方法2将1.0 g S-茚虫威溶于4 mL乙醇中,回流0.5~2 h形成茚虫威透明溶液。置于 –10~ –5 ℃中快速冷却,搅拌析出晶体,抽滤,用乙醇洗涤,40 ℃下真空干燥,得到S-茚虫威晶型A,收率在83%以上。熔点96~98 ℃。
1.2.1.3 晶型A单晶的制备称取1.0 g S-茚虫威溶于20 mL甲醇中,搅拌加热至回流,得黄色透明溶液。室温 (20~25 ℃) 下放置,缓慢挥发溶剂3 d后得无色透明棒状晶体。
1.2.2 无定型S-茚虫威的制备将1.0 g S-茚虫威加热至熔化后继续加热30 min,得到热熔物,立即置于 –10~ –5 ℃条件下快速冷却,得白色无定形粉末状固体。经测定,其无固定熔点,符合无定型的特点。
1.3 不同晶型S-茚虫威的检测分析 1.3.1 X射线粉末衍射 (PXRD)X射线粉末衍射 (X-ray powder diffraction, PXRD ) 由Philips粉末衍射仪PW1050/70收集,在40 kV和30 mA条件下,采用CuKα辐射 (波长0.154 2 nm) 和衍射束石墨单色器,按照常规方法测定。所得X射线衍射数据由计算机分析软件进行平滑处理、Kα2峰剥离及自动寻峰定位。
1.3.2 差示扫描量热分析 (DSC)不同晶型其热稳定性一般不同,可通过热稳定性差异判定晶型是否相同。称取2~4 mg供试样品,设置扫描频率为10 ℃/min,扫描范围40~160 ℃,用氮气流吹扫,采用差示扫描量热分析仪测定。用STARe软件分析数据。
1.3.3 热重分析 (TGA)分别将供试样品放入氧化铝坩埚中,温度范围:30~500 ℃,升温速率:10 ℃/min,氮气流速:50 mL/min,用SDT Q600综合热分析仪按照常规方法测定。
1.3.4 傅里叶变换红外光谱分析 (FTIR)采用KI混合压片法。采用分辨度4 cm–1,256次扫描测量得到谱图。
1.3.5 X射线单晶衍射 (X-ray)选取S-茚虫威晶型A大小为0.53 mm × 0.38 mm × 0.20 mm的晶体于衍射仪上,采用Mo Kα射线 (γ = 0.071 069 nm) 石磨单色器进行测定,测定温度 –30 ℃,晶体距IP板的距离为127.40 nm,以ω扫描、二段扫描方式,回摆角Δω = 5°,θ范围3.3~27.5°,共获得独立衍射点4 758个 (Rint = 0.021),其中可观察点3 843个 (I > 2σ ( I))。衍射数据经Lp因子校正和吸收校正,用直接法进行晶体结构解析,随后用数轮差值Fourier合成法确定了非氢原子和氢原子坐标,对全部非氢原子坐标进行了各向异性参数全矩阵的最小二乘法修正,氢原子采用各向同性参数跨骑修正,参与修正的变量为328个,衍射点数与变量参数之比为14.5,最终结构偏离因子R = 0.077,ωR = 0.220,(Δ/σ)max < 0.001结构解析采用SIR-92程序,精修、绘图及其他计算均用Crystal Structure 3.0软件完成。
1.4 不同晶型生物活性研究 1.4.1 悬浮剂的配制采用湿法研磨粉碎工艺[19]。分别称取S-茚虫威的晶型A和无定型粉末15 g于砂磨容器中,采用相同的配方配制其悬浮剂:S-茚虫威有效含量 (质量分数,下同) 为15%,分散剂D-425为3%,分散剂SF-04为0.8%,黄原胶XG为0.2%,高效有机硅消泡剂S-29为0.4%,防冻剂乙二醇为2%,水为78.5%。先于0~5 ℃、3 000 r/min下剪切30 min,再加入100 mL直径为1~2 mm的氧化锆珠,室温下研磨90 min,分别得到质量分数为15%的S-茚虫威晶型A悬浮剂 (SC-1) 和15%的S-茚虫威无定型悬浮剂 (SC-2)。
1.4.2 悬浮剂的物理性质测定参考文献[19]方法,采用激光粒度分布仪测定样品的粒径。参考文献[20]方法测定悬浮剂的悬浮率。
1.4.3 生物活性测定 1.4.3.1 供试药剂15% S-茚虫威晶型A悬浮剂 (SC-1),15% S-茚虫威无定型悬浮剂 (SC-2) 和15%安打悬浮剂。
1.4.3.2 供试靶标小菜蛾Plutella xyllostella (L.) 和二化螟Chilo suppressalis (Walker),均为室内常年累代饲养虫种。
1.4.3.3 药液配制准确称取一定质量 (精确至0.000 1 g) 的供试药剂,用蒸馏水溶解并配制成有效成分质量浓度为5 000 mg/L的母液,继而用蒸馏水稀释成测定时所需浓度的药液,备用。根据预试验,设定小菜蛾活性测定施药剂量 (有效成分) 分别为10、2.5和0.625 mg/L,二化螟活性测定施药剂量 (有效成分) 分别为6、2和0.6 mg/L。
1.4.3.4 杀虫活性测定1) 对小菜蛾活性测定
采用浸叶法[21]。将适量甘蓝叶在配制好的供试药液中充分浸润后自然阴干,放入垫有滤纸的培养皿中,接种斜纹夜蛾2龄中期幼虫10头/皿,置于24~26 ℃、14 h光照的观察室内培养。3次重复。2 d后调查结果。以0.1%的吐温水溶液为空白对照。以毛笔触动虫体,无反应视为死虫,分别按公式 (1) 和 (2) 计算死亡率和校正死亡率。
| ${\text{死亡率}}/{\text{%}} = \frac{{\text{死亡个体数}}}{{\text{供试总虫数}}} \times 100$ | (1) |
| $\begin{split}&{\text{校正死亡率}}/{\text{%}} = \\ & \quad\frac {{\text{对照组内生存率} - {\text{处理组内生存率}}}}{\text{对照组内生存率}} \times 100\end{split}$ | (2) |
2) 对二化螟活性测定
采用浸苗法[21]。选取长势良好的水稻幼苗,吸干表面水分,在配制好的供试药液中浸渍约10 s后自然阴干,移入试管中。接种二化螟2龄幼虫,10头/管,用棉花塞好。每处理2次重复。置于26~28 ℃、16 h光照/8 h黑暗,室内培养,3 d后调查结果。以空白对照取食率为100%,按公式 (3) 和 (4) 分别计算取食率和校正取食率。
| ${\text{取食率}}/{\text{%}} = \frac{{\text{取食活个体数}}}{{\text{供试总虫数}}} \times 100$ | (3) |
| $\begin{split}&{\text{校正取食率}}/{\text{%}} = \\ & \quad\frac {{\text{对照组内取食率} - {\text{处理组内取食率}}}}{\text{对照组内取食率}} \times 100\end{split}$ | (4) |
本研究发现,分别将S-茚虫威溶于异丙醇、甲醇、乙醇、正丁醇、乙二醇、乙酸乙酯、四氢呋喃和甲苯等溶剂中,均可得到晶型A,且由不同溶剂中析出晶体的熔点、外观及PXRD测定结果均一致,熔点均在96~98 ℃之间,但与文献报道中S-茚虫威的熔点值 (88.1 ℃)[22]不同。可见晶型不同,熔点不同。无定型态是物质存在多晶型现象中的一种形式,也是一种特殊的晶体状态,属晶型的一种,常用制备方法有骤冷处理 (熔融法)、沉淀处理、冷冻干燥、喷雾干燥等,本研究中采用熔融法制备得到无定型的S-茚虫威,是最常用的方法,简便易得。
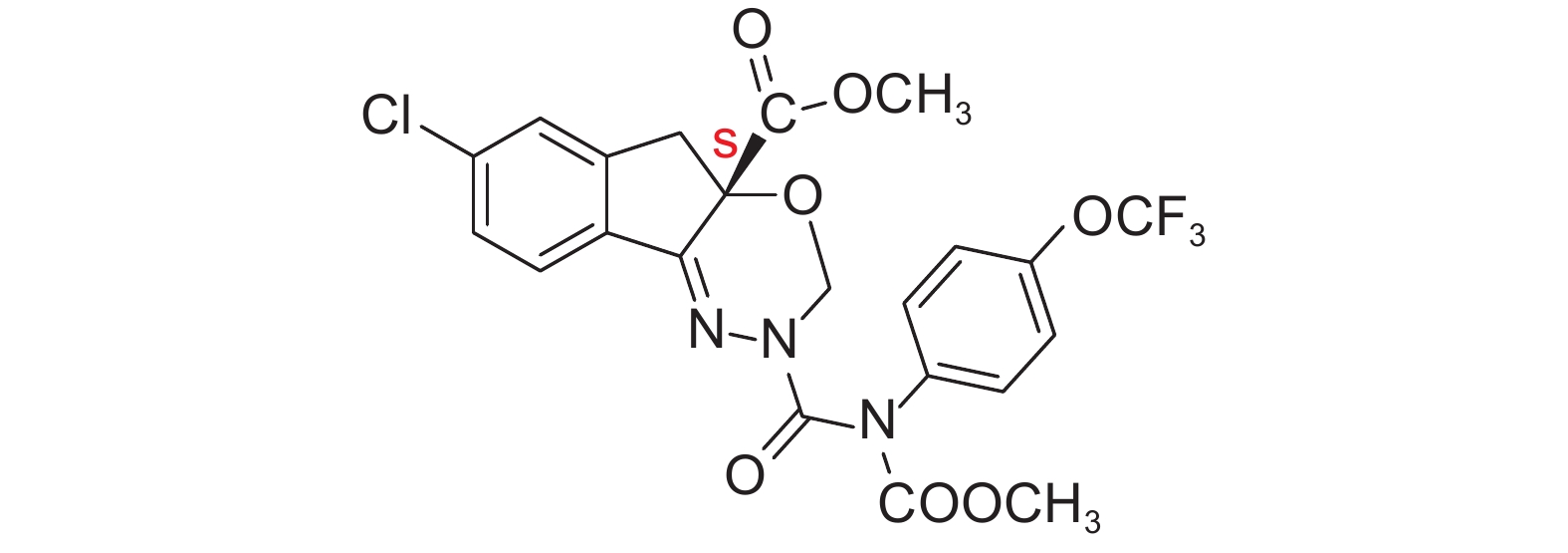
2.2 不同晶形S-茚虫威的表征 2.2.1 X射线粉末衍射 (PXRD)X-射线衍射是研究药物多晶型的主要手段之一,多晶型的衍射图互不相同,而且具有特征峰,特别适用于晶型鉴别[22]。S-茚虫威的晶型A和无定型粉末的X射线衍射图分别见图1-a和图1-b。由图1-a可以看出:其在以下位置存在尖锐特征峰 (2θ/°):9.22、9.56、11.90、14.34、14.54、15.12、16.99、18.48、19.08、19.56、20.63、21.16、23.42、23.90、24.88、27.34、32.08和33.32,表明其为典型的晶态化合物。由图1-b可以看出,其衍射图呈弥散状,为典型的无定型态。
|
图 1 S-茚虫威晶型A (a) 和无定型 (b) 的 XRD 图 Fig. 1 The XRD spectra of polymorph A (a) and amorphous form (b) of S-indoxacarb |
2.2.2 差示扫描量热分析 (DSC)
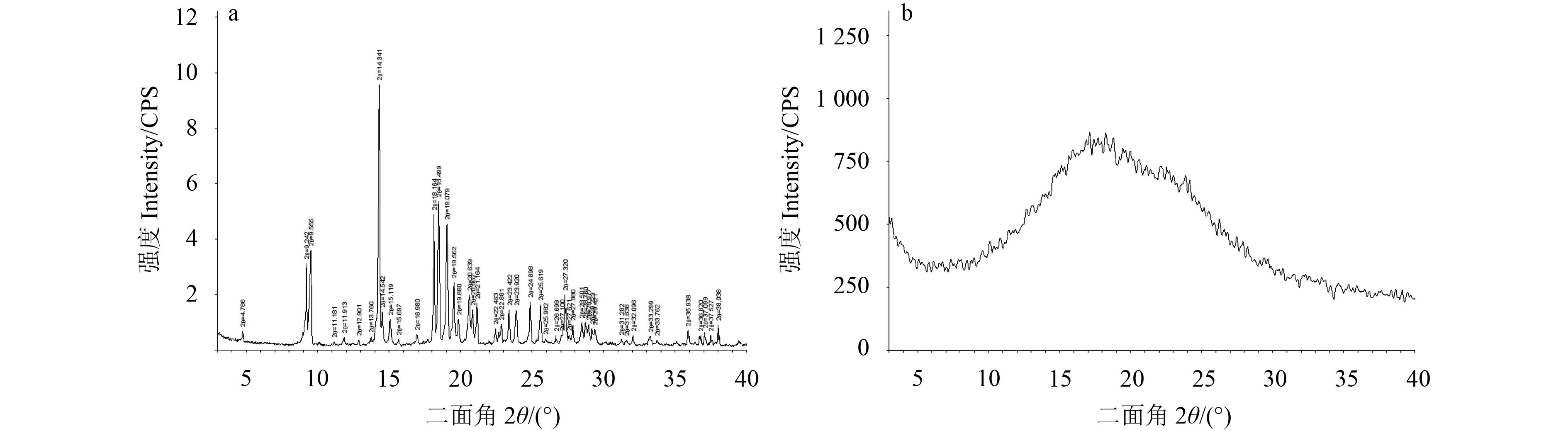
DSC法是在程序控温下监测固体物质随着温度变化其物理性质发生相应变化的分析方法。DSC检测适用于分析样品的熔融状态,根据图谱的差异可辨别多晶型[23]。S-茚虫威的晶型A与无定型粉末的DSC结果见图2。由图2可知,S-茚虫威晶型A与无定型粉末的热稳定性不同。晶型A熔融温度为93.07~99.08 ℃,无定型态则没有明显的吸热峰。
|
图 2 S-茚虫威晶型A (a) 和无定型 (b) 的差示扫描量热分析图 Fig. 2 The DSC spectra of polymorph A (a) and amorphous form (b) of S-indoxacarb |
2.2.3 热重分析 (TGA)
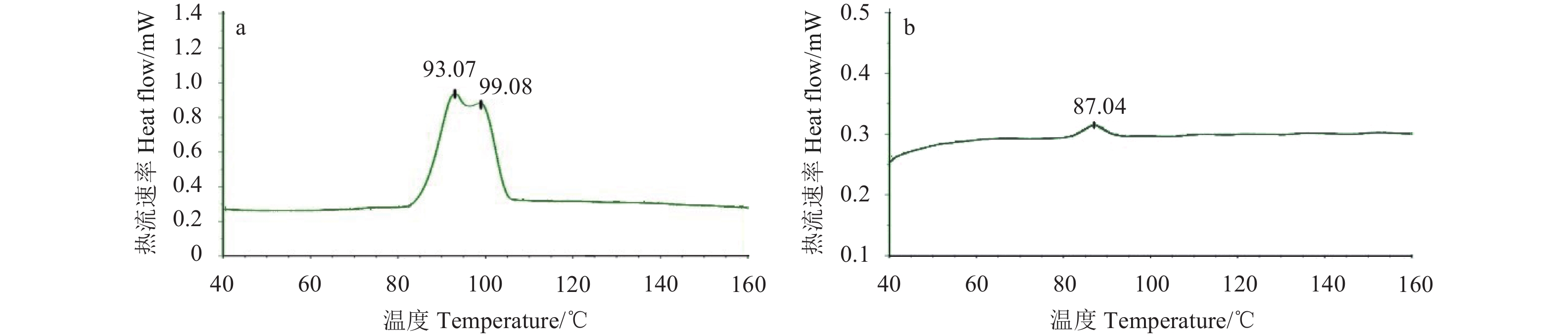
S-茚虫威晶型A和无定型粉末的热重分析 (TGA) 结果见图3。从图中可以看出,晶型A和无定型S-茚虫威在分解前均没有质量损失,说明均为无水晶型,并且晶型A在308.72 ℃左右开始熔融,无定型在259.20 ℃左右开始熔融。
|
图 3 S-茚虫威晶型A (a) 和无定型 (b) 的TGA图 Fig. 3 The TGA spectra of polymorph A (a) and amorphous form (b) of S-indoxacarb |
2.2.4 傅里叶变换红外光谱 (FTIR)
一般来说,不同晶型的晶体其红外光谱谱图不同。图4-a为S-茚虫威晶型A的红外光谱图。其特征吸收峰有v 592 cm–1处的CF3的变形振动及O=C—N变形振动;767 cm–1处的C—Cl伸缩振动峰;3 465 cm–1处的O—H和1 741、1 693 cm–1处的C=O伸缩振动峰;2 963 cm–1处的C—H伸缩振动峰;1 271 cm–1处的C—O—C的不对称伸缩振动及1 554 cm–1处的C—N伸缩振动峰。图4-b为S-茚虫威无定型粉末的红外光谱图。其在v 3 465、1 747、1 693、767及592 cm–1处同样具有特征峰,但是将两个红外光谱图进行匹配,匹配度只有69.42%,因此可判定为两种不同类型的晶型。
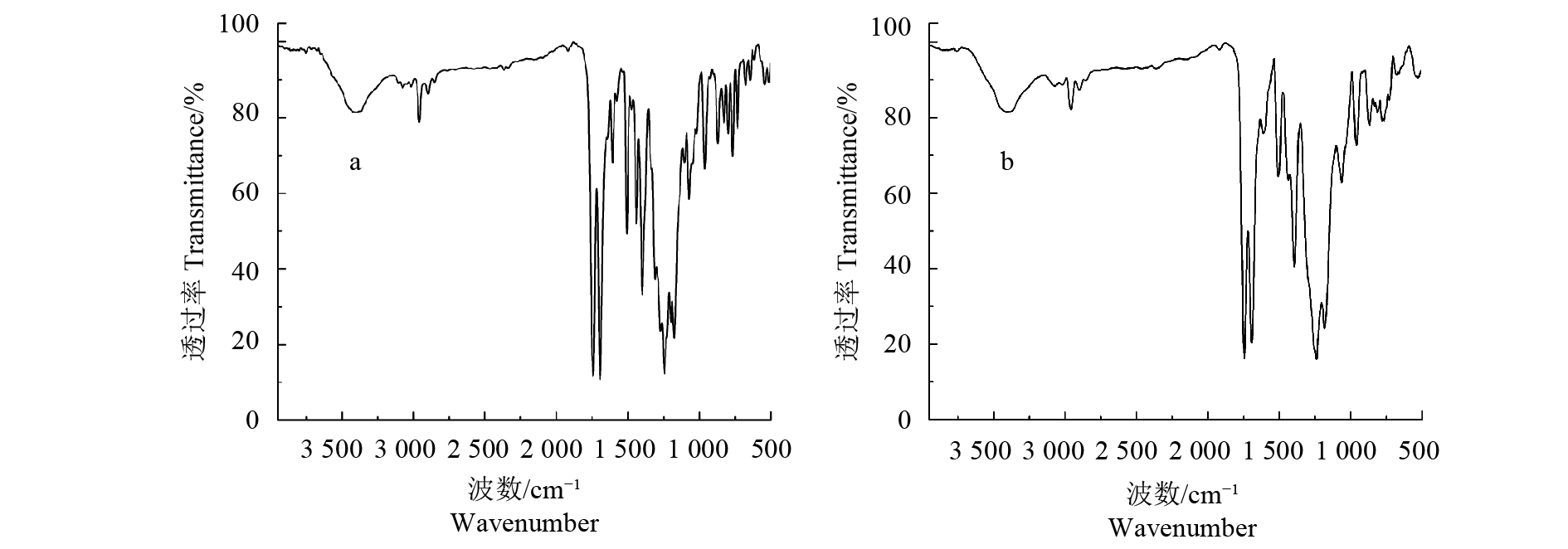
|
图 4 S-茚虫威晶型A (a) 和无定型 (b) 的傅里叶变换红外图谱 Fig. 4 The FTIR spectra of polymorph A (a) and amorphous form (b) of S-indoxacarb |
2.2.5 X射线单晶衍射 (X-ray)
目前,S-茚虫威的单晶结构尚未有文献报道。通过对S-茚虫威晶型A的X-射线单晶结构分析,对其结构进行进一步的确证,通过X射线衍射数据分析表明制备得到的这种晶型 (C22H17ClF3N3O7,Mr = 527.84) 属于单斜晶系,C2空间群,晶胞参数为:a = 19.618 3 (8) nm, b = 6.390 3 (3) nm, c = 18.953 5 (9) nm, α = γ = 90°, β = 101.396 (2)°, 晶胞体积V = 2 329.29 (18) nm3,Z = 4,Dc = 1.505 g/cm3,R = 0.077,ωR = 0.220,μ = 0.24 mm–1。通过ORTEP软件得到S-茚虫威晶型A的分子结构 (图5),晶体结构表明:C1、C2、C3、C8、C9、C10所在苯环的平面1与苯环C16、C17、C18、C19、C20、C21所在平面2的夹角为87.19 ℃,且C5为手型分子,C5与平面1的垂直距离为0.253 nm,C5与平面2的垂直距离为4.313 nm (Mercury软件分析)。
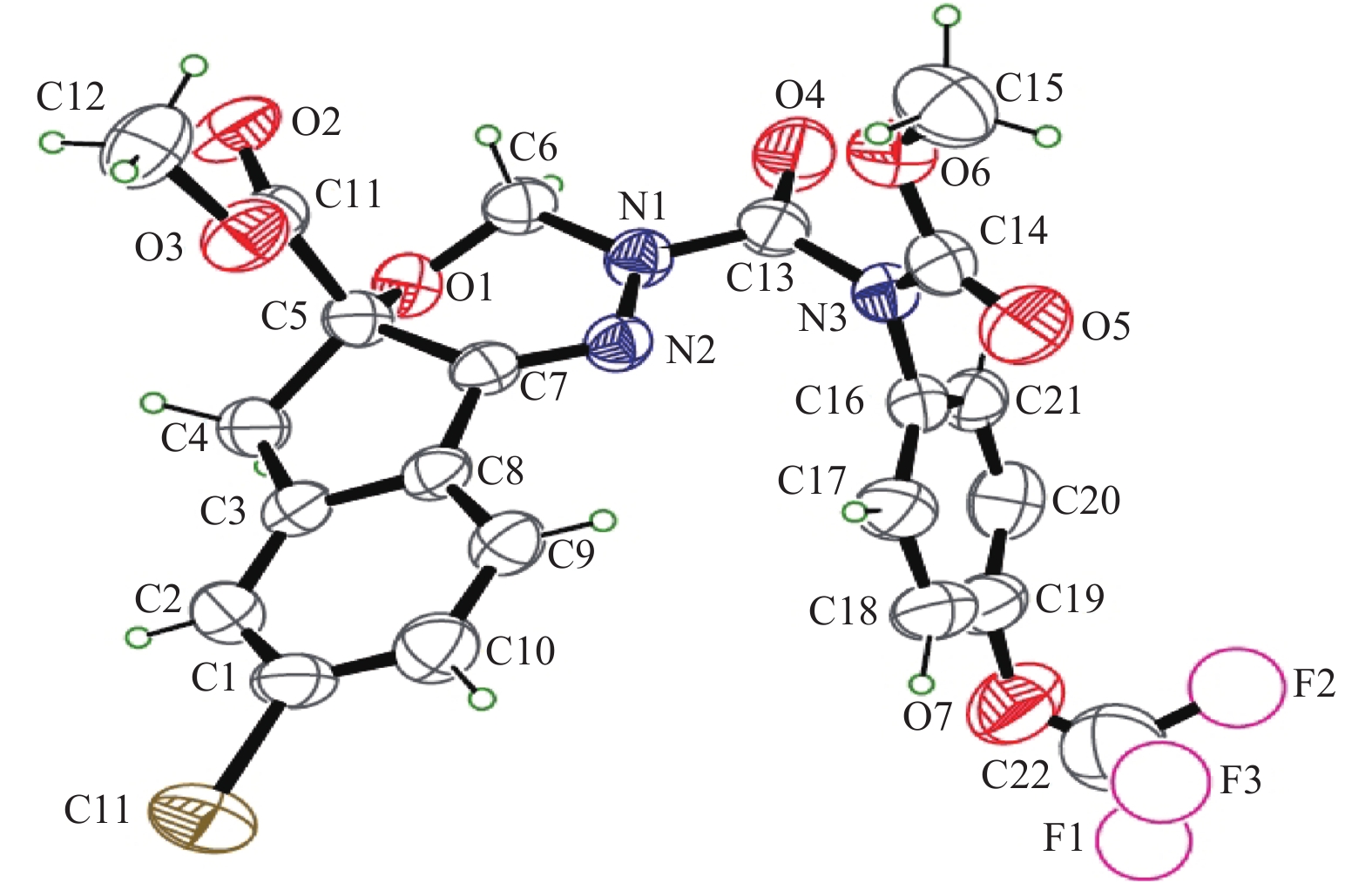
|
图 5 S-茚虫威晶型A的分子结构图 Fig. 5 The molecular structure of polymorph A of S-indoxacarb |
2.3 不同晶型S-茚虫威的杀虫活性
不同晶型的农药会影响其制剂的制备工艺、质量和稳定性,而且可能影响药物的生物利用度和药效。因此,在制备了S-茚虫威晶型A和无定型的基础上,选用适当助剂,分别配制了与市售产品15%安达悬浮剂相同的剂型SC-1和SC-2。通过测试表明,SC-2的粒径大于SC-1,分别为3.20 μm和2.51 μm。SC-1与SC-2的悬浮率分别为96.39%和90.32%。SC-2的悬浮率稍低于SC-1,可能是因为无定型茚虫威的粒径比晶型A的稍大,导致其悬浮率稍低。但总的来说,两种悬浮剂的悬浮率均是合格的,可以用于进一步生物活性测定。
选择茚虫威的登记靶标害虫——小菜蛾和二化螟作为测试对象,以15%安打悬浮剂为对照药剂进行杀虫活性测定,结果见图6和图7。
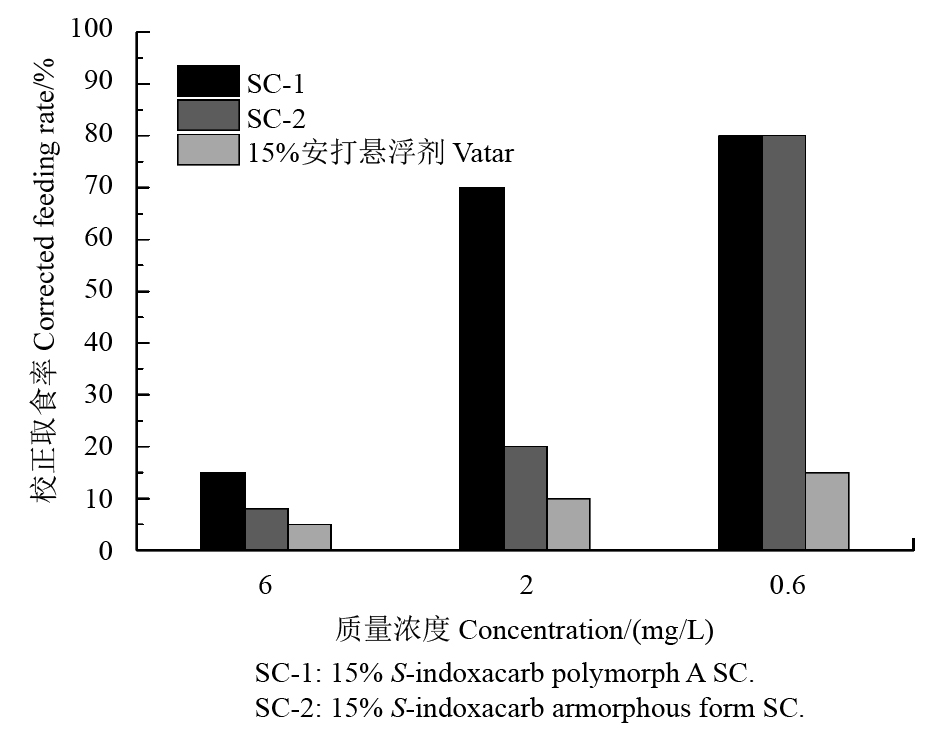
|
图 6 S-茚虫威不同制剂对二化螟的杀虫活性 Fig. 6 The insecticide activity of different formulations of S-indoxacarb against Chilo suppressalis |
用不同质量浓度、不同晶型S-茚虫威制剂处理后二化螟的取食率不同,取食率越低,表示杀虫活性越高。由图6可以看出:15%的S-茚虫威无定型悬浮剂 (SC-2) 的杀虫活性高于茚虫威晶型A悬浮剂 (SC-1),但略低于15%安打悬浮剂,这可能与本研究中制备悬浮剂时所选用助剂种类以及悬浮剂配方未经优化有关。
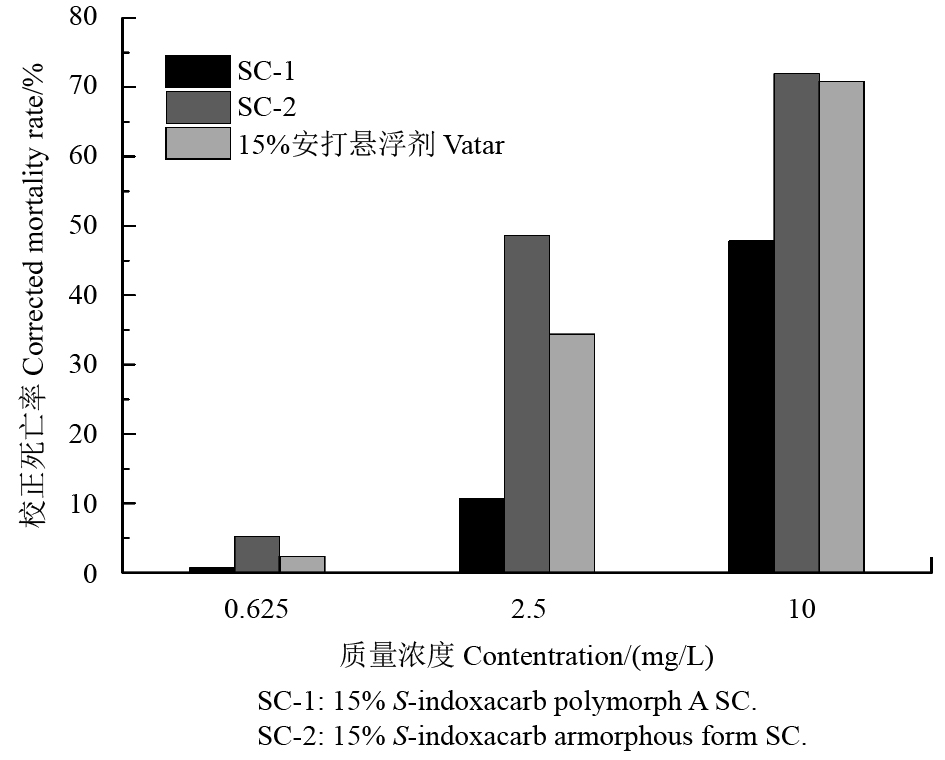
|
图 7 S-茚虫威不同制剂对小菜蛾的杀虫活性 Fig. 7 The insecticide activity of different formulations of S-indoxacarb against Plutella xyllostella |
对小菜蛾的杀虫活性试验结果 (图7) 表明:在3种供试浓度下,SC-2的杀虫活性均高于对照药剂15%安打悬浮剂,而SC-1的活性则较低。
上述试验结果表明,具有相同ee值的S-茚虫威的无定型悬浮剂的杀虫活性明显高于其晶型A悬浮剂,说明S-茚虫威的无定型形式为药效好的优势晶型。这可能是因为无定型态具有较高能量的非结晶性或形成了尚未结晶化的超细晶粒,使S-茚虫威保持高度分散状态,所以活性更高。
3 结论本研究采用溶剂结晶法 (异丙醇和乙醇) 制备得到S-茚虫威的一种新晶型A,并首次获得了其单晶结构;采用熔融法制备得到S-茚虫威的无定型形式,通过X射线粉末衍射 (PXRD)、差示扫描量热分析 (DSC)、热重分析 (TGA) 及傅里叶变换红外光谱分析 (FTIR) 等技术对不同晶型结构进行了表征。进一步制备了S-茚虫威不同晶型的15%悬浮剂,并对其生物活性进行了对比研究。结果表明,S-茚虫威存在晶型A和无定型两种不同的晶型状态,其无定型的悬浮剂对二化螟和小菜蛾的杀虫活性显著高于其晶型A的悬浮剂。本研究证实了S-茚虫威存在多晶型状态,在固体制剂状态下,比如悬浮剂,其无定型形式为其活性优势晶型。这一结果也为研究其他农药晶型提供了良好的借鉴与思路。
| [1] |
吕杨, 杜冠华. 晶型药物[M]. 北京: 人民卫生出版社, 2009: 1-7. LV Y, DU G H. Polymorphic drugs[M]. Beijing: People’s Medical Publishing House, 2009: 1-7. |
| [2] |
JIA C Y, YIN Q X, GONG J B, et al. Solubility of form B pravastatin sodium in (water + 2-propanol)[J]. J Chem Eng Data, 2009, 54(7): 2120-2122. DOI:10.1021/je800919m |
| [3] |
CUI P L, YIN Q X, GUO Y H, et al. Polymorphic crystallization and transformation of candesartan cilexetil[J]. Ind Eng Chem Res, 2012, 51(39): 12910-12916. DOI:10.1021/ie2024855 |
| [4] |
杨梁, 张敏, 鹿颐, 等. 盐酸林可霉素两种晶型晶体结构的分析与比较[J]. 药物分析杂志, 2005, 25(1): 76-80. YANG L, ZHANG M, LU Y, et al. Analysis and comparison of polymorphs crystal structure of lincomycin hydrochloride[J]. Chin J Pharm Anal, 2005, 25(1): 76-80. |
| [5] |
杜冠华, 吕扬. 药品质量的影响因素——化学固体药物的晶型研究[J]. 药学研究, 2017, 36(6): 311-314, 336. DU G H, LYU Y. Polymorphism of drugs: the main factor affecting the drug quality[J]. J Pharm Res, 2017, 36(6): 311-314, 336. |
| [6] |
姜爽, 王莹, 秦宇佳, 等. 农药生产中的工业结晶技术[J]. 农药, 2016, 55(12): 864-866. JIANG S, WANG Y, QIN Y J, et al. Industrial crystallization technology in agrochemical industry[J]. Agrochemicals, 2016, 55(12): 864-866. |
| [7] |
JESCHKE P, VELTEN R, OLENIK B, et al. Insecticidal mixtures with improved properties: WO 2012076471(A1)[P/OL]. 2010-12-09[2012-06-14]. https://worldwide.espacenet.com/WO2012076471.
|
| [8] |
ZAMIR S, FAKTOROVITCH I. Polymorphs of 3-(E)-2-{2-[6-(2-cyanophenoxy) pyrimidin-4-yloxy]phenyl}-3-methoxyacrylate: WO 2008093325[P/OL]. 2007-02-01[2008-01-02]. https://worldwide.espacenet.com/WO2008093325.
|
| [9] |
ZIEGLER H, MAYER W, KROEHL T, SCHNEIDER K H. et al. Crystalline modifications to pyraclostrobin: WO 2006136357[P/OL]. 2005-06-20[2006-12-28]. https://worldwide.espacenet.com/WO2006136357.
|
| [10] |
FINCH C W. A process for preparing an aqueous suspension of an organic pesticide compound: WO 2011006896[P/OL]. 2009-07-14[2011-02-01]. https://worldwide.espacenet.com/WO2011006896.
|
| [11] |
AGUILAR M, DAY M N, NUTTER M R, et al. Message delivery across a plurality of processors: WO 2006021473(A1)[P/OL]. 2004-08-26[2006-02-03]. https://worldwide.espacenet.com/WO2006021473.
|
| [12] |
程春生, 任忠宝, 于萍, 等. 咪草烟的制备方法: CN 102453022[P/OL]. 2010-10-27[2013-09-11]. http://www.pss-system.gov.cn/sipopublicsearch/patentsearch/showViewList-jumpToView.shtml. CHENG C S, REN Z B, YU P, et al. Method for preparing imazethapyr: CN 102453022[P/OL]. 2010-10-27[2013-09-11]. http://www.pss-system.gov.cn/sipopublicsearch/patentsearch/showViewList-jumpToView.shtml. |
| [13] |
禹凯, 岳刚, 关登仕, 等. pH值对啶酰菌胺晶型的影响[J]. 精细化工中间体, 2015, 45(1): 24-27. YU K, YUE G, GUAN D S, et al. The study of the effect of PH value on boscalid crystalline form[J]. Fine Chem Intermed, 2015, 45(1): 24-27. |
| [14] |
赵金浩, 郑敏, 程敬丽, 等. 精茚虫威的晶型: CN 105111164A[P/OL]. 2015-12-02[2018-03-09]. http://www.pss-system.gov.cn/sipopublicsearch/patentsearch/showViewList-jumpToView.shtml. ZHAO J H, ZHENG M, CHENG J L, et al. Crystal form of refined indoxacarb: CN 105111164A[P/OL]. 2015-12-02[2018-03-09]. http://www.pss-system.gov.cn/sipopublicsearch/patentsearch/showViewList-jumpToView.shtml. |
| [15] |
丁宁, 孟庆伟, 赵伟杰, 等. 噁二嗪类杀虫剂茚虫威的研究进展[J]. 农药学学报, 2005, 7(2): 97-103. DING N, MENG Q W, ZHAO W J, et al. Progress on indoxacarb as an oxadiazine Insecticide[J]. Chin J Pestic Sci, 2005, 7(2): 97-103. |
| [16] |
李翔, 马海军, 顾林玲, 等. 茚虫威合成路线研究与比较[J]. 现代农药, 2009, 8(5): 23-26. LI X, MA H J, GU L L, et al. Research and comparison of the synthetic routes of indoxacarb[J]. Modern Agrochem, 2009, 8(5): 23-26. |
| [17] |
陈丽萍, 郭建辉, 蔡恩兴, 等. 茚虫威在菜用大豆上残留动态及安全使用技术[J]. 农药学学报, 2008, 10(4): 443-449. CHEN L P, GUO J H, CAI E X, et al. Residual dynamics and safe usage technology of indoxacarb on vegetable soybean[J]. Chin J Pestic Sci, 2008, 10(4): 443-449. |
| [18] |
王欢庆, 董丰收, 刘新刚, 等. 茚虫威对映体在番茄、葡萄及水中的液相色谱-串联质谱检测方法[J]. 农药学学报, 2012, 14(5): 539-544. WANG H Q, DONG F S, LIU X G. Determination of indoxacarb enantiomers in tomato, grape and water by liquid chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2012, 14(5): 539-544. |
| [19] |
刘梅凤, 魏晓林, 魏方林, 等. 20%茚虫威悬浮剂的热贮物理稳定性预测研究[J]. 农药学学报, 2013, 15(5): 574-581. LIU M F, WEI X L, WEI F L, et al. Research on the prediction of physical stability for indoxacarb 200SC after thermal storage[J]. Chin J Pestic Sci, 2013, 15(5): 574-581. |
| [20] |
农药悬浮率测定方法: GB/T 14825—2006[S]. 北京: 中国标准出版社, 2007. Determination method for suspensibility of pesticides: GB/T 14825—2006[S]. Beijing: Standards Press of China, 2007. |
| [21] |
农药室内生物测定试验准则 杀菌剂 第2部分: 抑制病原真菌菌丝生长试验 平皿法: NY/T 1156.2—2006[S]. 北京: 中国农业出版社, 2006. Pesticides guidelines for laboratory bioactivity tests part 2: petri plate test for determining fungicide inhibition of mycelial growth: NY/T 1156.2—2006[S]. Beijing: China Agriculture Press, 2006. |
| [22] |
SCHMUCKLER M E, COOKE L A. Physical and chemical characteristics of DPX-KN128[R]. Wilmington: E. I. du Pont de Nemours and company, report no. AMR 4141-96, 1997. https://echa.europa.eu/documents/10162/85def842-b077-974f-fcb6-c9450a76031b
|
| [23] |
李凯霞. 蒿甲醚结晶热力学及多晶型研究[D]. 广州: 华南理工大学, 2010. LI K X. Study on crystallization thermodynamics and polymorphism of β-artemether[D]. Guangzhou: South China University of Technology, 2010. |
 2018, Vol. 20
2018, Vol. 20


