2. 山东农业大学 山东省农药毒理与应用技术重点实验室,山东 泰安271018;
3. 山东农业大学 农学院,山东 泰安271018
2. Key Laboratory of Pesticide Toxicology & Application Technique, Shandong Agricultural University, Taian 271018, Shandong Province, China;
3. College of Agronomy, Shandong Agricultural University, Taian 271018, Shandong Province, China
农药减量施用是现代农药研究非常重要的方向。2017年2月14日,在国务院印发的《“十三五”国家药品安全规划》中也提出了对农业源头污染治理的发展目标,其中要求对主要农作物病虫害绿色防控覆盖率需达到30%以上,农药利用率达到40%以上[1]。喷雾助剂的使用是实现农药减施增效的重要途径之一,在农药使用时通过桶混添加喷雾助剂,可以提高农药有效成分的活性,改善药液物理性能,在达到防治目标的同时,减少农药的使用量,提高农药利用率[2]。目前已有许多学者对喷雾助剂进行了相关研究,特别对有机硅类[3-5]、甲酯化油类[6]、高分子聚合物类[7-9]以及植物油类[2, 5, 10]等喷雾助剂的研究较为广泛。耐雨水冲刷喷雾助剂是农药喷雾助剂一个分支,有关其品种的开发和性能的研究日益增加[11-13]。
玉米是中国主要的粮食作物之一。中国主要夏玉米产区的病、虫、草害多发于7、8月份的雨季,降雨等不利环境因素对玉米田农药喷雾防效的影响很大。农药喷施后若短时间内发生降雨,会减少农药有效成分在植物表面的持留量,降低防治效果。嘧菌酯可用于防治玉米大斑病和玉米小斑病等病害,因其具有荧光特性,也可以作为评价喷雾助剂耐雨水冲刷性能的荧光指示剂[8]。目前嘧菌酯常用残留检测方法有气相色谱-电子捕获检测法 (GC-ECD)、液相色谱-质谱检测法 (HPLC-MS) 和气相色谱-质谱检测法 (GC-MS) 等[14-16]。为明确喷雾助剂对农药的耐雨水冲刷性能,结合本研究特点,笔者建立了能简单快速检测玉米叶片表面嘧菌酯含量的荧光显微镜法和高效液相色谱法,并采用这两种方法初步探究了实验室自行研制的4种喷雾助剂在室内模拟雨水冲刷条件下提高玉米叶片表面嘧菌酯附着量的效果,进而评价喷雾助剂对提高嘧菌酯在玉米叶片上耐雨水冲刷的能力;对两种检测方法所测定的结果进行了相关性分析;同时测定了喷雾助剂对嘧菌酯药液一些物理性状的影响。
鉴于氯虫苯甲酰胺是玉米上常用的杀虫剂之一[17],故本研究选择将其与喷雾助剂桶混后对玉米进行喷雾处理,通过测定处理前后玉米植株生长速率和鲜重的变化,探究了喷雾助剂对玉米的安全性。
1 材料与方法 1.1 供试材料 1.1.1 供试玉米郑单958、浚单20和登海605,均为市售常见玉米品种。
1.1.2 药剂和试剂250 g/L嘧菌酯 (azoxystrobin) 悬浮剂,先正达 (苏州) 作物保护有限公司;200 g/L氯虫苯甲酰胺 (chlorantraniliprole) 悬浮剂,美国杜邦公司;嘧菌酯标准品 (99.5%),国家标准物质标准样品信息中心;乙腈 (色谱纯),上海星可高纯溶剂有限公司;其他试剂为市售分析纯。
1.1.3 主要仪器PB600-1型微量注射器,瑞士哈密尔顿公司;SMZ25型荧光显微镜,日本尼康公司;JC2000D1型接触角测量仪,上海中晨数字技术设备有限公司;MATABI SUPER GREEN 16型手动喷雾器,西班牙盖世堡公司;Agilent 1200高效液相色谱仪,美国安捷伦公司。
1.2 喷雾助剂的配制供试4种喷雾助剂AY904-1、AY904-2、AY904-3和AY904-4为本实验室自行研制,配方组成见表1。
|
|
表 1 喷雾助剂配方组成 Table 1 Formulations of different spray adjuvants |
1.3 试验方法 1.3.1 添加不同喷雾助剂的嘧菌酯药液在玉米叶片表面接触角的测定
在250 g/L嘧菌酯悬浮剂500倍液中分别添加4种喷雾助剂,添加质量分数分别为0.1%、0.5%和1.0%,以不添加喷雾助剂的250 g/L嘧菌酯悬浮剂500倍液和清水作为对照,测定4种喷雾助剂对嘧菌酯药液在玉米叶片表面接触角的影响。将玉米种子种在250 mm × 300 mm的花盆中,置于玻璃温室内培养,温度控制在28 ℃ ± 1 ℃,相对湿度为75%~80%,光照条件良好,待玉米长至4~5叶期,备用。剪取适当体积的玉米叶片,避开叶脉并确保不破坏叶片表面结构,用双面胶将其平整地贴在载玻片上,使用接触角测定仪测定供试系列药液在玉米叶片表面的接触角[18]。从滴加样品到记录测量结果在5 s内完成,每个处理重复6次,结果取平均值。
1.3.2 添加不同喷雾助剂的嘧菌酯药液干燥时间的测定参照鲁梅等[19]的方法进行。药液的配制同1.3.1节。用微量注射器吸取药液,将针头靠近平放的涂有石蜡的载玻片表面,滴加1滴(5 μL)药液,通过双目镜观察记录在室温26 ℃、相对湿度60%条件下液滴完全干燥所需的时间,即为药液干燥时间。每处理重复测定5次,结果取平均值。
1.3.3 助剂溶胀度和溶解性测定采用质量测定法[9] 测定。根据预试验中喷雾助剂经干燥后残留物质量的不同,分别称取1.80 g AY904-1、2.50 g AY904-2、3.10 g AY904-3和4.20 g AY904-4于直径6 cm的玻璃培养皿中,加入2.5 mL去离子水,搅拌均匀,于室温下静置72 h,形成质量为0.62~0.66 g的薄膜,膜中水的质量分数在2.6%~6.5%之间。用数字游标卡尺测得膜的厚度为76~133 μm,将膜称重后置于盛有500 mL去离子水的烧杯中,并将烧杯置于不同温度的水浴锅内,不要搅动,每隔一定时间取出薄膜,用吸水纸吸去表面水分并称重,按 (1) 式计算溶胀度 (swelling degree)。试验设置3组水浴温度 (8、18和28 ℃) 以模拟不同的环境温度。
| $SD = \frac{{{m_t} - {m_0}}}{{{m_0}}}$ |
其中:SD为溶胀度,mt代表时间为t时膜的重量,m0代表膜干燥时的初始重量。
1.3.4 玉米叶片上嘧菌酯持留量的测定 1.3.4.1 室内模拟雨水冲刷试验根据BBCH scale (一种描述作物生育期的方法) 的标准[20],选用生育期为16 (GS16)、叶片位置为5 (LP5) 的郑单958玉米叶片上表面作为研究表面。将玉米叶片剪成2.0 cm × 2.0 cm的方块,避开叶脉,叶片上表面向上,用双面胶固定于载玻片中部。将4种喷雾助剂按照质量分数为0.01%、0.05%、0.1%、0.5%和1.0%的剂量加入到质量分数为1.0%的嘧菌酯溶液中。用微量注射器吸取药液,点滴在玉米叶片中央,每个叶片1滴 (1.0 μL)。以不添加助剂的1.0%的嘧菌酯溶液作对照,每个处理重复4次。点滴药液的叶片自然干燥30 min后置于自制的室内冲刷装置 (图1,在Symonds等[8]所设计装置基础上改造完成,载玻片水平倾角为45°,50 mL酸式滴定管出口与叶片上待冲刷样品的垂直距离为2.0 cm,水滴速率为3滴/s,水滴大小为1/28 mL) 中,用滴定管中的去离子水冲刷叶片上的沉积物,每个叶片共冲刷6次,每次用水1.0 mL。

|
图 1 室内冲刷装置 Fig. 1 Laboratory-scale washing device |
1.3.4.2 荧光显微镜法测定玉米叶片上嘧菌酯的持留量
叶片上的沉积物冲刷前后均在荧光显微镜下成像并提取图像。所有试验图像均通过Image J软件进行分析,计算各图片荧光面积[21-22]。设定冲刷前沉积物的荧光覆盖率为100%,分别计算每次冲刷后沉积物的荧光面积占冲刷前面积的百分比,从而评价4种喷雾助剂在提高玉米叶片上嘧菌酯抵抗水冲刷的潜能。
1.3.4.3 高效液相色谱法测定玉米叶片上嘧菌酯持留量筛选1.3.4.1节中的部分处理 (表2),使用高效液相色谱法对叶片表面的嘧菌酯进行定量测定,得到冲刷前后玉米叶片表面嘧菌酯准确的量,计算出冲刷后嘧菌酯占初始点滴量的百分比,与荧光显微镜法测定结果对比,探究两种方法的相关性大小。
|
|
表 2 室内冲刷嘧菌酯残留试验处理 Table 2 Lab-scale wash-off treatments of azoxystrobin residue |
1) 色谱分析检测条件:SB-C18色谱柱;柱温为室温;流动相为V (乙腈) : V(水) = 60:40;流速1.0 mL/min;检测波长225 nm;保留时间 8 min;定量体积20 μL。
2) 标准曲线制作:准确称取0.1 g (精确至0.000 1 g) 嘧菌酯标准品于100 mL容量瓶中,用乙腈溶解并定容,配制成1 000.0 mg/L的嘧菌酯标准溶液,继而稀释成0.05、0.1、0.2、0.5、1.0、5.0和10.0 mg/L的系列标准溶液,在上述液相色谱条件下测定,以嘧菌酯标准溶液的质量浓度为横坐标,相应的峰面积为纵坐标,绘制标准曲线。
3) 样品前处理方法:将待测样品放入离心管中,加入5 mL乙腈剧烈振荡3 min进行初提取,转移提取液;再加入5 mL乙腈进行第2次振荡提取,合并提取液于干净离心管中。加入1.0 g无水硫酸钠,放置4 h,期间摇晃3次。抽滤,旋转蒸发浓缩至近干,加入2 mL乙腈回溶,过0.22 μm有机滤膜,用高效液相色谱仪测定嘧菌酯含量。另选取未经过药液处理的玉米叶片,用上述操作步骤进行前处理和色谱分析,以确定所用叶片未被嘧菌酯污染。
4) 添加回收率测定:将1.0 μL质量浓度为0.05、1.0和10.0 g/L的嘧菌酯标准溶液分别滴加在玉米叶片表面,自然干燥1 h,按上述操作对样品进行前处理和色谱分析。每浓度重复4次。测定嘧菌酯的添加回收率和相对标准偏差 (RSD)。
1.3.5 喷雾助剂对玉米品种的安全性测定利用温室盆栽法测定4种喷雾助剂对3个常见玉米品种 (浚单20、郑单958和登海605) 的安全性。助剂质量分数设定为0.5%、1.0%和2.0%,分别与200 g/L氯虫苯甲酰胺悬浮剂3 000倍液经桶混后对玉米进行均匀喷雾处理,喷药时期分别为玉米4~5叶期和8~9叶期,设置清水空白对照和200 g/L氯虫苯甲酰胺3 000倍液的药剂对照。
试验在日光温室内进行。将饱满、大小一致的玉米种子播种在塑料盆 (250 mm × 300 mm) 内,播种深度为2.5 cm,每盆8粒,土壤为壤土。施药前1 d间苗,选择保留生长一致的植株,每盆3株。每处理4盆玉米。使用手动喷雾器对3个不同品种玉米进行均匀喷雾处理,喷雾压力为300 kPa。按照清水对照、药剂对照及喷雾助剂低浓度到高浓度与200 g/L氯虫苯甲酰胺悬浮剂3 000倍液桶混药液处理的顺序喷雾,喷雾量以达到流失点为标准。施药前测量玉米株高,药后14 d同时测定玉米株高和地上鲜重,并观察所有处理玉米植株的叶片颜色、形态等与对照相比有无差异,以评价不同喷雾助剂对玉米生长的安全性。
2 结果与分析 2.1 喷雾助剂对嘧菌酯药液在玉米叶片表面的接触角以及干燥时间的影响结果 (表3) 表明:在嘧菌酯药液中添加喷雾助剂会降低药液在玉米叶片表面的接触角,但较药剂对照差异不显著,较清水对照差异显著;随喷雾助剂质量分数的增加,药液干燥时间缩短,其中添加1.0% AY904-1处理的干燥时间最短,为46.3 min,较药剂对照缩短了6.6 min,但当喷雾助剂的添加量控制在0.5%以内时,添加的助剂不会明显缩短药剂的干燥时间。因此,加入喷雾助剂对降低叶片上药液接触角和液滴干燥时间的作用是有限的。
|
|
表 3 4种喷雾助剂对嘧菌酯药液在玉米叶片表面的接触角以及药液干燥时间的影响 Table 3 Effect of four spray adjuvants on the contact angle of azoxystrobin solution on maize leaf surface and solution drying time |
2.2 助剂干燥成膜后的溶胀度和溶解性
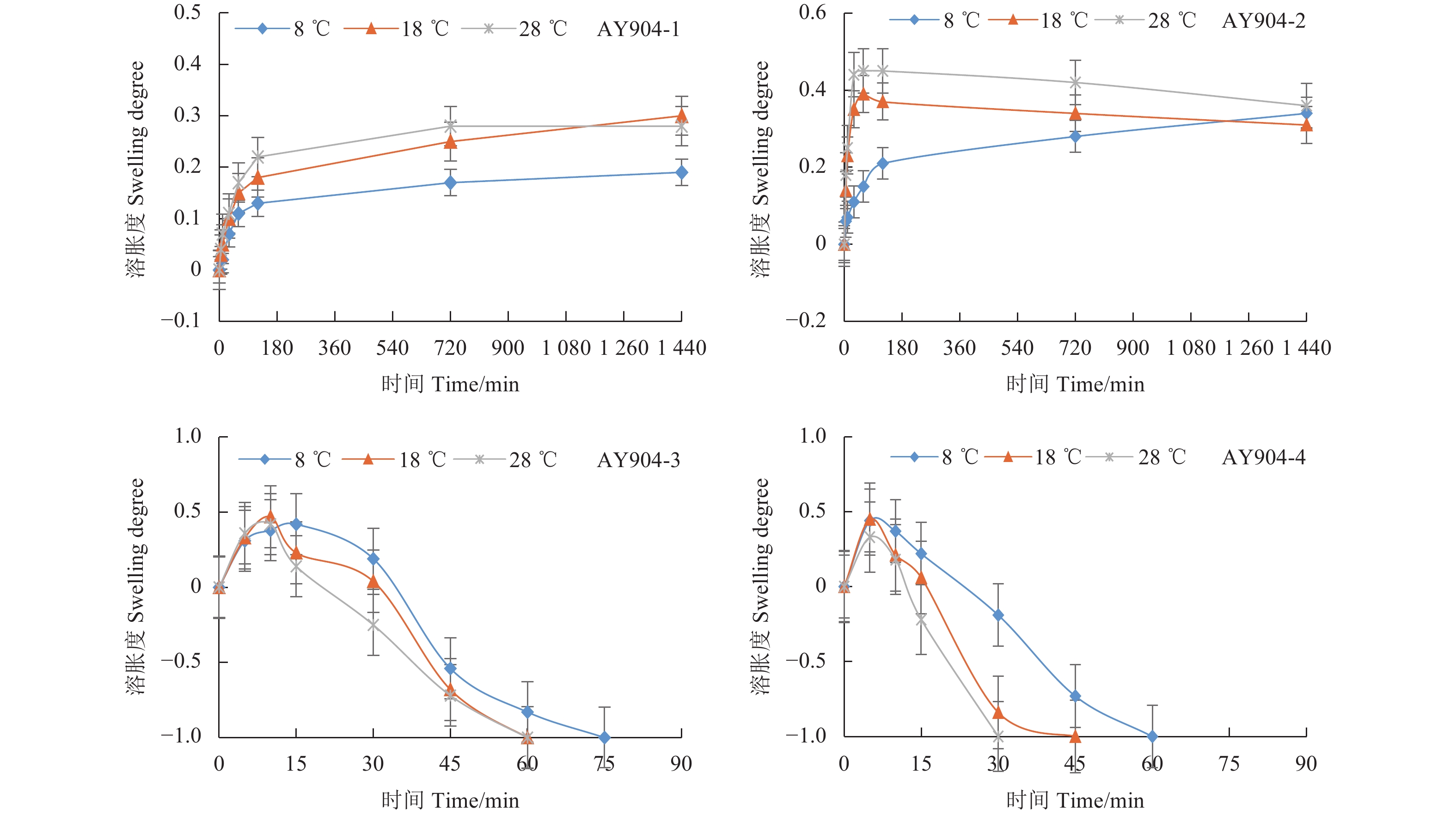
图2、图3分别表示喷雾助剂AY904-1、AY904-2、AY904-3和AY904-4分别在8、18、28 ℃模拟环境温度下的溶胀及溶解情况。溶胀度正值表示溶胀,负值表示有质量损失或溶解。结果表明:AY904-1和AY904-2所形成的膜在水中性质比较稳定,24 h后保持轻微溶胀,没有明显溶解,其中助剂AY904-1最稳定。AY904-3和AY904-4所形成的膜在1 h内先有一定程度的溶胀,随后慢慢溶解,其中AY904-4的膜在30 min内溶解。4种助剂的溶胀性均随温度的升高而增大,较高的温度会加快膜的溶胀和溶解。

|
图 2 4种喷雾助剂干燥成膜和吸水后不同状态对比 (18 ℃) Fig. 2 Comparison of four spray adjuvants in dry film formation and water absorption state |
|
图 3 不同温度下4种喷雾助剂薄膜在水中的溶胀度和溶解性 Fig. 3 Swelling and solubility of four spray adjuvants films in water at different temperatures |
2.3 喷雾助剂对玉米叶片上嘧菌酯持留量的影响 2.3.1 荧光显微镜法测定结果
室内冲刷试验测定结果 (图4、表4) 表明:未添加喷雾助剂的对照组处理,在经过6次去离子水冲刷后,玉米叶片上嘧菌酯的荧光覆盖率降低至8.7%;而添加不同浓度4种喷雾助剂的处理,与对照相比,均显著提高了嘧菌酯在玉米叶片表面的持留量。在相同的助剂浓度下,AY904-1对提高玉米叶片上嘧菌酯持留量的效果最好,其次为AY904-2、AY904-3和AY904-4。例如在助剂质量分数为0.1%时,经过6次室内冲刷,AY904-1、AY904-2、AY904-3和AY904-4对应玉米叶片上荧光覆盖率分别为88.6%、84.9%、51.6%和35.5%。在室内设定条件下,助剂AY904-1和AY904-2质量分数为0.1%~1.0%的处理以及助剂AY904-3和AY904-4质量分数为0.5%~1.0%的处理在6次点滴冲刷后,荧光覆盖率仍达到80%以上,表现出很好的耐冲刷性能。

|
图 4 室内冲刷条件下4种喷雾助剂对嘧菌酯荧光覆盖率的影响 Fig. 4 Effects of four spray adjuvants on azoxystrobin fluorescence coverage |
|
|
表 4 4种喷雾助剂对嘧菌酯在玉米叶片上荧光覆盖率的影响 Table 4 Effects of four spray adjuvants on the fluorescence coverage of azoxystrobin on maize leaves |
2.3.2 高效液相色谱法测定结果
在本研究所设定的色谱条件下,嘧菌酯的保留时间为5.96 min,线性回归方程为y = 90.589x – 0.150 1,相关系数r = 0.999 6,表明嘧菌酯在质量浓度为0.05~10.0 μg/mL范围内其色谱峰面积与其质量浓度间呈良好的线性关系;检出限为0.014 mg/L,定量限为0.05 mg/L;在添加水平为0.05、1.0和10.0 g/L下,嘧菌酯的平均添加回收率在88.57%~102.89%之间,相对标准偏差 (n = 4) 为5.63%。
2.4 高效液相色谱法与荧光显微镜法测定嘧菌酯持留量结果的相关性分析用荧光显微镜法测得表2中各处理嘧菌酯的荧光覆盖率在19.3%~96.3%之间,用高效液相色谱法测得表2中各处理嘧菌酯的残留量在26.7%~89.2%之间。两组数据经过相关性分析得到的相关性曲线见图5。由图5可知,两种测定方法在室内条件下评价喷雾助剂对嘧菌酯在玉米叶片上的持留量有很好的相关性,线性回归方程y = 0.777 9x + 11.966,r = 0.996 1。该试验结果验证了通过荧光显微镜测定嘧菌酯的荧光覆盖率来评价喷雾助剂性能的可靠性。但在研究中发现,对于嘧菌酯的荧光覆盖率较小的处理通过高效液相色谱法测得的嘧菌酯残留量却偏高。这可能是因为被冲刷掉荧光的区域仍有少量嘧菌酯,但由于荧光太弱而不易通过荧光显微镜法检测并用ImageJ软件分析,但可通过残留分析的方法进行定量测定。

|
图 5 嘧菌酯荧光覆盖率和残留量的相关性 Fig. 5 Correlation of azoxystrobin fluorescent coverage and residue |
2.5 喷雾助剂对不同品种玉米的室内安全性
由表5、表6数据可以看出:将4种喷雾助剂按质量分数为0.5%、1.0%和2.0%的添加量与常规用量的200 g/L氯虫苯甲酰胺悬浮剂3 000倍液桶混后,分别在供试的3个品种玉米植株4~5叶期和8~9叶期施药,各处理的生长速率和地上鲜重较空白对照均无显著差异,4种喷雾助剂对供试玉米的植株形态、叶片颜色等性状也无不良影响,均表现出对玉米很高的安全性。
|
|
表 5 4种喷雾助剂与200 g/L氯虫苯甲酰胺悬浮剂3 000倍液桶混喷雾对不同玉米品种的室内安全性测定结果 (4~5叶期) Table 5 Interior safety test results of four spray adjuvants mixed with 200 g/L chlorantranilone SC 3 000 times on different maize varieties (GS14-GS15) |
|
|
表 6 4种喷雾助剂与200 g/L氯虫苯甲酰胺悬浮剂3 000倍液桶混喷雾对不同玉米品种的室内安全性测定结果 (8~9叶期) Table 6 Interior safety test results of four spray adjuvants mixed with 200 g/L chlorantranilone SC 3 000 times on different maize varieties (GS18-GS19) |
3 结论与讨论
在农药制剂中添加合适的喷雾助剂可以改善农药的喷雾性能,进而提高其防治效果[8, 23-24]。本研究中,在嘧菌酯药液中添加自行研制的AY904-1、AY904-2、AY904-3和AY904-4 4种喷雾助剂后进行喷雾处理,再经室内模拟雨水冲刷试验后发现,玉米叶片上嘧菌酯的持留量随各喷雾助剂的添加量增大而增加。其中,在同一添加浓度下,AY904-1的效果最好,其次为AY904-2、AY904-3和AY904-4。对于玉米叶片上嘧菌酯持留量的测定,采用高效液相色谱法测定的结果与荧光显微镜法测定嘧菌酯的荧光覆盖率结果有很好的相关性,表明使用荧光显微镜法评价嘧菌酯在玉米叶片上持留量的方法是可靠的。通过对喷雾助剂物理性质的测定发现,4种喷雾助剂均不会显著影响嘧菌酯药液在玉米叶片上的接触角及干燥时间。初步确定喷雾助剂AY904-1和AY904-2在水中性质比较稳定,长时间浸泡也不易破裂和分解,而AY904-3和AY904-4的效果较差。对玉米安全性室内生物测定证明了4种喷雾助剂对玉米均表现出较高的安全性,不会影响作物的正常生长。综上所述,在嘧菌酯中添加0.1%~0.5%的喷雾助剂AY904-1和AY904-2和添加0.5%~1.0%的AY904-3和AY904-4可显著提高嘧菌酯在玉米叶片上的持留量,效果较好。
鉴于嘧菌酯在环境中的光解和水解速率均较缓慢[25],故本研究未考虑因环境条件所造成的嘧菌酯损失。试验所用玉米叶片为离体叶片,且在空白对照试验测定嘧菌酯在玉米叶片上残留量时,直接用10 mL乙腈通过前处理清洗叶片所得到嘧菌酯残留量与滴定药液1 h后再用10 mL乙腈通过前处理清洗叶片所得嘧菌酯残留量无显著性差异,该叶片对嘧菌酯的内吸传导作用很弱,而且本研究的相关测定是在药液喷施后的在较短时间内完成,所以嘧菌酯的内吸部分可忽略不计。因此本研究中未考虑玉米叶片对嘧菌酯的内吸性所造成的试验偏差。后续将会开展有关喷雾助剂对嘧菌酯在玉米叶片上内吸性的影响研究。聚合物的成膜性在水中的溶胀度和溶解性是衡量其耐水性的标准之一[9],本研究发现:不同温度下4种喷雾助剂在水中的溶胀度和溶解性不同,其原因可能是因为温度升高,增加了体系的不稳定性,使薄膜内部分子更加活跃,进而溶胀度增加;添加4种喷雾助剂对嘧菌酯药液的表面张力、pH值等无显著影响。喷雾助剂的主要作用是其提高了农药有效成分在植物叶片表面的黏附力,增强抵抗雨水机械冲刷的效果。
室内模拟试验虽不能准确反映喷雾助剂在田间实际应用的效果,但可通过该方法初步确定其作为耐雨水冲刷喷雾助剂的潜能。本实验室对于田间模拟降雨条件和自然降雨条件下,4种喷雾助剂对提高农药有效成分在叶片上持留量影响的研究,以及在模拟降雨条件下添加不同浓度4种喷雾助剂对嘧菌酯防治玉米大斑病的室内生测试验也已开展,将另文发表。
| [1] |
" 十三五”国家药品安全规划[N]. 中国医药报, 2017-02-22(003). The 13th five-year plan for national drug safety[N]. China Pharmaceutical News, 2017-02-22(003). |
| [2] |
张春华, 张宗俭, 刘宁, 等. 农药喷雾助剂的作用及植物油类喷雾助剂的研究进展[J]. 农药科学与管理, 2012, 33(11): 16-18. ZHANG C H, ZHANG Z J, LIU N, et al. Effect of pesticide spray adjuvants and research progress of vegetable oil spray adjuvants[J]. Pestic Sci Admin, 2012, 33(11): 16-18. DOI:10.3969/j.issn.1002-5480.2012.11.007 |
| [3] |
朱金文, 李洁, 吴志毅, 等. 有机硅喷雾助剂对草甘膦在空心莲子草上的沉积和生物活性的影响[J]. 农药学学报, 2011, 13(2): 192-196. ZHU J W, LI J, WU Z Y, et al. Influence of organosilicone adjuvant on deposition and phytotoxicity of glyphosate against Alternanthera philoxeroides [J]. Chin J Pestic Sci, 2011, 13(2): 192-196. |
| [4] |
廖洪流. 有机硅助剂在农业中的应用进展[J]. 精细与专用化学品, 2008, 16(14): 26-27. LIAO H L. Application progress on silicone assistant in agriculture[J]. Fine Spec Chem, 2008, 16(14): 26-27. DOI:10.3969/j.issn.1008-1100.2008.14.015 |
| [5] |
MELO AA, USANO-ALEMANY J, GUEDES J V C, et al. Impact of tank-mix adjuvants on deposit formation, cuticular penetration and rain-induced removal of chlorantraniliprole[J]. Crop Prot, 2015, 78: 253-262. DOI:10.1016/j.cropro.2015.09.021 |
| [6] |
李亦松, 王俊刚, 王少山, 等. 甲酯化油助剂对氯虫苯甲酰胺在甘蓝叶片上沉积的影响[J]. 植物保护, 2015, 41(5): 105-109. LI Y S, WANG J G, WANG S S, et al. Impacts of methylated oil adjuvants on chlorantraniliprole spray droplet deposition rate on cabbage leaves[J]. Plant Prot, 2015, 41(5): 105-109. |
| [7] |
卢向阳, 徐筠. 两种喷雾助剂对氟磺胺草醚在反枝苋上的吸收和药效的影响[J]. 农药学学报, 2006, 8(2): 162-166. LU X Y, XU J. Influence of two spray adjuvants on uptake and efficacy of fomesafen on red- root, Amaranthus retroflexus [J]. Chin J Pestic Sci, 2006, 8(2): 162-166. |
| [8] |
SYMONDS B L, LINDSAY C I, THOMSONN R, et al. Chitosan as a rainfastness adjuvant for agrochemicals[J]. RSC Adv, 2016, 6(104): 102206-102213. DOI:10.1039/C6RA23485B |
| [9] |
SYMONDS B L, THOMSON N R, LINDSAY C I, et al. Rainfastness of poly(vinyl alcohol) deposits on Vicia faba leaf surfaces: from laboratory-scale washing to simulated rain
[J]. ACS Appl Mater Interfaces, 2016, 8(22): 14220-14230. DOI:10.1021/acsami.6b01682 |
| [10] |
安国栋, 耿鹏, 胡美英, 等. 植物油助剂在农药领域中的研究进展[J]. 农药, 2012, 51(8): 558-561. AN G D, GENG P, HU M Y, et al. Research advance in plant oil as pesticide adjuvant[J]. Pesticide, 2012, 51(8): 558-561. |
| [11] |
GASKINR E, MANKTELOW D W L, NORTHCOTTG L. Effects of adjuvants on distribution and rainfastness of captan sprays on apple leaf scars to control European canker[J]. New Zealand Plant Protec, 2014, 67: 139-144. |
| [12] |
WEAVERM A, JIN X, HOAGLANDR E, et al. Improved bioherbicidal efficacy by Myrothecium verrucaria via spray adjuvants or herbicide mixtures
[J]. Biol Control, 2009, 50(2): 150-156. DOI:10.1016/j.biocontrol.2009.03.007 |
| [13] |
MULROONEYJ E, ELMOREC D. Rainfastening of bifenthrin to cotton leaves with selected adjuvants[J]. J Environ Qual, 2000, 29(6): 1863-1866. |
| [14] |
吴加伦, 王怀昌, 武秀停, 等. 嘧菌酯在人参和西洋参中的残留监测及其膳食风险评估[J]. 农药学学报, 2012, 14(1): 67-73. WU J L, WANG H C, WU X T, et al. Determination of azoxystrobin residue in Panax ginseng and Panax quinquefolium and dietary intake risk assessment [J]. Chin J Pestic Sci, 2012, 14(1): 67-73. |
| [15] |
吴映璇, 林峰, 林海丹, 等. 豆类中腈嘧菌酯残留的高效液相色谱-串联质谱法测定[J]. 分析测试学报, 2009, 28(5): 617-620. WU Y X, LIN F, LIN H D, et al. Determination of azoxystrobin residues in legume using high performance liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J]. J Instrum Anal, 2009, 28(5): 617-620. |
| [16] |
SUNDRAVADANAS, et al. Determination of azoxystrobin residue by UV detection high performance liquid chromatography in mango[J]. J Braz Chem Soc, 2008, 19(1): 60-63. DOI:10.1590/S0103-50532008000100010 |
| [17] |
刘同金, 庄乾营, 赵维, 等. 氯虫苯甲酰胺防治玉米田小地老虎和玉米螟试验[J]. 山东农业科学, 2010(9): 81-82. LIU T J, ZHUANG Q Y, ZHAO W, et al. Chlorantraniliprole for controlling Agrotis ipsilon and Ostrinia nubilalis in maize field [J]. Shandong Agric Sci, 2010(9): 81-82. |
| [18] |
徐广春, 顾中言, 徐德进, 等. 常用农药在水稻叶片上的润湿能力分析[J]. 中国农业科学, 2012, 45(9): 1731-1740. XU G C, GU Z Y, XUD J, et al. Wettability analysis of pesticides on rice leaf[J]. Scientia Agricultura Sinica, 2012, 45(9): 1731-1740. |
| [19] |
鲁梅, 王金信, 王云鹏, 等. 除草剂助剂对药液物理性状及对磺草酮药效的影响[J]. 农药学学报, 2004, 6(4): 78-82. LU M, WANG J X, WANG Y P, et al. The effect of herbicide adjuvants on the physical characteristics and the bioactivity of sulcotrione[J]. Chin J Pestic Sci, 2004, 6(4): 78-82. |
| [20] |
KISHOREK. Phenological growth stages of Indian gooseberry (Phyllanthus emblica L.) according to the extended BBCH scale
[J]. Sci Hortic, 2017, 225: 607-614. DOI:10.1016/j.scienta.2017.08.004 |
| [21] |
DOMÍNGUEZC. IJ-OpenCV: combining ImageJ and OpenCV for processing images in biomedicine[J]. Comput Biol Med, 2017, 84: 189-194. DOI:10.1016/j.compbiomed.2017.03.027 |
| [22] |
张鑫, 王海红, 王晨, 等. ImageJ软件测量白癜风白斑面积及与Photoshop的比较[J]. 实用皮肤病学杂志, 2017, 10(1): 4-8. ZHANG X, WANG H H, WANG C, et al. The performance of ImageJ in measuring the area of vitiligo macule[J]. J Pract Dermatol, 2017, 10(1): 4-8. |
| [23] |
张靖, 吕和平, 曹立冬, 等. 六种喷雾助剂提高硝磺草酮防除稗草及反枝苋效果的作用机理初探[J]. 农药学学报, 2015, 17(3): 348-356. ZHANG J, LV H P, CAO L D, et al. Synergism of six spray adjuvants on mesotrione in controlling Echinochloa crus-galli and Amaranthus retroflexus [J]. Chin J Pestic Sci, 2015, 17(3): 348-356. |
| [24] |
HOLLOWAY P J, ELLIS M C B, WEBB D A, et al. Effects of some agricultural tank-mix adjuvants on the deposition efficiency of aqueous sprays on foliage[J]. Crop Prot, 2000, 19(1): 27-37. DOI:10.1016/S0261-2194(99)00079-4 |
| [25] |
刘晓旭, 侯志广, 吴敬慧. 嘧菌酯水解动力学研究[J]. 农业环境科学学报, 2012, 31(8): 1603-1607. LIU X X, HOU Z G, WU J H, et al. Hydrolyze kinetics and mechanism of azoxystrobin[J]. J Agro-Environ Sci, 2012, 31(8): 1603-1607. |
 2018, Vol. 20
2018, Vol. 20


