2. 广西大学 植物科学国家级实验教学示范中心,南宁 530005
2. National Demonstration Center for Experimental Plant Science Education, Guangxi University, Nanning 530005, China
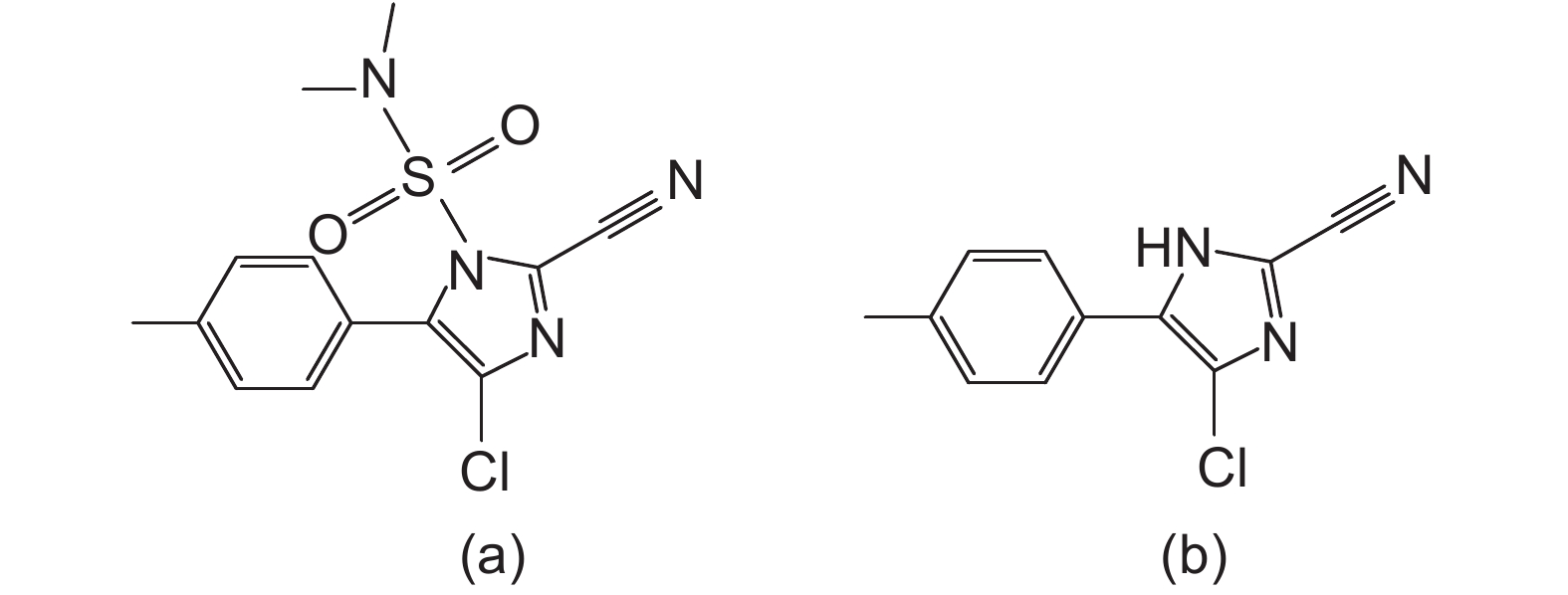
氰霜唑 (cyazofamid,图式 1a) 是日本石原株式会社研制、BASF共同开发、对卵菌门细菌具有高度活性的新型苯基咪唑类杀菌剂[1],已在中国黄瓜、葡萄、荔枝、番茄、西瓜、马铃薯、辣椒和荔枝等多种作物上获得登记[2],广泛用于防治霜霉病、霜疫霉病、晚疫病和疫病等病害[3]。氰霜唑在蔬菜类作物上使用后会迅速分解,其主要代谢物为4-氯-5-(4-甲苯基)-1H-咪唑-2-腈 (CCIM)[4] (图式 1b)。研究表明,CCIM较母体氰霜唑更易被吸收,其毒性 (大鼠经口急性LD50 > 324 mg/kg) [5]较氰霜唑 (大鼠经口急性LD50 > 5 000 mg/kg) [6-7]更高,其在农产品中的残留可能会带来更高的膳食摄入风险。在2015年农药残留联席会议 (JMPR) 制定的农药最大残留限量 (MRL) 标准中,氰霜唑在葫芦科作物上的MRL值为0.09 mg/kg[5]。中国国家标准规定[2],氰霜唑在黄瓜中的临时MRL值为0.5 mg/kg,且氰霜唑的残留定义为“氰霜唑及其代谢物CCIM之和”。
|
图式1 氰霜唑 (a) 和CCIM (b) 的结构式 Scheme1 Structural formula of cyazofamid (a) and its metabolite CCIM (b) |
关于氰霜唑及CCIM残留的分析方法,Lee等[8-10]在苹果、大豆、马铃薯等 6 种作物和Xu等[11]在番茄上运用QuEChERS前处理方法结合LC–MS/MS检测了氰霜唑及CCIM的残留;黄雅丽等[12]研究了氰霜唑在黄瓜上的残留和消解动态,但并未对其代谢物CCIM进行检测。本研究采用优化的QuEChERS前处理方法,以V (乙酸) : V (乙腈) = 1 : 99混合溶液为提取溶剂,应用超高效液相色谱-串联质谱 (UPLC-MS/MS) 建立氰霜唑及CCIM在黄瓜及土壤中残留的分析方法,并对黄瓜和土壤中氰霜唑的消解规律及CCIM的代谢规律进行了研究,以期了解氰霜唑及CCIM在农业生产中的归趋转化,为农产品中氰霜唑残留的监测,以及其在黄瓜上的膳食风险和环境风险的评价提供科学依据。
1 材料与方法 1.1 主要仪器1290-G6460C高效液相色谱-串联电喷雾三重四极杆质谱仪 (Agilent, USA);G6460C质谱系统 (Agilent, USA);THZ-82B气浴恒温振荡仪 (金坛医疗仪器);Vortex-Genie2多管涡旋振荡仪 (上海旦鼎国际贸易有限公司);JA3003分析天平 (上海精密科学仪器有限公司);Milli-Q超纯水仪 (美国Millipore公司);TDZ5-WS低速离心机。
1.2 供试药剂和试剂98.9%氰霜唑 (cyazofamid) 和96.05% CCIM标准品 (德国Dr. Ehrenstorfer公司);乙腈和乙酸 (色谱纯,德国默克公司);甲酸和乙腈 (分析纯,成都科龙化学试剂公司)。
1.3 仪器检测条件色谱条件:XBridge-C18色谱柱 (150 mm × 2.1 mm,3.5 μm);柱温30 ℃;流速0.3 mL/min;进样量3 μL;流动相0.1%甲酸水-乙腈 (V/V) 溶液,详细洗脱梯度见表1。
|
|
表 1 流动相梯度洗脱参数 Table 1 The gradient elution procedure of mobile phase |
质谱条件:电喷雾离子源,正离子扫描方式 (ESI+);毛细管电压4.0 kV;脱溶剂气温度330 ℃;脱溶剂气流速13 L/min;雾化气压力103.425 kPa;多反应监测模式 (MRM),以保留时间和离子对信息比较进行定性分析,以母离子和响应值最高的子离子进行定量分析,氰霜唑及代谢物 (CCIM) 的保留时间、监测离子、裂解电压及碰撞能量见表2。
|
|
表 2 串联质谱多反应监测模式下氰霜唑及CCIM的分析参数 Table 2 UPLC-MS/MS parameters for the determination of cyazofamid and CCIM in the MRM mode |
1.4 标准溶液配制及标准曲线的绘制
分别准确称取0.002 5 g (精确至0.000 1 g) 氰霜唑和CCIM标准品于25 mL容量瓶中,分别用乙腈和基质 (土壤、黄瓜) 空白对照液,稀释配得100 mg/L系列混合标准储备液和基质匹配标准储备液,再分别稀释得到0.005、0.05、0.1、0.5和1 mg/L的系列标准溶液,按1.3节的条件测定,以氰霜唑和CCIM的标准溶液和基质匹配标准溶液质量浓度与监测离子峰面积作标准曲线。
1.5 样品前处理方法称取黄瓜及土壤样品10 g于100 mL离心管中,加入10 mLV (乙酸) : V (乙腈) = 1 : 99混合溶液,涡旋5 min;加入4 g无水硫酸镁和1 g氯化钠,涡旋2 min后,于4 500 r/min下离心5 min;取上清液经0.22 μm微膜过滤,待测。
1.6 消解动态试验方法按文献[13]的要求,于2016—2017年在广西、湖南和安徽3地开展消解动态试验。黄瓜试验小区和土培试验小区面积各为30 m2,重复3次,施药剂量为有效成分540 g/hm2 (制剂用量900 g/hm2),于发病初期喷雾施药1次。分别于施药后2 h及1、2、3、5、7、14、21、28 d采集黄瓜和土壤样品。另设不施药对照区。样品采集和制备按照《农药登记残留田间试验标准操作规程》[14]要求进行,样品于 –20 ℃贮存,待测。
2 结果与讨论 2.1 方法的线性范围及检测限在0.005~1 mg/L范围内,氰霜唑和CCIM的峰面积与其质量浓度间呈良好的线性关系,氰霜唑标准曲线方程为y = 69 092x – 10.3 (R2 > 999),CCIM标准曲线方程为 y = 32 583x + 36.90 (R2 > 0.999);氰霜唑在黄瓜中的线性方程为 y = 63 378x – 8.818 8 (R2 > 0.999),在土壤中的线性方程为 y = 65 248x – 65.38 (R2 = 0.999 9);CCIM在黄瓜中的线性方程为y = 14 322x – 19.419 (R2 > 0.999),在土壤中的线性方程为 y = 16 563x – 18.26 (R2 > 0.999)。氰霜唑和CCIM在黄瓜和土壤中的定量限 (LOQ) 均为0.01 mg/kg,其标准溶液MRM色谱图见 图1。

|
图 1 0.5 mg/kg氰霜唑和CCIM标准溶液MRM色谱图 Fig. 1 MRM chromatogram of 0.5 mg/kg cyazofamid and CCIM |
2.2 方法的精密度、重复性和准确度
称取黄瓜和土壤空白样品,添加氰霜唑及CCIM标准品。结果表明:在0.01、0.1和0.5 mg/kg添加水平下,每个水平重复5次,氰霜唑及CCIM在黄瓜及土壤中的回收率均在84%~103%之间,相对偏标准偏差 (RSD) 在2.0%~3.9%之间,符合农药残留试验要求[13] (表3)。
|
|
表 3 氰霜唑和CCIM在黄瓜和土壤中的平均添加回收率及相对标准偏差 Table 3 Recoveries and RSDs of the cyazofamid and CCIM residue in soil and cucumber samples |
2.3 基质效应
由表4可知:在0.01~0.5 mg/kg添加水平下,用乙腈标准溶液进行校正时,氰霜唑在黄瓜和土壤中的回收率均有所降低 (75%~84%),存在基质减弱效应 (–16.2% ~ –4.5%);CCIM在黄瓜和土壤中的回收率为35%~45%,基质减弱效应明显 (–62.4% ~ –49.3%)。故本研究采用土壤和黄瓜的基质匹配标准溶液进行校正。
|
|
表 4 氰霜唑和CCIM在黄瓜和土壤中的基质效应及回收率 Table 4 Matrix effect and recoveries of cyazofamid and CCIM in cucumber and soil samples |
2.4 提取溶剂的选择
本研究分别考察了以V (乙酸) : V (乙腈) = 1 : 99混合溶液、乙腈、V (乙酸) : V (甲醇) = 1 : 99混合溶液以及甲醇为提取溶剂对氰霜唑和CCIM在黄瓜和土壤中回收率的影响。结果表明:以V (乙酸) : V (乙腈) = 1 : 99混合溶液为提取剂时,氰霜唑和CCIM的回收率较高 (84%~103%),且杂质较少;而以乙腈为提取剂时虽然对氰霜唑的提取效率较高 (72%~86%),但对CCIM的提取效率相对较低 (54%~74%);而以V (乙酸) : V (甲醇) = 1 : 99混合溶液和甲醇作为提取剂时,对氰霜唑和CCIM的回收率均较低 (< 52%),且用甲醇提取时黄瓜样品中的色素含量较高,故最终选用V (乙酸) : V (乙腈) = 1 : 99混合溶液作为提取溶剂。Xu等[12]采用乙腈作为提取剂,经2次提取后加甲酸调pH值及使用净化剂C18、PSA和MgSO4净化,氰霜唑和CCIM在番茄中的回收率在76%~108%之间。本研究在乙腈中加入乙酸后,经一次提取,回收率即可达到84%~103%,提取步骤比Xu等的简单且省时。
2.5 流动相的选择分别考察了以甲醇-水、乙腈-水、乙腈-0.1%甲酸水溶液和甲醇-0.1%甲酸水溶液作为流动相体系时对氰霜唑及CCIM的分离效果。结果表明:以乙腈-0.1%甲酸水溶液作为流动相时、流速为0.3 mL/min时,氰霜唑与CCIM的分离效果和峰型均较好,且基线平稳,保留时间适中;以甲醇-水和乙腈-水作为流动相时,氰霜唑与CCIM峰型虽均好,但两者的分离效果差;而以甲醇-0.1%甲酸水溶液作为流动相时,两者的分离效果好,但CCIM的峰型较差。综合考虑,最终选择以乙腈-0.1%甲酸水溶液作为氰霜唑及CCIM的流动相。
2.6 质谱条件的优化在朱光艳等[15]的研究基础上,本研究主要对质谱的电离模式、裂解电压和碰撞能量进行了优化。选用1 mg/L的氰霜唑和CCIM标准溶液,采用直接进样方式检测,扫描范围m/z为100~400,以确定电离模式。结果表明:在正离子模式下 (ESI+),氰霜唑和CCIM电离效果最佳,并分别获得m/z 325和m/z 218的[M+H]+准分子离子峰;调节氰霜唑的裂解电压为100 V时,氰霜唑的[M+H]+峰具有最大丰度;调节CCIM的裂解电压为130 V时,CCIM的[M+H]+峰具有最大丰度。
对氰霜唑的[M+H]+进行二级质谱扫描得到碎片离子,选择离子对m/z 325/217和m/z 325/108分别为定性和定量离子对;调节碰撞能量的范围为10~30 V。结果表明:当碰撞能量为20 V时,离子m/z 217的相对丰度最大;当碰撞能量为15 V时,离子m/z 108的相对丰度最大。离子m/z 108的响应值比离子m/z 217大,因此选择m/z 108作为定量离子。对CCIM的[M+H]+进行二级质谱扫描时,定性离子对为m/z 218/183,定量离子对为m/z 218/139;调节碰撞能量的范围为18~30 V。结果表明:当碰撞能量为20 V时,离子m/z 183的相对丰度最大;当碰撞能量为25 V时,离子m/z 139的相对丰度最大。离子m/z 139比离子m/z 183的响应值大,因此选择m/z 139作为定量离子。
2.7 氰霜唑和CCIM的降解规律结果 (表5) 表明:氰霜唑在黄瓜和土壤中的消解动态均符合一级动力学特征,在广西、湖南和安徽3地试验点土壤中的半衰期为6.6~9.6 d,黄瓜中的为1.7~4.0 d,属于易降解农药 (t1/2 < 30 d) [16]。
|
|
表 5 氰霜唑在土壤和黄瓜中的消解动力学参数 Table 5 Dissipation kinetic parameters of cyazofamid in cucumber and soil |
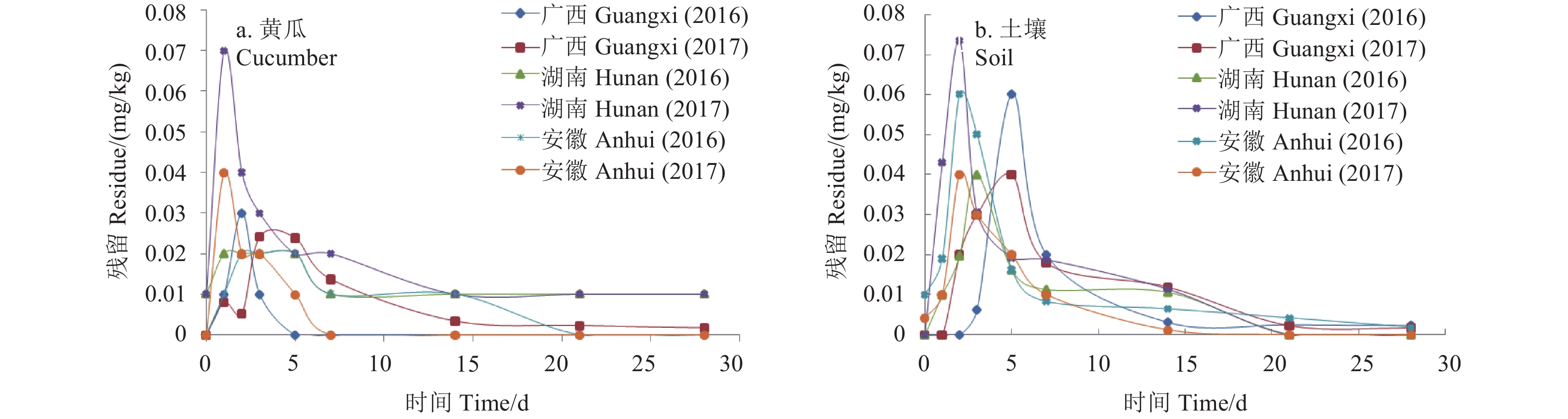
根据GB2763—2016规定[2],氰霜唑的残留定义为“氰霜唑及其代谢物CCIM之和”,故对氰霜唑的食品安全性和环境安全性开展评价时,必须将氰霜唑与CCIM综合考虑。2015年JMPR研究报告[5]中指出,在25 ℃条件下,氰霜唑的水解半衰期为10.6 d~13.3 d,而光解半衰期为30 min,表明氰霜唑的降解主要以光解为主。从氰霜唑消解动态曲线 (图2) 可以得出:在广西、湖南、安徽 (2016—2017年) 2年3地的试验中,氰霜唑在偏碱性和平均日照时间较长的安徽试验地中降解较快,施药5 d后的降解率达到了50%~89%;而在广西偏酸性和平均日照时间较短试验地中氰霜唑较为稳定,其降解速率小于湖南、安徽2地。该结果与2015年JMPR研究报告及韩耀宗[17]的研究结果相一致。氰霜唑在黄瓜中的最大原始沉积量为0.23 mg/kg,随着时间延长,其在黄瓜中的残留量逐渐降低,笔者认为与该药降解快及黄瓜的生长稀释作用有关。氰霜唑和CCIM在黄瓜和土壤的整个消解过程中,以母体残留为主,CCIM作为主要代谢产物,始终处于较低的残留水平。2015年JMPR研究报告中规定,施药后7 d,氰霜唑在黄瓜中的残留量小于0.04 mg/kg,CCIM的残留量小于0.01 mg/kg[5],本研究结果 (图3) 与其接近,施药后7 d,黄瓜和土壤中CCIM的残留量达最大值 (< 0.07 mg/kg),之后逐渐降低,14 d后低于定量限0.01 mg/kg,说明CCIM在黄瓜和土壤中的降解也较快。

|
图 2 氰霜唑在黄瓜和土壤中的消解动态曲线 Fig. 2 Dissipation curve of cyazofamid in cucumber and soil |
|
图 3 CCIM在黄瓜和土壤中的消解曲线 Fig. 3 Dissipation curves of CCIM in cucumber and soil |
3 结论
本研究采用QuEChERS样品前处理方法,结合超高效液相色谱-串联三重四极杆质谱技术,以及正离子扫描和多反应监测模式,建立了黄瓜和土壤中氰霜唑及代谢物CCIM的残留检测方法。以乙腈-0.1%甲酸水溶液作为流动相时,采用梯度洗脱,色谱分离度及灵敏度最好。以V (乙酸) : V (乙腈) = 1 : 99混合溶液作为提取溶剂,氰霜唑及CCIM在黄瓜和土壤中的回收率为 84%~103%,相对标准偏差 (RSD) 为 1.2%~3.8%,定量限 (LOQ) 均为0.01 mg/kg,符合农药残留检测要求。氰霜唑在黄瓜和土壤中的半衰期小于9.6 d,属于易降解农药;施药后2~7 d,代谢物CCIM在黄瓜和土壤中的残留量达最大值,之后随母体逐渐降解。综上所述,本方法具有检测限低、线性关系良好和回收率高等优点,适用于黄瓜和土壤中氰霜唑及CCIM残留的检测。
| [1] |
OHSHIMA T, KOMYOJI T, MITANI S, et al. Development of a novel fungicide, cyazofamid[J]. J Pest Sci, 2004, 29(2): 136-138. DOI:10.1584/jpestics.29.136 |
| [2] |
食品中农药最大残留限量: GB 2763—2016[S]. 北京: 中国标准出版社, 2016. National food safety standard: Maximum residue limits for pesticides in food: GB 2763—2016[S]. Beijing: Standards Press of China, 2016. |
| [3] |
中国农药信息网. 氰霜唑悬浮剂[EB/OL]. (2014-10-25).[2017-12-10].Http://www.chinapesticide.gov.cn/myquery/tagdetail?pdno=PD20141025. China Pesticide Information Network. Cyazofamid suspension[EB/OL]. (2014-10-25).[2017-12-10].Http://www.chinapesticide.gov.cn/myquery/tagdetail?pdno=PD20141025. |
| [4] |
Pesticides Experts Committee. Evaluation report cyazofamid[EB/OL]. (2004-09-25). Http://www.fsc.jp/english/evaluationreports/pesticide/cyazofamid_fullreport, 2004.
|
| [5] |
Food and Agriculture Organization of United Nation. Pesticide residues in food[EB/OL]. Geneva: World Health Organization, (2015-10-23). [2017-12-10]. http://www.fao.org/fileadmin/templates/ agphome/documents/Pests_Pesticides/JMPR/Evaluation2015/CYAZOFAMID__281_.pdf.
|
| [6] |
European Food Safety Authority. Peer review of th e pesticide risk assessment of the active substance cyazofamid [EB/OL]. (2016-06-15). [2017-12-10]. https://www.efsa.europa.eu/en/efsajournal/pub/4503
|
| [7] |
US Environmental Protection Agency. Pesticide fact sheet for cyazofamid[EB/OL]. (2004-09-04). http://www.epa.gov/ pesticides/chem-search/reg_actions/registration/fs_PC-085651_01.
|
| [8] |
LEE H, KIM E, LEE J H, et al. Analysis of cyazofamid and its metabolite in the environmental and crop samples using LC–MS/MS[J]. Bull Environ Contaminat Toxicol, 2014, 93(5): 586-590. DOI:10.1007/s00128-014-1369-4 |
| [9] |
LEE H, KIM E, SHIN Y, et al. Identification and formation pattern of metabolites of cyazofamid by soil fungus Cunninghamella elegans
[J]. Appl Biolog Chem, 2016, 59(1): 9-14. |
| [10] |
LEE H, KIM E, MOON J H, et al. Establishment of analytical method for cyazofamid residue in apple, mandarin, korean cabbage, green pepper, potato and soybean[J]. J Korean Soc Appl Biolog Chem, 2012, 55(2): 241-247. DOI:10.1007/s13765-012-1042-8 |
| [11] |
XU Z L, ZHANG C P, YU J Z, et al. Field investigations of dissipations and residues of cyazofamid in soil and tomato: risk assessment of human exposure to cyazofamid via tomato intake[J]. Environ Sci Pollut Res, 2017, 24(4): 3483-3492. DOI:10.1007/s11356-016-8106-y |
| [12] |
黄雅丽, 吴慧明, 毛黎娟, 等. 高效液相色谱法测定黄瓜和土壤中的氰霜唑残留[J]. 浙江农业学报, 2015, 17(1): 19-22. HUANG Y L, WU H M, MAO L J, et al. Determination of cyazofamid residues in cucumber and soil by high effective liquid phase chromatography[J]. Acta Agriculturae Zhejiangensis, 2015, 17(1): 19-22. |
| [13] |
农药残留试验准则: NY/T 788—2004[S] 北京: 中国农业出版社, 2004. Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
| [14] |
农业部农药检定所. 农药登记残留田间试验标准操作规程[M]. 北京: 中国标准出版社, 2007. Pesticide Verification Institute of the Ministry of Agriculture. Standard operating procedures on pesticide registration residue field trials[M]. Beijing: China Agriculture Press, 2007. |
| [15] |
朱光艳, 郑尊涛, 简秋, 等. 氰霜唑及其代谢物在葡萄和土壤中的残留规律[J]. 农药, 2015, 54(6): 438-441. ZHU G Y, ZHENG Z T, JIAN Q, et al. Residue dynamics of cyazofamid and its metabolite in grape and soil[J]. Agrochemicals, 2015, 54(6): 438-441. |
| [16] |
蔡道基. 化学农药对环境安全性评价[J]. 环境化学, 1991, 10(3): 41-46. CAI D J. Environmental safety assessment of chemical pesticides[J]. Environ Chem, 1991, 10(3): 41-46. |
| [17] |
韩耀宗. 氰霜唑的水解与光解研究[D]. 长沙: 湖南农业大学, 2008: 13-15. HAN Y Z. The hydrolysis and photolysis of cyazofamid[D]. Changsha: Hunan Agricultural University, 2008: 13-15. |
 2018, Vol. 20
2018, Vol. 20


