2. 广东省农业科学院 植物保护研究所/广东省植物保护新技术重点实验室,广州 510640
2. Plant Protection Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Guangzhou 510640, China
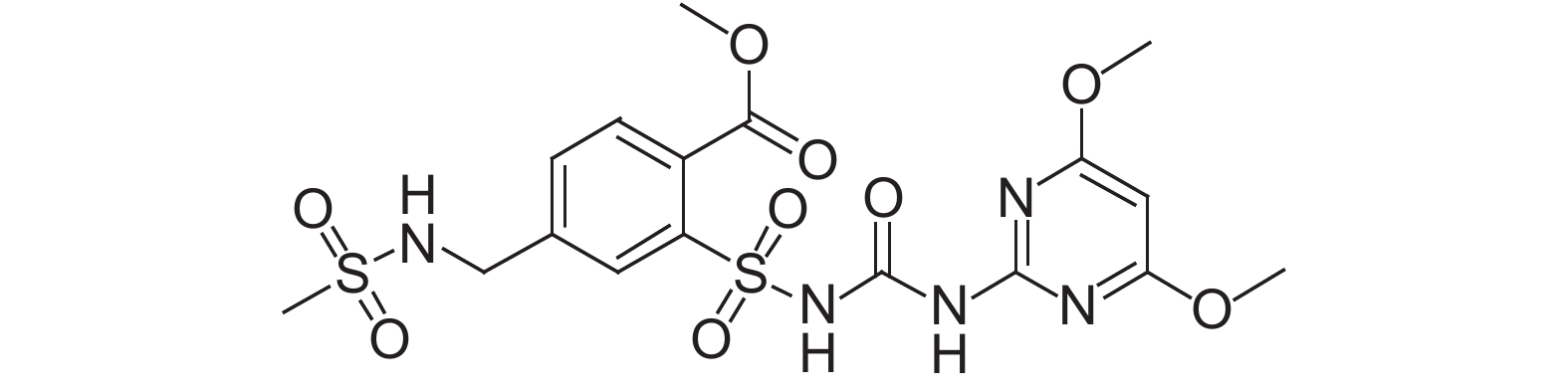
看麦娘Alopecurus aequalis是一种常见禾本科杂草,广泛分布于中国华东、中南、西南及黄河流域等部分地区,在长江中下游地区为害严重,主要为害小麦、油菜等夏收作物。磺酰脲类除草剂甲基二磺隆 (mesosulfuron-methyl,图式 1) 是目前防除小麦田杂草的主要除草剂品种之一,尤其被广泛用于防除已对精唑禾草灵产生抗性的禾本科杂草。甲基二磺隆通过抑制杂草体内乙酰乳酸合成酶 (ALS) 的活性,导致其支链氨基酸合成受阻,从而影响蛋白质的合成而造成杂草死亡[1]。
|
图式1 甲基二磺隆结构式 Scheme1 Structural formula of mesosulfuron-methyl |
研究表明,ALS抑制剂类除草剂非常容易导致杂草抗药性的产生[2]。截至目前,全球范围内已报道160种杂草对该类除草剂产生了抗性[3],在中国,看麦娘、日本看麦娘A. japonicus及菵草Beckmannia syzigachne等小麦田杂草已对甲基二磺隆产生了抗性[3-6]。靶标位点突变是最常见的ALS抑制剂类除草剂抗性机理,目前在ALS酶的122、197、205、376、377、574、653、654等8个氨基酸位点上已发现28种抗性突变形式,其中涉及197位点的突变多达13种[7]。不同的突变位点通常可导致杂草对不同类别ALS抑制剂类除草剂产生交互抗性[8];反之,连续使用某种ALS抑制剂类除草剂防治杂草,抗性种群中最终保留下来的突变位点也会呈现出一定的规律性[9]。这为针对性地设计抗性分子检测方法提供了可能。检索有关甲基二磺隆抗性的报道,发现ALS基因突变均是杂草对其产生抗性的重要机理,且均为197位点或574位点的突变,如关于日本看麦娘,Bi等报道了P197T、W574L 2种突变[5, 10],关于菵草,Li等报道了P197S突变[6],关于看麦娘则目前共报道了P197R、P197S、P197T和W574L 4种突变[11-13]。
田间杂草种群对除草剂抗性的产生是一个逐渐演化的过程,若能在抗性产生的早期准确进行检测,则有助于采取措施减缓抗性的蔓延,提高防除效果。目前常用的抗性检测方法主要有整株盆栽法[14]、培养皿法[15]、基因测序法[16]及衍生性酶切扩增多态性序列 (derived cleaved amplified polymorphic sequence,dCAPS) 分子标记法[17]等。其中,整株盆栽法和培养皿法可针对不同类型抗性机制进行检测,其检测结果与田间实际情况较为相符,但需提前采集种子,无法实现当季检测,且整株盆栽法需要可靠的喷雾设备并会占用大量的温室空间;基因测序法检测结果准确,可一次性检测多个突变位点,还可检测出未知的新突变,但该方法费用相对较高,且需对测序结果进行专业的生物信息学分析;dCAPS方法只能针对已知的突变位点进行检测,且只能专一性地检测一个突变位点,但该方法可在田间杂草幼苗期进行当季检测,其操作简单,检测结果直观,检测周期短,可实现高通量检测。笔者等前期已报道了抗甲基二磺隆看麦娘种群ALS 574位点突变的dCAPS分子标记[4],本研究针对另一常见的甲基二磺隆抗性突变位点197位点设计了dCAPS分子标记,以期在甲基二磺隆抗性愈发突出的形势下,为其快速检测提供理论依据。
1 材料与方法 1.1 供试材料针对看麦娘ALS 197位点目前共报道了P197R、P197S及P197T 3种突变形式,本研究选取课题组先前报道的分别含P197R和P197S突变的AHSX-5[12]和SDTC-4[13]种群,以及含P197T突变的JSHX-1种群(未报道)为研究材料,以已报道的野生敏感种群HNXY-1[4]作为对照。看麦娘种群采集点具体信息见表1。
|
|
表 1 看麦娘种群采集点信息 Table 1 The collection site of A. aequalis populations |
供试药剂:30 g/L的甲基二磺隆 (mesosulfuron-methyl) 可分散油悬浮剂 (OF),拜耳作物科学有限公司;2 × 十六烷基三甲基溴化铵 (CTAB) 溶液 (自配):20 g/L CTAB,100 mmol/L (pH 8.0) Tris-HCl,20 mmol/L (pH 8.0) 乙二胺四乙酸 (EDTA),1.4 mol/L氯化钠及10 g/L聚乙烯吡咯烷酮 (PVP);限制性内切酶BamH I,宝生物工程 (大连) 有限公司;50 × TAE缓冲液 (使用时稀释至1 × ) 及溴化乙锭染色液,北京索莱宝科技有限公司。
主要仪器设备:T100 Thermal cycler PCR仪,美国伯乐公司;ChampGel 6000紫外凝胶成像系统,北京赛智创业科技有限公司;JY300C型电泳仪,北京君意东方电泳设备有限公司;OSE-Y20型电动组织研磨器、TGear微型离心机及OSE-96型干式恒温金属浴,天根生化科技 (北京) 有限公司。
1.2 试验方法 1.2.1 甲基二磺隆单剂量测定采用整株法[4]。看麦娘种子催芽及幼苗培养方法同文献中。每种群处理30株,3~4叶期时施药,喷液量450 L/hm2,甲基二磺隆有效成分用量为 9 g/hm2,以HNXY-1作为种群对照,清水处理为空白对照。于药剂处理后21 d观察记录各种群看麦娘生长情况:若生长良好,与对照无明显差异,则标记为高抗性 (RR) 植株;若生长明显受到抑制但能够存活,且有新叶长出,则标记为中等抗性 (RS) 植株;若植株表现出萎蔫、脱水及干枯死亡等症状,则标记为敏感 (SS) 植株[18-19]。
1.2.2 ALS基因片段测序因所扩增的基因片段无内含子,故直接采用总DNA作为模板进行扩增。在各抗性种群中,选取经甲基二磺隆单剂量处理后存活的植株进行DNA提取及克隆测序,以验证各抗性种群中是否确含上述突变。看麦娘总DNA提取、扩增及测序过程中所需引物 (含PCR引物AL-F1、AL-R1及测序引物AL-F2、AL-F3)、PCR反应条件、PCR反应体系及测序方法均同文献[13]。
1.2.3 ALS 197位点dCAPS检测分析dCAPS方法是通过在抗性突变位点附近人为引入酶切位点,使酶切电泳图谱具有多态性,从而判断某一特定位点是否存在碱基突变,该过程包含PCR扩增、限制性酶切及电泳3个基本步骤[17]。本研究中用于dCAPS分析的看麦娘基因组DNA提取采用CTAB法[20]。
由于抗性看麦娘ALS 197位点上已报道3种突变形式,针对每种突变形式设计dCAPS分子标记较为繁琐,因此本研究针对野生型看麦娘ALS 197位点序列进行设计,利用dCAPS在线设计工具dCAPS Finder 2.0[21]及常规引物设计软件Primer Premier 5.0,设计出一对引物D197F和D197R (表2)。通过在引物D197F序列的3′ 端引入一个错配碱基,扩增所得不同种群看麦娘的ALS片段经限制性内切酶BamH I酶切后表现出多态性:野生型看麦娘ALS片段被完全酶切,从而含有36和200 bp的2个片段;纯合突变型看麦娘无法被酶切,只有236 bp的1个片段;而杂合突变型看麦娘则同时含有36、200及236 bp的3个片段。
|
|
表 2 用于看麦娘ALS 197位点dCAPS分析的引物信息 Table 2 Primers used for dCAPS in ALS 197 codon of A. aequalis |
除引物外,dCAPS检测分析中PCR扩增的反应体系及反应条件均同文献[13],但因片段较短,延伸时间设置为30 s,反应循环数为36个。酶切反应体系共20 μL,含3 μL PCR产物、1 μL限制性内切酶、2 μL 10 × Buffer及14 μL灭菌水。限制性内切酶BamH I反应温度为30 ℃,酶切时间均为30 min。待酶切反应完成后,向体系中加入2 μL 10 × Loading Buffer (随酶附赠),混匀,取10 μL至2.5%的琼脂糖凝胶,在1 × TAE电泳缓冲液中、120 V电压下电泳35 min。电泳结束后将凝胶在溴化乙锭水溶液中染色10min,通过紫外凝胶成像系统观察并拍照。每个抗性种群随机选取15株进行dCAPS检测分析,以HNXY-1种群作为野生型对照。将dCAPS检测与整株法得到的结果进行卡方检验,以验证两种方法对甲基二磺隆抗性看麦娘的检测结果是否具有显著性差异 (P < 0.05)。
2 结果与分析 2.1 甲基二磺隆单剂量测定结果施药后21 d,清水对照组各种群看麦娘生长良好,甲基二磺隆处理组不同种群植株存活数及生长状态略有不同。由表3可知,野生型种群HNXY-1对甲基二磺隆仍十分敏感,9 g/hm2剂量处理时完全死亡;而AHSX-5、JSHX-1及SDTC-4种群中均含有较高比例的甲基二磺隆抗性植株,但不同种群间RR、RS和SS型植株所占比例存在一定差异,说明不同的抗性种群其抗性机理可能不同,或处于不同的抗性进化阶段。
|
|
表 3 不同种群看麦娘对甲基二磺隆敏感性单剂量 (有效成分 9 g/hm2) 测定结果 Table 3 Sensitivity of different A. aequalis populations to mesosulfuron-methyl at single dose (9 g a.i./hm2) |
2.2 ALS基因片段测序
测序结果表明,扩增所得ALS基因片段长度为1 860 bp,编码619个氨基酸,与预期结果一致。经过BLAST比对分析,所扩增片段序列与Genbank登记的看麦娘ALS序列 (LC200800.1)、大穗看麦娘ALS序列 (AJ437300.2) 及菵草ALS序列 (KR809881.1) 同源性分别在99%、96%和97%左右,证明所扩增的片段即为目标片段。
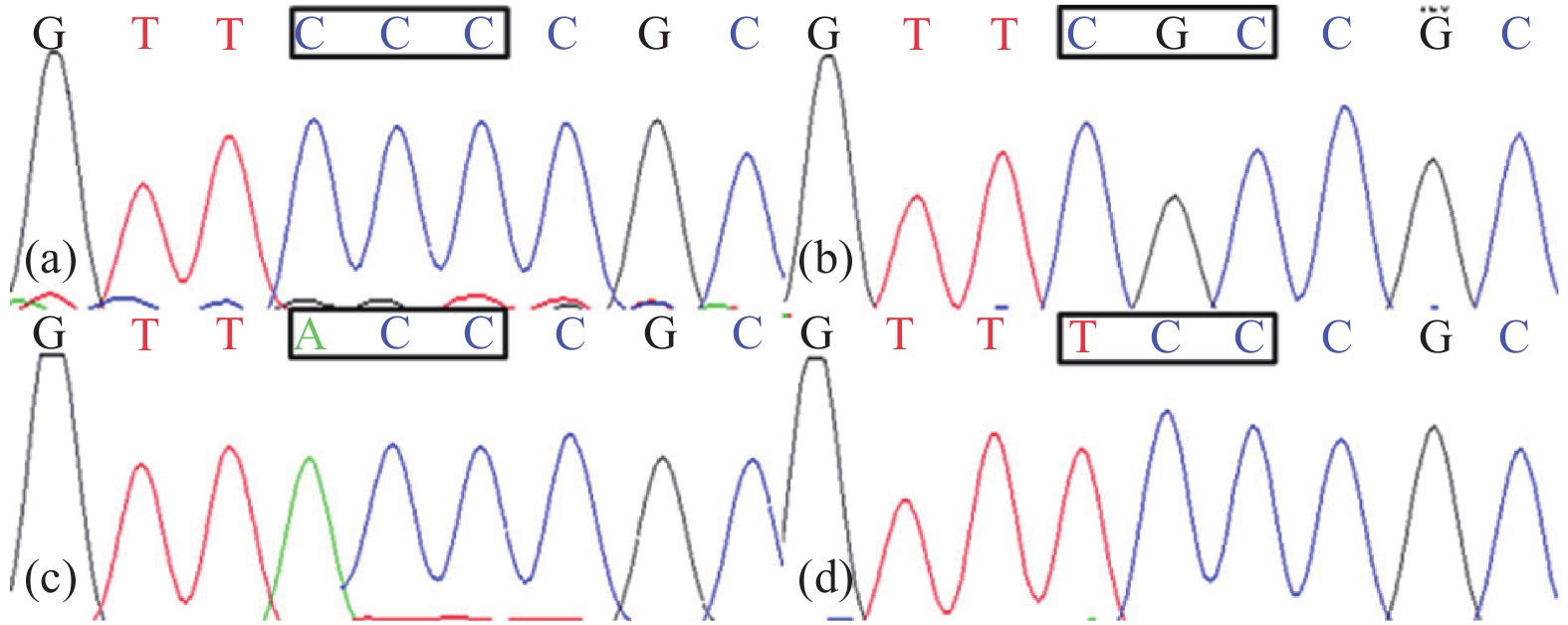
就3个抗性和野生敏感种群ALS片段序列进行比对,发现种群AHSX-5、JSHX-1和SDTC-4的抗性植株中分别存在P197R (CCC-CGC)、P197T (CCC-ACC) 及P197S (CCC-TCC) 3种氨基酸突变形式,且在其他已知的突变位点处均未产生突变 (图1)。
|
a. HNXY-1 种群,野生型;b. AHSX-5 种群,P197R突变型;c. JSHX-1 种群,P197T突变型;d. SDTC-4 种群,P197S突变型。 a. HNXY population, wild type; b. AHSX-5 population, P197R mutant type; c. JSHX-1 population, P197T mutant type; d. SDTC-4 population, P197S mutant type. 图 1 不同种群看麦娘ALS基因 197位点测序峰图 Fig. 1 Sequence chromatograms at ALS 197 codon of different A. aequalis populations |
2.3 看麦娘ALS基因 197位点dCAPS检测分析
本研究针对野生型ALS基因设计酶切位点,从而使扩增的野生型ALS基因片段能够被限制性内切酶特异性切割。在引物D197F中引入一个错配碱基,使得野生型ALS基因片段在197位点处形成了一个BamH I的酶切位点 (GGATCC)。
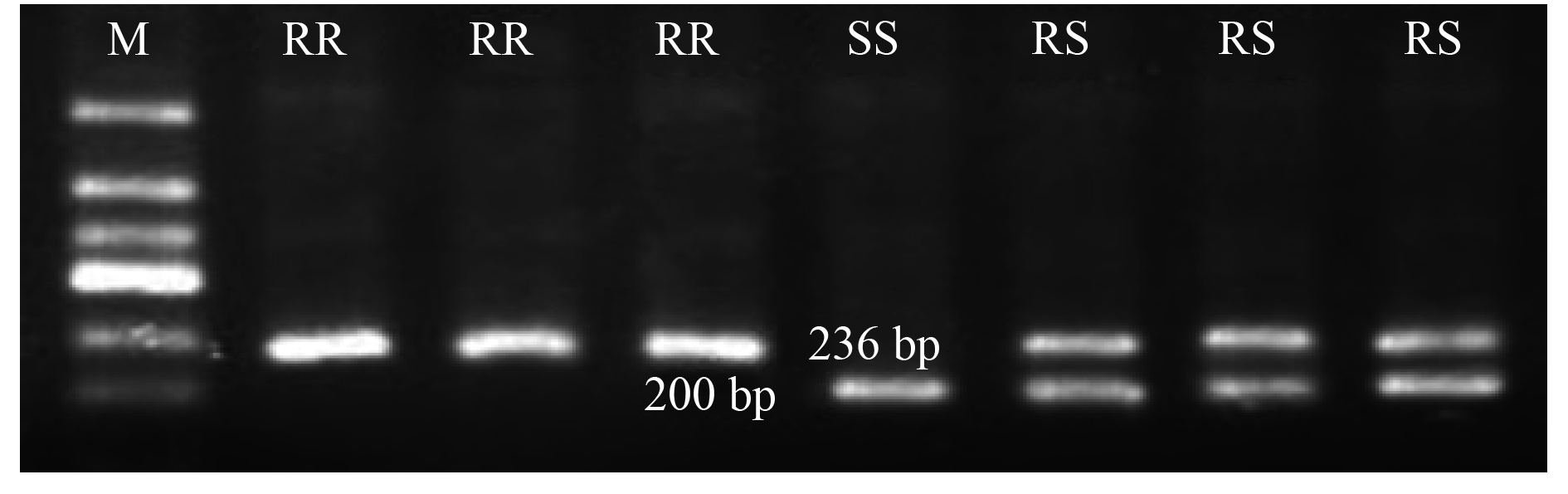
以看麦娘基因组DNA为模板,引物D197F/D197R在突变型和野生型植株中均扩增得到一条236 bp的片段,与预期结果相符。将PCR产物用限制性内切酶BamH I进行酶切,在电泳图谱上,野生型分别产生了200和36 bp的两个条带,纯合突变型因无法被切开,只有236 bp的一个条带,而杂合突变型则同时产生了上述3个条带,但因36 bp的条带太短,无法在电泳图谱上清晰显示 (图2)。
|
M:50 bp DNA marker;RR:高抗纯合突变植株,分别取自AHSX-5、JSHX-1和SDTC-4种群;RS:中抗杂合突变植株,分别取自AHSX-5、JSHX-1和SDTC-4种群;SS:野生敏感植株,取自HNXY-1种群。 M: 50 bp DNA marker; RR: highly resistant homozygous mutant plants, from AHSX-5, JSHX-1 and SDTC-4 population respectively; RS: moderately resistant heterozygous mutant plants, from AHSX-5, JSHX-1 and SDTC-4 population respectively; SS: susceptible wild type plant, from HNXY-1 population. 图 2 看麦娘ALS基因197位点BamH I酶切电泳图 Fig. 2 The dCAPS profile for ALS 197 codon in A. aequalis population using BamH I |
研究表明,3个种群甲基二磺隆抗性植株的ALS基因197位密码子均发生了突变,虽然具体的突变碱基不同,但均发生在197位密码子的前两个碱基上,而这两个碱基均包含在BamH I的识别位点上,因此只要197位密码子前两位碱基产生突变,均可被该dCAPS分子标记检测到。对AHSX-5种群进行分析时,所检测的15株中有5株为抗性纯合型,9株为抗性杂合型,1株为野生型;而JSHX-1种群15株中有4株为抗性纯合型,10株为抗性杂合型,1株为野生型;SDTC-4种群15株中有8株为抗性纯合型,7株为抗性杂合型。经验证,3种ALS 197纯合突变型植株均表现为高抗性,杂合突变型植株表现为中等抗性,且不同抗性种群经dCAPS分析检测到的高抗及中等抗性植株比例与表3中整株水平测定结果无显著性差异 (表4),说明本研究设计的dCAPS分析方法可对甲基二磺隆抗性看麦娘197位点的突变进行准确可靠的检测。
|
|
表 4 dCAPS分析与整株法对甲基二磺隆抗性看麦娘检测结果对比 Table 4 Comparison of dCAPS and whole-plant bioassay in the detection of mesosulfuron-methyl resistant in A. aequalis |
3 结论与讨论
自2002年上市以来,甲基二磺隆的市场规模不断扩大,2012年销售额已达2.9亿美元,居磺酰脲类除草剂产品首位[22]。截至2018年3月,甲基二磺隆相关制剂在中国的登记产品共有48个[23]。然而,使用面积和频次的增长也带来了极高的抗性风险,尤其是在当前杂草对精唑禾草灵抗性已较为普遍的前提下,若其对甲基二磺隆也产生抗性,则将可能导致小麦田抗性禾本科杂草面临无药可治的窘境[24]。另外,作为一种茎叶处理剂,若因抗性问题导致杂草防治失败,则后期有可能因杂草过大以及顾忌作物安全性等而很难采取补救措施,从而导致严重的产量损失。
目前,全球除草剂市场已有20多年未见新作用机制除草剂产生[25],如何延缓杂草对现有除草剂抗性的产生和发展,延长药剂的市场周期已成为必须面对的问题,而抗性检测是其中重要的一环。抗性杂草检测方法多样,根据检测层次的不同,可分为表型水平、生理生化水平和分子水平检测3大类[26]。表型水平检测一般是指采用生物测定方法,比较除草剂对抗性及敏感生物型植株的不同效果,死亡率和生物量是其中最常用的检测指标。该类方法简单易行、对不同抗性机制均可检测,但通常需要较大的温室空间,费时费力;另外,当杂草不同生物型对除草剂处理的反应差异不明显时,还需要人为进行评估,从而有可能影响结果的准确性和可重复性。生理生化水平检测一般是通过对靶标酶和相关代谢酶活性进行测定,判断待测杂草靶标酶对除草剂敏感性是否降低、或代谢酶活性是否提高而甄别抗性,这类方法技术要求较高,有时需要放射性标记的底物。分子水平检测方法较多,不同的方法技术难度、精度要求及费用差别较大。其中,定量PCR、转录组测序对靶标和非靶标抗性机制均可检测,但设备昂贵、费用高,不适合田间种群的大量检测;常用的桑格测序法主要是针对靶标基因检测相关位点的突变,崔海兰等基于该方法实现了猪殃殃对ALS抑制剂靶标抗性的快速分子检测[16],但该方法需要进行两次测序反应,测序结果需要专业软件进行生物信息学分析。
大量研究证明,ALS靶标位点突变是杂草对该类除草剂产生抗性的主要机制之一[2, 9]。虽然与ALS抑制剂类除草剂相关的突变位点多达8个,但具体到甲基二磺隆,则仅在197和574两个位点上产生了突变,其中197位点上共有3种突变形式。除dCAPS外,基于荧光标记单碱基延伸原理的SNaPshot技术[27]以及等温扩增技术 (LAMP)[28]等也可用于已知突变的检测,但前者设备和试剂昂贵,后者设计方法复杂,因此目前这两种方法应用均较少。dCAPS检测技术的成本主要来源于限制性内切酶,而本研究选用的内切酶BamH I较为廉价,每个样品所需费用低于0.5元。Pan等报道了菵草ALS基因P197S突变的dCAPS分子标记[29],可用于专一性检测P197S这一种突变,而本研究设计的dCAPS分子标记可检测197位点上任一形式的突变。另外由于ALS基因较为保守,看麦娘与日本看麦娘、菵草等杂草的ALS基因序列同源性极高,因此本研究中的dCAPS分子标记方法可能也适用于其他种类杂草抗性的检测,具体还有待进一步验证。
对田间杂草进行抗性检测不仅有利于减轻已有抗性杂草的危害,还有利于了解抗性产生的过程,对抗性风险进行预测,指导科学合理地使用除草剂,调整防治策略,防止抗性的大面积蔓延。本研究设计的dCAPS分子标记方法具有操作简单、结果直观、价格低廉及可高通量检测等优点,并且可在田间直接采集叶片实现当季检测,结合本课题组设计的ALS基因574位点突变的dCAPS分子标记[4],可实现看麦娘等杂草对甲基二磺隆等ALS抑制剂类除草剂靶标抗性的快速检测。然而,由于dCAPS方法只能针对已知的单个靶标位点突变进行检测,因此对于非靶标抗性及未知的新突变位点则还需要结合其他检测方法进行。
| [1] |
MCCOURT J A, PANG S S, KING-SCOTT J, et al. Herbicide-binding sites revealed in the structure of plant acetohydroxyacid synthase[J]. Proc Natl Acad Sci USA, 2006, 103(3): 569-573. DOI:10.1073/pnas.0508701103 |
| [2] |
POWLES S B, YU Q. Evolution in action: plants resistant to herbicides[J]. Annu Rev Plant Biol, 2010, 61: 317-347. DOI:10.1146/annurev-arplant-042809-112119 |
| [3] |
HEAP I. The international survey of herbicide resistant weeds[DB/OL]. [2018-03-18]. http://www.weedscience.org/Summary/Country.aspx?CountryID=9.
|
| [4] |
GUO W L, YUAN G H, LIU W T, et al. Multiple resistance to ACCase and AHAS-inhibiting herbicides in shortawn foxtail (Alopecurus aequalis Sobol.) from China
[J]. Pestic Biochem Physiol, 2015, 124: 66-72. DOI:10.1016/j.pestbp.2015.04.006 |
| [5] |
BI Y L, LIU W T, GUO W L, et al. Molecular basis of multiple resistance to ACCase- and ALS-inhibiting herbicides in Alopecurus japonicus from China
[J]. Pestic Biochem Physiol, 2016, 126: 22-27. DOI:10.1016/j.pestbp.2015.07.002 |
| [6] |
LI L X, LIU W T, CHI Y C, et al. Molecular mechanism of mesosulfuron-methyl resistance in multiply-resistant American sloughgrass (Beckmannia syzigachne)
[J]. Weed Sci, 2015, 63(4): 781-787. DOI:10.1614/WS-D-15-00026.1 |
| [7] |
TRANEL P J, WRIGHT T R, HEAP I M. Mutations in herbicide-resistant weeds to ALS inhibitors[DB/OL]. [2018-03-18]. http://www.weedscience.org/Mutations/MutationDisplayAll.aspx.
|
| [8] |
BECKIE H J, TARDIF F J. Herbicide cross resistance in weeds[J]. Crop Prot, 2012, 35: 15-28. |
| [9] |
YU Q, POWLES S B. Resistance to AHAS inhibitor herbicides: current understanding[J]. Pest Manag Sci, 2014, 70(9): 1340-1350. DOI:10.1002/ps.2014.70.issue-9 |
| [10] |
BI Y L, LIU W T, LI L X, et al. Molecular basis of resistance to mesosulfuron-methyl in Japanese foxtail, Alopecurus japonicus
[J]. J Pestic Sci, 2013, 38(2): 74-77. DOI:10.1584/jpestics.D12-075 |
| [11] |
XIA W W, PAN L, LI J, et al. Molecular basis of ALS- and/or ACCase-inhibitor resistance in shortawn foxtail (Alopecurus aequalis Sobol.)
[J]. Pestic Biochem Physiol, 2015, 122: 76-80. DOI:10.1016/j.pestbp.2014.12.019 |
| [12] |
GUO W L, LV L L, ZHANG L L, et al. Herbicides cross resistance of a multiple resistant short-awn foxtail (Alopecurus aequalis Sobol.) population in wheat field
[J]. Chil J Agric Res, 2016, 76(2): 163-169. DOI:10.4067/S0718-58392016000200005 |
| [13] |
郭文磊, 赵宁, 李伟, 等. 山东省小麦田看麦娘对甲基二磺隆的抗性及其基因突变[J]. 麦类作物学报, 2016, 36(12): 1688-1694. GUO W L, ZHAO N, LI W, et al. Resistance of shortawn foxtail (Alopecurus aequalis Sobol.) to mesosulfuron-methyl in wheat fields in Shandong Province [J]. J Triticeae Crops, 2016, 36(12): 1688-1694. DOI:10.7606/j.issn.1009-1041.2016.12.20 |
| [14] |
BURGOS N R, TRANEL P J, STREIBIG J C, et al. Review: confirmation of resistance to herbicides and evaluation of resistance levels[J]. Weed Sci, 2013, 61(1): 4-20. DOI:10.1614/WS-D-12-00032.1 |
| [15] |
KAUNDUN S S, HUTCHINGS S J, DALE R P, et al. Syngenta ‘RISQ’ test: a novel in-season method for detecting resistance to post-emergence ACCase and ALS inhibitor herbicides in grass weeds[J]. Weed Res, 2011, 51(3): 284-293. DOI:10.1111/wre.2011.51.issue-3 |
| [16] |
崔海兰, 王藏月, 徐林林, 等. 猪殃殃对 AHAS 抑制剂靶标抗性的快速分子检测[J]. 植物保护学报, 2016, 43(6): 1049-1054. CUI H L, WANG C Y, XU L L, et al. Rapid molecular detection of the resistance of Galium aparine var. tenerum to AHAS inhibitors [J]. J Plant Prot, 2016, 43(6): 1049-1054. |
| [17] |
KAUNDUN S S, WINDASS J D. Derived cleaved amplified polymorphic sequence, a simple method to detect a key point mutation conferring acetyl CoA carboxylase inhibitor herbicide resistance in grass weeds[J]. Weed Res, 2006, 46(1): 34-39. DOI:10.1111/wre.2006.46.issue-1 |
| [18] |
DÉLYE C, MATÉJICEK A, MICHEL S. Cross-resistance patterns to ACCase-inhibiting herbicides conferred by mutant ACCase isoforms in Alopecurus myosuroides Huds. (black-grass), re-examined at the recommended herbicide field rate
[J]. Pest Manag Sci, 2008, 64(11): 1179-1186. DOI:10.1002/ps.v64:11 |
| [19] |
XU H L, LI J, ZHANG D, et al. Mutations at codon position 1999 of acetyl-CoA carboxylase confer resistance to ACCase-inhibiting herbicides in Japanese foxtail (Alopecurus japonicus)
[J]. Pest Manag Sci, 2014, 70(12): 1894-1901. DOI:10.1002/ps.2014.70.issue-12 |
| [20] |
DOYLE J J, DOYLE J L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J]. Phytochem Bull, 1987, 19(1): 11-15. |
| [21] |
NEFF M M, TURK E, KALISHMAN M. Web-based primer design for single nucleotide polymorphism analysis[J]. Trends Genet, 2002, 18(12): 613-615. DOI:10.1016/S0168-9525(02)02820-2 |
| [22] |
DUHOUX A, PERNIN F, DESSERRE D, et al. Herbicide safeners decrease sensitivity to herbicides inhibiting acetolactate-synthase and likely activate non-target-site-based resistance pathways in the major grass weed Lolium sp. (rye-grass)
[J]. Front Plant Sci, 2017, 8: 1310. DOI:10.3389/fpls.2017.01310 |
| [23] |
中国农药信息网. 农药登记数据[DB/OL]. [2018-03-18]. http://www.chinapesticide.org.cn/hysj/index.jhtml. China Pesticide Information Network. Data of pesticide registration[DB/OL]. [2018-03-18]. http://www.chinapesticide.org.cn/hysj/index.jhtml. |
| [24] |
韩玉皎, 崔海兰, 李香菊. 我国冬小麦区菵草种群对甲基二磺隆的抗性水平[J]. 杂草科学, 2015, 33(2): 37-42. HAN Y J, CUI H L, LI X J. Survey of resistance levels to mesosulfuron-methyl in Beckmannia syzigachne (Steud.) Fernald populations in winter wheat fields in China [J]. Weed Sci, 2015, 33(2): 37-42. |
| [25] |
DUKE S O. Why have no new herbicide modes of action appeared in recent years?[J]. Pest Manag Sci, 2012, 68(4): 508-512. |
| [26] |
R4P Network. Trends and challenges in pesticide resistance detection[J]. Trends Plant Sci, 2016, 21(10): 834-853. DOI:10.1016/j.tplants.2016.06.006 |
| [27] |
MARSHALL R, HANLEY S J, HULL R, et al. The presence of two different target-site resistance mechanisms in individual plants of Alopecurus myosuroides Huds., identified using a quick molecular test for the characterisation of six ALS and seven ACCase SNPs
[J]. Pest Manag Sci, 2013, 69(6): 727-737. DOI:10.1002/ps.2013.69.issue-6 |
| [28] |
PAN L, LI J, Zhang W N, et al. Detection of the I1781L mutation in fenoxaprop-p-ethyl-resistant American sloughgrass (Beckmannia syzigachne Steud.), based on the loop-mediated isothermal amplification method
[J]. Pest Manag Sci, 2015, 71(1): 123-130. DOI:10.1002/ps.2015.71.issue-1 |
| [29] |
PAN L, GAO H T, WU H, et al. Molecular basis of multiple resistance to herbicides inhibiting acetyl-CoA carboxylase and acetolactate synthase in American sloughgrass (Beckmannia syzigachne) from China
[J]. Crop Pasture Sci, 2016, 67(11): 1208-1214. DOI:10.1071/CP16109 |
 2018, Vol. 20
2018, Vol. 20


