2. 辽宁省生物农药工程技术研究中心,沈阳 110866
2. Engineering & Technological Research Center of Biopesticide, Shenyang 110866, China
昆虫病原线虫共生菌是一类革兰氏阴性细菌, 属肠杆菌科, 包含致病杆菌属 (Xenorhabdus) 和发光杆菌属 (Photorhabdus)[1-2]。该类细菌寄生于病原线虫的肠道中,可随线虫一起侵入宿主昆虫,而后被释放,可在昆虫血腔中汲取营养并大量繁殖。此时,共生菌会产生一系列酶分解昆虫有机体,同时还会产生一些次生代谢产物并分泌多种微量抗生素,既使得宿主昆虫患败血症而死亡,又保证了死亡虫体不再受土壤中其他微生物的侵染[3-5]。昆虫病原线虫共生菌的这一生物学特性,使其具有开发为杀虫剂、杀菌剂等生物农药的潜力,给新型农药的开发带来新的希望,若能成功开发,不仅可减少广谱化学农药的施用量,还可对保护生态环境起到推动性作用[6-7]。
笔者利用大蜡螟生物诱导技术从土壤中分离出一株菌株,采用 16S rDNA方法对该菌株进行了鉴定。采用硅胶柱层析、凝胶柱层析、高效液相制备等化学分离技术,对该菌发酵液中的活性化合物进行了分离及纯化,并通过质谱及核磁共振等波谱技术以及相关文献调研确定了所分离化合物的结构。利用微量稀释法测定了化合物对几种植物病原真菌的抑制作用。
1 材料与方法 1.1 供试材料 1.1.1 植物病原真菌番茄灰霉病菌Botrytis cinerea、辣椒疫霉Phytophthoa capsici、水稻纹枯病菌Thanatephorus cucumeris和小麦根腐病菌Bipolaris sorokiniana,均由沈阳农业大学植物保护学院微生物次生代谢产物研究室保存并提供。
1.1.2 仪器及试剂ZF-20A型暗箱四用紫外分析仪 (上海嘉鹏科技有限公司);R-1001-LN型旋转蒸发仪 (郑州长城科工贸有限公司);Agilent 1260型液相分析色谱仪及半制备型C18柱 (美国Agilent公司);Avance 600 核磁共振仪 (Bruker公司);Agilent 6500 系列四极杆-飞行时间质谱仪 (美国Agilent公司);AP-300 型旋光仪 (日本爱拓公司);MultiskanTM FC型酶标仪 (芬兰Thermo Fisher Scientific公司)。
XAD-16大孔吸附树脂 (罗门哈斯国际贸易有限公司);ZCX-Ⅱ型柱层析硅胶 (青岛海洋化工厂);Sephadex LH-20 柱层析凝胶 (瑞典Pharmacia公司);色谱纯甲醇 (美国Sigma-Aldrich公司);其他试剂为市售分析纯。75%百菌清 (chlorothaloni) 可湿性粉剂 (山东潍坊化工股份有限公司)。
1.1.3 培养基RPMI Medium 1640 培养基 (北京索莱宝科技有限公司)。
溴百里酚蓝鉴别型培养基 (NBTA):氯化三苯基四氮唑0.040 g/L,牛肉膏3.0 g/L,溴百里酚蓝0.025 g/L,氯化钠5.0 g/L,蛋白胨10.0 g/L,琼脂粉15.0 g/L,蒸馏水1.0 L,pH值7.0。
LB培养基:胰蛋白胨10.0 g/L,氯化钠 10.0 g/L,酵母提取物5.0 g/L,蒸馏水1.0 L,pH值7.0。
M培养基:葡萄糖6.13 g/L,硫酸铵2.46 g/L,蛋白胨21.29 g/L,磷酸氢二钾 1.11 g/L,硫酸镁 1.50 g/L,磷酸二氢钾 1.11 g/L,硫酸钠 1.72g/L,蒸馏水1.0 L,pH值7.2~7.6。
1.2 试验方法 1.2.1 菌株分离及鉴定供试菌株来源于辽宁省通辽市扎鲁特旗采集的土样,通过大蜡螟Galleria mellonella进行生物诱导,待虫体死亡后,剪开腹部,将血淋巴液滴到溴百里酚蓝鉴别型培养基 (NBTA) 上,并利用该培养基进行分离纯化,获得蓝绿色初生型菌株。参照Liu等[8] 的方法提取DNA 。
1.2.2 菌株粗提物制备挑取已纯化的蓝绿色单菌落于装有 5 mL LB培养基的试管中,在28 ℃、180 r/min的摇床中培养 24 h,得到一级种子发酵液。将此一级种子发酵液接种到100 mL装有 40 mL M培养基的锥形瓶中,于相同条件下培养 24 h,得到二级种子发酵液。再次将此二级种子发酵液接种到含有 20 g XAD-16 大孔树脂、400 mL M培养基的 2 L锥形瓶中 (总发酵量为48 L),再次以相同条件培养5 d。收集大孔树脂,用蒸馏水洗去表面菌体并烘干。先后用16 L甲醇浸泡已干燥的树脂 680 g,收集浸提液并浓缩至干。用V (蒸馏水) : V (甲醇) : V (二氯甲烷) = 1:1:2的混合液 (总体积 800 mL) 萃取4次,得到粗提物浸膏 7.5 g。
1.2.3 活性物质分离纯化及鉴定采用硅胶层析柱将7.5 g粗提物进行纯化,以二氯甲烷与甲醇混合溶液进行梯度洗脱 (体积比依次为100:0、100:4、100:8、100:16、1:1、0:100),每50 mL收集为一馏分。经薄层层析 (TLC) 检测,合并为6个不同组分 (Fr.1-Fr.6)。将Fr.2 (1.02 g) 经凝胶柱层析[流动相为V(二氯甲烷):V(甲醇)= 1:1]纯化,并再次经硅胶柱层析 (二氯甲烷与甲醇体积比依次为 100:1.5、100:3),后利用高效液相色谱仪对目标化合物进行半制备,得到化合物:1 (7.4 mg;洗脱条件为体积分数40%甲醇60%水,保留时间 (tR) = 24~27 min);2 (17.4 mg;洗脱条件为体积分数65%甲醇35%水,tR = 30~40 min)、3 (14.6 mg;洗脱条件为体积分数30%甲醇70%水,tR = 25~30 min)。
利用MS、1D和 2D NMR波谱技术,并经文献比对,确定3个化合物的结构。
1.2.4 抑菌活性测定采用 96 孔酶标微量稀释法[9]测定3个化合物对番茄灰霉病菌、辣椒疫霉、水稻纹枯病菌和小麦根腐病菌4种植物病原真菌的抑制活性。将每种植物病原真菌接种到RPMI Medium 1640 培养基中制成菌悬液,用酶标仪调整其浓度,在波长620 nm处其OD值为 0.07~0.09。用少量二甲基亚砜 (DMSO) 溶解化合物,加无菌水配制成初始质量浓度为 256 μg/mL的母液 (DMSO含量2%)。将母液用不同体积的培养基稀释并加入到每孔含有100 μL菌悬液的 96 孔板中,使得每孔总体积为 200 μL,化合物终浓度依次为128、64、32、16、8、4、2和1 μg/mL。分别设相应质量浓度的百菌清药液加2% DMSO溶液及菌悬液作为阳性对照,设2% DMSO溶液加培养基稀释的菌悬液 (稀释倍数如实验组) 作为阴性对照,以2% DMSO溶液加培养基作为空白对照。每处理3次重复。用酶标仪在波长620 nm处分别于初始和 25 ℃培养 36 h、48 h后检测OD值,参照Wang等[10] 的方法计算IC50值,用SPSS 22.0 软件的Probit回归分析处理数据。
2 结果与分析 2.1 菌株的分类鉴定对供试菌株的16S rDNA基因序列进行分析。结果表明:其序列长度为1 442 bp,将该序列上传至NCBI GenBank,获得登记号为MG385844.1。构建系统发育树见图1,发现其与Xenorhabdus nematophila ATCC 19061T/FN667742 的亲缘关系最为接近,因此初步将其鉴定并命名为嗜线虫致病杆菌 (Xenorhabdus nematophila) SN313。

|
图 1 嗜线虫致病杆菌SN313 菌株16S rDNA基因系列构建的系统发育树 Fig. 1 Phylogenetic tree of strain Xenorhabdus nematophilaSN313 based on 16S rDNA sequence |
2.2 化合物的结构鉴定
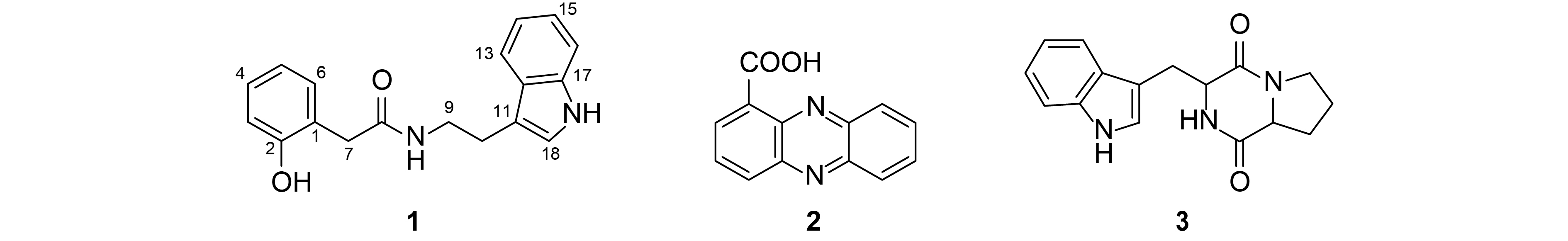
化合物1:7.4 mg,棕黄色膏体,易溶于氯仿。根据高分辨质谱 (HRESIMS,测量值m/z 317.126 5 [M + Na]+, 计算值为317.129 1) 推断其分子式为C18H18N2O2,并得到其 13C NMR数据的佐证。1H NMR (600 MHz, CDCl3)(表1) 显示:δH 2.96、3.48、3.59为3个亚甲基氢信号,δH 6.82~7.55为芳香氢信号,δH 8.09为活泼氢信号,δH 9.87为酚羟基氢信号。根据 13C NMR (150 MHz, CDCl3)(表1) 显示:δC 111.40~156.41及HSQC谱中相关氢信号说明可能存在一个吲哚环和一个芳香环结构,其中δC 156.41 为一羟基取代位碳信号;δC 173.35 和 1H NMR中氨基酸氢信号δH 5.98说明可能存在酰胺羰基。在HMBC谱图中,δH 6.98 (H-3) 和δH 3.48 (H-7) 与δC 156.41 (C-2) 相关,δH 3.48 (H-7) 和δH 3.59 (H-9) 与δC 173.35 (C-8) 相关,进一步证实C-2被羟基化而C-8存在羰基。在COSY谱图中,氨基酸氢信号δH 5.98与δH 3.59 (H-9) 相关,证实了氨基与C-9相连;δH 3.59 (H-9) 和δH 2.96 (H-10) 相关以及HMBC谱图中δH 2.96 (H-10) 与δC 112.48 (C-11) 远程相关,说明吲哚基可能为乙胺的β位取代。基于以上数据,并与文献[11]中结构类似物的 1H NMR、13C NMR数据比对,发现两个化合物的酚羟基在苯环上的取代位置不同,且该结构类似物在C-3 位存在氯代。就此推断化合物1为一个新的β-吲哚基乙胺类 (tryptamine) 类衍生物,命名为N-(2-羟基苯基乙酰) 色胺。
|
|
表 1 化合物1的氢谱和碳谱数据 Table 1 1H NMR and 13C NMR data of compound 1 |
化合物2:17.4 mg,黄色粉末状固体,易溶于氯仿。根据质谱 (MS,测量值247.0 m/z [M + Na]+) 推断其分子式为C13H8N2O2。1H NMR (600 MHz, CDCl3) 显示:δH 8.0~9.0范围内的质子峰说明了分子结构中多芳香环且存在氮原子,δH 19.57为羧基氢信号。13C NMR (150 MHz, CDCl3) 显示δC 166.01为羰基碳信号,δC 125.02~144.17说明有芳香环结构,δC 125.02是羧基取代位碳信号。经与文献[12]中化合物比对,发现与其 1H NMR和 13C NMR数据基本一致。因此,确定化合物2为吩嗪-1-羧酸。
化合物3:14.6 mg,棕黄色膏体,易溶于氯仿。根据质谱 (MS,测量值284.1 m/z [M + H]+) 推断其分子式是C16H17N3O2。1H NMR (600 MHz, CDCl3) 显示δH 1.84~3.68 之间为3个亚甲基氢信号,δH 8.42为一个活泼氢信号,δH 5.79可能为一个氨基氢信号,δH 7.08~7.59为芳香环氢信号。结合 13C NMR (150 MHz, CDCl3) 显示δC 165.31、169.13 说明可能存在酰胺羰基,δC 109.61~136.43 说明可能存在一个吲哚环。经与文献[13]中化合物比对,发现与其 1H NMR和 13C NMR数据基本一致。因此,确定化合物3为环 (脯氨酸-色氨酸)。
化合物1、2、3的化学结构见图2。
|
图 2 化合物1、2和3的化学结构 Fig. 2 Stuctural fomula of compound 1, 2 and 3 |
2.3 化合物对植物病原真菌的抑制活性
抑菌活性测定结果 (表2) 表明:化合物1对番茄灰霉病菌 (IC50 = 28.94 μg/mL) 与辣椒疫霉病菌 (IC50 = 11.20 μg/mL) 有明显的抑制效果,对其他两种病原真菌抑制效果一般 (IC50 > 50 μg/mL);化合物 2对4种供试病原真菌均有明显的抑制效果 (IC50 < 40 μg/mL);化合物 3对番茄灰霉病菌具有较好的抑制效果 (IC50 = 41.58 μg/mL),对其他3种病原真菌抑制效果一般 (IC50 > 50 μg/mL)。
|
|
表 2 化合物1、2、3对4种植物病原真菌的抑制活性 Table 2 Antifungal activities of compounds 1, 2, 3 against phytopathogenic fungi |
3 讨论
本研究通过化学分离技术从SN313的发酵液中分离得到3个化合物,其中化合物1[N-(2-羟基苯基乙酰) 色胺]和3[环 (脯氨酸-色氨酸)] 均为吲哚类化合物,已有研究表明,该类化合物具有抗真菌、细菌的作用,是致病杆菌次生代谢产物中一类重要物质[14-16]。除吲哚类化合物外,还有大量结构丰富且具有生物活性的天然产物来源于致病杆菌,如dithiolopyrrolones[15]、benzopy-ran-1-one[17]、phenylpyruvate dimmers[18]和benzylideneacetone[19]等。化合物1是一个新的β-吲哚基乙胺类衍生物,Garca等[20]基于3-氯-4-对羟基苯乙酰胺人工合成过与其结构类似的物质,但关于在生物发酵条件下生成此类结构的研究未见报道,因此化合物1的发现使天然产物中吲哚类物质的结构多样性得以丰富。另外,鉴于化合物1对番茄灰霉病菌与辣椒疫霉病菌均具有明显的抑制效果,可将其作为先导化合物,为防治这些类病原菌的生物农药开发提供参考。化合物2 (吩嗪-1-羧酸) 的初始来源菌株为荧光假单胞菌Pseudomonas Fluorescens M18[21],也是申嗪霉素的主要有效成分[22],对瓜类、蔬类、棉花、水稻和小麦等作物的枯萎病、疫病、纹枯病、蔓枯病和赤霉病等均有很好的防治效果[23-24]。本研究首次从嗜线虫致病杆菌的次生代谢产物中分离出此化合物,为吩嗪-1-羧酸的天然获取提供了新的途径。
| [1] |
THOMAS G M, POINAR JR G O. Xenorhabdus gen. nov., a genus of Entomopathogenic, Nematophilic bacteria of the family Enterobacteriaceae
[J]. Int J Syst Bacteriol, 1979, 29(4): 352-360. DOI:10.1099/00207713-29-4-352 |
| [2] |
POINAR JR G O, THOMAS G M. A new bacterium, Achromobacter nematophilus sp. nov. (Achromobacteriaceae: Eubacteriales) associated with a nematode
[J]. Int J Syst Bacteriol, 1965, 15(4): 249-252. DOI:10.1099/00207713-15-4-249 |
| [3] |
SAN-BLAS E. Progress on entomopathogenic nematology research: a bibliometric study of the last three decades: 1980-2010[J]. Biol Control, 2013, 66(2): 102-124. DOI:10.1016/j.biocontrol.2013.04.002 |
| [4] |
HERBERT E E, GOODRICH-BLAIR H. Friend and foe: the two faces of Xenorhabdus nematophila
[J]. Nat Rev Microbiol, 2007, 5(8): 634-646. DOI:10.1038/nrmicro1706 |
| [5] |
CICHE T A, DARBY C, EHLERS R U, et al. Dangerous liaisons: the symbiosis of entomopathogenic nematodes and bacteria[J]. Biol Control, 2006, 38(1): 22-46. DOI:10.1016/j.biocontrol.2005.11.016 |
| [6] |
LACEY L A, GRZYWACZ D, SHAPIRO-ILAN D I, et al. Insect pathogens as biological control agents: back to the future[J]. J Invertebr Pathol, 2015, 132: 1-41. DOI:10.1016/j.jip.2015.07.009 |
| [7] |
OGIER J C, DUVIC B, LANOIS A, et al. A new member of the growing family of contact-dependent growth inhibition systems in Xenorhabdus doucetiae
[J]. PLoS One, 2016, 11(12): e0167443. DOI:10.1371/journal.pone.0167443 |
| [8] |
LIU J, BERRY R, POINAR G, et al. Phylogeny of Photorhabdus and Xenorhabdus species and strains as determined by comparison of partial 16S rRNA gene sequences
[J]. Int J Syst Bacteriol, 1997, 47(4): 948-951. DOI:10.1099/00207713-47-4-948 |
| [9] |
CRAWFORD J M, PORTMANN C, ZHANG X, et al. Small molecule perimeter defense in entomopathogenic bacteria[J]. Proc Natl Acad Sci USA, 2012, 109(27): 10821. DOI:10.1073/pnas.1201160109 |
| [10] |
WANG J F, HE W J, HUANG X L, et al. Antifungal new oxepine-containing alkaloids and xanthones from the deep-sea-derived fungus Aspergillus versicolor SCSIO 05879
[J]. J Agric Food Chem, 2016, 64(14): 2910-2916. DOI:10.1021/acs.jafc.6b00527 |
| [11] |
DAVIS R A, PIERENS G K, PARSONS P G. Synthesis and spectroscopic characterisation of a combinatorial library based on the fungal natural product 3-chloro-4-hydroxyphenylacetamide[J]. Magn Reson Chem, 2007, 45(5): 442-445. DOI:10.1002/(ISSN)1097-458X |
| [12] |
LEE J Y, MOON S S, HWANG B K. Isolation and in vitro and in vivo activity against Phytophthora capsici and Colletotrichum orbiculare of phenazine-1-carboxylic acid from Pseudomonas aeruginosa strain GC-B26
[J]. Pest Manag Sci, 2003, 59(8): 872-882. DOI:10.1002/ps.688 |
| [13] |
CAMPBELL J, LIN Q, GESKE G D, et al. New and unexpected insights into the modulation of LuxR-type quorum sensing by cyclic dipeptides[J]. ACS Chem Biol, 2009, 4(12): 1051-1059. DOI:10.1021/cb900165y |
| [14] |
LI J X, CHEN G H, WEBSTER J M, et al. Antimicrobial metabolites from a bacterial symbiont[J]. J Nat Prod, 1995, 58(7): 1081-1086. DOI:10.1021/np50121a016 |
| [15] |
LI J X, CHEN G H, WEBSTER J M. Nematophin, a novel antimicrobial substance produced by Xenorhabdus nematophilus (Enterobactereaceae)
[J]. Can J Microbiol, 1997, 43(8): 770-773. DOI:10.1139/m97-110 |
| [16] |
MCINERNEY B V, GREGSON R P, LACEY M J, et al. Biologically active metabolites from Xenorhabdus spp., Part 1. Dithiolopyrrolone derivatives with antibiotic activity
[J]. J Nat Prod, 1991, 54(3): 774-784. DOI:10.1021/np50075a005 |
| [17] |
MCINERNEY B V, TAYLOR W C, LACEY M J, et al. Biologically active metabolites from Xenorhabdus spp., Part 2. Benzopyran-1-one derivatives with gastroprotective activity
[J]. J Nat Prod, 1991, 54(3): 785-795. DOI:10.1021/np50075a006 |
| [18] |
BRACHMANN A O, FORST S, FURGANI G M, et al. Xenofuranones A and B: phenylpyruvate dimers from Xenorhabdus szentirmaii
[J]. J Nat Prod, 2006, 69(12): 1830-1832. DOI:10.1021/np060409n |
| [19] |
JI D J, YI Y, KANG G H, et al. Identification of an antibacterial compound, benzylideneacetone, from Xenorhabdus nematophila against major plant-pathogenic bacteria
[J]. FEMS Microbiol Lett, 2004, 239(2): 241-548. DOI:10.1016/j.femsle.2004.08.041 |
| [20] |
GARCÍA M D, WILSON J A, EMMERSON D P G, et al. Synthesis, crystal structure and biological activity of β-carboline based selective CDK4-cyclin D1 inhibitors
[J]. Org Biomol Chem, 2007, 4(24): 4478-4484. |
| [21] |
许煜泉. 绿色微生物源抗菌剂申嗪霉素(M18)[J]. 精细与专用化学品, 2004, 12(20): 8-9. XU Y Q. Green microorganism based antimicrobial: shenqinmycin (M18)[J]. Fine Spec Chem, 2004, 12(20): 8-9. DOI:10.3969/j.issn.1008-1100.2004.20.004 |
| [22] |
方运玲, 孙爽, 申阅, 等. 微生物源农药申嗪霉素的研制与应用[J]. 农药学学报, 2014, 16(4): 387-393. FANG Y L, SUN S, SHEN Y, et al. Progress on the development and application of biopesticide shenqinmycin[J]. Chin J Pestic Sci, 2014, 16(4): 387-393. |
| [23] |
CHIN-A-WOENG T F C, BLOEMBERG G V, LUGTENBERG B J J. Phenazines and their role in biocontrol by Pseudomonas bacteria
[J]. New Phytol, 2003, 157(3): 503-523. DOI:10.1046/j.1469-8137.2003.00686.x |
| [24] |
PRICE-WHELAN A, DIETRICH L E P, NEWMAN D K. Pyocyanin alters redox homeostasis and carbon flux through central metabolic pathways in Pseudomonas aeruginosa PA14
[J]. J Bacteriol, 2007, 189(17): 6372-6381. DOI:10.1128/JB.00505-07 |
 2018, Vol. 20
2018, Vol. 20


