2. 南京农业大学 植物保护学院,南京 210095;
3. 淮北师范大学 生命科学学院,安徽 淮北 235000
2. College of Plant Protection, Nanjing Agricultural University, Nanjing 210095, China;
3. College of Life Sciences, Huaibei Normal University, Huaibei 235000, Anhui Province, China
灰飞虱Laodelphax striatellus (Fallén) 属半翅目, 飞虱科,是为害水稻、小麦和玉米等粮食作物的重要农业害虫,主要分布于亚洲地区的温带和亚热带区域,特别在中国南方的长江流域和北方黄淮地区为害最重[1-3]。2004年在江苏苏北地区,曾由于灰飞虱种群暴发引起水稻条纹叶枯病流行,受害水稻面积达157万hm2,波及80%的水稻产区,减产高达30%~40%;2007年以来,灰飞虱在江苏、安徽、浙江、河南等地曾造成水稻黑条矮缩病暴发,经济损失巨大;在黄淮地区,灰飞虱为害夏播苗期玉米曾引发玉米粗缩病,造成严重减产[4]。之后灰飞虱的防治被重视,近年来未见大规模爆发为害,但鉴于其危害的严重性,研究其抗药性分子机制仍极为重要,可为该虫害的有效治理提供新策略和新靶标。
近年来受耕作制度改变影响,灰飞虱终年均可以繁殖为害,夏季高温下由于抗性品系具有高的适合度,繁殖更快,从而增加了抗性基因的携带频率[5]。化学农药是防治灰飞虱的主要手段,但由于其对常用杀虫剂逐渐产生抗药性,抗性问题已成为导致虫害爆发并传播流行性病毒的重要因素[6]。目前,灰飞虱已对毒死蜱 (chlorpyrifos)、吡虫啉 (imidacloprid)、溴氰菊酯 (deltamethrin)、氟虫腈 (fipronil)、噻嗪酮 (buprofezin) 和乙虫腈 (ethiprole) 分别产生了17.5~188、7.1~91.2、1 072、112.1、136.4~271.1和188倍的中到高等水平抗性[7-14];对丁硫克百威 (carbosulfan)、仲丁威 (fenobucarb)、二嗪磷 (diazinon)、噻虫胺 (clothianidin) 和吡蚜酮 (pymetrozine) 的抗性倍数分别为3.2、3.6、4.9、4.6和1.9~5.5,介于敏感到低等水平抗性之间[7, 10]。因此,深入解析灰飞虱抗药性形成机制,对防控其抗性及降低危害尤为重要[15]。
害虫对杀虫剂抗性的形成是人工选择的微进化过程,该选择过程中,适应杀虫剂环境的抗性个体具有抗性基因[16]。在杀虫剂施用初期,抗性基因在种群中所占比例小,害虫总体上对杀虫剂是敏感的;但随着杀虫剂施用时期延长,抗性个体数量逐渐增加,抗性基因频率上升,形成抗性种群,杀虫剂药效下降,害虫产生抗药性;而世代数较多的害虫,由于用药次数多,抗性发展更为迅速[17]。研究表明,采用点滴或浸苗法,用毒死蜱、吡虫啉、溴氰菊酯、氟虫腈、噻嗪酮和乙虫腈连续处理8代以上,灰飞虱即可对上述杀虫剂形成中至高等程度抗性[1, 11-14, 18],且抗性基因在杀虫剂选择中可稳定表达。
抗药性分子机制通常涉及两个方面:靶标基因突变和解毒代谢酶基因表达上调。阐释由靶标位点突变介导的抗药性可以揭示杀虫剂如何发挥致死效应,而探究代谢抗性可以揭示杀虫剂到达分子靶标之前如何被代谢酶降解[19]。本文基于详实的文献调研,拟就灰飞虱对毒死蜱、吡虫啉、溴氰菊酯、氟虫腈、噻嗪酮和乙虫腈抗性分子机制的最新研究成果进行综述,分析存在的问题,并展望其未来发展方向,以期促进灰飞虱防治技术及效果的提高。
1 灰飞虱对毒死蜱的抗性分子机制毒死蜱 (chlorpyrifos,图式 1) 属于有机磷类杀虫剂,其作用机制是经脱硫作用成为毒死蜱氧磷,后者可使昆虫乙酰胆碱酯酶磷酸化而失活,从而不能催化神经递质乙酰胆碱的水解,导致乙酰胆碱过量,乙酰胆碱受体被过度刺激而致使害虫死亡[20]。2014年,Xu等报道,江苏省灰飞虱田间种群对毒死蜱产生了31.5~49.9倍的抗性[1];而该省建湖灰飞虱种群室内筛选25代后对毒死蜱产生了158.58倍的抗性[1];2012年,Zhang等报道,云南省楚雄灰飞虱种群室内筛选25代后对毒死蜱产生了188倍的抗性[21]。目前认为灰飞虱对毒死蜱的抗性分子机制主要涉及解毒酶和三磷酸腺苷结合盒 (adenosine triphosphate binding cassette,ABC) 转运蛋白基因表达上调及乙酰胆碱酯酶的突变。
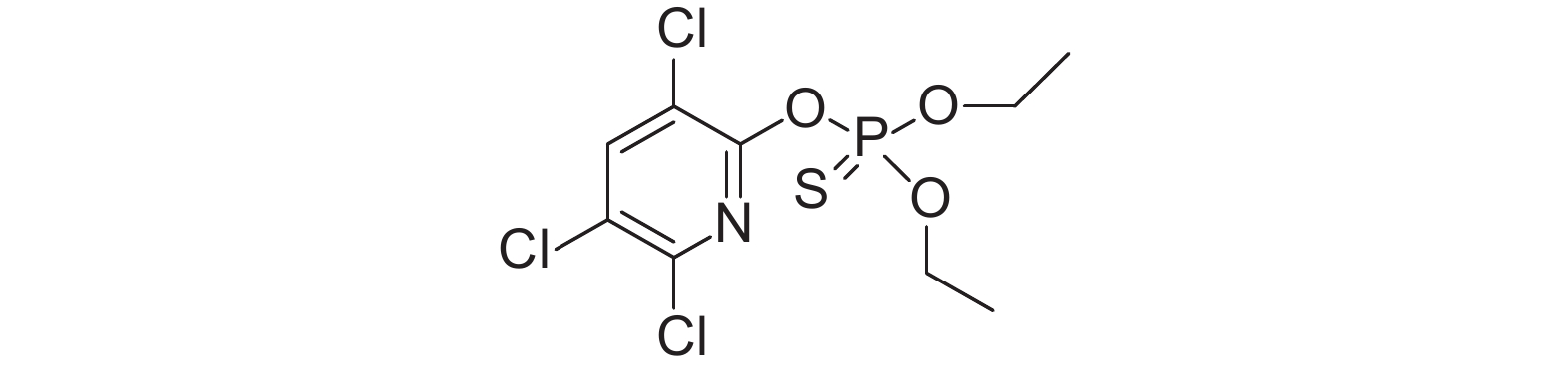
|
图式1 毒死蜱 Scheme1 chlorpyrifos |
1.1 由解毒酶基因表达上调介导的对毒死蜱的抗性
Xu等研究发现,在经过毒死蜱25代筛选后抗性达158.58倍的江苏建湖灰飞虱高抗品系JH-chl中,P450基因CYP6AY3v2、CYP306A2v2、CYP353D1v2和LSCE36呈过量表达 (6.87~12.14倍),核糖核酸干扰 (ribonucleic acid interference, RNAi) 试验证实,降低上述基因的表达量可引起成虫死亡率显著上升[1],即组成型解毒酶基因的过表达介导了江苏省建湖灰飞虱种群对毒死蜱的抗性。Xu等[1]认为其成因可能是:P450基因通过脱硫反应,将毒死蜱转化为毒死蜱氧磷,而RNAi通过降低P450基因的表达从而导致害虫对毒死蜱抗性升高。Zhang等研究发现:在对毒死蜱抗性达188倍的云南省楚雄灰飞虱YN-CPF高抗品系和YN-RSF抗性恢复品系中,酯酶基因Ls.CarE1分别呈32.06和8.6倍的过量表达;经蛋白质印迹分析发现,其蛋白在YN-CPF品系中呈过量表达[22];通过构建Ls.CarE1过表达的果蝇品系,证实其介导了对毒死蜱的抗性[23]。JH-chl和YN-CPF品系分别涉及不同的代谢抗性机制,其区别可能在于不同地理种群具有不同的遗传背景,因而对相同的杀虫剂发展出了不同的抗性机制,表明灰飞虱对毒死蜱抗性的形成是个较为复杂的过程。
1.2 由ABC转运蛋白基因表达上调介导的对毒死蜱的抗性Sun等[24]研究发现,灰飞虱ABC转运蛋白基因LsABCB2、LsABCC4、LsABCD1、LsABCF1、LsABCG2、LsABCG6、LsABCG8、LsABCG10和LsABCG11在毒死蜱抗性品系JH-chl中呈过量表达,通过ABC转运蛋白增效试验显示,维拉帕米 (verapamil) 可降低毒死蜱的致死中浓度,增效达到3.02倍。表明ABC转运蛋白也参与了灰飞虱对毒死蜱抗性的形成。
1.3 由乙酰胆碱酯酶突变介导的对毒死蜱的抗性乙酰胆碱酯酶 (acetylcholinesterase,AChE) 一般被认为是有机磷类杀虫剂的主要作用靶标,在灰飞虱中共包括乙酰胆碱酯酶1基因 (AChE1) 和乙酰胆碱酯酶2基因 (AChE2) 两种 (基因登录号:JX566825)。对比云南省楚雄灰飞虱YN-CPF抗性和YN敏感个体,发现抗性个体Ls.AChE1基因在439位存在氨基酸突变 (F439H),其突变频率在云南楚雄灰飞虱的YN-CPF、YN-RSF和YN品系中分别占91%、54%和0%;而相似位点F455W、F392W和F331Y的突变在三带喙库蚊Culex tritaeniorhynchus、烟粉虱Bemisia tabaci和伊氏叶螨Tetranychus evansi中均涉及到对有机磷类杀虫剂的抗性[25-27]。由此推测,灰飞虱YN-CPF品系中Ls.AChE1基因的F439H点突变或许同样介导了对毒死蜱的抗性,其可能降低了酰基口袋的疏水性和破坏了催化剂的正确排列,且由于组氨酸比苯丙氨酸或色氨酸的疏水性低,因此该突变也导致了AChE电子特征的变化,从而使AChE变得不敏感,因而表现出对毒死蜱的抗性[22]。但由于灰飞虱的F439H位于酰基口袋内,并非像白背飞虱Sogatella furcifera和褐飞虱Nilaparvata lugens那样位于保守序列内或保守序列之间[28-29],因此,该突变是否导致AChE与毒死蜱亲和力下降还需进一步研究,F439H点突变是否广泛存在于田间毒死蜱抗性灰飞虱种群中也还需要证实。
2 灰飞虱对吡虫啉的抗性分子机制吡虫啉 (imidacloprid,图式 2) 是一种硝基亚甲基类内吸性杀虫剂,属于新烟碱类[30],作用于昆虫乙酰胆碱酯酶受体,目前节肢动物杀虫剂抗性数据库 (arthropod pesticide resistance database,APRD) 中共包含超过330种昆虫对吡虫啉的抗性事件,其中部分涉及灰飞虱[31]。现有研究表明,灰飞虱对吡虫啉的抗性分子机制主要涉及P450和ABC转运蛋白基因表达上调。
|
图式2 吡虫啉 Scheme2 imidacloprid |
2.1 由P450基因介导的对吡虫啉的抗性
Elzaki等[18]通过研究P450基因,发现其CYP4C71v2、CYP4C72、CYP6AY3v2和CYP353D1v2基因在灰飞虱抗性品系Imid-R中表达量上调 (分别达1.67、7.96、8.94和1.82倍),但用吡虫啉处理不同抗、感品系后,仅CYP353D1v2基因表达量显著上调 (2.89~6.75倍),并且当用吡虫啉二次处理Sus敏感品系、Chlor-R抗性品系、Delt-R抗性品系和田间抗性品系时,其基因表达量分别进一步上调至9.5、5.91、3.76和16.2倍。经分析,针对不同品系灰飞虱试虫,吡虫啉处理次数的增加均与CYP353D1v2基因表达量增加呈线性关系。RNAi试验表明,CYP353D1v2基因表达量下调能导致灰飞虱对吡虫啉敏感性增强[18]。采用杆状病毒表达系统表达CYP353D1v2和CYP6AY3v2的重组蛋白并进行代谢试验,发现CYP353D1v2和CYP6AY3v2蛋白能将吡虫啉氧化为5-羟基-吡虫啉,CYP353D1v2蛋白对对硝基苯甲醚、乙氧基香豆素和乙氧基异吩唑3种传统探针的代谢活性分别为32.70、0.317和1.22 pmol/(min·pmol),表明对硝基苯甲醚是检测灰飞虱对吡虫啉代谢抗性的潜在探针,而CYP353D1v2基因成为潜在的吡虫啉抗性分子检测标志物[32]。Wang等通过构建过表达的CYP6AY3v2果蝇品系,监测发现其表达水平达到62.82倍,生物测定结果显示其对吡虫啉的抗性显著增加,证实CYP6AY3v2基因的过表达介导了灰飞虱对吡虫啉抗性的形成[33]。
2.2 由ABC转运蛋白基因介导的对吡虫啉的抗性Sun等[24]通过对ABC转运蛋白的研究,发现其LsABCB2、LsABCC4、LsABCD1、LsABCG2、LsABCG6、LsABCG8、LsABCG10、LsABCG11、LsABCH4、LsABCH5和LsABCH6基因在江苏省建湖灰飞虱抗性品系JH-imi中呈过表达;同时,对其进行的增效试验显示,维拉帕米可以降低吡虫啉的致死中浓度,增效比达1.52,初步确认ABC转运蛋白可能参与了灰飞虱对吡虫啉抗性的形成,但ABC转运蛋白具体是如何将吡虫啉转运排除至昆虫体外的还需进一步研究。
3 灰飞虱对溴氰菊酯的抗性分子机制溴氰菊酯 (deltamethrin,图式 3) 是Elliott于1974年在研究天然除虫菊酯化学结构的基础上合成的一种含有α-氰基的拟除虫菊酯类仿生杀虫剂,杀虫谱广,具有触杀和胃毒作用,靶标位点为钠离子通道,可干扰钠离子通道的门控动力学,在膜去极化期间减缓失活,延长钠离子电流,引起重复后放及阻断神经传导,从而导致害虫死亡[34]。现有研究表明,灰飞虱对溴氰菊酯的抗性分子机制也主要涉及P450和ABC转运蛋白基因表达的上调。
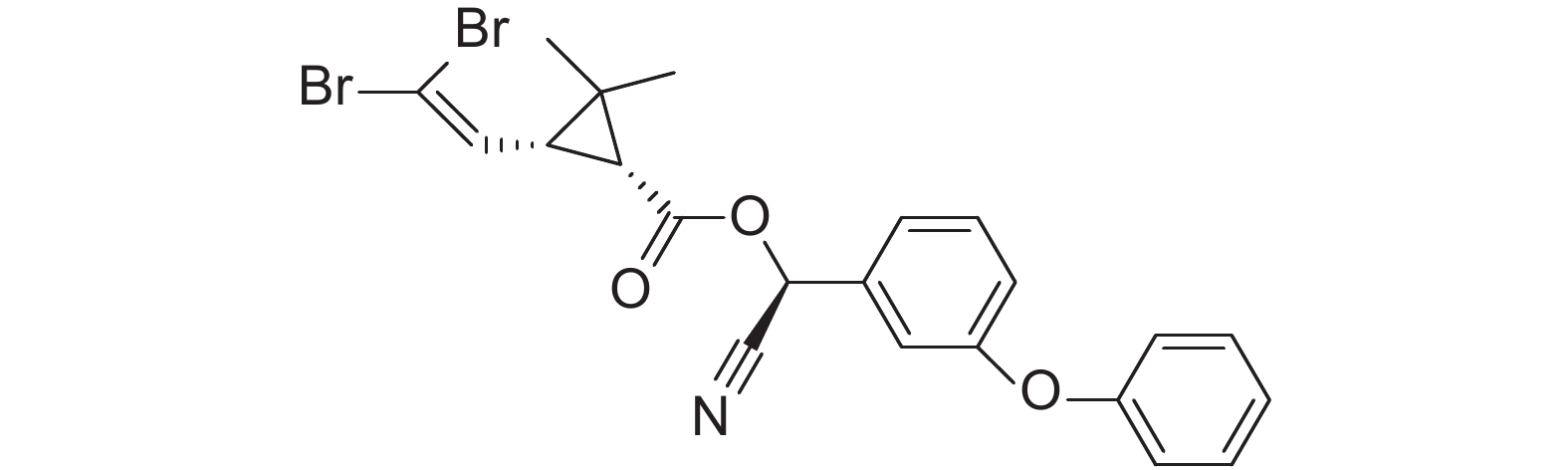
|
图式3 溴氰菊酯 Scheme3 deltamethrin |
3.1 由P450基因介导的对溴氰菊酯的抗性
Xu等[11]利用实时荧光定量PCR (quantitative real-time PCR, qPCR) 技术筛选了P450、羧酸酯酶、磷酸酯酶和谷光甘肽-S-转移酶基因,发现CYP439A1v3、CYP6AY3v2、CYP314A1v2、CYP6FU1、CYP353D1v2和LSCE12 在高达1 072倍抗性的江苏省建湖灰飞虱高抗品系JH-del中呈过表达,其中CYP6AY3v2 (24.0倍)、CYP6FU1 (16.0倍) 和LSCE12 (11.1倍) 的表达量上调尤为显著。张万方[35]通过喂食法干扰研究,发现干扰单个溴氰菊酯抗性相关解毒酶基因并不能提高灰飞虱对溴氰菊酯的敏感性,但同时干扰多个相关解毒酶基因则能明显提高试虫对药剂的敏感性。Elzaki等[36]利用昆虫杆状病毒表达系统,以Sf9细胞为宿主细胞系,体外表达了溴氰菊酯抗性解毒酶基因CYP6AY3v2和CYP6FU1,以及果蝇的NADPH-细胞色素P450还原酶 (cytochrome P450 reductase, CPR) 基因CYP6AY3v2和CYP6FU1,均可将溴氰菊酯氧化代谢为无毒的4-羟基溴氰菊酯,表明CYP6AY3v2和CYP6FU1参与了灰飞虱对溴氰菊酯抗性的形成。在分析JH-del品系中CYP6FU1基因表达上调的原因时,发现此基因的5’ 侧翼序列中的d2、d3、M2和Inr 1这4个突变位点的联合作用导致了CYP6FU1基因表达的上调,表明多个顺式作用元件上调CYP6FU1基因的表达介导了江苏省建湖灰飞虱JH-del高抗品系对溴氰菊酯抗性的形成[37]。除此之外,CYP439A1v3、CYP6AY3v2、CYP314A1v2、CYP353D1v2和LSCE12基因表达的上调是否存在相似的作用机制,是否同样介导了灰飞虱对溴氰菊酯抗性的形成还需进一步研究。
3.2 由ABC转运蛋白基因介导的对溴氰菊酯的抗性Sun等[24]的研究证实,JH-del品系中有13个过表达的ABC转运蛋白基因也参与了对溴氰菊酯抗性的形成,其中包括LsABCA1、LsABCB2、LsABCC4、LsABCD1、LsABCF1、LsABCG1、LsABCG2、LsABCG3、LsABCG6、LsABCG7、LsABCG8、LsABCG10及LsABCG11,其维拉帕米增效试验增效比为2.24。但上述基因在抗性形成中的具体功能仍需进一步研究确定。
4 灰飞虱对噻嗪酮的抗性分子机制噻嗪酮 (buprofezin,图式 4) 是一种可抑制昆虫表皮几丁质合成的生长调节剂,通过影响昆虫外骨骼的几丁质蛋白质结构而干扰其蜕皮,导致昆虫脱水死亡,具有对目标害虫活性高和对非靶标生物安全等优点,已被用于防治稻飞虱等农业害虫[3]。中国于20世纪80年代开始将噻嗪酮用于稻田飞虱的防治,自2005年稻田主要害虫褐飞虱对吡虫啉产生高水平抗性之后,噻嗪酮在褐飞虱防治上的用量开始大幅度增加,自2004年稻田次要害虫灰飞虱爆发为害后,噻嗪酮也被广泛用于防治灰飞虱[38]。下面拟分别阐述由CYP6CW1和CPR基因介导的灰飞虱对噻嗪酮的抗性分子机制。
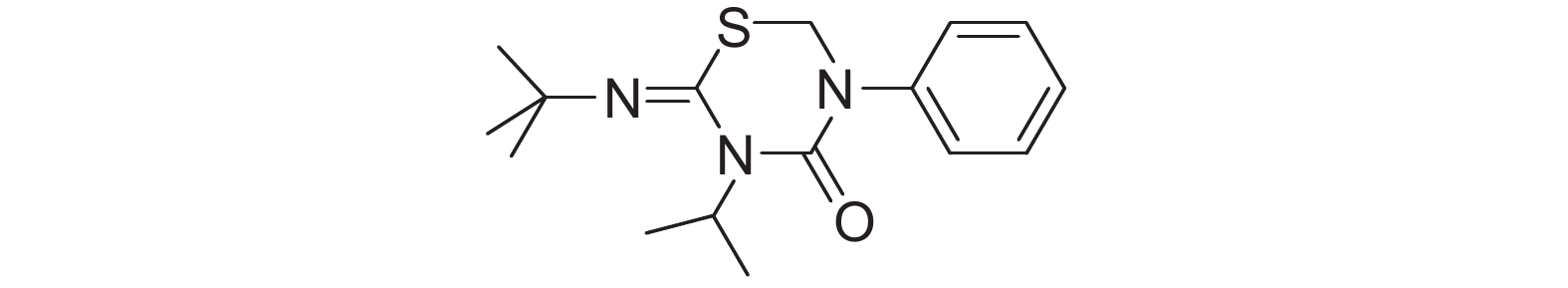
|
图式4 噻嗪酮 Scheme4 buprofezin |
4.1 由CYP6CW1基因介导的对噻嗪酮的抗性
田间监测和室内抗性筛选均发现了灰飞虱对噻嗪酮的高水平抗性[13]。Zhang等采用噻嗪酮对云南省楚雄灰飞虱敏感品系 (YN) 进行室内32代筛选,获得YN-BPF抗性品系,使用实时荧光定量PCR技术分析抗性及敏感品系中38条P450基因时发现,其CYP6CW1基因在抗性品系YN-BPF中呈过量表达 (22.78倍);RNAi试验表明,CYP6CW1基因表达量的下降能导致灰飞虱对噻嗪酮的敏感性升高[39]。但有关CYP6CW1基因表达调控的形成机制及基因表达产物代谢杀虫剂的功能等还需进一步研究证实[13]。
4.2 由CPR基因介导的对噻嗪酮的抗性P450氧化代谢反应的发生需要CPR作为电子供体,以实现烟酰胺腺嘌呤二核苷酸磷酸将电子传递到核心酶的过程。由于CPR基因与P450基因的相互作用,使得昆虫的CPR基因成为了P450基因介导抗药性的重要组成部分,因此可将CPR基因作为杀虫剂增效剂研发的新靶标。
Zhang等[40]对比了云南灰飞虱抗性品系YN-BPF和敏感品系YN中的CPR基因序列,未发现突变,并且在抗性品系YN-BPF和敏感品系YN中其表达量也没有明显差异。通过喂食法干扰CPR基因,检测不同浓度噻嗪酮对抗、感品系灰飞虱的活性,发现YN-BPF品系中经dsLsCPR干扰后成虫死亡率显著升高,而YN品系中成虫死亡率没有明显变化,表明CPR基因表达量下降可显著增强灰飞虱对噻嗪酮的敏感性。
作为电子供体,CPR基因和P450基因的互作可促进昆虫对甾体化合物和杀虫剂的代谢,而抗性品系中P450等位基因的变异可增加其与CPR基因互作的频率,从而影响害虫对杀虫剂的代谢;若抗性品系P450基因中存在多态位点,则CPR基因表达量下降可能对抗性的发展影响更大。此外,CPR基因也可与血红素加氧酶和细胞色素b5互作,同时其还参与了表皮碳氢化合物的合成,可提高杀虫剂在昆虫表皮中的穿透作用。
总之,虽然CPR基因并未直接参与灰飞虱对噻嗪酮抗性的形成,但其参与了CYP6CW1基因的代谢过程。然而,有关CPR基因在CYP6CW1基因介导灰飞虱对噻嗪酮抗性中的解毒调控路径及功能还需进一步研究。
5 灰飞虱对乙虫腈和氟虫腈的抗性分子机制中国于20世纪90年代中期引进氟虫腈 (fipronil,图式 5A),其属于苯基吡唑类杀虫剂,分子靶标为离子型γ-氨基丁酸 (GABA) 受体,是GABA的非竞争性拮抗剂,通过抑制GABA诱导的氯离子进入神经细胞,引起昆虫神经系统过度兴奋而导致死亡[41]。其在水稻、蔬菜等作物上均有登记,应用广泛,对灰飞虱具有活性高、持效期长等特点[42]。乙虫腈 (ethiprole,图式 5B) 属于第二代作用于GABA受体的苯基吡唑类杀虫剂,其在低用量下对刺吸式害虫更有效,已于2012年在中国取得正式登记。下面拟分别阐述由P450基因、GABA及谷氨酸门控氯离子通道 (glutamate gated chloride channel,GluCl) 基因突变介导的灰飞虱对乙虫腈和氟虫腈的抗性分子机制。
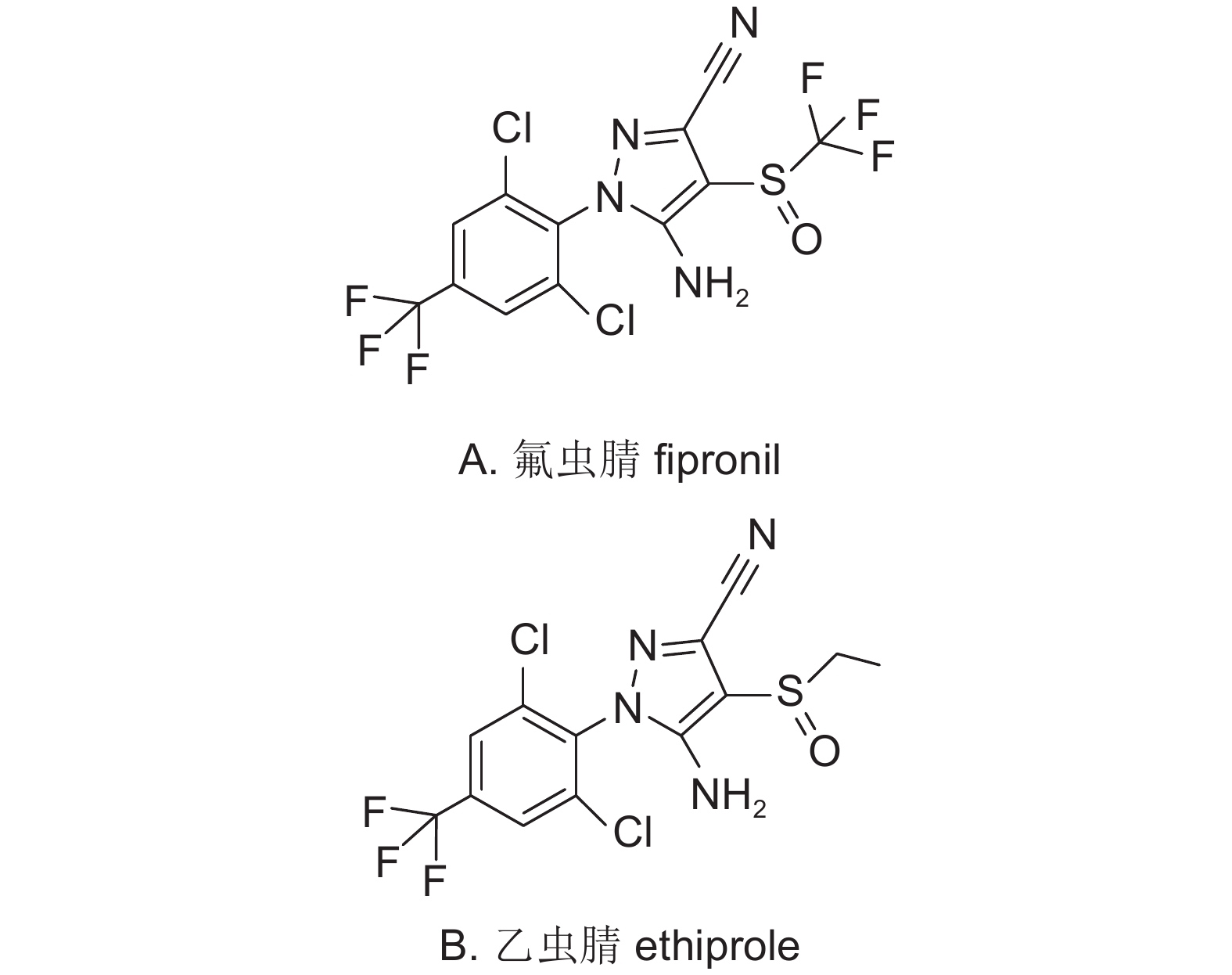
|
图式5 |
5.1 由P450基因介导的对乙虫腈抗性
2015年,Elzaki等[14]发现山东省济宁灰飞虱田间种群对乙虫腈的抗性已达107倍,经过8代室内筛选后其抗性增长到180倍,且发现灰飞虱经过少于10代的乙虫腈室内抗性筛选即可迅速发展至高水平抗性。对比经乙虫腈室内筛选得到的山东省济宁灰飞虱抗性品系Ethi-R和敏感品系Sus中71个转录组的P450基因,发现Ethi-R品系中CYP4DE1和CYP6CW3v2基因呈显著过表达,喂食dsRNA干扰这两个基因,发现CYP4DE1和CYP6CW3v2表达量的下降可导致灰飞虱对乙虫腈的敏感性上升[14]。
5.2 由GABA A2’N突变介导的对氟虫腈抗性王耀洲等[43]在室内用氟虫腈筛选江苏省建湖灰飞虱种群,得到21.1倍的抗性品系,对比敏感品系发现,细胞色素P450酶活力升高与试虫对氟虫腈的抗性相关。然而,Wei等[12]用氟虫腈对江苏省无锡灰飞虱种群室内连续筛选123代,得到63.6倍的抗性品系LsFR,却发现抗、感品系中解毒酶活力并没有显著差异。有关灰飞虱对氟虫腈抗性分子机制的研究目前多集中在对靶标位点的研究上。Nakao等[44]从灰飞虱个体中克隆得到一个419 bp片段的GABA受体抗狄氏剂 (resistance to dieldrin,RDL) 亚基基因,将灰飞虱GABA的RDL cDNA插入到pAc5.1-lac-Hygro载体中,转染至果蝇的mel-2细胞中进行表达,通过全细胞膜片钳记录发现,氟虫腈、艾氏剂和SR9553均可以抑制RDL GABA诱导电流。对比2009年在日本福冈发现的氟虫腈抗性及敏感品系灰飞虱中Rdl基因序列,发现氟虫腈抗性杂合子中存在A2’N突变[45]。将野生敏感型灰飞虱和A2’N突变个体的Rdl基因共同或单独转染至果蝇S2细胞中,通过膜电位测定,显示氟虫腈对单独转染进入S2细胞的野生型和A2’N突变个体Rdl基因同聚体的EC50值分别为0.72和11.0 μmol/L,而对共转染组的EC50值为1.4 μmol/L,表明野生型和A2’N突变个体RDL GABA基因共表达可恢复昆虫GABA的敏感性,并且氟虫腈对野生敏感型灰飞虱GABA的IC50值为14 nmol/L[45]。表明A2’N突变消除了氟虫腈对Rdl基因的抑制活性。
江苏省无锡灰飞虱种群经过氟虫腈室内连续筛选123代,得到63.6倍的抗性品系LsFR,同时产生了与氟虫腈抗性相关的A2’N突变,且发现抗性品系LsFR中存在高频率的A2’N突变 (23/35),而敏感品系LsFS中未检测到该突变[12]。利用注射法对灰飞虱进行RNA干扰,发现其抗、感品系中Rdl基因表达量均显著降低,同时对氟虫腈的敏感性增强[46]。上述结果显示,A2’N突变介导了灰飞虱对氟虫腈的抗性。利用快速聚合酶链反应-限制性片段长度多态性技术 (PCR-RFLP) 检测日本群马县4个不同区域的114个灰飞虱个体,发现80%个体的Rdl基因存在A2’N突变[47]。利用等位基因特异性PCR扩增技术,检测江苏省无锡灰飞虱LsFR、LsFS品系和江苏省海门田间灰飞虱种群,发现LsFS和海门田间种群的个体均是敏感纯合子,而LsFR个体中有91.2%为杂合子,63%为抗性纯合子,仅2.5%为敏感纯合子,证实A2’N突变在灰飞虱对氟虫腈的抗性中普遍存在。之后也有新的突变R305Q及R305W在RDL GABA受体中的M3-M4环被发现[48],但其在灰飞虱对氟虫腈抗性中的功能尚有待证实。
5.3 由GluCl P278S突变介导的对氟虫腈抗性谷氨酸门控氯离子通道 (GluCl) 基因是氟虫腈的另一靶标位点,在灰飞虱中共存在6个GluCl变体 (LsGluCl-AS、LsGluCl-BS、LsGluCl-CS、LsGluCl-AL、LsGluCl-BL及LsGluCl-CL)。Wu等将LsGluCl-AS和LsGluCl-AL基因的cRNA注射至非洲爪蟾Xenopus laevis的卵母细胞中,通过测定谷氨酸浓度-响应关系,证实了GluCl是氟虫腈的重要靶标[49]。研究人员对筛选所得江苏省无锡氟虫腈抗性及敏感品系灰飞虱的对比研究发现,75个位点的碱基突变可以导致灰飞虱的氨基酸发生替换,其中P278S氨基酸替换虽然在抗性品系中出现的频率仅为十分之一,但与已报道的第二跨膜区中的P299S点突变[50]相比,都是由非极性、疏水型的脯氨酸转换成了极性、中性的丝氨酸,表明该突变可能导致了氟虫腈与谷氨酸门控氯离子通道受体之间亲和性的改变[51]。因此,推测P278S可能是潜在的导致灰飞虱对氟虫腈产生抗性的突变位点,但该位点在氟虫腈抗性形成中的功能还需进一步研究证实。
6 现存问题与展望自2004年江苏省灰飞虱在稻田暴发为害,造成巨大经济损失之后,其抗药性问题开始被广泛关注和研究;自2010年起,灰飞虱抗药性的分子机制开始逐渐被报道 (表1)[52]。目前有关灰飞虱对不同种类杀虫剂代谢抗性分子机制的研究大多基于对抗性品系中解毒酶基因表达量上调的筛选,首先初步确定涉及抗性的解毒酶候选基因,再通过RNAi试验和昆虫杆状病毒表达系统体外表达试验证实这些候选基因在抗性中的功能。然而,RNAi的脱靶效应容易使基因功能不明确,导致表型缺失,同时体外表达的抗性非解毒酶相关基因也可代谢杀虫剂,以及杀虫剂本身可以诱导解毒酶基因表达量上调等问题,成为功能验证中暂时无法避免的弊端,因此这些候选基因在抗性形成中的功能还需要利用新技术进一步研究证实。目前,CRISPR/Cas9基因编辑技术等新技术的应用,使基因定点编辑变得更加方便与快捷,可以将灰飞虱中过表达的解毒酶基因进行精确切割,分别证实其在抗性中的作用[53]。
|
|
表 1 与灰飞虱对几种杀虫剂抗性相关的过表达基因及点突变 Table 1 Overexpressed genes and point mutations associated with resistance to several insecticides in L. striatellus |
代谢抗性是昆虫抗性形成中的重要机制。目前已证实灰飞虱对毒死蜱、吡虫啉、溴氰菊酯、噻嗪酮和乙虫腈的抗性均由其解毒酶活力改变引起,其中P450基因表达量上调在灰飞虱对这些杀虫剂的抗性中起到了关键作用[54]。解毒酶活力升高体现在基因组层面上,可能是由于基因拷贝数增加或者基因表达上调,其中解毒酶基因表达上调是较为普遍的机制,由其介导的抗性可能由于基因重复、基因扩增或位点氨基酸替换引起[4]。但目前关于灰飞虱中细胞色素P450基因表达上升的调控机制尚未见报道。其中,核受体是一类依赖配体激活的转录因子,起转录开关的作用,可以调控P450基因的转录过程[55],因此可以利用转录组测序方法鉴定出这些响应杀虫剂的转录调控因子,为解毒酶基因介导杀虫剂抗性的调控机制提供分子基础,同时解析出杀虫剂的代谢通路,探明灰飞虱对上述不同种类杀虫剂产生抗性的分子路径。
有关杀虫剂靶标基因的鉴定对于明确靶标基因在抗性形成中的功能具有重要作用,应结合生物信息学分析和模式昆虫的基因组,鉴定其靶标及与靶标互作的调控蛋白。调控蛋白的鉴定为深入探寻靶标抗性的形成提供了新的研究点,同时可为新杀虫剂的研究开发提供新靶标。因此,灰飞虱中已报道的乙酰胆碱酯酶、GABA受体和GluCl均需要进一步鉴定相关的调控蛋白,探明靶标抗性形成的具体调控路径[56]。靶标基因突变介导昆虫靶标抗性,降低杀虫剂与靶标结合的能力,其对于研究基因结构与生物功能的关系具有重要价值。笔者认为,将CRISPR/Cas9基因编辑技术引入灰飞虱抗性研究中,能精确编辑、改变靶标基因结构,准确探明毒死蜱和氟虫腈靶基因突变在抗性中的作用。而灰飞虱对吡虫啉、溴氰菊酯及噻嗪酮的抗性,由于尚未鉴定出自然产生的靶标突变,因此可以考虑通过人工诱变的方法,在控制相似遗传背景的条件下诱导靶基因产生突变,从而精准探明单个基因突变与抗性的关系,确定田间自然发生的突变,有利于开发新型杀虫剂并评估其交互抗性的形成机制。
灰飞虱的交互抗性可能在同类型或不同类型杀虫剂之间产生,推测其形成机制是由于灰飞虱中过表达的抗性相关基因重叠所致。但是,目前对灰飞虱抗性分子机制的研究多数集中在一类或单个基因上,而害虫抗药性的形成是复杂的遗传学现象,除解毒基因表达的上调和靶标突变外,还涉及新的基因表达。比如:Rostant等发现,转座子通过插入基因的5’ 或3’ 端序列、切除基因和改变基因转录导致基因扩增3种方式介导了昆虫对杀虫剂的抗性[57];热激蛋白或G蛋白偶联受体基因表达量上调介导了昆虫对菊酯类杀虫剂的抗性[58-59]。目前新一代基因测序技术已使得我们能够快速获得海量数据,因此利用灰飞虱抗性及敏感品系,结合新一代转录组测序技术,研究灰飞虱对上述农药的抗性所涉及到的基因变化新信息,揭示多重抗性新的分子机制,可为灰飞虱的防治提供新策略[60]。未来针对抗药性分子机制的研究将不再仅局限于基因突变或转录水平,更应深入到蛋白组学水平上进行探讨。
抗药性的形成是一个遗传学现象,灰飞虱对杀虫剂的抗性分子机制涉及到不同亚家族的解毒酶基因及多个靶基因的突变,同时也与杀虫剂的施用技术有关[17],但目前控制遗传基因还有一定的难度,化学农药的施用在相当长的时期内仍将是控制灰飞虱的主要手段,因此需要及早开发出配套的高效田间施药技术,达到杀虫剂减施、增效的目的。田间应综合使用各种科学、高效的施药技术,降低农药对害虫的选择压,同时结合生物信息学、生物进化等多学科的交叉理论和方法,深入揭示杀虫剂抗性形成、演化和管理机制,指导杀虫剂的合理施用及新型杀虫剂的开发,以延长杀虫剂的使用寿命。
| [1] |
XU L, WU M, HAN Z J. Biochemical and molecular characterisation and cross-resistance in field and laboratory chlorpyrifos-resistant strains of Laodelphax striatellus (Hemiptera: Delphacidae) from eastern China
[J]. Pest Manag Sci, 2014, 70(7): 1118-1129. DOI:10.1002/ps.2014.70.issue-7 |
| [2] |
王彦华, 吴长兴, 赵学平, 等. 灰飞虱对杀虫剂抗药性的研究进展[J]. 植物保护, 2010, 36(4): 29-35. WANG Y H, WU C X, ZHAO X P, et al. Advances in the research of insecticide resistance of the small brown planthopper, Laodelphax striatellus [J]. Plant Prot, 2010, 36(4): 29-35. |
| [3] |
毛旭连, 刘锦, 李许可, 等. 灰飞虱对噻嗪酮的抗性风险及机理[J]. 应用生态学报, 2016, 27(1): 255-262. MAO X L, LIU J, LI X K, et al. Resistance risk, cross-resistance and biochemical resistance mechanism of Laodelphax striatellus to buprofezin [J]. Chin J Appl Ecol, 2016, 27(1): 255-262. |
| [4] |
徐鹿, 赵春青, 徐德进, 等. 亚致死剂量氟啶虫胺腈对灰飞虱细胞色素P450的影响[J]. 植物保护学报, 2017, 44(4): 679-686. XU L, ZHAO C Q, XU D J, et al. Effects of sublethal sulfoxaflor on cytochrome P450 of the small brown planthopper, Laodelphax striatellus [J]. J Plant Prot, 2017, 44(4): 679-686. |
| [5] |
WANG L H, SHAN D, ZHANG Y L, et al. Effects of high temperature on life history traits and heat shock protein expression in chlorpyrifos-resistant Laodelphax striatella
[J]. Pestic Biochem Physiol, 2017, 136: 64-69. DOI:10.1016/j.pestbp.2016.08.002 |
| [6] |
WANG L H, ZHANG Y L, HAN Z J, et al. Cross-resistance and possible mechanisms of chlorpyrifos resistance in Laodelphax striatellus (Fallén)
[J]. Pest Manag Sci, 2010, 66(10): 1096-1100. DOI:10.1002/ps.1984 |
| [7] |
班兰凤, 高聪芬, 郭昊岩. 灰飞虱对几种杀虫剂的抗性[J]. 植物保护, 2015, 41(1): 158-162. BAN L F, GAO C F, GUO H Y. Resistance to insecticides in the small brown planthopper, Laodelphax striatellus (Homoptera: Delphacidae) [J]. Plant Prot, 2015, 41(1): 158-162. |
| [8] |
马崇勇, 高聪芬, 韦华杰, 等. 灰飞虱对几类杀虫剂的抗性和敏感性[J]. 中国水稻科学, 2007, 21(5): 555-558. MA C Y, GAO C F, WEI H J, et al. Resistance and susceptibility to several groups of insecticides in the small brown planthopper, Laodelphax striatellus (Homoptera: Delphacidae) [J]. Chin J Rice Sci, 2007, 21(5): 555-558. |
| [9] |
刘淑华, 施必富, 葛赏书, 等. 不同地区灰飞虱对吡虫啉的抗性[J]. 植物保护, 2015, 41(2): 181-186. LIU S H, SHI B F, GE S S, et al. Imidacloprid resistance in Laodelphax striatellus (Fallén) populations from different areas in China [J]. Plant Prot, 2015, 41(2): 181-186. |
| [10] |
JEONG I H, LEE S W, CHOI B R, et al. Monitoring and evaluation of differential insecticide resistance profiles in the immigrant vs. indigenous populations of the small brown planthopper (Laodelphax striatellus Fallén) in Korea
[J]. J Asia-Pac Entomol, 2016, 19(1): 247-252. DOI:10.1016/j.aspen.2015.12.002 |
| [11] |
XU L, WU M, HAN Z J. Overexpression of multiple detoxification genes in deltamethrin resistant Laodelphax striatellus (Hemiptera: Delphacidae) in China
[J]. PLoS One, 2013, 8(11): e79443. DOI:10.1371/journal.pone.0079443 |
| [12] |
WEI Q, MU X C, WU S F, et al. Cross-resistance to three phenylpyrazole insecticides and A2’N mutation detection of GABA receptor subunit in fipronil-resistant Laodelphax striatellus (Hemiptera: Delphacidae)
[J]. Pest Manag Sci, 2017, 79(8): 1618-1624. DOI:10.1002/ps.4498 |
| [13] |
ZHANG Y L, GUO H F, YANG Q, et al. Overexpression of a P450 gene (CYP6CW1) in buprofezin-resistant Laodelphax striatellus (Fallén)
[J]. Pestic Biochem Physiol, 2012, 104(3): 277-282. DOI:10.1016/j.pestbp.2012.10.002 |
| [14] |
ELZAKI M E A, ZHANG W F, HAN Z J, et al. Cytochrome P450 CYP4DE1 and CYP6CW3v2 contribute to ethiprole resistance in Laodelphax striatellus (Fallén)
[J]. Insect Mol Biol, 2015, 24(3): 368-376. DOI:10.1111/imb.12164 |
| [15] |
赵春青, 韩召军, 唐涛. 杀虫剂 fluralaner 及其衍生物的生物效应和毒理学研究进展[J]. 农药学学报, 2015, 17(3): 251-256. ZHAO C Q, HAN Z J, TANG T. Research progress on bioeffect and toxicology of insecticide fluralaner and its derivatives[J]. Chin J Pestic Sci, 2015, 17(3): 251-256. |
| [16] |
PUINEAN A M, FOSTER S P, OLIPHANT L, et al. Amplification of a cytochrome P450 gene is associated with resistance to neonicotinoid insecticides in the aphid Myzus persicae
[J]. PLoS Genet, 2010, 6(6): e1000999. DOI:10.1371/journal.pgen.1000999 |
| [17] |
顾中言, 张先进. 合理使用农药 延缓害虫抗药性[J]. 江苏农业科学, 1988(2): 26-27. GU Z Y, ZHANG X J. Rational use of pesticide and delay insect resistance[J]. Jiangsu Agric Sci, 1988(2): 26-27. |
| [18] |
ELZAKI M E A, ZHANG W F, FENG A, et al. Constitutive overexpression of cytochrome P450 associated with imidacloprid resistance in Laodelphax striatellus (Fallén)
[J]. Pest Manag Sci, 2016, 72(5): 1051-1058. DOI:10.1002/ps.2016.72.issue-5 |
| [19] |
PERRY T, BATTERHAM P, DABORN P J. The biology of insecticidal activity and resistance[J]. Insect Biochem Mol Biol, 2011, 41(7): 411-422. DOI:10.1016/j.ibmb.2011.03.003 |
| [20] |
AFZAL M B S, IJAZ M, FAROOQ Z, et al. Genetics and preliminary mechanism of chlorpyrifos resistance in Phenacoccus solenopsis Tinsley (Homoptera: Pseudococcidae)
[J]. Pestic Biochem Physiol, 2015, 119: 42-47. DOI:10.1016/j.pestbp.2015.02.008 |
| [21] |
ZHANG Y L, WANG L H, GUO H F, et al. A transcriptome-based screen of carboxylesterase-like genes that are involved in chlorpyrifos resistance in Laodelphax striatellus (Fallén)
[J]. Pestic Biochem Physiol, 2012, 104(3): 224-228. DOI:10.1016/j.pestbp.2012.08.006 |
| [22] |
ZHANG Y L, LI S, XU L, et al. Overexpression of carboxylesterase-1 and mutation (F439H) of acetylcholinesterase-1 are associated with chlorpyrifos resistance in Laodelphax striatellus
[J]. Pestic Biochem Physiol, 2013, 106(1-2): 8-13. DOI:10.1016/j.pestbp.2013.03.002 |
| [23] |
王芮, 张浩淼, 邓蕾, 等. 灰飞虱羧酸酯酶 LsCarE1 介导杀虫剂抗性[J]. 昆虫学报, 2017, 60(9): 1006-1012. WANG R, ZHANG H M, DENG L, et al. Carboxylesterase LsCarE1 mediates insecticide resistance in Laodelphax striatellus (Hemiptera: Delphacidae) [J]. Acta Entomologica Sinica, 2017, 60(9): 1006-1012. |
| [24] |
SUN H, PU J, CHEN F, et al. Multiple ATP-binding cassette transporters are involved in insecticide resistance in the small brown planthopper, Laodelphax striatellus
[J]. Insect Mol Biol, 2017, 26(3): 343-355. DOI:10.1111/imb.2017.26.issue-3 |
| [25] |
ALON M, ALON F, NAUEN R, et al. Organophosphates’ resistance in the B-biotype of Bemisia tabaci (Hemiptera: Aleyrodidae) is associated with a point mutation in an ace1-type acetylcholinesterase and overexpression of carboxylesterase
[J]. Insect Biochem Mol Biol, 2008, 38(10): 940-949. DOI:10.1016/j.ibmb.2008.07.007 |
| [26] |
OH S H, KOZAKI T, MIZUNO H, et al. Expression of Ace-paralogous acetylcholinesterase of Culex tritaeniorhynchus with an amino acid substitution conferring insecticide insensitivity in baculovirus-insect cell system
[J]. Pestic Biochem Physiol, 2006, 85(1): 46-51. DOI:10.1016/j.pestbp.2005.10.003 |
| [27] |
CARVALHO R, YANG Y H, FIELD L M, et al. Chlorpyrifos resistance is associated with mutation and amplification of the acetylcholinesterase-1 gene in the tomato red spider mite, Tetranychus evansi
[J]. Pestic Biochem Physiol, 2012, 104(2): 143-149. DOI:10.1016/j.pestbp.2012.05.009 |
| [28] |
HE M, AI Z X, JIANG Z Q, et al. Biochemistry and molecular characterisation of chlorpyrifos resistance in field strains of the white-backed planthopper Sogatella furcifera (Hemiptera: Delphacidae)
[J]. Aust Entomol, 2015, 54(4): 376-384. DOI:10.1111/aen.12140 |
| [29] |
ZHANG Y X, YANG B, LI J, et al. Point mutations in acetylcholinesterase 1 associated with chlorpyrifos resistance in the brown planthopper, Nilaparvata lugens Stål
[J]. Insect Mol Biol, 2017, 26(4): 453-460. DOI:10.1111/imb.2017.26.issue-4 |
| [30] |
ZHANG Y X, YANG Y X, SUN H H, et al. Metabolic imidacloprid resistance in the brown planthopper, Nilaparvata lugens, relies on multiple P450 enzymes
[J]. Insect Biochem Mol Biol, 2016, 79: 50-56. DOI:10.1016/j.ibmb.2016.10.009 |
| [31] |
BASS C, DENHOLM I, WILLIAMSON M S, et al. The global status of insect resistance to neonicotinoid insecticides[J]. Pestic Biochem Physiol, 2015, 121: 78-87. DOI:10.1016/j.pestbp.2015.04.004 |
| [32] |
ELZAKI M E A, MIAH M A, WU M, et al. Imidacloprid is degraded by CYP353D1v2, a cytochrome P450 overexpressed in a resistant strain of Laodelphax striatellus
[J]. Pest Manag Sci, 2017, 73(7): 1358-1363. DOI:10.1002/ps.2017.73.issue-7 |
| [33] |
WANG R, ZHU Y, DENG L, et al. Imidacloprid is hydroxylated by Laodelphax striatellus CYP6AY3v2
[J]. Insect Mol Biol, 2017, 26(5): 543-551. DOI:10.1111/imb.2017.26.issue-5 |
| [34] |
徐鹿. 灰飞虱对毒死蜱和溴氰菊酯的抗性及其机理的研究[D]. 南京: 南京农业大学, 2013: 8-10. XU L. Studies on chlorpyrifos and deltamethrin resistance in small brown planthopper, Laodelphax striatellus (Fallén) and possible mechanisms[D]. Nanjing: Nanjing Agricultural University, 2013: 8-10. |
| [35] |
张万方. 灰飞虱对溴氰菊酯抗性相关解毒酶基因的功能分析[D]. 南京: 南京农业大学, 2015: 15-39. ZHANG W F. Functional characterization of detoxification genes related to deltamethrin resistance in small brown planthopper, Laodelphax striatellus (Fallén)[D]. Nanjing: Nanjing Agricultural University, 2015: 15-39. |
| [36] |
ELZAKI M E A, MIAH M A, PENG Y C, et al. Deltamethrin is metabolized by CYP6FU1, a cytochrome P450 associated with pyrethroid resistance in Laodelphax striatellus
[J]. Pest Manag Sci, 2017. DOI:10.1002/ps.4808 |
| [37] |
PU J, SUN H N, WANG J D, et al. Multiple cis-acting elements involved in up-regulation of a cytochrome P450 gene conferring resistance to deltamethrin in smal brown planthopper, Laodelphax striatellus (Fallén)
[J]. Insect Biochem Mol Biol, 2016, 78: 20-28. DOI:10.1016/j.ibmb.2016.08.008 |
| [38] |
张月亮. 灰飞虱对毒死蜱和噻嗪酮的抗性机制研究[D]. 南京: 南京农业大学, 2012: 45-46. ZHANG Y L. Studies on the resistance mechanism of Laodelphax striatellus (Fallén) to chlorpyrifos and buprofezin[D]. Nanjing: Nanjing Agricultural University, 2012: 45-46. |
| [39] |
ZHANG Y L, HAN Y C, LIU B S, et al. Resistance monitoring and cross-resistance role of CYP6CW1 between buprofezin and pymetrozine in field populations of Laodelphax striatellus (Fallén)
[J]. Sci Rep, 2017, 7: 14639. DOI:10.1038/s41598-017-15294-9 |
| [40] |
ZHANG Y L, WANG Y M, WANG L H, et al. Knockdown of NADPH-cytochrome P450 reductase results in reduced resistance to buprofezin in the small brown planthopper, Laodelphax striatellus (Fallén)
[J]. Pestic Biochem Physiol, 2016, 127: 21-27. DOI:10.1016/j.pestbp.2015.08.006 |
| [41] |
NARUSUYE K, NAKAO T, ABE R, et al. Molecular cloning of a GABA receptor subunit from Laodelphax striatella (Fallén) and patch clamp analysis of the homo-oligomeric receptors expressed in a Drosophila cell line
[J]. Insect Mol Biol, 2007, 16(6): 723-733. DOI:10.1111/j.1365-2583.2007.00766.x |
| [42] |
彭永强, 高聪芬, 马崇勇, 等. 灰飞虱对氟虫腈抗性风险评估、遗传分析及杀虫剂敏感性研究[J]. 中国水稻科学, 2009, 23(6): 645-652. PENG Y Q, GAO C F, MA C Y, et al. Risk assessment and genetic analysis of fipronil resistance and insecticide susceptibility in the small brown planthopper, Laodelphax striatellus (Homoptera: Delphacidae) [J]. Chin J Rice Sci, 2009, 23(6): 645-652. |
| [43] |
王耀洲, 韩召军. 灰飞虱对氟虫腈的抗性及其机制研究[J]. 南京农业大学学报, 2010, 33(4): 49-54. WANG Y Z, HAN Z J. Fipronil resistance in small brown planthopper Laodelphax striatellus (Fallén) and mechanisms [J]. J Nanjing Agric Univ, 2010, 33(4): 49-54. |
| [44] |
NAKAO T, KAWASE A, KINOSHITA A, et al. The A2’N mutation of the RDL γ-aminobutyric acid receptor conferring fipronil resistance in Laodelphax striatellus (Hemiptera: Delphacidae)
[J]. J Econ Entomol, 2011, 104(2): 646-652. DOI:10.1603/EC10391 |
| [45] |
NAKAO T. Mechanisms of resistance to insecticides targeting RDL GABA receptors in planthoppers[J]. NeuroToxicology, 2017, 60: 293-298. DOI:10.1016/j.neuro.2016.03.009 |
| [46] |
WEI Q, WU S F, NIU C D, et al. knockdown of the ionotropic γ-aminobutyric acid receptor (gabar) rdl gene decreases fipronil susceptibility of the small brown planthopper, Laodelphax striatellus (Hemiptera: Delphacidae)
[J]. Arch Insect Biochem Physiol, 2015, 88(4): 249-261. DOI:10.1002/arch.v88.4 |
| [47] |
OGURA Y, AIZAWA T, SHIMADA K. Control effect of fipronil on Laodelphax striatellus and distribution of fipronil resistant individuals in gunma prefecture
[J]. Annu Rep Kanto-Tosan Plant Prot Soc, 2015, 201562: 116-118. |
| [48] |
WEI Q, WU S F, GAO C F. Molecular characterization and expression pattern of three GABA receptor-like subunits in the small brown planthopper Laodelphax striatellus (Hemiptera: Delphacidae)
[J]. Pestic Biochem Physiol, 2017, 136: 34-40. DOI:10.1016/j.pestbp.2016.08.007 |
| [49] |
魏琪. 灰飞虱离子型 GABA 受体的基因克隆及功能研究[D]. 南京: 南京农业大学, 2015: 51-56. WEI Q. Cloning and functional analysis of ionotropic gaba receptors in small brown planthopper, Laodelphax striatellus (Hemiptera: Delphacidae)[D]. Nanjing: Nanjing Agricultural University, 2015: 51-56. |
| [50] |
WU S F, MU X C, DONG Y X, et al. Expression pattern and pharmacological characterisation of two novel alternative splice variants of the glutamate-gated chloride channel in the small brown planthopper Laodelphax striatellus
[J]. Pest Manag Sci, 2017, 73(3): 590-597. DOI:10.1002/ps.2017.73.issue-3 |
| [51] |
陈宇. 灰飞虱对氟虫腈的抗性机制研究[D]. 南京: 南京农业大学, 2012: 25-33. CHEN Y. Resistance mechanisms to fipronil in Laodelphax striatellus (Fallén)[D]. Nanjing: Nanjing Agricultural University, 2012: 25-33. |
| [52] |
张林林, 徐鹿, 韩召军. 田间灰飞虱抗药性相关细胞色素 P450 基因和酯酶基因的筛选[J]. 南京农业大学学报, 2010, 33(5): 29-34. ZHANG L L, XU L, HAN Z J. Screening of cytochrome P450 and esterase genes related to insecticide resistance in field population of Laodelphax striatellus (Homoptera: Delphacidae) [J]. J Nanjing Agric Univ, 2010, 33(5): 29-34. |
| [53] |
PENNISI E. The CRISPR craze[J]. Science, 2013, 341(6148): 833-836. DOI:10.1126/science.341.6148.833 |
| [54] |
邱星辉. 细胞色素 P450 介导的昆虫抗药性的分子机制[J]. 昆虫学报, 2014, 57(4): 477-482. QIU X H. Molecular mechanisms of insecticide resistance mediated by cytochrome P450s in insects[J]. Acta Entomologica Sinica, 2014, 57(4): 477-482. |
| [55] |
徐鹿, 赵春青, 徐德进, 等. 灰飞虱雌激素相关受体基因的克隆、序列分析及在氟啶虫胺腈胁迫下的表达模式[J]. 昆虫学报, 2017, 60(3): 264-273. XU L, ZHAO C Q, XU D J, et al. Molecular cloning and sequence analysis of the estrogen-related receptor (ERR) gene in the small brown planthopper, Laodelphax striatellus(Delphacidae: Hemiptera) and its expression profiles under the stress of sulfoxaflor [J]. Acta Entomologica Sinica, 2017, 60(3): 264-273. |
| [56] |
XU L, ZHAO C Q, XU D J, et al. RNAi suppression of nuclear receptor genes results in increased susceptibility to sulfoxaflor in brown planthopper, Nilaparvata lugens
[J]. J Asia-Pac Entomol, 2017, 20(2): 645-653. DOI:10.1016/j.aspen.2017.03.022 |
| [57] |
ROSTANT W G, WEDELL N, HOSKEN D J. Transposable elements and insecticide resistance[J]. Adv Genet, 2012, 78: 169-201. |
| [58] |
LI T, LIU L N, ZHANG L, et al. Role of G-protein-coupled receptor-related genes in insecticide resistance of the mosquito, Culex quinquefasciatus
[J]. Sci Rep, 2014, 4: 6474. |
| [59] |
ZHANG Y H, JIANG R X, WU H S, et al. Next-generation sequencing-based transcriptome analysis of Cryptolaemus montrouzieri under insecticide stress reveals resistance-relevant genes in ladybirds
[J]. Genomics, 2012, 100(1): 35-41. DOI:10.1016/j.ygeno.2012.05.002 |
| [60] |
ZHAO W, LU L X, YANG P C, et al. Organ-specific transcriptome response of the small brown planthopper toward rice stripe virus[J]. Insect Biochem Mol Biol, 2016, 70: 60-72. DOI:10.1016/j.ibmb.2015.11.009 |
 2018, Vol. 20
2018, Vol. 20


