2. 中国农业科学院 农业质量标准与检测技术研究所/农业部农产品质量安全重点实验室,北京 100081;
3. 北京农学院 食品科学与工程学院/农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206
2. Institute of Quality Standard and Testing Technology for Agro-Products of CAAS /Key Laboratory of Agro-Food Safety and Quality, Ministry of Agriculture, Beijing 100081, China;
3. Food Science and Engineering College/Beijing Key Laboratory of Detection and Control of Spoilage Organisms and Pesticide Residues in Agricultural Products, Beijing University of Agriculture, Beijing 102206, China
草莓灰霉病是草莓种植中的一种常见病害,多从花期开始发病,后向果实扩展,感病品种病果率可达30%甚至更高,严重影响草莓的产量和品质[1]。针对草莓灰霉病,通常在草莓开花坐果期采取施药方式进行防治,但由于草莓是陆续开花、结果,且同一果穗中各级序果成熟期也不同,导致成熟的草莓果实上也会沾染药剂,从而引起草莓农药残留超标。为了保证草莓食用安全性,有必要对农药在草莓中的残留和消解动态进行研究。
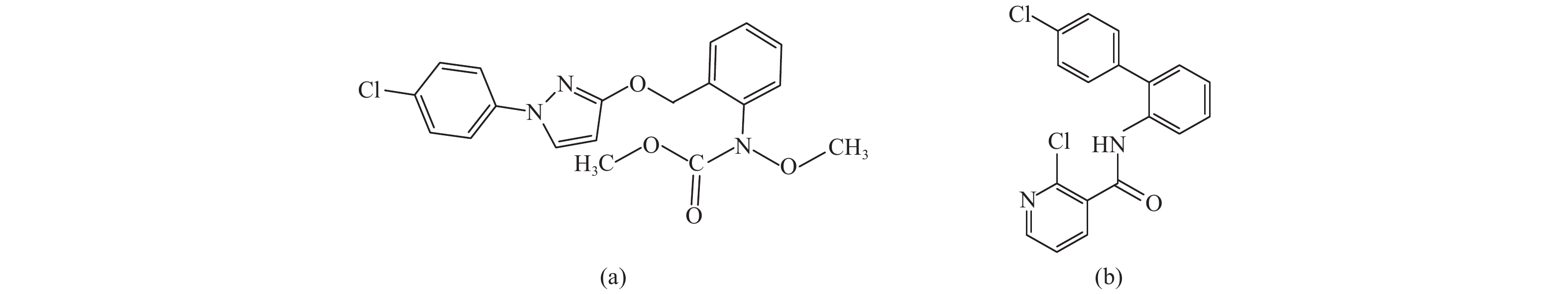
吡唑醚菌酯 (pyraclostrobin,见图式 1a) 是新型甲氧基丙烯酸酯类杀菌剂,广泛应用于多种作物的病害防治,不仅具有作用速度快、持效期长的特点,还具有改善作物生理机能、增强作物抗逆性、提高作物品质的作用[2];啶酰菌胺 (boscalid,见图式 1b) 是新型烟酰胺类杀菌剂,杀菌谱较广,对防治灰霉病、白粉病、根腐病、菌核病和各种腐烂病等非常有效[3]。Fernández-ortuo等[4]研究发现,将吡唑醚菌酯与啶酰菌胺复配,可延缓草莓灰霉病抗药性的产生,能更有效地防治草莓灰霉病。
|
图式1 吡唑醚菌酯 (a) 和啶酰菌胺 (b) 的结构式 Scheme1 Structural formula of pyraclostrobin (a) and boscalid (b) |
杨莉莉等[5]采用分散固相萃取-气相色谱-质谱联用的方法研究了50%啶酰菌胺水分散粒剂在草莓及土壤中的残留及消解动态,但有关吡唑醚菌酯单剂及其与啶酰菌胺复配制剂在草莓中的残留及消解动态的研究尚未见报道。已有研究发现,农药的用药量[5]、剂型[6]及混配制剂施用量[7-8]等均会影响农药的残留及消解动态。为了规范使用38%唑醚·啶酰菌悬浮剂,以保证草莓的食用安全,有必要开展农药残留试验,研究复配制剂中两种有效成分在草莓上的消解动态和最终残留量,评价其半衰期和安全间隔期,从而制定38%唑醚·啶酰菌悬浮剂在草莓上的合理使用方案。
目前,国内外对吡唑醚菌酯和啶酰菌胺检测方法的研究报道多采用液相色谱或液相色谱-质谱法[9-15]。汤永娇等[12]采用氨基固相萃取柱净化法,测定了芒果中的吡唑醚菌酯和啶酰菌胺;由晓等[13]采用弗罗里硅土柱净化法测定了糙米中的吡唑醚菌酯;陈莉等[14]采用液-液萃取法检测了草莓中的啶酰菌胺。这些方法均存在前处理步骤复杂、基质干扰大、溶剂用量多等不足。王玉然等[15]比较了液-液萃取、固相萃取以及QuEChERS 3种样品前处理方法对苹果叶片中吡唑醚菌酯的提取效果。结果表明,采用QuEChERS法提取回收率较高,且所需溶剂量少,时间短,重复性好。鉴于此,本研究采用QuEChERS前处理技术,结合高效液相色谱-串联质谱 (HPLC-MS/MS),建立了同时检测吡唑醚菌酯和啶酰菌胺在草莓和土壤中残留量的方法,并以38%唑醚·啶酰菌悬浮剂为供试药剂,通过2年2地的田间试验,采用所建立的方法测定了吡唑醚菌酯和啶酰菌胺在草莓和土壤中的消解动态和最终残留量。
为保证食品安全,各国制订了农药在果蔬中的最大残留限量 (MRL)。目前,中国和欧盟规定[16-17]:啶酰菌胺在草莓中的MRL值分别为3和6 mg/kg;中国尚未制定草莓中吡唑醚菌酯的MRL值,欧盟规定吡唑醚菌酯在草莓中的MRL值为0.5 mg/kg。
1 材料与方法 1.1 仪器与试剂Agilent 1200高效液相色谱仪、API2000质谱仪 (美国Agilent公司);IKA-2高速匀浆机 (德国IKA公司);VORTEX-5漩涡混合器 (海门市其林贝尔仪器有限公司);ST16R高速冷冻离心机 (美国Thermo公司);AL204万分之一电子天平 (瑞士Mettler Toledo公司)。
99%吡唑醚菌酯 (pyraclostrobin) 标准品和99%啶酰菌胺 (boscalid) 标准品 (均购自德国Dr. E公司);乙腈 (色谱纯,Fisher公司);无水硫酸镁、氯化钠、乙腈 (分析纯,北京化工厂);N-丙基乙二胺吸附剂 (PSA)(天津博纳艾杰尔科技有限公司)。38%唑醚·啶酰菌悬浮剂 (有效成分质量分数:12.8%吡唑醚菌酯,25.2%啶酰菌胺),由浙江禾本科技有限公司生产提供。
1.2 田间试验分别于 2015年4月至5月和 2016 年4月至5月在北京昌平 (平均气温18.5 ℃;平均相对湿度45%) 和山东济南 (平均气温19 ℃;平均相对湿度52%) 2地的草莓园 (露地) 进行田间试验。草莓品种分别为“红颜”和“丰香”。供试药剂为38%唑醚·啶酰菌悬浮剂。按《农药残留试验准则》[18]要求分别设空白对照区、低剂量处理区、高剂量处理区和消解动态处理区,小区面积为15 m2,每处理重复3次,随机排列,处理间设保护带。
1.2.1 消解动态试验参照文献[19]方法进行。施药剂量为有效成分342 g/hm2,分别于施药后2 h及1、3、5、7、10、14、21、28 d采集草莓样品,除去果梗,在匀浆机中捣碎成均匀的浆液,分别放入自封袋,于 –20 ℃保存备用;同时采集0~10 cm深的土壤样品,除去碎石和植物根茎等杂物,混匀后采用四分法留样,于 –20 ℃保存备用。
1.2.2 最终残留试验设2个施药剂量:低剂量为推荐高剂量 (有效成分228 g/hm2),高剂量是其1.5倍 (有效成分342 g/hm2),各设3次和4次施药2个处理,施药间隔期为5 d,分别于距最后一次施药后 3、5、7 d时采集草莓样品;同时采集0~15 cm土壤样品。其余采样及贮藏方法同1.2.1节。
1.3 样品前处理准确称取样品5.0 g (精确到0.01 g) 于50 mL离心管中,加入20 mL乙腈,涡旋0.5 min,超声30 min;加入2 mL饱和食盐水,均质5 min,在10 000 r/min下离心5 min;取上清液1.5 mL,加入30 mg PSA和50 mg无水硫酸镁,振荡1 min,静置5 min;取上清液,过0.22 μm滤膜,待测。
1.4 检测条件色谱条件:Waters X-bridge C18色谱柱 (150 mm × 2.1 mm,3.5 μm);流动相为V (乙腈) : V(0.1%甲酸水) = 70 : 30;流速0.20 mL/min;进样量5 μL。
质谱条件:电喷雾离子源 (ESI);毛细管电压5.5 kV;离子源温度500 ℃;雾化气345 kPa;辅助加热气207 kPa;气帘气276 kPa;碰撞室入口电压10 V;碰撞室出口电压4 V;扫描方式为正离子扫描,多重反应监测模式 (MRM)。其余参数见表1。
|
|
表 1 吡唑醚菌酯和啶酰菌胺的质谱检测参数 Table 1 The MS parameters for pyraclostrobin and boscalid |
1.5 标准溶液的配制及基质标准曲线绘制
分别准确称取0.01 g (精确至0.000 01 g) 吡唑醚菌酯和啶酰菌胺标准品,用乙腈溶解并定容至100.00 mL,分别配制成100 mg/L的吡唑醚菌酯和啶酰菌胺的标准品储备液,于4 ℃下避光保存。分别移取各标准储备液2.5 mL至10 mL容量瓶中,用乙腈定容,配成25 mg/L标准工作液,即用即配。
用空白草莓和土壤样品的提取液稀释标准工作液,配制系列浓度的吡唑醚菌酯和啶酰菌胺混合基质匹配标准溶液,其中吡唑醚菌酯的质量浓度为0.4、2、10、50、250、800和1 250 μg/L,啶酰菌胺的质量浓度为7、10、50、250、800、1 250、2 000 μg/L。按1.4节条件进行检测。分别以吡唑醚菌酯和啶酰菌胺的质量浓度为横坐标,相应的峰面积为纵坐标绘制标准曲线。
1.6 添加回收试验分别向空白草莓和土壤样品中添加3个水平的吡唑醚菌酯和啶酰菌胺混合标准溶液,吡唑醚菌酯的添加水平分别为0.015、1.5和3.0 mg/kg,啶酰菌胺的添加水平分别为0.03、3.0和6.0 mg/kg。按1.3节方法进行前处理,按1.4节条件检测,计算添加回收率及相对标准偏差 (RSD)。
2 结果与分析 2.1 方法的线性范围、准确度及精密度基质匹配外标法定量分析结果表明:在0.4~1 250 μg/L质量浓度范围内,吡唑醚菌酯的峰面积 (y) 与其质量浓度 (x) 间呈良好的线性关系,回归方程分别为:y = 688 x + 518,r = 0.998 4 (草莓) 和y = 842x + 217,r = 0.998 9 (土壤)。在7~2 000 μg/L范围内,啶酰菌胺峰面积 (y) 与质量浓度 (x) 间也呈良好的线性关系,回归方程分别为y = 30.5x + 404,r = 0.999 2 (草莓) 和y = 2.789x + 224,r = 0.999 1 (土壤)。
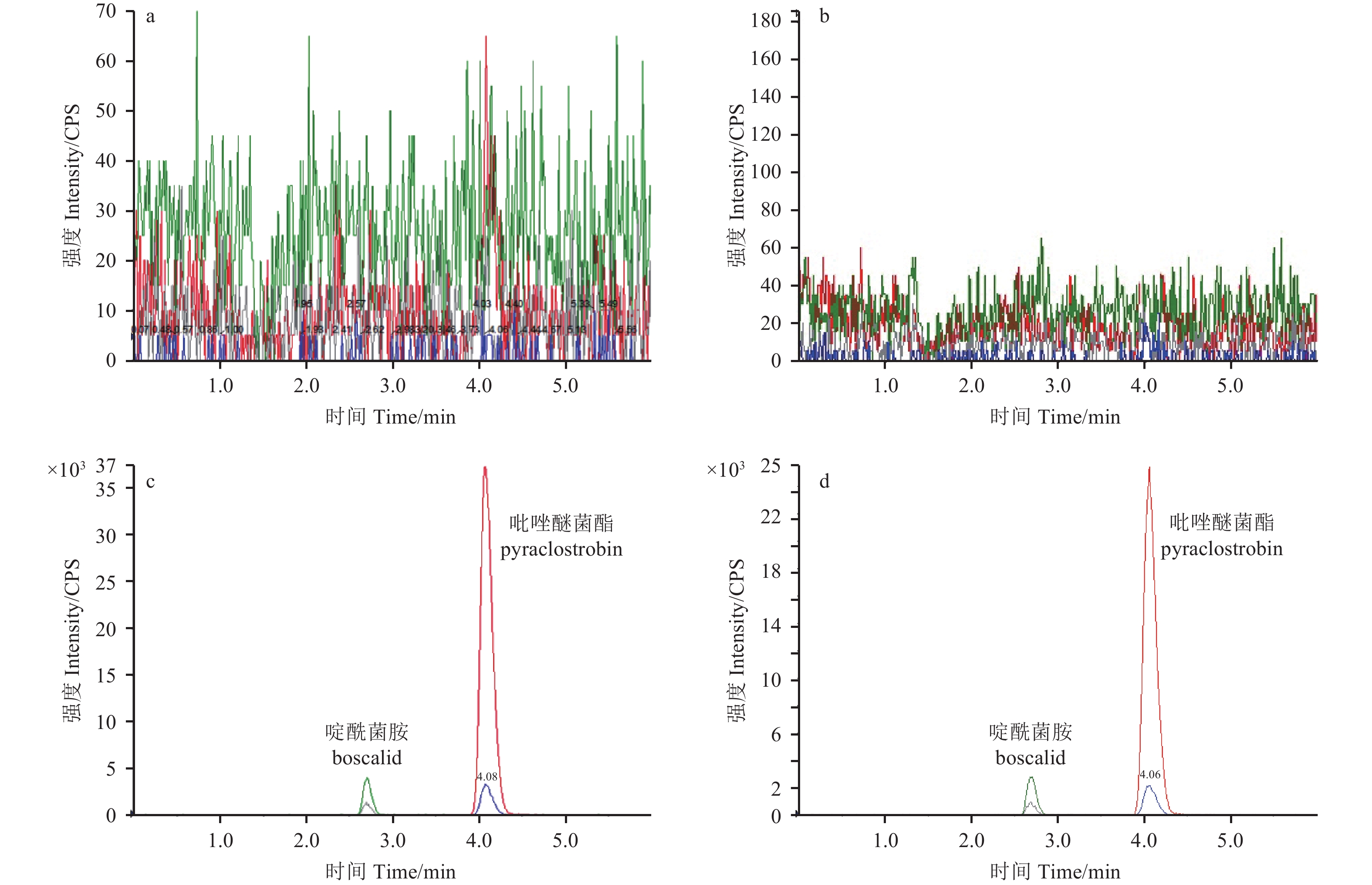
添加回收试验结果 (表2) 表明:在0.015、1.5和3.0 mg/kg添加水平下,吡唑醚菌酯在草莓和土壤中的平均回收率在94%~107%之间,RSDs为1.8%~4.1%;在 0.03、3.0和6.0 mg/kg添加水平下,啶酰菌胺在草莓和土壤中的平均回收率在90%~101%之间,RSDs为1.1%~14%。吡唑醚菌酯和啶酰菌胺的定量限 (LOQ) 分别为 0.015、0.03 mg/kg,最小检出量分别为1.2 × 10–5、1.48 × 10–4 ng,均符合《农药残留试验准则》[18]的要求。其典型色谱图见图1。
|
|
表 2 吡唑醚菌酯和啶酰菌胺在草莓及土壤中的添加回收率及相对标准偏差 (n = 5) Table 2 Average recoveries and relative standard deviation (RSD) for pyraclostrobin and boscalid in strawberries and soil (n = 5) |
|
a. 草莓空白样品;b. 土壤空白样品;c. 草莓中添加0.015 mg/kg吡唑醚菌酯和0.03 mg/kg啶酰菌胺;d. 土壤中添加0.015 mg/kg吡唑醚菌酯和0.03 mg/kg啶酰菌胺。 a. Blank strawberry; b. Blank soil; c. Strawberry spiked with 0.015 mg/kg pyraclostrobin and 0.03 mg/kg boscalid; d. Soil spiked with 0.015 mg/kg pyraclostrobin and 0.03 mg/kg boscalid. 图 1 草莓和土壤中添加吡唑醚菌酯和啶酰菌胺色谱图 Fig. 1 Chromatogram of strawberry and soil fortified with pyraclostrobin and boscalid |
2.2 吡唑醚菌酯和啶酰菌胺在草莓和土壤中的残留及消解动态 2.2.1 吡唑醚菌酯在草莓和土壤中的残留及消解动态
2年2地田间试验结果表明:施用38%唑醚·啶酰菌悬浮剂 (有效成分342 g/hm2,其中吡唑醚菌酯115.2 g/hm2,啶酰菌胺226.8 g/hm2) 后2 h,吡唑醚菌酯在草莓和土壤中的原始沉积量分别为0.053~0.222 mg/kg (北京) 和 0.050~0.876 mg/kg (山东),吡唑醚菌酯在草莓中的残留量与施药后间隔时间成指数关系,消解动态符合准一级动力学或一级动力学方程 (表3)。
|
|
表 3 吡唑醚菌酯在草莓及土壤中的消解动态 Table 3 Dissipation dynamics of pyraclostrobin in strawberry and soil |
2.2.2 啶酰菌胺在草莓和土壤中的残留及消解动态
与吡唑醚菌酯类似,施药后2 h,啶酰菌胺在草莓和土壤中的原始沉积量分别为0.646~2.957 mg/kg (北京) 和0.309~2.928 mg/kg (山东),其消解动态也符合准一级动力学或一级动力学方程 (表4)。
|
|
表 4 啶酰菌胺在草莓及土壤中的消解动态 Table 4 Dissipation dynamics of boscalid in strawberry and soil |
2.3 吡唑醚菌酯和啶酰菌胺在草莓和土壤中的最终残留量
38%唑醚·啶酰菌悬浮剂按有效成分228和342 g/hm2施药3~4次,施药间隔期5 d,吡唑醚菌酯和啶酰菌胺在北京和山东2015及2016年的最终残留试验结果见表5。其中吡唑醚菌酯和啶酰菌胺在草莓中的最高残留量分别为0.13和0.78 mg/kg;在土壤中的最高残留量分别为0.47和2.2 mg/kg。
|
|
表 5 草莓和土壤中吡唑醚菌酯和啶酰菌胺的最终残留量 Table 5 Final residue of pyraclostrobin and boscalid in strawberry and soil |
3 结论与讨论
本研究采用QuEChERS-HPLC-MS/MS方法检测了草莓和土壤中吡唑醚菌酯和啶酰菌胺的残留量,其定量限 (LOQ) 分别为0.015 mg/kg和0.03 mg/kg,最小检出量分别为1.2 × 10–5 ng和1.48 × 10–4 ng,与杨莉莉等[5]建立的采用GC-MS法测定啶酰菌胺在草莓和土壤中残留的方法相比,本方法的定量限更低,灵敏度高,而且实现了混配制剂中吡唑醚菌酯和啶酰菌胺在草莓和土壤中残留的同时检测。由残留试验结果可知,施药剂量越低,草莓和土壤中残留量越低,且其农药残留量随着采样间隔期延长而降低;采样间隔期一致时,施药次数越少,草莓中农药残留量越低,和杨莉莉等[5]的研究结果一致。
已有研究发现:吡唑醚菌酯在蓝莓上的消解半衰期为5.5~8.0 d[20],在花生和土壤中的半衰期分别为10.3~11.2 d和13.1~16.5 d[21];啶酰菌胺在番茄和土壤中半衰期为7.6~11.7 d和5.7-18.2 d[22]。本研究发现,吡唑醚菌酯和啶酰菌胺在草莓中的半衰期分别为4.8~6.0 d和5.1-11.0 d,可以看出吡唑醚菌酯在草莓中的半衰期与其在蓝莓中相差不大,啶酰菌胺在草莓中的半衰期与其在番茄中的相近,这可能与作物的生长规律和基质相似有关。混配制剂中的啶酰菌胺比其相应的单剂[5]在草莓中的消解速率快,可能是由于混配制剂中的各有效成分相互作用促进了降解,这与卢洪秀等[7]的研究结果一致。吡唑醚菌酯在土壤中的半衰期为5.4~6.9 d (北京) 和3.4~10.0 d (山东),啶酰菌胺在土壤中的半衰期为3.4~3.5 d (北京) 和5.1~6.0 d (山东),这与Zhang等[21]和郑尊涛等[22]报道的吡唑醚菌酯和啶酰菌胺在北京和山东等地土壤中的半衰期存在差异,这可能与具体试验地点的土壤微生物、酸碱度和土壤结构以及试验当年的气候条件等有关。综合来看,吡唑醚菌酯和啶酰菌胺在田间土壤中均属于易降解农药[23]。
最终残留试验结果表明,采用38%唑醚·啶酰菌悬浮剂按有效成分228 g/hm2和342 g/hm2,施药3、4次,施药间隔期5 d,距最后一次施药3、5、7 d后,草莓中吡唑醚菌酯的最高残留量为0.13 mg/kg,低于欧盟规定的草莓中吡唑醚菌酯的MRL值 (0.5 mg/kg),草莓中啶酰菌胺最高残留量为0.78 mg/kg,低于中国规定的草莓中啶酰菌胺的MRL值 (3.0 mg/kg),因此建议安全间隔期为3 d。
| [1] |
王凌宇, 廖晓兰, 张亚. 草莓灰霉病的防治研究进展[J]. 湖南农业科学, 2015(6): 142–144.
WANG L Y, LIAO X L, ZHANG Y. Research progress in the control of strawberry grey mould[J]. Hunan Agric Sci, 2015(6): 142–144. |
| [2] | Uddin Wakar. Pyraclostrobin: a promising new fungicide for turfgrass professionals: results from trials in the Northeast show that Insignia is highly effective in controlling gray leaf spot (blast), anthracnose basal rot, Pythium foliar blight, brown patch, gray snow[J]. Turf Grass Trends, 2001(11): 1–32. |
| [3] | Jabs T, Gunkel C, Pfirrmarm J, et al. Physiological effects of the new fungicide boscalid on crop quality[J]. Phytopathology, 2004, 94(6): S45. |
| [4] | FERNÁNDEZ-ORTUO D, CHEN F P; SCHNABEL G. Resistance to pyraclostrobin and boscalid in Botrytis cinerea isolates from strawberry fields in the carolinas [J]. Plant Dis, 2012, 96(8): 1198–1203. doi:10.1094/PDIS-12-11-1049-RE |
| [5] |
杨莉莉, 金芬, 杜欣蔚, 等. 啶酰菌胺在草莓和土壤中的残留及消解动态[J]. 农药学学报, 2015, 17(4): 455–461.
YANG L L, JIN F, DU X W, et al. Residue and dissipation dynamics of boscalid in strawberry and soil[J]. Chin J Pest Sci, 2015, 17(4): 455–461. |
| [6] |
王全胜, 曹梦超, 刘雅楠, 等. QuEChERS结合UPLC-ESI-MS/MS分析吡蚜酮和异丙威SC在稻田中的残留特征[J]. 农业环境科学学报, 2015, 34(3): 431–437.
WANG Q S, CAO M C, LIU Y N, et al. Analysis of residual profiles of pymetrozine and isoprocarb SC in paddy field by QuEChERS combined with UPLC-ESI-MS/MS[J]. J Agro-Environ Sci, 2015, 34(3): 431–437. doi:10.11654/jaes.2015.03.004 |
| [7] |
卢洪秀, 陈俊, 马步春. 混合农药在甘蓝及土壤中的残留动态研究[J]. 上海农业学报, 2014, 30(3): 82–88.
LU H X, CHEN J, MA B C. Residue dynamic of mixed pesticides in cabbage and soil[J]. Acta Agriculturae Shanghai, 2014, 30(3): 82–88. |
| [8] | SUN D L, ZHU Y M, PANG J X, et al. Residue level, persistence and safety of spirodiclofen-pyridaben mixture in citrus fruits[J]. Food Chem, 2016, 194: 805–810. doi:10.1016/j.foodchem.2015.08.044 |
| [9] |
侯雪, 韩梅, 邱世婷, 等. 改进的QuEChERS气相色谱-串联质谱法测定草莓中21种杀菌剂残留[J]. 农药学学报, 2017, 19(1): 46–52.
HOU X, HAN M, QIU S T, et al. Residues of 21 fungicides in Fragaria ananassa by modified QuEChERS and gas chromatography-tandem mass spectrometry [J]. Chin J Pest Sci, 2017, 19(1): 46–52. |
| [10] | DE OLIVEIRA L A B, PACHECO H P, SCHERER R. Flutriafol and pyraclostrobin residues in Brazilian green coffees[J]. Food Chem, 2016, 190: 60–63. doi:10.1016/j.foodchem.2015.05.035 |
| [11] | LAGUNAS-ALLUÉ L, SANZ-ASENSIO J, MARTÍNEZ-SORIA M T. Mobility and distribution of eight fungicides in surface, skin and pulp in grapes. An application to pyraclostrobin and boscalid[J]. Food Control, 2015, 51: 85–93. doi:10.1016/j.foodcont.2014.10.028 |
| [12] |
汤永娇, 袁宏球, 朱珠, 等. 超高效液相色谱法测定芒果中啶酰菌胺和吡唑醚菌酯[J]. 食品科学, 2014, 35(20): 175–179.
TANG Y J, YUAN H Q, ZHU Z, et al. Determination of boscalid and pyraclostrobin in mango by ultra performance liquid chromatography[J]. Food Sci, 2014, 35(20): 175–179. doi:10.7506/spkx1002-6630-201420035 |
| [13] |
由晓, 井乐刚. UPLC-MS/MS法测定糙米和稻壳中吡唑醚菌酯残留[J]. 中国粮油学报, 2016, 31(8): 148–151, 157.
YOU X, JING L G. Determination of pyraclostrobin residues in brown rice and rice husk by ultra performance liquid chromatography-tandem mass spectrometry[J]. J Chin Cer Oils Associat, 2016, 31(8): 148–151, 157. |
| [14] |
陈莉, 贾春虹, 贺敏, 等. 草莓和土壤中啶酰菌胺残留量的高效液相色谱分析[J]. 农药, 2009, 48(5): 360–361, 364.
CHEN L, JIA C H, HE M, et al. Residue analysis method of boscalid in strawberry and soil with HPLC[J]. Agrochemicals, 2009, 48(5): 360–361, 364. |
| [15] |
王玉然, 梁化雨, 李平亮, 等. 苹果叶片中吡唑醚菌酯残留的超高效液相色谱-串联质谱检测方法[J]. 农药学学报, 2016, 18(6): 752–758.
WANG Y R, LIANG H Y, LI P L, et al. Development and validation of an ultra-performance liquid chromatography-tandem mass spectrometry method for the residue analysis of pyraclostrobin in Malus domestica leaves [J]. Chin J Pest Sci, 2016, 18(6): 752–758. |
| [16] | Regulation (Ec) No 396/2005 of the European parliament and of the council[S]. EU, Brussels, 2005. |
| [17] |
食品中农药最大残留限量: GB 2763—2014[S]. 北京: 中国农业出版社, 2014.
Maximum residue limits for pesticides in food: GB 2763—2014[S]. Beijing: China Agriculture Press, 2014. |
| [18] |
农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004.
Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
| [19] |
农业部农药检定所. 农药登记残留田间试验标准操作规程[M]. 北京: 中国标准出版社, 2007.
Institute for the Control of Agrochemicals. Standard operating procedures on pesticide registration residue fiels trials[M]. Beijing: Standards Press of China, 2007. |
| [20] | MUNITZ M S, RESNIK S L, MONTTI M I T, et al. Validation of a SPME-GC method for azoxystrobin and pyraclostrobin in blueberries, and their degradation kinetics[J]. Agric Sci, 2014, 5(11): 964–974. |
| [21] | ZHANG F Z, WANG L, ZHOU L, et al. Residue dynamics of pyraclostrobin in peanut and field soil by QuEChERS and LC-MS/MS[J]. Ecotoxicol Environ Safety, 2012, 78: 116–122. doi:10.1016/j.ecoenv.2011.11.003 |
| [22] |
郑尊涛, 孙建鹏, 简秋, 等. 啶酰菌胺在番茄和土壤中的残留及消解动态[J]. 农药, 2012, 51(9): 672–674.
ZHENG Z T, SUN J P, JIAN Q, et al. The residues and dissipation of boscalid in tomato and soil[J]. Agrochemicals, 2012, 51(9): 672–674. |
| [23] |
化学农药环境安全评价试验准则 第1部分: 土壤降解试验: GB/T 31270.1—2014[S]. 北京: 中国标准出版社, 2014.
Test guidelines on environmental safety assessment for chemical pesticides-Part 1: Transformation in soils: GB/T 31270.1—2014[S]. Beijing: Standards Press of China, 2014. |
 2018, Vol. 20
2018, Vol. 20


