2. 中国农业科学院 蜜蜂研究所,北京 100093
2. Institute for the Apicultural Research, Chinese Academy of Agricultural Sciences, Beijing 100093, China
枸杞蚜虫Aphis sp.是危害枸杞产业的三大害虫之一,广泛分布于中国各枸杞种植区,内蒙古作为中国主要的枸杞产区,受害较为普遍[1]。其通过吸食枸杞汁液为害,并可在植株上分泌黏液,降低光合作用效率而造成直接损失[1-2]。化学防治是目前枸杞蚜虫防治的主要方法之一,其中枸杞蚜虫已对菊酯类杀虫剂产生了一定程度的抗药性,如在中国宁夏地区,有报道表明枸杞蚜虫对溴氰菊酯的抗性已高达2 738倍,对氯氟氰菊酯的抗性也达到了353.7倍[3]。
已有研究表明,害虫对拟除虫菊酯类杀虫剂最常见的抗性机制之一是其解毒酶[如羧酸酯酶 (CarE)]活性发生了变化[4-7]。联苯菊酯是一种常用的高活性菊酯类杀虫剂,在枸杞害虫防治上已有应用,但有关枸杞蚜虫对联苯菊酯的抗药性问题目前尚未见报道。因此,笔者研究了内蒙古不同地区枸杞蚜虫对联苯菊酯的抗药性情况,比较了敏感和抗性种群枸杞蚜虫羧酸酯酶的活性差异,尝试探讨枸杞蚜虫对联苯菊酯产生抗性的生理生化机制;同时选择毒死蜱、三唑磷、氧乐果和灭多威4种生产中常用的杀虫剂,研究了其对不同抗性水平枸杞蚜虫羧酸酯酶的抑制作用,旨在探讨不同类型药剂在枸杞蚜虫防治中的相互关系,以期为其抗性治理及今后生产中合理选择杀虫剂提供依据。
1 材料与方法 1.1 试验材料 1.1.1 供试昆虫枸杞蚜虫Aphis sp.于2015年6月采集,种群Ⅰ~Ⅲ 采于内蒙古农业大学。其中,敏感种群Ⅰ采自该校实验室培育的枸杞苗木上,枸杞苗木和枸杞蚜虫常年不接触农药;种群Ⅱ采自其农场枸杞苗木,除虫害大发生年份外一般不喷施农药,但可能受到周边农作物施药的影响;种群 Ⅲ 采自该校东校区校园景观枸杞植株,每年仅在春秋两季各喷施1次农药。种群Ⅳ和Ⅴ分别采自内蒙古呼和浩特市托克托县团结乡和五胜镇枸杞种植区,2个地区均常年使用化学农药, 但用药水平不同。
1.1.2 药剂96%联苯菊酯 (bifenthrin) 原药、95%毒死蜱 (chlorpyrifos) 原药及87.6%灭多威 (methomyl) 原药,江苏扬农化工股份有限公司;80.5%三唑磷 (triazophos) 原药,浙江永农化工有限公司;79.1%氧乐果 (omethoate) 原药,山东济南世邦农化公司。
α-乙酸萘酯 (α-NA) 购自上海源叶生物科技有限公司;固蓝B盐、5%十二烷基硫酸钠 (SDS)、吐温-80及99%毒扁豆碱 (eserine) 均购自Sigma公司;考马斯亮蓝G-250购自Fluka公司;其余试剂均为国产分析纯。
1.2 试验方法 1.2.1 联苯菊酯对枸杞蚜虫的毒力测定参照Shotkoski等[8]和鲁艳辉等[9]的玻璃管药膜法,有改进。先用丙酮将联苯菊酯原药溶解,配制成1 000 mg/L的母液,再根据预试验结果,用丙酮分别稀释成6~7个梯度浓度。取1 mL药液于15 mm × 100 mm指形管内,制成试管药膜。以丙酮作对照,每浓度重复3次。每管接入30头健康一致的无翅成蚜,置于25 ℃、相对湿度约50%~70%、光照17L : 7D的人工气候箱内,4 h后检查死亡虫数。用毛笔尖轻触虫体,不动者记为死亡[8]。以对照死亡率小于10%为有效测定,并用对照死亡率进行校正。采用POLO软件计算致死中浓度 (LC50)。
参照沈晋良等[10]的标准进行试虫抗药性程度划分。
1.2.2 羧酸酯酶活性测定 1.2.2.1 酶液制备取约100头于 –80 ℃下保存的枸杞蚜虫,加入1 mL预冷的0.04 mol/L磷酸缓冲液 (pH = 7.0,含体积分数为0.3%的吐温-80),冰浴下匀浆。匀浆液于4 ℃、12 000 × g离心20 min,上清液即为酶原液。
1.2.2.2 酶活性测定参照Van Aspern[11]的方法并稍加改动。将制备好的CarE酶原液用预冷的0.04 mol/L磷酸缓冲液 (pH = 7.0,含体积分数0.1%的吐温-80) 稀释。10 mL试管中依次加入0.9 mL预冷的0.04 mol/L磷酸缓冲液、3.6 mL 3 × 10–4 mol/L的α-NA(含体积比1 : 1的毒扁豆碱) 及0.1 mL稀释后的酶液,对照加入0.1 mL磷酸缓冲液,30 ℃水浴振荡反应30 min后,加入1.8 mL显色剂(1%固蓝B盐与5% SDS溶液按体积比2 : 5混合)终止反应。室温下放置5 min,于600 nm处测定其吸光度 (OD) 值。重复3次。根据所得OD值及计算出的酶液蛋白质含量计算酶的比活力。
1.2.3 杀虫剂对羧酸酯酶活性的抑制作用测定参照高希武等[12]的方法。先用丙酮将4种杀虫剂原药溶解,配制成1 000 mg/L的母液,再根据预试验结果,用丙酮分别稀释成6个梯度浓度。将不同浓度药液分别与枸杞蚜虫CarE酶液混合,在30 ℃水浴保温10 min后,再加入3.6 mL 3 × 10–4 mol/L的底物α-NA,于30 ℃水浴反应15 min,加入1.8 mL显色剂终止反应,5 min后在600 nm波长下测定残存的CarE的活性。将药剂终浓度转换成负对数值,与对应的抑制率几率值作图,求得回归方程,根据方程计算药剂对CarE的抑制中浓度 (I50)。每种药剂至少5个浓度,每浓度3次重复。
1.2.4 蛋白质含量测定参考Bradford考马斯亮蓝G-250法[13]。
2 结果与分析 2.1 联苯菊酯对不同种群枸杞蚜虫的毒力结果 (表1) 表明,不同种群枸杞蚜虫对联苯菊酯的敏感性不同,其中种群Ⅴ的抗性倍数达76.2,已属高水平抗性。
|
|
表 1 联苯菊酯对不同种群枸杞蚜虫的毒力 Table 1 The toxicities of bifenthrin to different populations of Aphis sp. |
2.2 不同种群枸杞蚜虫羧酸酯酶的特性 2.2.1 CarE比活力变化
表2显示,随着枸杞蚜虫对联苯菊酯抗性水平的提高,其体内CarE比活力逐渐增大。统计分析表明,枸杞蚜虫敏感种群和各抗性种群之间CarE比活力存在极显著差异 (P < 0.01)。
|
|
表 2 不同种群枸杞蚜虫羧酸酯酶比活力比较 Table 2 Activities of CarE in different populations of Aphis sp. |
2.2.2 米氏常数 (Km) 和最大反应速率 (Vmax)
联苯菊酯高抗种群Ⅴ与敏感种群Ⅰ的米氏曲线见图1。以α-NA为底物条件下,其比活力均先快速上升,再逐渐趋于平缓,但高抗种群Ⅴ的CarE比活力均显著高于敏感种群Ⅰ。其米氏常数 (Km) 值分别为0.539和0.527 μmol/L,二者无显著性差异;但高抗性种群ⅤCarE的最大反应速率 (Vmax) 为2.353 μmol/(min·mg),与敏感种群Ⅰ [1.129 μmol/(min·mg)] 相比存在显著性差异。
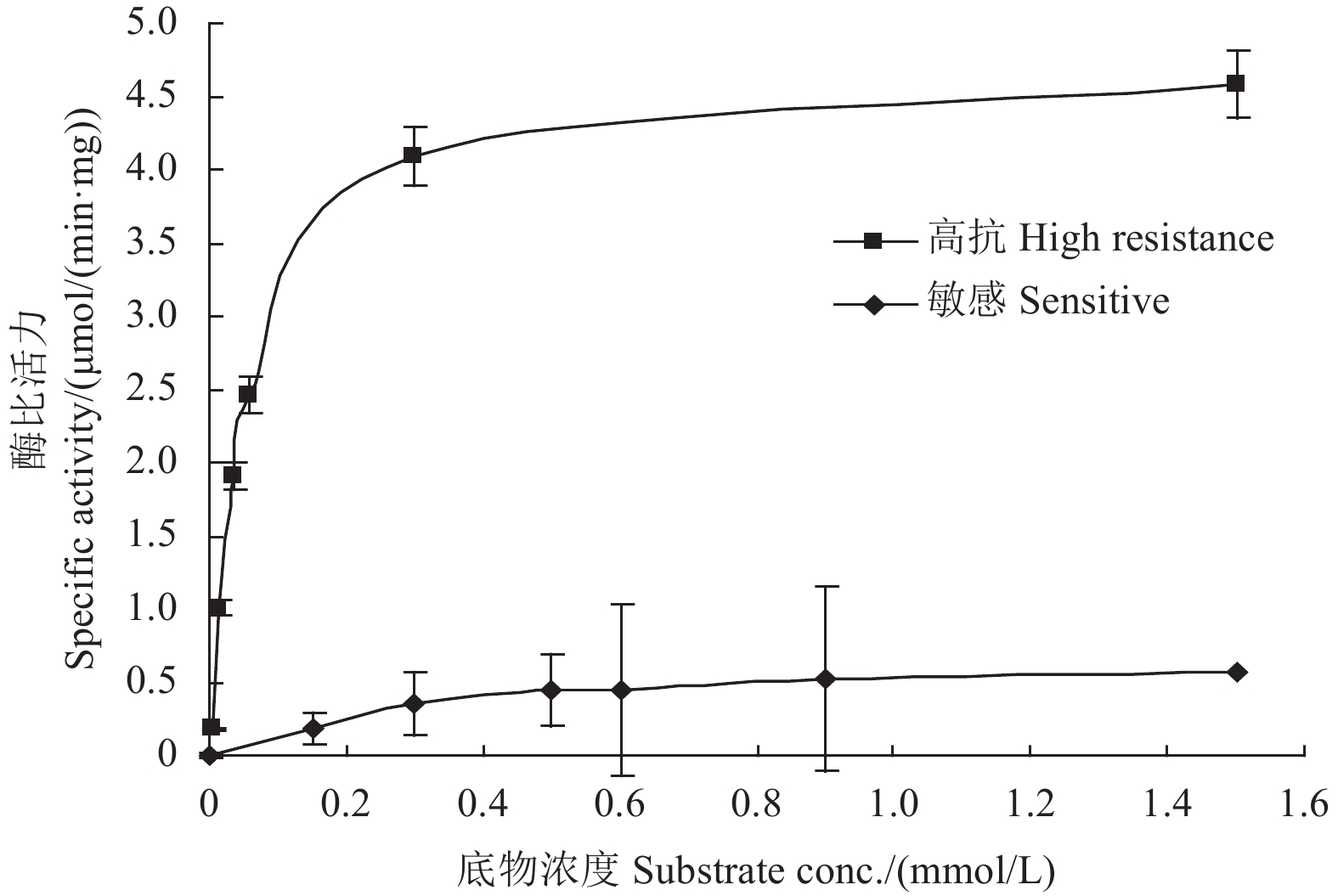
|
图 1 不同底物浓度下枸杞蚜虫敏感种群Ⅰ和高抗联苯菊酯种群Ⅴ的羧酸酯酶比活力 Fig. 1 Activities of CarE from sensitive population Ⅰ and high resistant population Ⅴ of Aphis sp. to substrate in different concentrations |
2.3 杀虫剂对不同种群枸杞蚜虫CarE的抑制作用
从表3中可看出,毒死蜱等4种杀虫剂对不同种群枸杞蚜虫CarE的抑制作用均随蚜虫对联苯菊酯抗性的增高而减弱,即随着蚜虫对联苯菊酯抗性程度升高,4种杀虫剂对其CarE的I50值逐渐增大。
|
|
表 3 供试4种杀虫剂对不同种群枸杞蚜虫CarE的抑制中浓度 Table 3 I50 of 4 insecticides to CarE in different populations of Aphis sp. |
3 小结与讨论
羧酸酯酶 (CarE) 是昆虫体内重要的解毒代谢酶系之一。现有研究表明,害虫抗药性的产生主要涉及其解毒代谢酶对药剂代谢能力增强所导致的代谢抗性和杀虫剂作用靶标敏感性降低导致的靶标抗性两方面[14]。本研究发现,枸杞蚜虫敏感种群与联苯菊酯低抗、中抗及高抗种群之间羧酸酯酶活性均存在极显著性差异 (P < 0.01),表明羧酸酯酶在枸杞蚜虫对联苯菊酯抗药性的产生中起到了关键作用。
对敏感及联苯菊酯高抗性种群枸杞蚜虫羧酸酯酶特性的研究发现,以α-NA为底物时,高抗种群羧酸酯酶的比活力和最大反应速率 (Vmax) 值均显著高于敏感种群,但表征其对底物α-NA亲和力高低的米氏常数 (Km) 值却不存在显著性差异,该结果与张桦[15]和Chang等[5]的研究结果类似。表明抗性及敏感种群枸杞蚜虫的羧酸酯酶只存在量的不同,其酶的性质并未发生改变,即枸杞蚜虫对联苯菊酯的抗性机制主要是由于羧酸酯酶活性的提高所致。
本研究表明,常用的氨基甲酸酯类杀虫剂灭多威及3种有机磷类杀虫剂氧乐果、毒死蜱和三唑磷对枸杞蚜虫CarE的抑制活性均随着试虫对联苯菊酯抗药性程度的升高而降低,与刘红霞等[6]的研究结论类似,表明由于抗性种群CarE活性提高,导致其对其他药剂的敏感性亦同时降低。但刘红霞等[6]的研究同时还发现,敌敌畏 (DDVP) 对溴氰菊酯抗性品系白纹伊蚊CarE的抑制活性反而高于对敏感品系,本研究结论与之相反。证明了害虫抗药性机制的复杂性,是否同时存在代谢抗性和靶标抗性还需深入研究。
研究枸杞蚜虫抗药性动态及其生理生化机制,一方面可为其抗性预测和治理提供理论依据,另一方面有助于采取科学合理的应对措施,提高防治效果。由于目前菊酯类和有机磷类杀虫剂依然是生产中主要的用药品种,研究二者之间的相互作用及关系,对合理选择农药,降低抗药性风险具有重要意义。
| [1] |
徐常青, 刘赛, 徐荣, 等. 我国枸杞主产区生产现状调研及建议[J]. 中国中药杂志, 2014, 39(11): 1979–1984.
XU C Q, LIU S, XU R, et al. Investigation of production status in major wolf berry producing areas of China and some suggestions[J]. China J Chin Mater Med, 2014, 39(11): 1979–1984. |
| [2] |
李锋. 枸杞病虫害可持续调控技术[M]. 银川: 宁夏人民出版社, 2012: 16-18.
LI F. The sustainable technology of controlling the diseases and insects in Chinese wolfberry[M]. Yinchuan: Ningxia People Press, 2012: 16-18. |
| [3] |
任月萍, 刘生祥, 张久园, 等. 枸杞蚜虫对三种菊酯类杀虫剂抗性研究[J]. 宁夏农林科技, 1997(6): 15–17.
REN Y P, LIU S X, ZHANG J Y, et al. Study on drug fast of wolfberry Aphid to three types of pyrethrins in Ningxia [J]. Ningxia J Agric For Sci Technol, 1997(6): 15–17. |
| [4] |
冷欣夫, 唐振华, 王荫长. 杀虫药剂分子毒理学及昆虫抗药性[M]. 北京: 中国农业出版社, 1996: 1-29.
LENG X F, TANG Z H, WANG Y C. Molecular toxicology of insecticides and insect resistance[M]. Beijing: China Agriculture Press, 1996: 1-29. |
| [5] | CHANG J, CAO C W, GAO X W. The effect of pretreatment with S,S,S-tributyl phosphorotrithioate on deltamethrin resistance and carboxylesterase activity in Aphis gossypii (Glover) (Homoptera: Aphididae) [J]. Pestic Biochem Physiol, 2010, 98(2): 296–299. doi:10.1016/j.pestbp.2010.06.021 |
| [6] |
刘洪霞, 冷培恩, 徐仁权, 等. 白纹伊蚊溴氰菊酯抗性和敏感品系羧酸酯酶性质比较[J]. 应用昆虫学报, 2012, 49(2): 403–407.
LIU H X, LENG P N, XU R Q, et al. Comparison of the biochemical characteristics of deltamethrin resistant and susceptible populations of Aedes albopictus [J]. Chin J Appl Entomol, 2012, 49(2): 403–407. doi:10.7679/j.issn.2095-1353.2012.055 |
| [7] |
郭天凤, 史雪岩, 高希武, 等. 棉蚜吡虫啉、啶虫脒不同品系解毒酶活性测定和增效剂作用的研究[J]. 环境昆虫学报, 2014, 36(3): 388–394.
GUO T F, SHI X Y, GAO X W, et al. Study on the activity of the detoxification enzymes and synergist synergism of cotton aphid (Aphis gossypiip) on imidacloprid, acetamiprid different strains [J]. J Environ Entomol, 2014, 36(3): 388–394. |
| [8] | SHOTKOSKI F A, MAYO Z B, PETERS L L. Induced disulfoton resistance in greenbugs (Homoptera: Aphididea)[J]. J Econ Entomol, 1990, 83(6): 2147–2152. doi:10.1093/jee/83.6.2147 |
| [9] |
鲁艳辉, 杨婷, 高希武. 禾谷缢管蚜和麦长管蚜玻璃管药膜法敏感毒力基线的建立[J]. 昆虫学报, 2009, 52(1): 52–58.
LU Y H, YANG T, GAO X W. Establishment of baseline susceptibility data to various insecticides for aphids Rhopalosiphum padi (Linnaeus) and Sitobion avenae (Fabricius) (Homoptera: Aphididae) by the method of residual film in glass tube [J]. Acta Entomologica Sinica, 2009, 52(1): 52–58. |
| [10] |
沈晋良, 谭建国, 肖斌, 等. 我国棉铃虫对拟除虫菊酯类农药的抗性监测及预报[J]. 昆虫知识, 1991(6): 337–341.
SHEN J L, TAN J G, XIAO B, et al. Prediction and resistance monitoring of Helicoverpa armigera to pyrethroids in China [J]. Kunchongzhishi, 1991(6): 337–341. |
| [11] | VAN ASPEREN K. A study of housefly esterases by means of a sensitive colorimetric method[J]. J Insect Physiol, 1962, 8(4): 401–414, IN3, 415-416. doi:10.1016/0022-1910(62)90074-4 |
| [12] |
高希武, 郑炳宗. 几种农药对蚜虫羧酸酯酶的抑制和拟除虫菊酯的增效[J]. 北京农业大学学报, 1991, 17(4): 89–94.
GAO X W, ZHENG B Z. Synergism of inhibitors of carboxylesterase to pyrethroid insecticides in aphids[J]. Acta Agriculturae Universitatis Pekinensis, 1991, 17(4): 89–94. |
| [13] | BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1-2): 248–254. doi:10.1016/0003-2697(76)90527-3 |
| [14] |
唐振华. 昆虫抗药性及其治理[M]. 北京: 农业出版社, 1993: 158-163.
TANG Z H. Insect resistance and management[M]. Beijing: Agriculture Press, 1993: 158-163. |
| [15] |
张桦. 抗高效氯氟氰菊酯大豆蚜羧酸酯酶生化及分子机制研究[D]. 长春: 吉林大学, 2013.
ZHANG H. Carboxylesterase biochemical and molecule mechanisms of resistant Aphis glycines to lambda-cyhalothrin[D]. Changchun: Jilin University, 2013. |
 2017, Vol. 19
2017, Vol. 19


