2. 山东省蔬菜病虫生物学重点实验室,山东 泰安 271018;
3. 山东农业大学 农药毒理与应用技术重点实验室,山东 泰安 271018
2. Shandong Provincial Key Laboratory for Biology of Vegetable Diseases and Insect Pests, Taian 271018, Shandong Province, China;
3. Shandong Agricultural University, Key Laboratory of Pesticide Toxicology and Application Technique, Taian 271018, Shandong Province, China
辣椒炭疽病是由炭疽菌属 (Colletotrichum spp.) 真菌引起的重要病害,主要为害果实,在露地辣椒上发病率较高,严重影响辣椒的产量和品质[1]。目前,辣椒已成为山东省重要的经济作物之一,露地种植面积逐年扩大,炭疽病主要发生在辣椒结果期 (7月初至9月中旬),期间正值该省高温多雨季节,导致发病严重,减产率可高达50%[2-3]。目前山东省辣椒炭疽病的主要致病菌为尖孢炭疽复合种Colletotrichum acutatum species complex[1],该类病菌寄主范围广,已知除侵染辣椒外,还可侵染草莓、柑橘、芒果等重要经济作物[4],危害十分严重。
辣椒炭疽病的防治主要包括农业、生物和化学等措施。其中农业措施以种植抗性品种为主,但由于抗性基因资源的有限性,不同辣椒品种间存在杂交障碍,严重阻碍了抗性品种的选育[5-6]。而生物防治主要以应用拮抗菌为主,由于技术尚不成熟,还难以在生产中广泛应用[7]。因此,喷施化学药剂是目前防治辣椒炭疽病的主要手段[8]。多菌灵、甲基硫菌灵、百菌清和代森锰锌等传统药剂对尖孢炭疽复合种所致炭疽病的防治效果均有限[8-9],而三唑类杀菌剂[10]及嘧菌酯[11]虽然对尖孢炭疽复合种具有较高的抑制活性,但由于防治成本较高,在田间并未大面积推广使用。Peres等[12]和Talhinhas等[13]发现,尖孢炭疽复合种已对苯并咪唑类药剂产生抗性。同时,邓维萍等[14]和曹雪仁等[15]也发现,与其他炭疽菌相比,尖孢炭疽复合种对苯并咪唑类杀菌剂敏感性较低。
吡唑醚菌酯是由德国巴斯夫公司研制的甲氧基丙烯酸酯类杀菌剂,其通过阻止复合物bc1间的电子传递而干扰真菌线粒体的呼吸作用,阻止线粒体内能量的产生而导致细胞死亡[16]。吡唑醚菌酯具有高效、低毒、广谱的特性,可用于防治子囊菌、担子菌、无性型真菌和卵菌等引起的病害[17]。Lewis-Ivey等[3]已证明吡唑醚菌酯与其他药剂交替使用可降低辣椒炭疽病的发病率。2016年,吡唑醚菌酯在中国正式登记用于辣椒炭疽病的防治,但尚未大面积推广。由于吡唑醚菌酯作用位点单一,而辣椒炭疽病发生周期长,若长期大量使用该药剂将存在较高的抗性风险,因此有必要建立尖孢炭疽复合种对吡唑醚菌酯的敏感基线,为监测其敏感性变化提供依据。此外,筛选合理的混用药剂有利于提高防效、降低用药成本和减缓病原菌抗药性产生的速度。为此,本研究从山东省不同地区采集了175株尖孢炭疽复合种,测定了其对吡唑醚菌酯的敏感性,并比较了吡唑醚菌酯与甲基硫菌灵、多菌灵等5种杀菌剂在不同配比混用情况下对尖孢炭疽复合种的联合毒力,以期筛选出增效配方,为辣椒炭疽病的高效防治提供依据。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株于2015年,在山东省济宁、菏泽、潍坊、德州、泰安、济南等辣椒主产区选取未使用过甲氧基丙烯酸酯类杀菌剂的地块,随机采集辣椒炭疽病病果,在室内采用单孢分离的方法进行分离纯化[8],共获得175株辣椒炭疽菌菌株,经形态学和分子生物学鉴定为尖孢炭疽复合种C. acutatum species complex[1]。所有菌株于4 ℃下保存,备用。
1.1.2 药剂及试剂98%吡唑醚菌酯 (pyraclostrobin) 原药,浙江禾本科技有限公司;98%咯菌腈 (fludioxonil) 原药,浙江省杭州宇龙化工有限公司;95%多菌灵 (carbendazim) 原药,江苏辉丰农化股份有限公司;95%甲基硫菌灵 (thiophanate-methyl) 原药,安徽广信农化股份有限公司;96%戊唑醇 (tebuconazole) 原药,江苏丰登作物保护股份有限公司;90%代森锰锌 (mancozeb) 原药,山东潍坊润丰化工股份有限公司。溶剂吐温-80,天津市凯通化学试剂有限公司;99%水杨肟酸 (SHAM),日本东京化成工业株式会社。
吡唑醚菌酯、咯菌腈、甲基硫菌灵和戊唑醇用丙酮溶解,多菌灵用0.1 mol/L的盐酸溶解,配成质量浓度为1 × 105 μg/mL的母液。由于代森锰锌在丙酮等常规有机溶剂中的溶解度极小,因此称取1.11 g代森锰锌和0.1 g吐温-80,用去离子水补足100 mL,经砂磨机于1 700 r/min研磨30 min,配制成1 × 105 μg/mL的均质水悬浮母液。所有母液于4 ℃保存,用于毒力测定。将SHAM溶于甲醇配成1 × 105 μg/mL的母液,用于吡唑醚菌酯室内毒力测定。
1.1.3 培养基马铃薯葡萄糖琼脂培养基 (PDA):马铃薯200 g,葡萄糖20 g,琼脂粉20 g,去离子水1 L;水琼脂培养基 (WA):葡萄糖20 g,琼脂粉20 g,去离子水1 L。
1.2 试验方法 1.2.1 尖孢炭疽复合种对吡唑醚菌酯的敏感性测定采用菌丝生长速率法[18]。供试菌株在PDA平板上于25 ℃培养8 d后,在菌落边缘打取直径8 mm的菌饼,接种在含吡唑醚菌酯分别为0、0.01、0.02、0.04、0.1、0.4和1.6 μg/mL的PDA平板中央。每皿接种1个菌饼,每个浓度重复4次。为抑制旁路氧化途径的影响[19],向PDA平板中加入100 μg/mL的SHAM。以加入等量吐温-80溶液的PDA平板为空白对照,以加入溶剂及吐温-80的PDA平板为溶剂对照,溶剂用量采用最小稀释倍数法确定。25 ℃黑暗培养6 d后,采用十字交叉法测量菌落直径 (cm),计算各浓度处理下药剂对菌丝生长的抑制率。
采用孢子萌发法[20]。用无菌水冲洗培养8 d的菌落,采用灭菌的双层纱布滤去菌丝,滤液于10 000 r/min离心5 min后弃掉上清液。将分生孢子重新悬浮于无菌水中,调节浓度至每毫升含 1 × 105个孢子。配制吡唑醚菌酯质量浓度分别为0、0.002 5、0.005、0.01、0.02、0.04和0.1 μg/mL的含药WA平板,吸取100 μL孢子悬浮液涂布于含药WA平板上,25 ℃黑暗培养8 h后,观察分生孢子的萌发情况,当芽管长度超过孢子长度的一半时视为萌发。每个平板至少观察200个以上的孢子,计算孢子萌发抑制率。
1.2.2 复配药剂的筛选二元混配:将1 × 105 μg/mL的吡唑醚菌酯 (A) 母液分别与1 × 105 μg/mL的多菌灵 (B)、甲基硫菌灵 (C)、代森锰锌 (D)、戊唑醇 (E)、咯菌腈 (F) 母液以体积比为1:3、1:1、3:1的比例复配,将各组配比的混合药剂制成含药培养基,每个配比设6个浓度,采用1.2.1节中所述的菌丝生长速率法和孢子萌发法测定复配药剂的联合毒力。
1.2.3 联合毒力评价方法采用Wadley法[21]进行评价。按公式 (1) 和 (2) 计算混剂的增效系数 (SR),SR > 1.5为增效作用,1.5 ≥ SR ≥ 0.5为相加作用,SR < 0.5为拮抗作用。
| $\begin{split}\!\!\!\!\!\!\!\!&\text{混剂}\,{\rm {EC}_{50}}\,\text{理论值} \!\!=\!\! \left({\text{混剂中}}\,{\rm A}\,\text{的质量分数} \!\!+\!\!\text{混剂中}\right.\\\!\!\!\!\!\!\!\!&\;\;\;\left.{\rm B}\;\text{的质量分数} \right)/\left(\text{混剂中}\;{\rm A}\;\text{的质量分数}/{\rm A}\;\text{的}\;\right.\\\!\!\!\!\!\!\!\!&\;\;\;\left.{{\rm E}{\rm C}_{50}}\;\text{值} +\text{混剂中}\;{\rm B}\;\text{的质量分数}/{\rm B}\;\text{的}\;{{\rm E}{\rm C}_{50}}\;\text{值} \right)\!\!\!\!\end{split}$ | (1) |
| ${\rm{SR}} = \text{混剂}\;{\rm{E}}{{\rm{C}}_{50}}\;\text{理论值}/\text{混剂}\;{\rm{E}}{{\rm{C}}_{50}}\;\text{实测值}$ | (2) |
如图1-A所示,吡唑醚菌酯对175株尖孢炭疽复合种菌丝生长的EC50值范围为0.056~0.530 μg/mL,最高值是最低值的9.46倍,平均EC50值为 (0.273 ± 0.067)μg/mL。其敏感性频率分布呈连续单峰曲线,正态检验P = 0.157(> 0.05),表明供试菌株对吡唑醚菌酯的敏感性频率符合正态分布。
175株尖孢炭疽复合种分生孢子萌发对吡唑醚菌酯的敏感性分布见图1-B,其中EC50值最高为0.027 μg/mL,最低为0.002 μg/mL,最高值是最低值的13.5倍,平均EC50值为 (0.014 ± 0.019) μg/mL。从敏感性频率分布图看,供试菌株对吡唑醚菌酯的敏感性呈连续单峰曲线变化,符合正态分布 (P = 0.908)。
因此,本研究所得平均EC50值可作为山东省辣椒炭疽病菌对吡唑醚菌酯敏感基线的参考值,用于其田间抗药性监测。
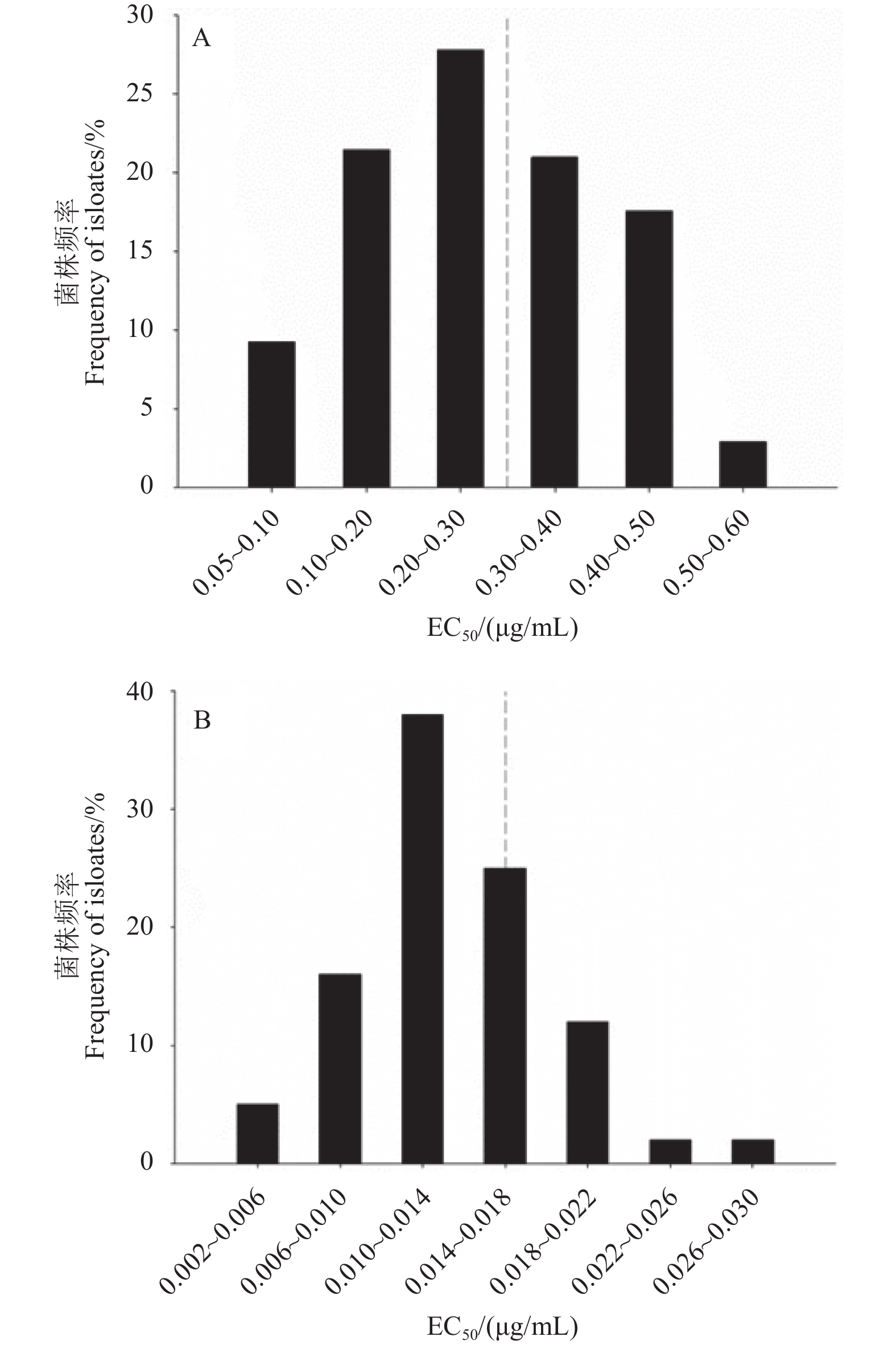
|
A. 菌丝生长;B. 分生孢子萌发。 A.Mycelial growth; B. Spore germination. 图 1 尖孢炭疽复合种对吡唑醚菌酯的敏感性频率分布 Fig. 1 Sensitivity frequency of C. acutatum species complex to pyraclostrobin |
2.2 不同采集地菌株对吡唑醚菌酯的敏感性差异
由表1可看出,6个采样地区的尖孢炭疽复合种对吡唑醚菌酯均表现为敏感,其中对菌丝生长和孢子萌发的平均EC50值范围分别为0.202~0.349和0.012~0.016 μg/mL。方差分析结果表明:来自不同地区的尖孢炭疽复合种对吡唑醚菌酯的敏感性存在一定差异,其中来源于菏泽市的菌株敏感性最高,来自潍坊市和德州市的菌株敏感性最低,且具有一定的差异显著性,说明尖孢炭疽复合种对吡唑醚菌酯的敏感性与菌株的地理来源有一定的相关性。
|
|
表 1 山东省不同地区尖孢炭疽复合种对吡唑醚菌酯的敏感性 Table 1 Sensitivity of C. acutatum species complex obtained from different locations in Shandong Province to pyraclostrobin |
2.3 复配药剂对尖孢炭疽复合种的联合毒力
吡唑醚菌酯与不同药剂复配对尖孢炭疽复合种菌丝生长表现出不同程度的抑制活性 (表2)。除吡唑醚菌酯与多菌灵 (1:3、1:1、3:1) 及吡唑醚菌酯与咯菌腈 (3:1) 复配时表现为相加作用外,其余配比均表现为增效作用,其中,吡唑醚菌酯和咯菌腈 (1:1) 复配的增效系数高达5.80,增效作用最佳。
|
|
表 2 混剂对辣椒上尖孢炭疽复合种菌丝生长的联合毒力 Table 2 Joint-toxicity of fungicide mixtures against mycelial growth of C. acutatum species complex in chili |
吡唑醚菌酯与不同药剂复配对尖孢炭疽复合种孢子萌发的毒力测定结果见表3。其中,吡唑醚菌酯与多菌灵 (1:3) 及吡唑醚菌酯与甲基硫菌灵 (1:3、3:1) 复配表现为增效作用,且吡唑醚菌酯与甲基硫菌灵 (1:3) 复配时增效系数最高,为3.94。
|
|
表 3 混剂对尖孢炭疽复合种分生孢子萌发的联合毒力 Table 3 Joint-toxicity of fungicide mixtures against conidia germination of C. acutatum species complex in chili |
综上所述,吡唑醚菌酯与甲基硫菌灵 (1:3、3:1) 复配对尖孢炭疽复合种菌丝生长和孢子萌发均表现为增效作用,即混剂对病原菌具有较高的抑制活性。
3 结论与讨论不同作用机理杀菌剂对病原菌各生长阶段的影响存在较大差异,了解杀菌剂的作用方式对指导其田间适期施用具有重要意义。研究表明,呼吸抑制剂类杀菌剂如甲氧基丙烯酸酯类[22-23]和琥珀酸脱氢酶抑制剂类[24]对病原真菌孢子萌发的抑制活性通常高于对菌丝生长的抑制活性,本研究结果与文献报道一致。其原因可能是由于分生孢子萌发过程与病原菌其他生长阶段相比需要更多的能量[25],而吡唑醚菌酯等呼吸抑制剂类杀菌剂抑制了菌体能量 (ATP) 的产生,使其无法满足孢子萌发的需求,从而表现出显著的抑制作用。
建立敏感基线是进行抗药性监测,制定抗性治理策略的重要内容。在杀菌剂正式推广用于防治某种病害之前,建立敏感基线有助于进行田间抗药性菌株的监测并制定科学的病害管理方案。本研究中,175株尖孢炭疽复合种对吡唑醚菌酯的敏感性频率分布呈连续单峰曲线,符合正态分布,对病原菌菌丝生长和孢子萌发的平均EC50值分别为 (0.273 ± 0.067) 和 (0.014 ± 0.019) μg/mL,表明引起山东省辣椒炭疽病的主要优势病原菌尖孢炭疽复合种对吡唑醚菌酯仍处于敏感阶段,因此可将吡唑醚菌酯对供试菌株的平均EC50值作为山东省尖孢炭疽复合种对吡唑醚菌酯的敏感基线参考值。林婷等[26]测定了65株草莓炭疽菌C. gloeosporioides对吡唑醚菌酯的敏感性,建立的敏感基线参考值为6.65 μg/mL。可见,来自炭疽属不同种的炭疽病菌对吡唑醚菌酯的敏感性存在一定差异。本研究中,不同地理来源的病原菌群体对吡唑醚菌酯的敏感性也存在一定差异,其中德州市和潍坊市菌株的敏感性相对较低,推测可能与当地的辣椒品种、种植模式与施药习惯等因素有关,具体还有待进一步明确。
由于吡唑醚菌酯作用位点单一,已被国际杀菌剂抗性委员会(FRAC)认证为高抗性风险类药剂,同时单独使用该药剂的成本也较高[17]。为延缓尖孢炭疽复合种对吡唑醚菌酯抗性发展速度及降低使用成本,合理复配使用是有效途径之一[27]。本研究选取了不同作用机制的5种药剂与吡唑醚菌酯复配,15种组合中仅吡唑醚菌酯与甲基硫菌灵 (体积比1:3和3:1) 复配对抑制尖孢炭疽复合种的菌丝生长和分生孢子萌发均具有增效作用,其中吡唑醚菌酯与甲基硫菌灵1:3复配时增效最为明显。陈芳娟等[28]研究发现,吡唑醚菌酯和甲基硫菌灵质量比1:8的混合物对红色辣椒炭疽病菌C. gloeosporioides和黑色辣椒炭疽病菌C. capsici菌丝生长和孢子萌发的抑制活性都表现为增效作用。甲基硫菌灵作为广谱、低毒的苯并咪唑类杀菌剂,具有内吸、预防和治疗作用[29],且价格相对较低,与吡唑醚菌酯混用具有较高的性价比。但有关复配剂的田间实际应用效果还需进一步验证。
| [1] |
高杨杨, 禾丽菲, 李北兴, 等. 山东省辣椒炭疽病病原菌的鉴定及高效防治药剂的筛选[J]. 中国农业科学, 2017, 50(8): 1452–1464.
GAO Y Y, HE L F, LI B X, et al. Identification of the pathogen causing pepper anthracnose in Shandong Province and screening of highly effective fungicides[J]. Scientia Agric Sinica, 2017, 50(8): 1452–1464. doi:10.3864/j.issn.0578-1752.2017.08.009 |
| [2] | RAMDIAL H, RAMPERSAD S N. Characterization of Colletotrichum spp. causing anthracnose of bell pepper (Capsicum annuum L.) in Trinidad [J]. Phytoparasitica, 2015, 43(1): 37–49. doi:10.1007/s12600-014-0428-z |
| [3] | LEWIS-IVEY M L, NAVA-DIAZ C, MILLER S A. Identification and management of Colletotrichum acutatum on immature bell peppers [J]. Plant Dis, 2004, 88(11): 1198–1204. doi:10.1094/PDIS.2004.88.11.1198 |
| [4] | PERES N A, TIMMER L W, ADASKAVEG J E, et al. Lifestyles of Colletotrichum acutatum [J]. Plant Dis, 2005, 89(8): 784–796. doi:10.1094/PD-89-0784 |
| [5] |
孙春英, 毛胜利, 张正海, 等. 辣椒抗炭疽病遗传与育种研究进展[J]. 园艺学报, 2013, 40(3): 579–590.
SUN C Y, MAO S L, ZHANG Z H, et al. Progress on genetics and breeding of resistance to anthracnose (Colletotrichum spp.) in pepper [J]. Acta Hortic Sinica, 2013, 40(3): 579–590. |
| [6] | KIM S H, YOON J B, PARK H G. Inheritance of anthracnose resistance in a new genetic resource, Capsicum baccatum PI594137 [J]. J Crop Sci Biot, 2008, 11(1): 13–16. |
| [7] |
曾庆华, 肖仲久, 向金玉, 等. 3 种杀菌剂对黑点型辣椒炭疽病菌的室内毒力测定[J]. 贵州农业科学, 2010, 38(5): 93–94.
ZENG Q H, XIAO Z J, XIANG J Y, et al. Indoor toxicity determination of 3 fungicides to anthrax germ with black spots of hot pepper[J]. Guizhou Agric Sci, 2010, 38(5): 93–94. |
| [8] |
夏花, 朱宏建, 周倩, 等. 湖南芷江辣椒上一种新炭疽病的病原鉴定[J]. 植物病理学报, 2012, 42(2): 120–125.
XIA H, ZHU H J, ZHOU Q, et al. Pathogen identification of a new anthracnose of pepper in Zhijiang, Hunan[J]. Acta Phytopathol Sinica, 2012, 42(2): 120–125. |
| [9] |
刘冰, 王连英, 黄新根, 等. 1 种辣椒新炭疽病的初步鉴定及室内药剂筛选[J]. 生物灾害科学, 2013, 36(3): 262–264.
LIU B, WANG L Y, HUANG X G, et al. Identification of a new anthracnose of peppers and screening of fungicides[J]. Biol Dis Sci, 2013, 36(3): 262–264. |
| [10] | DE LOS SANTOS GARCÍA DE PAREDES B, MUÑOZ F R. Effect of different fungicides in the control of Colletotrichum acutatum, causal agent of anthracnose crown rot in strawberry plants [J]. Crop Prot, 2002, 21(1): 11–15. doi:10.1016/S0261-2194(01)00054-0 |
| [11] |
李红霞, 刘照云, 王建新, 等. 辣椒炭疽病菌对嘧菌酯的敏感性测定[J]. 植物病理学报, 2005, 35(1): 73–77.
LI H X, LIU Z Y, WANG J X, et al. Baseline sensitivity of Colletotrichum gloeosporioides and C. capsici from capsium to azoxystrobin [J]. Acta Phytopathol Sinica, 2005, 35(1): 73–77. |
| [12] | PERES N A R, SOUZA N L, ZITKO S E, et al. Activity of benomyl for control of postbloom fruit drop of citrus caused by Colletotrichum acutatum [J]. J MED CHEM, 2002, 19(4): 512–516. |
| [13] | TALHINHAS P, SREENIVASAPRASAD S, NEVES-MARTINS J, et al. Molecular and phenotypic analyses reveal association of diverse Colletotrichum acutatum groups and a low level of C. gloeosporioides with olive anthracnose [J]. Appl Environ Microbiol, 2005, 71(6): 2987–2998. doi:10.1128/AEM.71.6.2987-2998.2005 |
| [14] |
邓维萍, 杨敏, 杜飞, 等. 云南葡萄产区葡萄炭疽病病原鉴定及致病力分析[J]. 植物保护学报, 2013, 40(1): 62–67.
DENG W P, YANG M, DU F, et al. Identification of the pathogen causing grape anthracnose in Yunnan and its pathogenicity[J]. Acta Phytophyl Sinica, 2013, 40(1): 62–67. |
| [15] |
曹学仁, 车海彦, 杨毅, 等. 2014 年海南省橡胶炭疽病菌对多菌灵和咪鲜胺的敏感性测定[J]. 植物病理学报, 2015, 45(6): 626–631.
CAO X R, CHE H Y, YANG Y, et al. Sensitivity of Colletotrichum spp. from Hevea brasiliensis to carbendazim and prochloraz in Hainan Province in China in 2014 [J]. Acta Phytopathol Sinica, 2015, 45(6): 626–631. |
| [16] | YPEMA H L, GOLD R E. Kresoxim-methyl: modification of a naturally occurring compound to produce a new fungicide[J]. Plant Dis, 1999, 83(1): 4–19. doi:10.1094/PDIS.1999.83.1.4 |
| [17] |
杨丽娟, 柏亚罗. 甲氧基丙烯酸酯类杀菌剂——吡唑醚菌酯[J]. 现代农药, 2012, 11(4): 46–50.
YANG L J, BAI Y L. Strobilurin fungicide—pyraclostrobin[J]. Mod Agrochem, 2012, 11(4): 46–50. |
| [18] | FORCELINI B B, SEIJO T E, AMIRI A, et al. Resistance in strawberry isolates of Colletotrichum acutatum from Florida to quinone-outside inhibitor fungicides [J]. Plant Dis, 2016, 100(10): 2050–2056. doi:10.1094/PDIS-01-16-0118-RE |
| [19] | LIANG H J, DI Y L, LI J L, et al. Baseline sensitivity of pyraclostrobin and toxicity of SHAM to Sclerotinia sclerotiorum [J]. Plant Dis, 2015, 99(2): 267–273. doi:10.1094/PDIS-06-14-0633-RE |
| [20] | AMIRI A, HEATH S M, PERES N A. Phenotypic characterization of multifungicide resistance in Botrytis cinerea isolates from strawberry fields in Florida [J]. Plant Dis, 2013, 97(3): 393–401. doi:10.1094/PDIS-08-12-0748-RE |
| [21] |
中华人民共和国农业部. 农药室内生物测定试验准则 杀菌剂第 6 部分: 混配的联合作用测定: NY/T 1156.6—2006[S]. 北京: 中国农业出版社, 2006.
Ministry of Agriculture of the People’s Republic of China. Pesticides guidelines for laboratory bioactivity tests Part 6: determining combined action of fungicide mixtures: NY/T 1156.6—2006[S]. Beijing: China Agriculture Press, 2006. |
| [22] | HINCAPIE M, WANG N Y, PERES N A, et al. Baseline sensitivity of Guignardia citricarpa isolates from Florida to azoxystrobin and pyraclostrobin [J]. Plant Dis, 2014, 98(6): 780–789. doi:10.1094/PDIS-03-13-0335-RE |
| [23] | ZHANG C Q, LIU Y H, WU H M, et al. Baseline sensitivity of Pestalotiopsis microspora, which causes black spot disease on Chinese hickory (Carya cathayensis), to pyraclostrobin [J]. Crop Prot, 2012, 42: 256–259. doi:10.1016/j.cropro.2012.07.018 |
| [24] | VELOUKAS T, KARAOGLANIDIS G S. Biological activity of the succinate dehydrogenase inhibitor fluopyram against Botrytis cinerea, and fungal baseline sensitivity [J]. Pest Manage Sci, 2012, 68(6): 858–864. doi:10.1002/ps.v68.6 |
| [25] | ALLEN P J. Metabolic aspects of spore germination in fungi[J]. Annu Rev Phytopat, 2003, 3: 313–342. |
| [26] |
林婷, 时浩杰, 戴德江, 等. 草莓炭疽病菌对吡唑醚菌酯的敏感性及旁路氧化在胶孢炭疽菌对 QoIs 敏感性中的作用[J]. 农药学学报, 2015, 17(5): 530–537.
LIN T, SHI H J, DAI D J, et al. Characterization of sensitivity of Colletotrichum gloeosporioides from strawberry to pyraclostrobin and involvement of alternative respiration in the regulation of sensitivity [J]. Chin J Pestic Sci, 2015, 17(5): 530–537. |
| [27] |
柏亚罗, 万红梅. 甲氧基丙烯酸酯类杀菌剂的抗性剖析[J]. 农药, 2009, 48(2): 88–95.
BAI Y L, WAN H M. Analysis for resistance to Qo inhitor fungicides[J]. Agrochemicals, 2009, 48(2): 88–95. |
| [28] |
陈娟芳, 任佐华, 彭伟业, 等. 吡唑醚菌酯和甲基硫菌灵对 2 种辣椒炭疽病菌的室内联合毒力测定[J]. 现代农药, 2016, 15(1): 44–47.
CHEN J F, REN Z H, PENG W Y, et al. Joint-toxicity of mixtures of pyraclostrobin with thiophanate-methyl against two kinds of Colletotrichum spp [J]. Mod Agrochem, 2016, 15(1): 44–47. |
| [29] |
苑学霞, 梁京芸, 王文博, 等. 苹果和土壤中甲基硫菌灵及其代谢物残留消解动态[J]. 生态环境学报, 2016, 25(1): 135–140.
YUAN X X, LIANG J Y, WANG W B, et al. Dynamics and residue of thiophanate-methyl and its metabolite in apple and soil[J]. Ecol Environ Sci, 2016, 25(1): 135–140. |
 2017, Vol. 19
2017, Vol. 19


