2. 山东医药技师学院,山东 泰安,271018
2. Shandong Medicine Technician College, Tai’an 271018, Shandong Province, China
农药微囊化由于能够提高药剂的稳定性[1-2],延长持效期,降低药剂对高等动物及非靶标生物的毒性而备受农药化工企业的关注[3-7]。微囊通常由囊芯和囊壁组成,不同壁材的微囊性能差异较大[8],尤其是在外观形貌、释放特性及药效方面[9-11],因此囊壁材料的选择是微囊制剂研发的关键,探索开发新的壁材和成囊工艺,研究新型微囊的理化性质对于制剂研究开发工作具有重要意义。目前,农药微囊的制备工艺主要以界面聚合法为主,多采用异氰酸酯类多聚物与交联剂发生聚合反应形成的聚脲[12-15]、聚氨酯[16-17]和聚酰胺[18-20]等作为壁材,但有研究报道,异氰酸酯类化合物对呼吸道具有刺激和损伤作用,并存在潜在致癌性[21],因此开发新的、安全性更高的囊壁材料对微囊技术的开发应用具有重要意义。
环氧树脂及其改性物因具有优异的理化性能已在航天航空、电子电气制造、机械制造和建筑等领域广泛应用,并可用于制备涂料、胶粘剂、复合材料等产品[22-24],但尚未见将其用于制备农药微囊的报道。Pascu等[25]以环氧树脂和羧酸反应后的交联产物为壁材制备了甲苯微囊;方一等[26]以酚醛环氧树脂与二元胺的聚合物为壁材,制备了溶有分散蓝染料的二芳基乙烷微囊。由于这些囊芯物质与农药及其溶剂性质相近,因此为使用环氧树脂材料制备农药微囊提供了可能性。
高效氯氟氰菊酯 (lambda-cyhalothrin) 是目前使用最普遍的拟除虫菊酯类杀虫剂之一,主要用于防治农业及卫生害虫[27]。由于其具有较强的皮肤致敏性,因此将高效氯氟氰菊酯制成微囊剂除了可延长持效期外还可以降低其刺激性和急性毒性[28]。目前已报道的用于制备菊酯类微囊的壁材有聚合4, 4'-二苯基甲烷二异氰酸酯 (MDI) 和多元胺的反应产物[29]、聚碳酸亚丙酯-聚乙二醇共混物[30]及脲醛树脂[31-32]等。本研究以高效氯氟氰菊酯为模式药剂,尝试以油相单体酚醛环氧树脂与水相单体丙二胺反应的聚合物为囊壁材料制备微囊,探索该材料制备高效氯氟氰菊酯微囊的可行性,明确壁材组分用量和制备工艺条件等对微囊参数的影响,评价其释放特性和初步生物活性,以期为农药微囊剂新型壁材的开发和使用提供参考。
1 材料与方法 1.1 仪器与试剂GC-2010 plus气相色谱仪,配备氢火焰离子化检测器 (FID,日本岛津公司);LS-POP (6) 激光粒度分析仪 (珠海欧美克仪器有限公司);CH-生物显微镜 (日本OLYMPUS公司);SS-550扫描电子显微镜 (日本岛津公司);JJ-1型数显测速电动搅拌器 (常州国华电器有限公司);HH-4超级恒温水浴锅 (金坛区西城新瑞仪器厂);T18剪切分散机 (德国IKA公司);血液混匀器 (上海旌派仪器有限公司);KQ-500DE型数控超声波清洗器 (昆山市超声波仪器有限公司)。
95%高效氯氟氰菊酯 (lambda-cyhalothrin) 原药 (江苏省农药研究所股份有限公司);2.5%高效氯氟氰菊酯乳油 (EC,山东神星药业有限公司);酚醛环氧树脂 (蓝星化工新材料股份有限公司无锡树脂厂);酚醛胺 (T-31) 环氧树脂固化剂 (上海寓言化工科技有限公司);木质素磺酸钠 (美国MeadWestvaco公司);乳化剂T-80 (邢台蓝星助剂厂);三甲苯、丙二胺、正己烷、无水乙醇、邻苯二甲酸二环己酯等试剂均为色谱纯。
1.2 供试昆虫小地老虎Agrotis ypsilon (Rottem-berg),由山东农业大学农药毒理及应用技术省级重点实验室提供。待幼虫孵化后,转移到添加新鲜人工饲料的24孔板中饲养,饲养条件为 (27 ± 1) ℃、16L :8D、相对湿度 (75 ± 5)%。
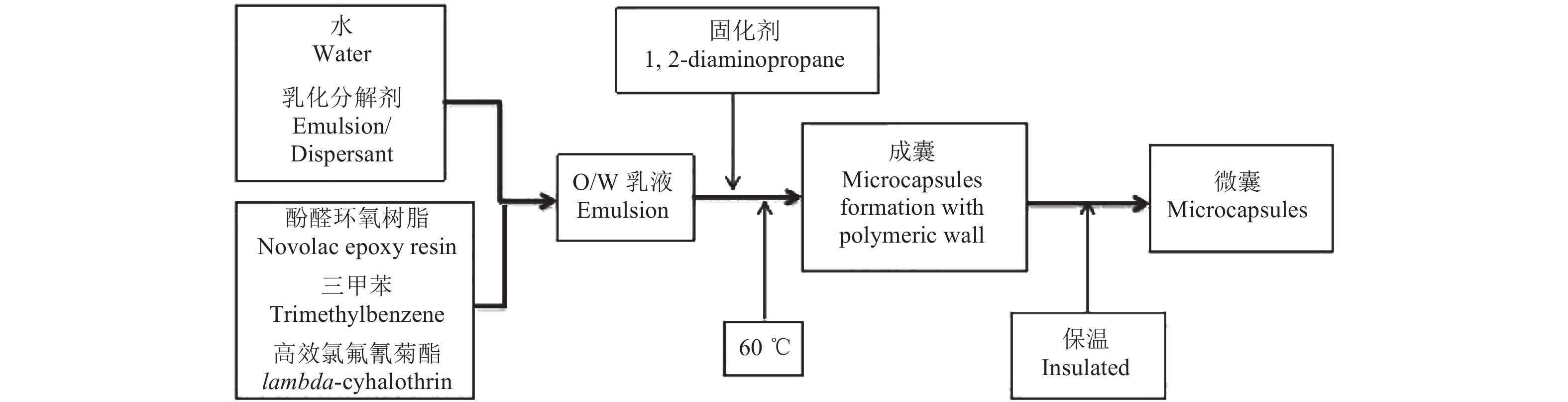
1.3 微囊制备方法参考方一等[26]报道的方法进行,制备流程见图1。油相的准备:常温下称取10.53 g高效氯氟氰菊酯原药与10.0 g三甲苯,搅拌混匀,再加入适量 (3.0~5.0 g) 酚醛环氧树脂,混合均匀。水相的准备:称取4.0 g木质素磺酸钠和1.5 g吐温-80,溶解于适量水中。将油相和水相混合后高速均质剪切,然后将O/W乳液转移至三口烧瓶中,搅拌并于50 ℃水浴加热10 min。称取2.0 g质量分数为20%的丙二胺溶液,加热至50 ℃,10 min内缓慢滴加到装有O/W乳液的三口烧瓶中,使发生界面聚合反应。逐步升温至65 ℃以固化囊壁,反应5 h后于室温 (25 ℃) 下冷却,储存在干燥的样品瓶中,备用。以三甲苯为囊芯制备空白酚醛环氧树脂微囊。
|
图 1 微囊制备流程 Fig. 1 The flow chart of the preparation of microcapsules |
1.4 微囊性能表征 1.4.1 形貌的表征
显微观察:用清水稀释10倍后,用光学显微镜进行拍照;通过电子扫描显微镜观察微囊的微观形貌并拍照。
1.4.2 粒径大小及分布测定用激光粒度分析仪测试微囊的粒径大小及分布。
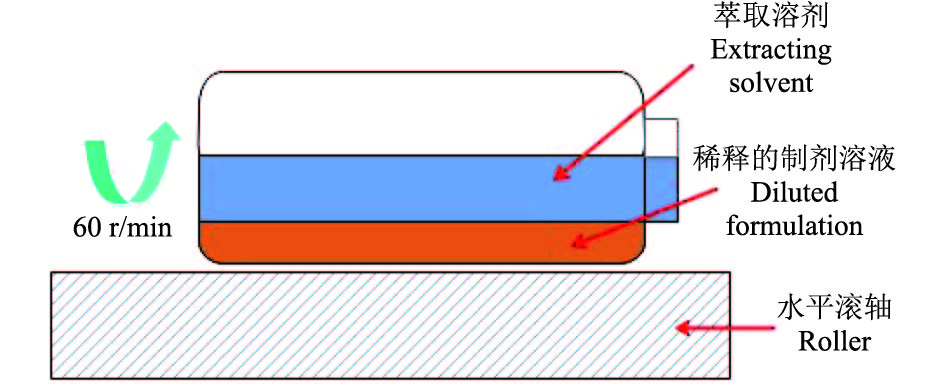
1.4.3 包封率测定参照国际农药分析协作委员会 (CIPAC) 制定的MT189中方法[33]进行,用于检测的微囊样品均为按照农药热贮和冷贮稳定性试验检测合格的样品 (以下试验样品均为检测合格的样品)。将含有70~80 mg高效氯氟氰菊酯的微囊样品装进60 mL洁净玻璃瓶中,加水5 mL,摇晃使其均匀分散 (尽量避免样品附着到瓶壁)。添加50 mL内标溶液 (将0.025 g邻苯二甲酸二环已酯溶解于900 mL正己烷-100 mL乙醇混合液中配得),旋紧瓶盖放至混匀器上 (图2),设置水平滚动转速为60 r/min (玻璃瓶应远离电机,以防止测试期间温度上升)。5 min后取下,立即取出约1 mL正己烷层,待气相色谱 (GC) 测定,整个过程在室温 (20~25 ℃) 下进行。按照公式 (1) 计算包封率 (R,%)[33]。
|
$R{\rm{/\% }} = \left[ {1 - \frac{{Q \times 50}}{{w \times c}}} \right] \times 100$
|
(1) |
式中:Q = 正己烷层中有效成分的质量浓度 (mg/mL),w = 样本质量 (g);c=总样本中高效氯氟氰菊酯的质量分数 (g/kg)。
气相色谱检测条件:HP-5色谱柱 (15.0 m × 0.53 mm);进样口温度260 ℃;柱温 (235 ± 5) ℃;检测器温度280 ℃;分流比10:1;气体流速,载气 (N2) 10 mL/min,H2 40 mL/min,空气400 mL/min,尾吹气 (N2) 20 mL/min;进样量1.0 μL。保留时间:邻苯二甲酸二环已酯约为3.5 min,高效氯氟氰菊酯约为6.6 min。
1.4.4 载药量测定将微囊制剂离心,用去离子水充分洗涤,干燥。准确称取干燥微囊样品0.05 g,加入适量乙醇中,经超声波细胞破碎仪破囊,用乙醇定容至100 mL,过0.22 μm有机滤膜后,采用气相色谱法测定高效氯氰菊酯的含量。微囊载药量 (φ,%) 按公式 (2) 计算。
|
$\phi / {\%} = \frac{{m_{{}_{\rm{1}}}}}{{m_{{}_2}}} \times {\rm{100}}$
|
(2) |
式中:m1 = 微囊中高效氯氟氰菊酯质量 (g),m2 = 微囊干样质量 (g)。
1.4.5 微囊释放性能表征微囊释放性能测定参照CIPAC制定的MT190[34]方法并进行改进。将含70~80 mg高效氯氟氰菊酯的微囊样品装入150 mL玻璃瓶中,加水5 mL,摇匀。添加内标溶液100 mL,旋紧瓶盖置于混匀器上,转速设置同1.4.3节。1 min后取下,立即取出约1 mL正己烷层,待气相色谱检测高效氯氟氰菊酯的含量。分别在开始试验后15、30、60、120和240 min时重复该过程,根据测定的高效氯氟氰菊酯释放量绘制释放曲线。
1.5 毒力测定采用浸叶法[35]测定供试药剂对小地老虎3龄幼虫的毒力。药剂先用去离子水配制成母液,再按照等比方法稀释得到5~7个系列浓度的药液。将空白甘蓝叶片制成直径1.5 cm的圆片,在药液中浸泡10 s,取出晾干后放入24孔养虫板中,每孔2个叶片。接入3龄幼虫1头,每处理重复3次,每重复20头试虫,以清水作对照。将养虫板置于 (27 ± 1) ℃、相对湿度 (75 ± 5)%、光周期16L:8D的实验室条件下,48 h后检查结果,用镊子轻触无反应者视为死亡。
用DPS软件计算不同粒径高效氯氟氰菊酯微囊及乳油对小地老虎的毒力回归方程、LC50值及95%置信限。
2 结果与分析 2.1 高效氯氟氰菊酯微囊的特征载药微囊、酚醛环氧树脂和高效氯氟氰菊酯原药的红外光谱图见图3。图3c中:3 069、2 965及2 882 cm–1的强峰是高效氯氟氰菊酯C—H伸缩振动的吸收峰,2 360 cm–1强峰是其C—N伸缩振动的吸收峰,1 728 cm–1是其C—O伸缩振动的吸收峰,1 590 和1 488 cm–1强峰是其C=C伸缩振动的吸收峰。比较图3中a和b线发现,环氧基的特征吸收峰912 cm–1在成囊固化后强度明显变弱,表明环氧基已经发生开环反应生成羟基;比较a和c线发现,高效氯氟氰菊酯的特征峰均未在a中出现,证明原药已被成功包裹。显微镜观察发现,采用优化条件制备的微囊呈球状,表面光滑且微囊之间无黏连,单分散性较好 (图4);通过扫描电镜观察到微囊结构完整,表面光滑且伴有少量褶皱 (图5)。

|
图 3 载药微囊 (a)、酚醛环氧树脂 (b) 和高效氯氟氰菊酯原药 (c) 的红外光谱图 Fig. 3 FTIR spectra of lambda-cyhalothrin microcapsules (a), epoxy/phenol-formaldehyde resin (b) and active ingredient of lambda-cyhalothrin (c) |

|
图 4 载药微囊的显微镜照片 (放大400倍) Fig. 4 Microscope photographs of lambda-cyhalothrin microcapsules (magnification 400 times) |

|
图 5 微囊扫描电镜照片 Fig. 5 SEM photographs of microcapsules |
2.2 催化剂对成囊速率的影响
催化剂在一定程度上可以缩短反应时间,提高反应效率。微囊剂的成囊时间是指从加入水溶性多元胺开始,在显微镜下持续观察至形成形态一致且蒸干水分后稳定不破裂的球体的时间。本研究尝试使用T-31作为成囊过程的催化剂,发现加入1.0 g的T-31催化后,成囊时间由未加催化剂前的4.0 h缩短为1.0 h,表明催化剂的加入明显加快了成囊速率,提高了反应效率。
2.3 酚醛环氧树脂用量对微囊包封率、载药量和粒径的影响包封率和载药量是评价微囊包覆效率的重要指标[36]。当剪切转速为3 000 r/min,保持其他条件不变时,壁材酚醛环氧树脂质量分数分别为3%、4%、5%和6%的微囊的包封率、载药量和粒径测定结果见表1。其中,酚醛环氧树脂用量对微囊的包封率基本无影响,但对载药量和粒径影响显著,随其用量增加,微囊的载药量逐渐降低,粒径逐渐增大。
|
|
表 1 酚醛环氧树脂用量对微囊包封率、载药量和粒径的影响 Table 1 The effect novolac epoxy resin amount on the encapsulation efficiency, loading capacity and particle size of the microcapsules |
2.4 酚醛环氧树脂用量对微囊释放性能的影响
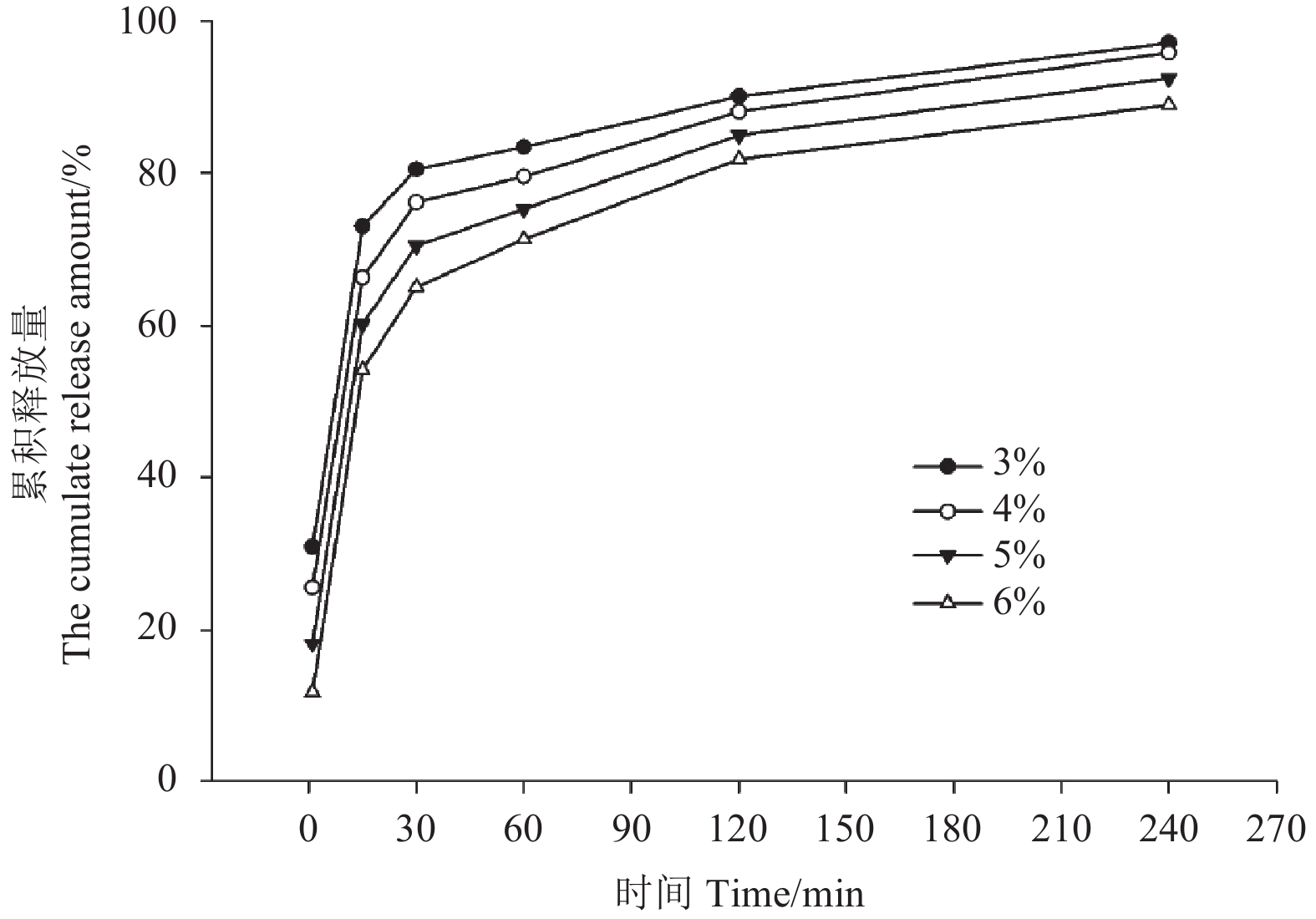
酚醛环氧树脂质量分数分别为3%、4%、5%和6%的高效氯氟氰菊酯微囊的释放性能测定结果见图6。1 min时,酚醛环氧树脂用量为3%的样品的初始累积释放量为30.95%,当其用量增加到6%时,样品的初始累积释放量降低至11.68%;1~15 min内出现了释放速率急剧增大的现象,说明此时段内大量芯材物质被释放到了囊壁外;15~30 min内释放速率开始下降;30~240 min内,各样品的累积释放量均趋于稳定,且在240 min时累积释放量分别达到97.04%、95.74%、92.40%和90.87%。总体而言,随着酚醛环氧树脂用量增加,芯材的释放速率逐渐降低,但各处理随时间变化的趋势基本一致。
|
图 6 不同酚醛环氧树脂用量对应微囊的释放性能 Fig. 6 The release profiles of microcapsules prepared with different contents of novolac epoxy resin |
2.5 乳化剪切转速对微囊粒径及释放的影响
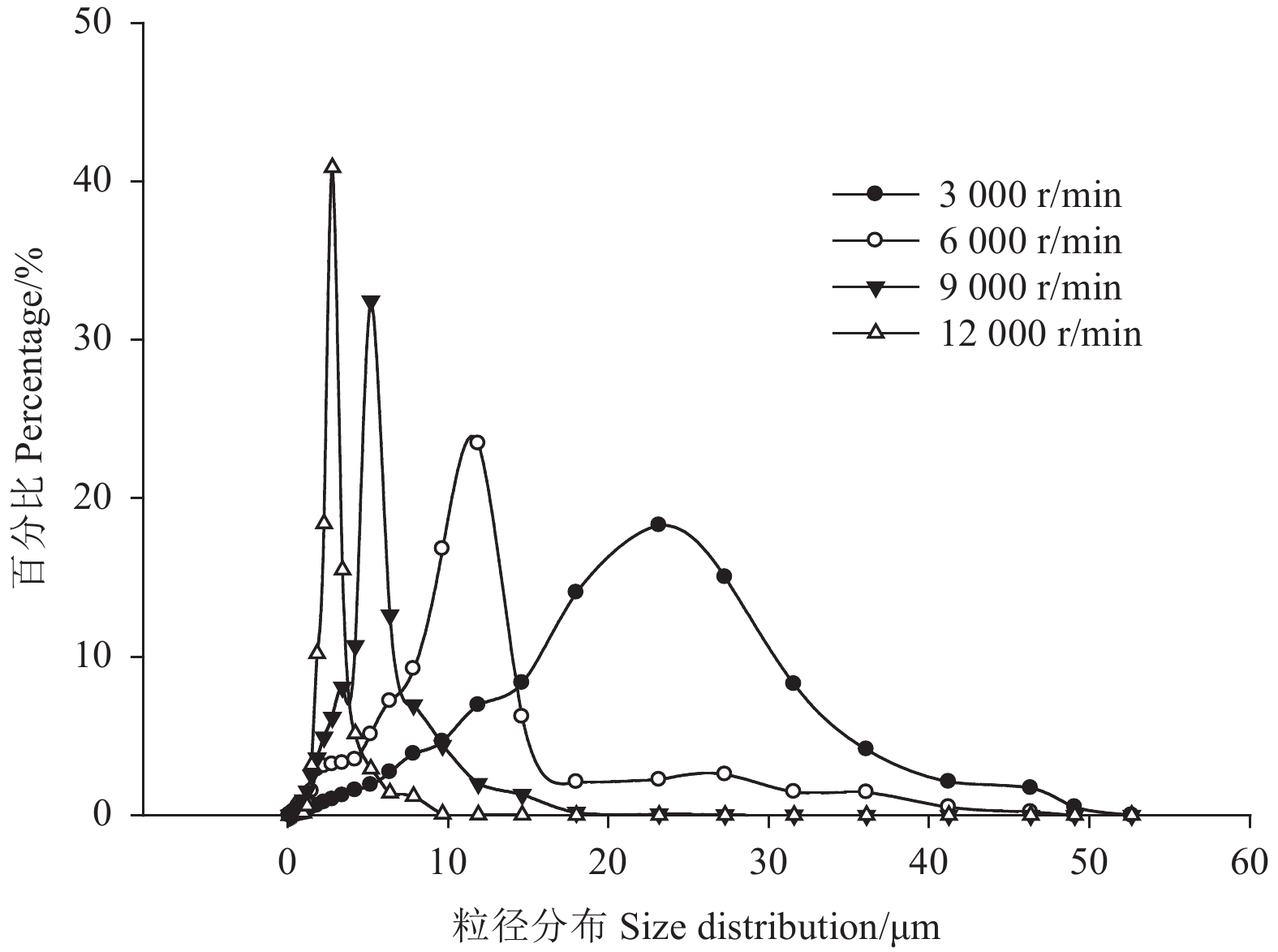
乳化剪切转速是影响微囊粒径的主要因素之一[36]。当酚醛环氧树脂质量分数为5%,保持其他条件不变时,3 000、6 000、9 000和12 000 r/min乳化剪切转速下制备的微囊的粒径分布见图7,其平均粒径分别为23.15、11.86、5.19和2.76 μm。图8为4个样品的显微镜照片,其平均粒径分别在25.00、10.00、7.50和2.50 μm左右,与激光粒度分析仪检测结果基本一致。
|
图 7 不同剪切转速对应微囊的粒径分布 Fig. 7 The particle size distribution of microcapsules prepared under different shear rate |

|
a. 3 000 r/min;b. 6 000 r/min;c. 9 000 r/min;d. 12 000 r/min。 图 8 不同剪切转速对应微囊的显微镜图片 (400×) Fig. 8 The microscope images of microcapsules prepared under different shear rate (400×) |
不同粒径样品的释放性能测定结果如图9所示,在1~240 min内均表现为随微囊粒径降低释放速率减缓的规律,在1 min时,随微囊粒径由23.15 μm减小到2.76 μm,其累计释放量由12.21%增加到62.01%。在0~15 min内各粒径样品的累积释放量均大于65%,表明该阶段为快速释放阶段;15 min后各样品释放速率均下降,且不同粒径微囊的释放速率差异逐渐减小;到240 min时,4种粒径 (23.15、11.86、5.19和2.76 μm) 微囊的有效成分累积释放量分别达到91.55%、94.38%、96.75%和98.80%。
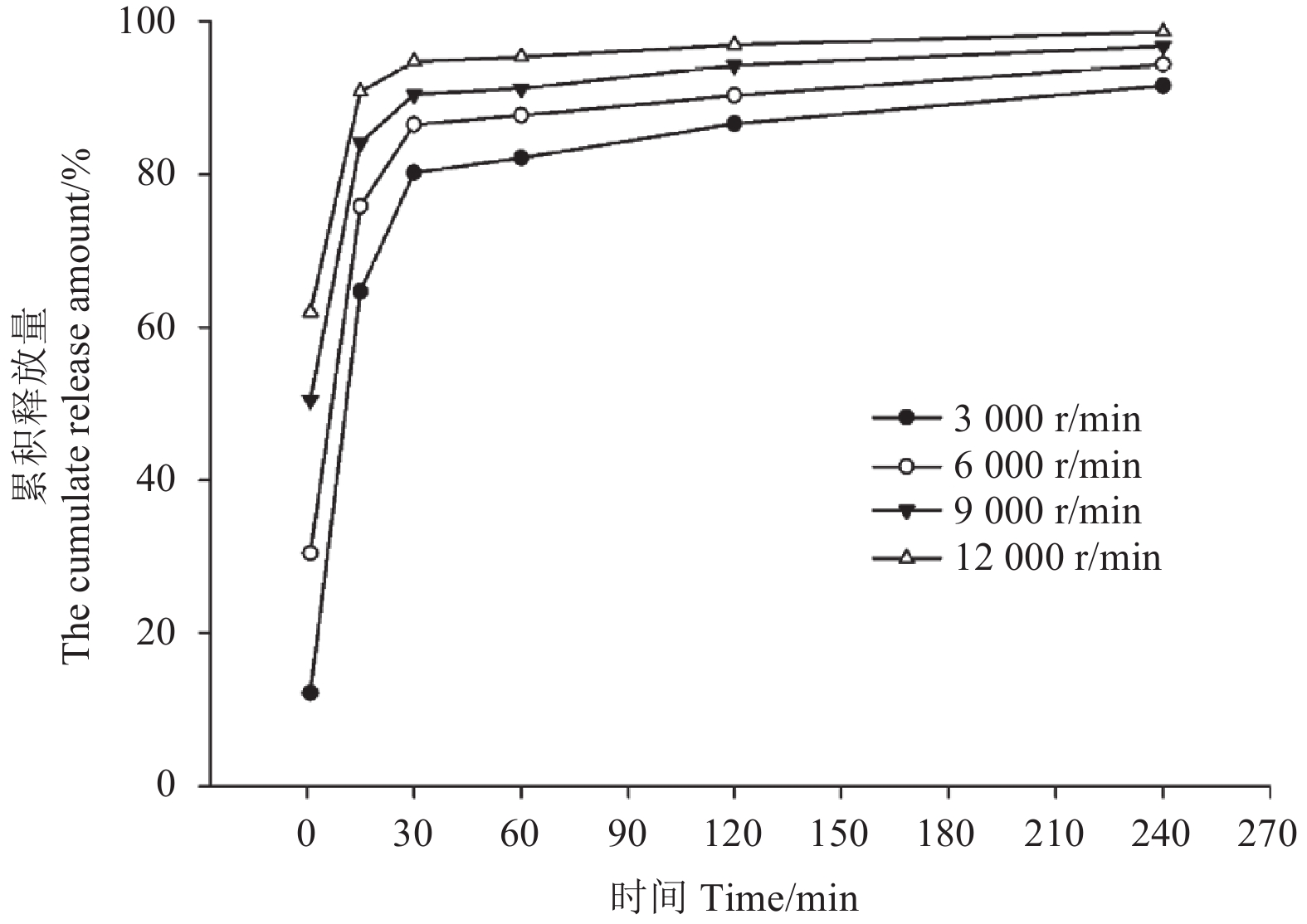
|
图 9 不同剪切转速对应微囊的释放性能 Fig. 9 The release profiles of microcapsules prepared under different shear rate |
2.6 高效氯氟氰菊酯微囊对小地老虎幼虫的毒力
不同粒径 (23.15、11.86、5.19和2.76 μm) 高效氯氟氰菊酯微囊和同剂量乳油处理对小地老虎3龄幼虫的毒力测定结果见表2。从95%置信限看,微囊各处理之间毒力均存在一定程度的交叉,其毒力差异不显著;但微囊处理组毒力普遍略低于乳油;表明经丙二胺-酚醛环氧树脂聚合物包覆的高效氯氟氰菊酯能够释放出来并发挥生物活性,但其释放速率受到囊壁对扩散的限制,从而影响了粒径大于5 μm的高效氯氟氰菊酯微囊的毒力。此外,随着微囊平均粒径减小,其对小地老虎3龄幼虫的毒力逐渐增大,说明通过调节微囊的粒径范围,可调控有效成分的释放速率,进而影响丙二胺-酚醛环氧树脂聚合物包覆的高效氯氟氰菊酯微囊的生物活性。
|
|
表 2 高效氯氟氰菊酯乳油和微囊对小地老虎幼虫的毒力 Table 2 Toxicity of lambda-cyhalothrin microcapsules and emulsifiable concentrate to Agrotis ypsilon |
3 结论与讨论
本研究以酚醛环氧树脂和丙二胺为聚合反应单体,通过界面聚合反应制得了高效氯氟氰菊酯微囊。其囊壁的红外光谱图中,环氧基的特征吸收峰 (912 cm–1) 强度在成囊固化后明显变弱,这与崔占臣等[37]研究环氧树脂与三乙硫醇胺固化动力学时的结果一致,证明了酚醛环氧树脂环氧基开环反应的发生。电镜照片显示,所制备的微囊为表面光滑无孔洞伴有少量褶皱的球状微粒,这些特征也与方一等[26]报道的以界面聚合法制备的微囊是一致的。而出现少量褶皱的原因可能是在制样时囊芯物质释放形成的,同时从另一方面也表明界面聚合法制备的微囊囊壁相对较薄。
反应温度和催化剂是影响界面聚合反应的重要因素。本研究中将温度提高到65 ℃后,在显微镜下可逐步观察到微囊的出现,表明反应单体开始聚合,但该过程相对缓慢,而加入催化剂可以显著加快反应速率,缩短微囊制备时间,这在工业化生产中对于提高生产效率和降低生产成本均非常重要。
包封率和载药量是评价核壳结构微囊成囊工艺的重要指标。本研究中不同酚醛环氧树脂用量下包封率均在90%左右,随其用量增加包封率并没有相应增加。其原因与当油相和水相中的反应单体在油-水界面上接触时,二者迅速发生化学反应形成了不溶于水的高分子聚合物有关。不过当油性单体用量增加时,反而导致了载药量降低和粒径的增大,分析其原因可能是随着酚醛环氧树脂单体用量的增加,聚合物的分子量逐渐增大,从而导致微囊载药量下降和粒径逐渐增大,这与采用其他材料经界面聚合工艺制备微囊时的结果[38-39]一致。
微囊制剂的粒径分布越接近正态表明其稳定性越好,而剪切转速的大小是决定乳液液滴直径的因素之一,从而在一定程度上影响着最终微囊颗粒的粒径大小及分布[38]。在一定范围内,随着剪切转速提高,所得微囊的平均粒径越小,粒径分布越接近正态分布,且粒径范围逐渐变窄[15, 26]。本研究中,当剪切转速由3 000 r/min升高至12 000 r/min时,微囊的平均粒径由23.15 μm降低至2.76 μm,其粒径变化范围也随之减小。
微囊的囊壁厚度及结构、微囊粒径等均会直接影响囊芯物质的释放[39]。傅桂华等[40]和夏红英等[41]在利用界面聚合法制备农药微囊的过程中均发现,增加反应单体的用量会导致囊壁厚度增加,傅桂华等还进一步证明了囊壁厚度的增加会减慢囊芯物质的释放。本研究同样发现:随酚醛环氧树脂用量提高,微囊囊壁逐渐变厚,囊芯的释放速率逐渐降低;随微囊粒径减小,囊壁的比表面积逐渐增大,其释放速率随之加快。这与其他材料制备的农药微囊[11]也类似。本研究制得的高效氯氟氰菊酯微囊对小地老虎幼虫的杀虫活性随粒径的增大而降低,且其毒力低于相应的乳油剂型,这与囊芯物质的释放受到了囊壁材料的阻碍有关。而有关其屏蔽光的能力、对水生生物的毒性、对药剂致敏性的影响以及田间应用效果等尚待进一步研究明确。
综上所述,酚醛环氧树脂与二元胺反应的聚合物可用于制备高效氯氟氰菊酯微囊,其表面光滑无孔洞,微囊的粒径以及囊芯的释放速率可通过改变乳化剪切转速和酚醛环氧树脂单体的用量进行调节。所制备的高效氯氟氰菊酯微囊具有明显的缓释特性,表现为在0~15 min时为快速释放阶段,15~240 min为缓慢释放阶段。其对小地老虎的触杀胃毒活性低于乳油,且随着微囊平均粒径的减小生物活性逐渐升高,但其田间实际应用效果仍需进一步评价。
| [1] | AGHBASHLO M, MOBLI H, RAFIEE S, et al. Optimization of emulsification procedure for mutual maximizing the encapsulation and exergy efficiencies of fish oil microencapsulation[J]. Powder Technol, 2012, 225: 107–117. doi:10.1016/j.powtec.2012.03.040 |
| [2] | AGHBASHLO M, MOBLI H, RAFIEE S, et al. Energy and exergy analyses of the spray drying process of fish oil microencapsulation[J]. Biosyst Eng, 2012, 111(2): 229–241. doi:10.1016/j.biosystemseng.2011.12.001 |
| [3] | LI B X, WANG W C, ZHANG X P, et al. Using coordination assembly as the microencapsulation strategy to promote the efficacy and environmental safety of pyraclostrobin[J]. Adv Funct Mater, 2017, 27(29): 1701841. doi:10.1002/adfm.v27.29 |
| [4] | ZHANG D X, LI B X, ZHANG X P, et al. Phoxim microcapsules prepared with polyurea and urea-formaldehyde resins differ in photostability and insecticidal activity[J]. J Agric Food Chem, 2016, 64(14): 2841–2846. doi:10.1021/acs.jafc.6b00231 |
| [5] | LI B X, GUAN L, WANG K, et al. Formula and process optimization of controlled-release microcapsules prepared using a coordination assembly and the response surface methodology[J]. J Appl Polym Sci, 2016, 133(1): 42865. |
| [6] | PIACENTINI E, GIORNO L, DRAGOSAVAC M M, et al. Microencapsulation of oil droplets using cold water fish gelatine/gum arabic complex coacervation by membrane emulsification[J]. Food Res Int, 2013, 53(1): 362–372. doi:10.1016/j.foodres.2013.04.012 |
| [7] |
李北兴, 张大侠, 张灿光, 等. 微囊化技术研究进展及其在农药领域的应用[J]. 农药学学报, 2014, 16(5): 483–496.
LI B X, ZHANG D X, ZHANG C G, et al. Research advances and application prospects of microencapsulation techniques in pesticide[J]. Chin J Pestic Sci, 2014, 16(5): 483–496. |
| [8] |
赵德, 韩志任, 杜有辰, 等. 毒死蜱微胶囊化及释放性能表征[J]. 中国农业科学, 2007, 40(12): 2753–2758.
ZHAO D, HAN Z R, DU Y C, et al. Preparation of chlorpyrifos microcapsules and its controlled release characteristics[J]. Scientia Agricultural Sinica, 2007, 40(12): 2753–2758. doi:10.3321/j.issn:0578-1752.2007.12.013 |
| [9] |
张贵森. 不同壁材高效氯氰菊酯微囊悬浮剂应用及环境特性的影响[D]. 泰安: 山东农业大学, 2012: 1.
ZHANG G S. Effect of the different wall material of Beta-cypermethrin microcapsule suspensions on the differences of application and environment characteristics[D]. Tai’an: Shandong Agricultural University, 2012: 1. |
| [10] |
张贵森, 杨法辉, 郭慧玲, 等. 不同壁材高效氯氰菊酯微囊悬浮剂在土壤中迁移与光解的差异性[J]. 农药学学报, 2012, 14(12): 214–220.
ZHANG G S, YANG F H, GUO H L, et al. Research on the differences of the migration in soil and photolysis of different wall materials of microcapsule suspensions of beta-cypermethrin [J]. Chin J Pestic Sci, 2012, 14(12): 214–220. |
| [11] |
张大侠. 脲醛树脂和聚氨酯壁材微胶囊农药应用性能的对比研究[D]. 泰安: 山东农业大学, 2011: 31.
ZHANG D X. The comparative study of performance properties of microcapsules encapsulated by urea-formaldehyde and polyurethane[D]. Tai’an: Shandong Agricultural University, 2011: 31. |
| [12] | HONG K J, PARK S M. Preparation and characterization of polyurea microcapsules with different diamines[J]. Mater Res Bull, 1999, 34(6): 963–969. doi:10.1016/S0025-5408(99)00088-4 |
| [13] | TAKASU M, KAWAGUCHI H. Preparation of colored latex with polyurea shell by miniemulsion polymerization[J]. Colloid Polym Sci, 2005, 283(7): 805–811. doi:10.1007/s00396-004-1248-3 |
| [14] | XIE Z Y, CHEN N C, LIU C S, et al. Synthesis and characterization of ethylenediamine tetraacetic acid tetrasodium salt loaded in microcapsules with slow release properties[J]. Chin J Chem Eng, 2010, 18(1): 149–155. doi:10.1016/S1004-9541(08)60336-5 |
| [15] |
丑靖宇, 谭利, 孙俊, 等. 330 g/L 二甲戊灵微囊悬浮剂的制备[J]. 农药, 2015, 54(1): 26–30.
CHOU J Y, TAN L, SUN J, et al. Preparation of pendimethalin 330 g/L aqueous capsule suspension[J]. Agrochemicals, 2015, 54(1): 26–30. |
| [16] | TSUDA N, OHTSUBO T, FUJI M. Preparation of self-bursting microcapsules by interfacial polymerization[J]. Adv Powder Technol, 2012, 23(6): 724–730. doi:10.1016/j.apt.2011.09.005 |
| [17] | JABBARI E, KHAKPOUR M. Morphology of and release behavior from porous polyurethane microspheres[J]. Biomaterials, 2000, 21(20): 2073–2079. doi:10.1016/S0142-9612(00)00135-6 |
| [18] |
夏晓静, 周建平, 王翔, 等. 伊维菌素聚乳酸微球的制备[J]. 中国药科大学学报, 2004, 35(5): 429–432.
XIA X J, ZHOU J P, WANG X, et al. Preparation of polylactic acid microspheres loading ivermectin[J]. J China Pharm Univ, 2004, 35(5): 429–432. |
| [19] |
杨石有, 刘德坤, 张翠, 等. 毒死蜱微球和乳油在水中的消解动态及其对白纹伊蚊幼虫的毒力[J]. 农药学学报, 2013, 15(4): 464–468.
YANG S Y, LIU D K, ZHANG C, et al. Decline dynamics of chlorpyrifos microspheres and emulsifiable concentrate in water and its toxicity to the larvae of Aedes albopictus [J]. Chin J Pestic Sci, 2013, 15(4): 464–468. |
| [20] | LEE J, HILL A, KENTISH S. Formation of a thick aromatic polyamide membrane by interfacial polymerisation[J]. Sep Purif Technol, 2013, 104(104): 276–283. |
| [21] |
. 甲苯二异氰酸酯(TDI)致癌性的综合评估[J]. 生态毒理学报, 2016, 11(4): 26–60.
PRUEITT R L, RHOMBERG L R, GUAN N, et al. Evaluation of the carcinogenicity of toluene diisocyanate[J]. Asian J Ecotoxicol, 2016, 11(4): 26–60. |
| [22] |
李颜, 邓新平, 熊海铮, 等. 20% 甲基嘧啶磷微囊悬浮剂的研制[J]. 农药研究与应用, 2010, 14(4): 25–29.
LI Y, DENG X P, XIONG H Z, et al. Preparation of pirimiphos-methy 20% CS[J]. Agrochem Res Appl, 2010, 14(4): 25–29. |
| [23] |
白云起, 薛丽梅, 刘云夫. 环氧树脂的改性研究进展[J]. 化学与粘合, 2007, 29(4): 289–292.
BAI Y Q, XUE L M, LIU Y F. Advance in modification of epoxy resin[J]. Chem Adhes, 2007, 29(4): 289–292. |
| [24] |
洪彬, 王天祯. 环氧树脂应用领域市场分析[J]. 热固性树脂, 2011, 26(3): 54–58.
HONG B, WANG T Z. Market analysis of epoxy applications[J]. Thermosetting Resin, 2011, 26(3): 54–58. |
| [25] | PASCU O, GARCIA-VALLS R, GIAMBERINI M. Interfacial polymerization of an epoxy resin and carboxylic acids for the synthesis of microcapsules[J]. Polym Int, 2008, 57(8): 995–1006. doi:10.1002/pi.v57:8 |
| [26] |
方一, 李路海, 莫黎昕, 等. 不同分散手段和反应条件对合成酚醛环氧树脂微胶囊的影响[J]. 包装工程, 2008, 29(10): 33–36.
FANG Y, LI L H, MO L X, et al. Influence of different dispersing methods and reaction conditions on the preparation of novolac epoxy resin microcapsules[J]. Packaging Eng, 2008, 29(10): 33–36. doi:10.3969/j.issn.1001-3563.2008.10.010 |
| [27] |
徐汉虹. 植物化学保护学[M]. 4 版. 北京: 中国农业出版社, 2007: 87.
XU H H. Plant chemical protection[M]. 4th ed. Beijing: China Agriculture Press, 2007: 87. |
| [28] | SCHER H B, RODSON M, LEE K S. Microencapsulation of pesticides by interfacial polymerization utilizing isocyanate or aminoplast chemistry[J]. Pestic Sci, 1998, 54(4): 394–400. doi:10.1002/(SICI)1096-9063(199812)54:4<>1.0.CO;2-A |
| [29] |
向家来. 卫生杀虫微胶囊剂的研制及药效[D]. 武汉: 华中农业大学, 2005: 1.
XIANG J L. Development of pesticide microcapsules and tests for their effects on health pests[D]. Wuhan: Huazhong Agricultural University, 2005: 1. |
| [30] |
宋思思, 夏娇, 王宁, 等. 噻虫嗪-高效氯氰菊酯复配农药微胶囊的制备与性能[J]. 农药, 2016, 55(1): 22–25.
SONG S S, XIA J, WANG N, et al. Preparation and performance characteristics of thiamethoxam and beta-cypermethrin compound pesticide microcapsule [J]. Agrochemicals, 2016, 55(1): 22–25. |
| [31] |
陆静. 高效氯氟氰菊酯微胶囊悬浮剂的研制及释放机理研究[D]. 杭州: 浙江工业大学, 2013: 17.
LU J. Proparation and release mechanism of the insecticide lambda-cyalothrin microcapsule suspensions[D]. Hangzhou: Zhejiang University of Technology, 2013: 17. |
| [32] |
杨志川, 陶黎明, 黄青春. 10% 三氟氯氰菊酯微胶囊悬浮剂的缓释性能和杀虫活性探究[J]. 农药, 2015, 54(2): 88–90.
YANG Z C, TAO L M, HUANG Q C. Slow release property and insecticidal activity of cyhalothrin 10% microcapsule suspension[J]. Agrochemicals, 2015, 54(2): 88–90. |
| [33] | MT189. Determination of free lambda-cyhalothrin in CS formulations[M]//CIPAC Handbook L. Physio-chemical methods for technical formulated pesticides. Oxfordshire: Marston Book Services Ltd, 2004: 137-139. |
| [34] | MT190. Determination of release properties of lambda-cyhalothrin CS formulations[M]// CIPAC Handbook L. Physio-chemical methods for technical formulated pesticides. Oxfordshire: Marston Book Services Ltd, 2004: 140-142. |
| [35] |
慕立义. 植物化学保护研究方法[M]. 北京: 中国农业出版社, 1994: 27-29.
MU L Y. The research methods of plant chemical protection[M]. Beijing: China Agriculture Press, 1994: 27-29. |
| [36] |
宋健, 陈磊, 李效军. 微胶囊化技术及应用[M]. 北京: 化学工业出版社, 2001: 25-29.
SONG J, CHEN L, LI X J. Microencapsulation technology and application[M]. Beijing: Chemical Industry Press, 2001: 25-29. |
| [37] |
崔占臣, 吕长利, 杨柏, 等. 环氧树脂/三乙硫醇胺固化反应行为的研究[J]. 高分子学报, 2002(2): 149–152.
CUI Z C, LÜ C L, YANG B, et al. Autocatalytic curing behavior of epoxy/nitrogen-containing polythiol system[J]. Acta Polymerica Sinica, 2002(2): 149–152. |
| [38] | KUMAR P, MISHRA S, MALIK A, et al. Preparation and characterization of PEG-Mentha oil nanoparticles for housefly control [J]. Colloids Surf B: Biointerfaces, 2013, 116: 707–713. |
| [39] |
梁治齐. 微胶囊技术及其应用[M]. 北京: 中国轻工业出版社, 1999: 362-371.
LANG Z Q. Microencapsulation technology and application[M]. Beijing: China Light Industry Press, 1999: 362-371. |
| [40] |
傅桂华, 钟滨, 陈建宇, 等. 界面聚合法制备农药微胶囊剂的研究[J]. 农药, 2005, 44(2): 66–68.
FU G H, ZHONG B, CHEN J Y, et al. Pesticide microcapsules prepared by an interfacial polymerization method[J]. Chin J Pestic, 2005, 44(2): 66–68. |
| [41] |
夏红英, 段先志, 蔡红梅. 辛硫磷农药微胶囊制备工艺[J]. 农药, 2006, 45(6): 392–393.
XIA H Y, DUAN X Z, CAI H M. Process for the preparation of microcapsulation of phoxim pesticide[J]. Agrochemicals, 2006, 45(6): 392–393. |
 2017, Vol. 19
2017, Vol. 19