玉米是中国第三大粮食作物,地位仅次于水稻和小麦[1]。近年来,随着鲜食玉米越来越受到消费者的喜爱,其已被作为经济作物大力推广[2]。由于市场需求量巨大,导致部分地区鲜食玉米的生产已由一年单季发展为一年多季种植模式[3]。由Bipolaris maydis (Nisikado et Miyake) Shoem侵染导致的玉米小斑病 (southern corn leaf blight, SCLB) 是玉米生产上的重要叶部真菌病害,严重影响其产量和品质[4]。随着鲜食玉米种植产业化的发展,以及优质高产杂交品种的推广和栽培模式的变革,玉米小斑病在中国鲜食玉米主产区发生日益严重[5-6]。福建省属于亚热带海洋性季风气候,其温暖潮湿的气候环境比中国北方玉米产区更适宜玉米小斑病的流行及暴发,已成为制约该省鲜食玉米生产的主要因素。
目前,喷施代森锰锌、百菌清和麦角甾醇抑制剂类 (sterol demethylation inhibitors,DMIs) 杀菌剂仍是防治玉米小斑病的重要措施[7-9]。由于长期使用相同或作用机制相似的杀菌剂,容易使得靶标菌对该类杀菌剂的敏感性降低,甚至产生抗药性[10-11]。在目前尚未发现高抗玉米小斑病种子资源的情况下,筛选高效且无交互抗性的杀菌剂作为防治玉米小斑病的替代或轮换药剂,在生产上具有重要意义。二甲酰亚胺类 (dicarboximides,DCs) 和甲氧基丙烯酸酯类 (quinone outside inhibitors,QoIs) 是20世纪后期开发的高效、广谱性杀菌剂。其中,以异菌脲为代表的DCs杀菌剂可有效抑制真菌孢子萌发及菌丝生长,兼具保护和治疗作用[12],对其作用机制目前尚不完全清楚,有报道表明DCs杀菌剂可抑制蛋白激酶,控制细胞内信号,破坏真菌细胞膜结构[13],目前主要用于灰霉病的防治,可有效控制已对苯并咪唑类和麦角甾醇抑制类药剂产生抗性的真菌病害[14]。以吡唑醚菌酯为代表的QoIs杀菌剂是一类线粒体呼吸抑制剂,主要作用于真菌细胞呼吸电子传递链中的复合物III,阻断cytb和c1间的电子传递,从而扰乱细胞正常代谢所需能量 (ATP) 的合成[15-16]。因此,吡唑醚菌酯具有较强的抑制真菌孢子萌发及菌丝生长的能力,是一类具有较长持效期及一定治疗活性的杀菌剂[17]。然而,杀菌剂抗性行动委员会 (fungicide resistance action committee,FRAC) 将异菌脲和吡唑醚菌酯均归类为高风险抗药性杀菌剂[18]。目前,已有黄瓜灰霉病菌Botrytis cinerea[19]、草坪草币斑病菌Sclerotinia homoeocarpa[14]、梨褐斑病菌Stemphylium vesicarium[20]和番茄黑斑病菌Alternaria alternate[21]对DCs杀菌剂,以及番茄灰霉病菌Botrytis cinerea[22]、甜菜褐斑病菌Cercospora beticola[16]、葫芦白粉病菌Podosphaera fusca[23]和苹果黑星病菌Venturia inaequalis[24]对QoIs杀菌剂产生抗性的报道。
在引入新杀菌剂进行植物病害防治之前,建立病原菌对该药剂的敏感性基线是合理选用药剂及有效防治植物病害的基础。因此,本研究测定了分离自福建省7个不同玉米产区的73株玉米小斑病菌对以异菌脲和吡唑醚菌酯为代表的DCs和QoIs杀菌剂的敏感性,建立了玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感基线,明确其对玉米小斑病的田间防治效果,以期为玉米小斑病化学防治有效药剂的选择与合理使用提供科学依据,同时为玉米小斑病菌的田间抗药性风险评估及抗性监测奠定基础。
1 材料与方法 1.1 供试菌株供试的73株玉米小斑病菌B. maydis采用单孢分离法[6]于2015—2016年分离自福建省宁德、福州、莆田、漳州、龙岩、三明和南平7个未施用过DCs和QoIs杀菌剂的玉米产区, 经形态学鉴定和rDNA-ITS序列分析确认。单孢菌株采用滤纸片法[25]保存于 –20 ℃冰箱中。
1.2 药剂和试剂异菌脲 (iprodione) 原药 (97.5%,江苏辉丰农化股份有限公司);吡唑醚菌酯 (pyraclostrobin) 原药 (95.4%,青岛瀚生生物科技有限公司);50%异菌脲悬浮剂 (SC)[拜耳作物科学 (中国) 有限公司,登记号:PD20070395];25%吡唑醚菌酯乳油 (EC)(德国巴斯夫公司,登记号:PD20152385);25%丙环唑EC(瑞士先正达作物保护有限公司,登记号:PD28-87);75%百菌清可湿性粉剂 (WP)(江苏利民化工股份有限公司,登记号:PD86180-5);80%代森锰锌WP(美国陶氏益农公司,登记号:PD220-97);二甲亚砜 (DMSO) 和吐温-80(分析纯,国药集团化学试剂有限公司)。
1.3 玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感性测定采用菌丝生长速率法[26]测定。将异菌脲和吡唑醚菌酯原药分别溶于DMSO中,配制成1.562 5 × 105 μg/mL的母液,试验时再用无菌的1.0%吐温-80溶液分别稀释成0.2、1、5、25、125和625 μg/mL。每99 mL马铃薯葡萄糖琼脂培养基 (PDA,45~60 ℃) 中分别加入1 mL上述各浓度药液,制成0.002、0.01、0.05、0.25、1.25和6.25 μg/mL的含药平板。将各供试菌株在PDA平板上于28 ℃、黑暗条件下活化4~5 d后,用打孔器沿菌落边缘打取直径0.6 cm的新鲜菌碟,每皿接种一片菌碟至含药PDA平板中央,以不含药平板作对照 (培养基中DMSO和吐温-80浓度与药剂处理组一致)。每浓度4次重复,于28 ℃、黑暗培养7 d后,采用十字交叉法测量菌落直径,参考Russell[27]和Liang等[26]的方法计算菌丝生长抑制率 (%) 及EC50值。
1.4 敏感基线的建立分别以0.5和1.0为区间间隔,将73株玉米小斑病菌对异菌脲和吡唑醚菌酯的EC50值划分成不同区间,统计各区间内菌株的出现频率 (%)。以不同EC50值区间为横坐标,相应的菌株出现频率为纵坐标,分别绘制73株玉米小斑病菌群体对异菌脲和吡唑醚菌酯的敏感性频率分布图,参考Russell[27]的方法建立玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感基线。
1.5 异菌脲和吡唑醚菌酯对玉米小斑病的田间防治效果试验设在福建省福州市和屏南县的玉米田进行。玉米品种为上品,正常水肥管理。共设8个处理:50%异菌脲SC和25%吡唑醚菌酯EC按药剂推荐使用剂量 (有效成分,其余同) 及其0.5倍稀释剂量分别为750、375 g/hm2和150、75 g/hm2;药剂对照25%丙环唑EC、75%百菌清WP和80%代森锰锌WP按药剂推荐使用剂量分别为150、1 875和2 000 g/hm2;并设清水空白对照。每处理重复3次,不同处理随机排列,每处理20 m2。由于福州试验点前期未见发病,故在施药前48 h于傍晚用背负式电动喷雾器均匀喷施浓度为每毫升含105个孢子的孢子悬浮液于玉米植株表面,至叶面滴液为宜。
于玉米苗期 (8~9叶期),将上述各浓度供试药液用背负式电动喷雾器均匀喷施于玉米植株表面,至叶面滴液为宜。于第1次施药10 d后再补施1次,2次施药剂量或空白对照用水量均相同。分别于第1次施药前1 d和第2次施药后10 d调查各处理发病情况,病叶分级参照Liu等的标准[28],病情指数及防效计算参考Chen等的方法[29]。
1.6 数据统计分析数据均采用Microsoft Excel 2003 和 DPS(v7.05) 软件进行计算和方差分析;采用Duncan’s 新复极差法分析各处理间的差异显著性。
2 结果与分析 2.1 玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感性及敏感基线敏感性测定结果 (图1) 表明,来自福建省7个不同地区的73株玉米小斑病菌对异菌脲和吡唑醚菌酯的EC50值范围分别在0.168~2.990和0.017~6.583 μg/mL之间,平均值分别为 (1.003 ± 0.533) 和 (1.437 ± 1.490) μg/mL,不同菌株间对异菌脲和吡唑醚菌酯的变异系数 (最大EC50值/最小EC50值) 分别为17.8和378.4[30]。表明福建省玉米小斑病菌田间种群对异菌脲和吡唑醚菌酯均比较敏感,但是供试菌株个体间对不同药剂的敏感性存在较大差异。
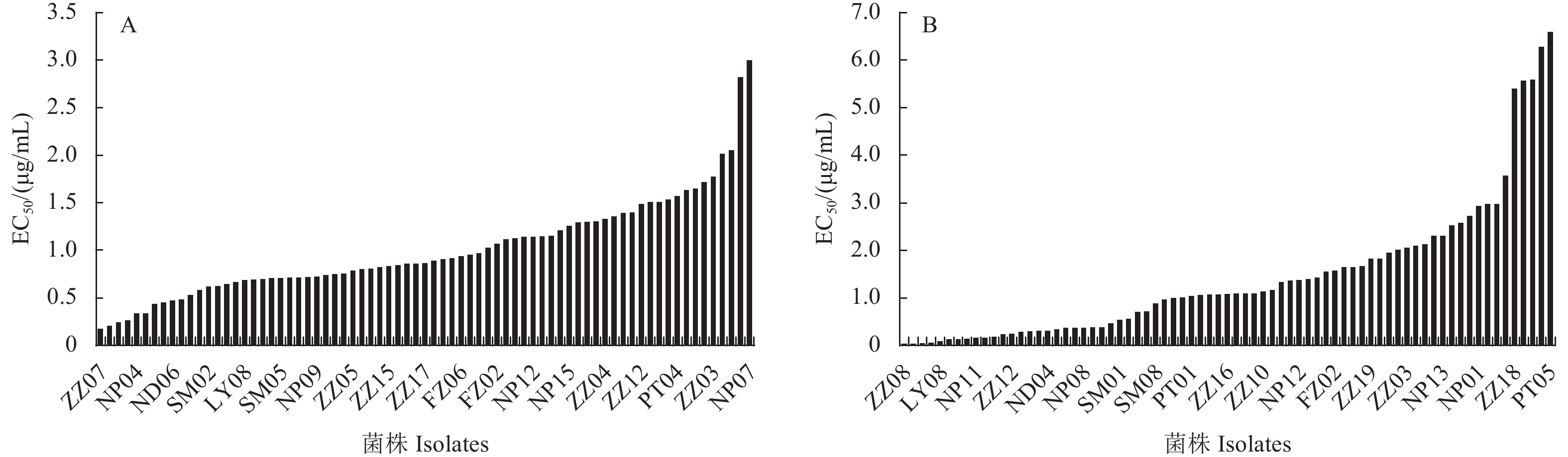
|
图 1 福建省玉米小斑病菌对异菌脲 (A) 和吡唑醚菌酯 (B) 的EC50值分布 Fig. 1 Distribution of EC50 values of B. maydis to iprodione (A) and pyraclostrobin (B) in Fujian province |
供试73株玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感性频率分布图均为连续的单峰曲线 (图2)。W正态性检验 (即Shapiro-Wilk检验) 结果表明,供试菌株对异菌脲 (W = 0.947 3,P = 0.717 6 > 0.05) 和吡唑醚菌酯 (W = 0.846 2,P = 0.182 8 > 0.05) 的敏感性频率分布均符合正态分布,因此可将其平均EC50值 (1.003 ± 0.533) μg/mL和 (1.437 ± 1.490) μg/mL分别作为福建省玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感基线。
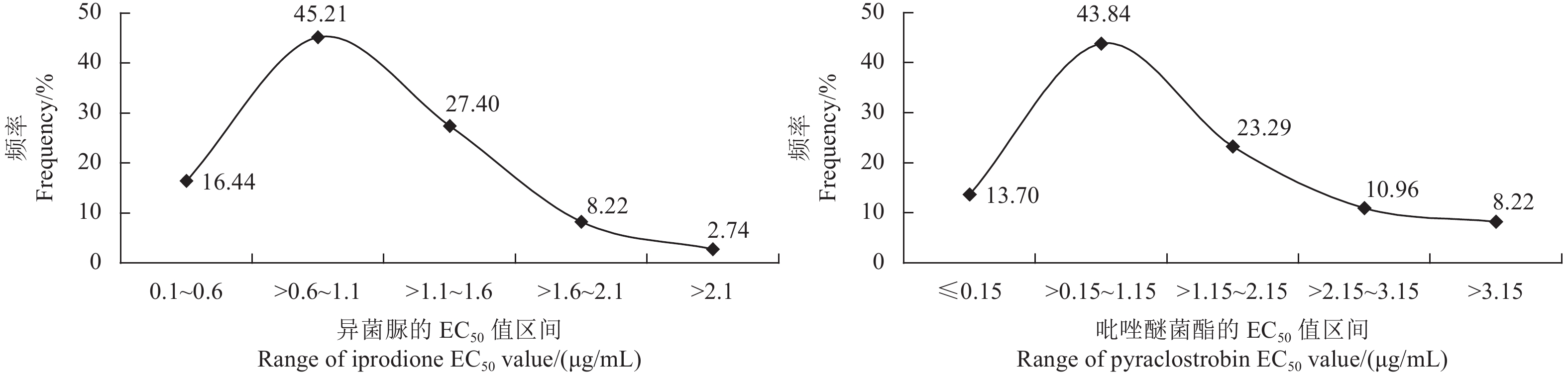
|
图 2 福建省玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感性频率分布 Fig. 2 Frequency distribution of sensitivity of B. maydis to iprodione and pyraclostrobin in Fujian province |
2.2 不同地区菌株对异菌脲和吡唑醚菌酯的敏感性水平比较
单孢分离自福建省南平、宁德、福州、莆田、漳州、龙岩和三明7个不同地区的73株玉米小斑病菌对异菌脲的敏感性差异不明显,菌株间变异系数仅为17.8;而不同地区菌株对吡唑醚菌酯的敏感性存在较大差异,菌株间变异系数高达378.4。方差分析结果表明,除莆田地区种群外,不同地区间菌株群体对异菌脲和吡唑醚菌酯的敏感性均无显著差异 (表1)。
|
|
表 1 福建省7个地区玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感性 Table 1 Sensitivity of B. maydis isolates to iprodione and pyraclostrobin in seven regions of Fujian province |
2.3 异菌脲和吡唑醚菌酯对玉米小斑病的田间防效
福州和屏南2地的田间防效试验结果 (表2) 表明,分别喷施2次有效剂量为750 g/hm2 的50%异菌脲SC和150 g/hm2 的25%吡唑醚菌酯EC 10 d后,对玉米小斑病的防治效果均较好,且随处理剂量增大,防效相应提高,各处理间存在显著差异 (P < 0.05)。与喷施2次有效剂量为150 g/hm2的25%丙环唑EC的防效相当,且均显著高于喷施2次有效剂量分别为1 875和2 000 g/hm2的75%百菌清WP和80%代森锰锌WP的防效 (P < 0.05)。试验期间,在推荐剂量范围内,各浓度供试药剂对玉米苗期发育、开花、孕穗和抽雄均无影响。研究表明,异菌脲和吡唑醚菌酯可考虑作为麦角甾醇抑制剂类杀菌剂 (如丙环唑) 的替代药剂或轮换药剂,用于玉米小斑病的防治。
|
|
表 2 异菌脲和吡唑醚菌酯对玉米小斑病的田间防治效果 Table 2 Efficacies of iprodione and pyraclostrobin in the control of southern corn leaf blight |
3 小结与讨论
化学防治是目前玉米小斑病防治的主要措施。以异菌脲和吡唑醚菌酯为代表的DCs和QoIs杀菌剂对许多重要经济作物上的多种病害均具有极好的保护和治疗作用[31-32]。然而截至目前,在植物病原真菌对杀菌剂的敏感性测定中,尚未见有关玉米小斑病菌对DCs和QoIs杀菌剂敏感性的报道。本研究采用菌丝生长速率法,测定了福建省7个不同地区的73株玉米小斑病菌对DCs 和 QoIs 杀菌剂代表药剂异菌脲和吡唑醚菌酯的敏感性。结果表明,福建省玉米小斑病菌田间种群对2类杀菌剂的敏感性均呈正态分布,由于供试菌株均来自未施用过DCs和QoIs杀菌剂的玉米产区,因此可将其平均EC50值 (1.003 ± 0.533) μg/mL 和 (1.437 ± 1.490) μg/mL 分别作为福建省玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感基线。研究结果对福建省玉米小斑病防治药剂的合理选用及病原菌田间抗药性监测均具有重要的参考价值。
比较福建省不同地区玉米小斑病菌田间种群对异菌脲和吡唑醚菌酯的敏感性发现,采样7个地区中,莆田种群对供试2种杀菌剂的敏感性相对较低,且供试 73 株菌株个体间对异菌脲和吡唑醚菌酯的敏感性存在较大差异,其变异系数分别为17.8和378.4。推测福建省玉米小斑病菌田间种群中可能存在对吡唑醚菌酯敏感性较低的天然耐药个体,其原因可能是由于玉米小斑病菌本身存在一定的生理差异,或是由于群体组成的多样性,也可能是由于与生产中使用过的其他杀菌剂之间产生了一定的交互抗性所致。此外,玉米小斑病菌对吡唑醚菌酯的敏感性差异是否还与旁路氧化途径等因素有关,还有待进一步研究。福建省玉米小斑病菌对吡唑醚菌酯天然耐药个体的出现,预示着采用该药剂防治玉米小斑病时,应更重视对其田间抗药性的监测。
尽管福建省玉米小斑病菌不同菌株间对异菌脲和吡唑醚菌酯的敏感性表现出一定的差异,但整体而言其敏感性仍然很高,具有很好的应用潜能。田间防治效果亦表明,喷施2次有效剂量分别为750和150 g/hm2的50%异菌脲SC和25% 吡唑醚菌酯EC,对玉米小斑病均具有较好的防效 (> 60%),其防效与丙环唑相当,且显著高于对照药剂百菌清和代森锰锌。随着鲜食玉米种植面积的迅速扩大以及复种指数的提高,势必会加重玉米小斑病的发病趋势。DMIs杀菌剂是目前防治玉米小斑病较为理想的药剂,但若长时间单一使用该类杀菌剂进行防治,将加重药剂的田间选择压力,致使病原菌对DMIs杀菌剂的抗性风险显著提高。因此,可考虑将异菌脲和吡唑醚菌酯用作为DMIs杀菌剂的替代或轮换药剂,从而延缓病原菌对DMIs杀菌剂抗性的产生和发展。
| [1] | WANG X, MA J, LI X W, et al. Optimization of chemical fungicide combinations targeting the maize fungal pathogen, Bipolaris maydis: a systematic quantitative approach [J]. IEEE Trans Biomed Eng, 2015, 62(1): 80–87. doi:10.1109/TBME.2014.2339295 |
| [2] |
王世恒, 冯凤琴, 徐仁政. 超甜玉米营养品质分析[J]. 玉米科学, 2004, 12(1): 61–62.
WANG S H, FENG F Q, XU R Z. Analysis on nutritional quality of super-sweet corn[J]. J Maize Sci, 2004, 12(1): 61–62. |
| [3] |
甘林, 王志纯, 代玉立, 等. 不同杀菌剂对玉米小斑病菌的抑制作用及其防治效果[J]. 福建农业学报, 2015, 30(12): 1160–1165.
GAN L, WANG Z C, DAI Y L, et al. Inhibition on Bipolaria maydis and disease control on southern corn leaf blight of various fungicides [J]. Fujian J Agric Sci, 2015, 30(12): 1160–1165. doi:10.3969/j.issn.1008-0384.2015.12.006 |
| [4] | ULLSTRUP A J. The impacts of the southern corn leaf blight epidemics of 1970–1971[J]. Annu Rev Phytopathol, 2003, 10(1): 37–50. |
| [5] |
叶坤浩, 龚国淑, 祁小波, 等. 几种栽培措施对玉米纹枯病和小斑病的影响[J]. 植物保护, 2015, 41(4): 154–159.
YE K H, GONG G S, QI X B, et al. Effect of cultivation measures on sheath blight and southern leaf blight of corn[J]. Plant Prot, 2015, 41(4): 154–159. |
| [6] | DAI Y L, YANG X J, GAN L, et al. First report of southern leaf blight caused by Cochliobolus heterostrophus on corn (Zea mays) in Fujian province, China [J]. Plant Dis, 2016, 100(8): 1781. |
| [7] |
马佳, 张婷, 王猛, 等. 玉米小斑病发生前期化学防治初步研究[J]. 上海交通大学学报(农业科学版), 2013, 31(4): 45–50.
MA J, ZHANG T, WANG M, et al. Chemical prevention and treatment of maize southern leaf blight at early growth season[J]. J Shanghai Jiaotong Univ (Agric Sci), 2013, 31(4): 45–50. |
| [8] | RAID R N. Fungicidal control of foliar sweet corn diseases in the presence of high inoculum levels[J]. Proc Fla State Hortic Soc, 1991, 104: 267–270. |
| [9] |
甘林, 代玉立, 滕振勇, 等. 福建省玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺的敏感性[J]. 农药学学报, 2016, 18(2): 194–200.
GAN L, DAI Y L, TENG Z Y, et al. Sensitivity of Bipolaris maydis to propiconazole, diniconazole and prochloraz in Fujian province [J]. Chin J Pestic Sci, 2016, 18(2): 194–200. |
| [10] |
张立新, 张军, 王建华, 等. 安徽省玉米小斑病菌对 5 种杀菌剂的敏感性[J]. 植物保护, 2011, 37(4): 163–166.
ZHANG L X, ZHANG J, WANG J H, et al. Sensitivity of Bipolaris maydis to five fungicides in Anhui province [J]. Plant Prot, 2011, 37(4): 163–166. |
| [11] |
张立新, 董猛, 杨丽敏, 等. 安徽省玉米小斑病菌生理小种鉴定及对烯唑醇的敏感性[J]. 植物病理学报, 2011, 41(4): 441–444.
ZHANG L X, DONG M, YANG L M, et al. Identification of physiological races of Bipolaris maydis and their sensitivities to diniconazole in Anhui province [J]. Acta Phytopathologica Sinica, 2011, 41(4): 441–444. |
| [12] | STEEL C C, NAIR N G. Oxidative protective mechanisms and resistance to the dicarboximide fungicide, iprodione, in Alternaria alternata [J]. J Phytopathol, 1995, 143(9): 531–535. doi:10.1111/j.1439-0434.1995.tb00658.x |
| [13] |
任璐, 韩巨才, 刘慧平. 番茄早疫病菌对异菌脲的敏感基线及其抗性突变体的生物学特性[J]. 农药学学报, 2010, 12(2): 155–160.
REN L, HAN J C, LIU H P. Baseline sensitivity of Alternaria solani to iprodione and characteristics of the resistant mutants [J]. Chin J Pestic Sci, 2010, 12(2): 155–160. |
| [14] | SANG H, POPKO Jr J T, CHANG T, et al. Molecular mechanisms involved in qualitative and quantitative resistance to the dicarboximide fungicide iprodione in Sclerotinia homoeocarpa field isolates [J]. Phytopathology, 2017, 107(2): 198–207. doi:10.1094/PHYTO-05-16-0211-R |
| [15] | FISHER N, MEUNIER B. Molecular basis of resistance to cytochrome bc1 inhibitors [J]. FEMS Yeast Res, 2008, 8(2): 183–192. doi:10.1111/fyr.2008.8.issue-2 |
| [16] | BIRLA K, RIVERA-VARAS V, SECOR G A, et al. Characterization of cytochrome b from European field isolates of Cercospora beticola with quinone outside inhibitor resistance [J]. Eur J Plant Pathol, 2012, 134(3): 475–488. doi:10.1007/s10658-012-0029-y |
| [17] |
王海强, 周俞辛, 王景元, 等. 水稻稻瘟病菌不同发育阶段对 7 种QoI类杀菌剂的敏感性[J]. 农药学学报, 2009, 11(4): 434–440.
WANG H Q, ZHOU Y X, WANG J Y, et al. Sensitivity of Magnapothe grisea at different development stages to seven QoI fungicides [J]. Chin J Pestic Sci, 2009, 11(4): 434–440. |
| [18] | Fungicide Resistance Action Committee (FRAC). Pathogen risk list[EB/OL]. [2017-03-15]. http://www.frac.info/publications/downloads. |
| [19] | ELAD Y, YUNIS H, KATAN T. Multiple fungicide resistance to benzimidazoles, dicarboximides and diethofencarb in field isolates of Botrytis cinerea in Israel [J]. Plant Pathol, 1992, 41(1): 41–46. doi:10.1111/ppa.1992.41.issue-1 |
| [20] | ALBERONI G, COLLINA M, PANCALDI D, et al. Resistance to dicarboximide fungicides in Stemphylium vesicarium of Italian pear orchards [J]. Eur J Plant Pathol, 2005, 113(2): 211–219. doi:10.1007/s10658-005-2332-3 |
| [21] | MALANDRAKIS A A, APOSTOLIDOU Z A, MARKOGLOU A, et al. Fitness and cross-resistance of Alternaria alternata field isolates with specific or multiple resistance to single site inhibitors and mancozeb [J]. Eur J Plant Pathol, 2015, 142(3): 489–499. doi:10.1007/s10658-015-0628-5 |
| [22] | BANNO S, YAMASHITA K, FUKUMORI F, et al. Characterization of QoI resistance in Botrytis cinerea and identification of two types of mitochondrial cytochrome b gene [J]. Plant Pathol, 2009, 58(1): 120–129. doi:10.1111/ppa.2009.58.issue-1 |
| [23] | FERNÁNDEZ-ORTUÑO D, PÉREZ-GARCÍA A, LÓPEZ-RUIZ F, et al. Occurrence and distribution of resistance to QoI fungicides in populations of Podosphaera fusca in south central Spain [J]. Eur J Plant Pathol, 2006, 115(2): 215–222. doi:10.1007/s10658-006-9014-7 |
| [24] | SALLATO B V, LATORRE B A, AYLWIN G. First report of practical resistance to QoI fungicides in Venturia inaequalis (apple scab) in Chile [J]. Plant Dis, 2006, 90(3): 375. |
| [25] | THOMAS A, LANGSTON JR D B, STEVENSON K L. Baseline sensitivity and cross-resistance to succinate-dehydrogenase-inhibiting and demethylation-inhibiting fungicides in Didymella bryoniae [J]. Plant Dis, 2012, 96(7): 979–984. doi:10.1094/PDIS-09-11-0744-RE |
| [26] | LIANG H J, DI Y L, LI J L, et al. Baseline sensitivity and control efficacy of fluazinam against Sclerotinia sclerotiorum [J]. Eur J Plant Pathol, 2015, 142(4): 691–699. doi:10.1007/s10658-015-0644-5 |
| [27] | RUSSELL P E. Sensitivity baselines in fungicide resistance research and management[M]. FRAC Monograph No 3, United Kingdom: AIMPRINT, 2004. |
| [28] | LIU L, ZHANG Y D, LI H Y, et al. QTL Mapping for gray leaf spot resistance in a tropical maize population[J]. Plant Dis, 2016, 100(2): 304–312. doi:10.1094/PDIS-08-14-0825-RE |
| [29] | CHEN Y, ZHANG Y, YAO J, et al. Frequency distribution of sensitivity of Ustilaginoidea virens to four EBI fungicides, prochloraz, difenoconazole, propiconazole and tebuconazole, and their efficacy in controlling rice false smut in Anhui province of China [J]. Phytoparasitica, 2013, 41(3): 277–284. doi:10.1007/s12600-013-0288-y |
| [30] | SONG Y Y, XU D T, LU H B, et al. Baseline sensitivity and efficacy of the sterol biosynthesis inhibitor triflumizole against Botrytis cinerea [J]. Aust Plant Pathol, 2016, 45(1): 65–72. doi:10.1007/s13313-015-0384-1 |
| [31] |
祝明亮, 严金平, 孙启玲, 等. 植物病原真菌对二甲酰亚胺类杀菌剂的抗性分子机制[J]. 生物技术, 2005, 15(5): 95–97.
ZHU M L, YAN J P, SUN Q L, et al. Molecular mechanisms of the resistance to dicarboximides fungicides (DCFs) in phytopathogenic fungi[J]. Biotechnology, 2005, 15(5): 95–97. |
| [32] |
杨丽娟, 柏亚罗. 甲氧基丙烯酸酯类杀菌剂 —— 吡唑醚菌酯[J]. 现代农药, 2012, 11(4): 46–50.
YANG L J, BAI Y L. Strobilurin fungicide — pyraclostrobin[J]. Mod Agrochem, 2012, 11(4): 46–50. |
 2017, Vol. 19
2017, Vol. 19


