2. 华中师范大学 化学学院 农药与化学生物学教育部重点实验室,武汉 430079
2. Key Laboratory of Pesticide & Chemical Biology of Ministry of Education, College of Chemistry, Central China Normal University, Wuhan 430079, China
对羟基苯基丙酮酸双加氧酶 (p-hydroxyphenylpyruvate dioxygenase, HPPD,EC 1.13.11.27) 广泛存在于植物、哺乳动物及微生物等需氧生物体中,可催化p-羟基苯基丙酮酸 (p-hydroxyphenylpyruvic acid,HPPA) 氧化脱羧转变为尿黑酸 (homogentisicacid, HGA) 并释放出CO2[1-5]。在植物体中,尿黑酸依次经过脱羧、聚戊二烯基化和烷基化,最终生成质体醌和生育酚。HPPD的活性一旦被抑制,则质体醌和生育酚的正常合成途径将被阻断,进而造成类胡萝卜素的生物合成减少、光合作用中的电子传递链受阻、以及质体的光氧化等多种现象,最终导致植株中叶绿素分子被破坏,促使叶片出现白化症状,甚至植株死亡。因此,HPPD已经被发展成为最重要的除草剂作用靶标之一。HPPD抑制剂具有广谱的除草活性,能有效防除玉米和水稻田的阔叶杂草,在苗前、苗后均可使用,具有广谱性、高活性、低残留及使用安全等特点。因此HPPD抑制型除草剂的研究已成为近年来化学农药研究的一个热点[6-12]。
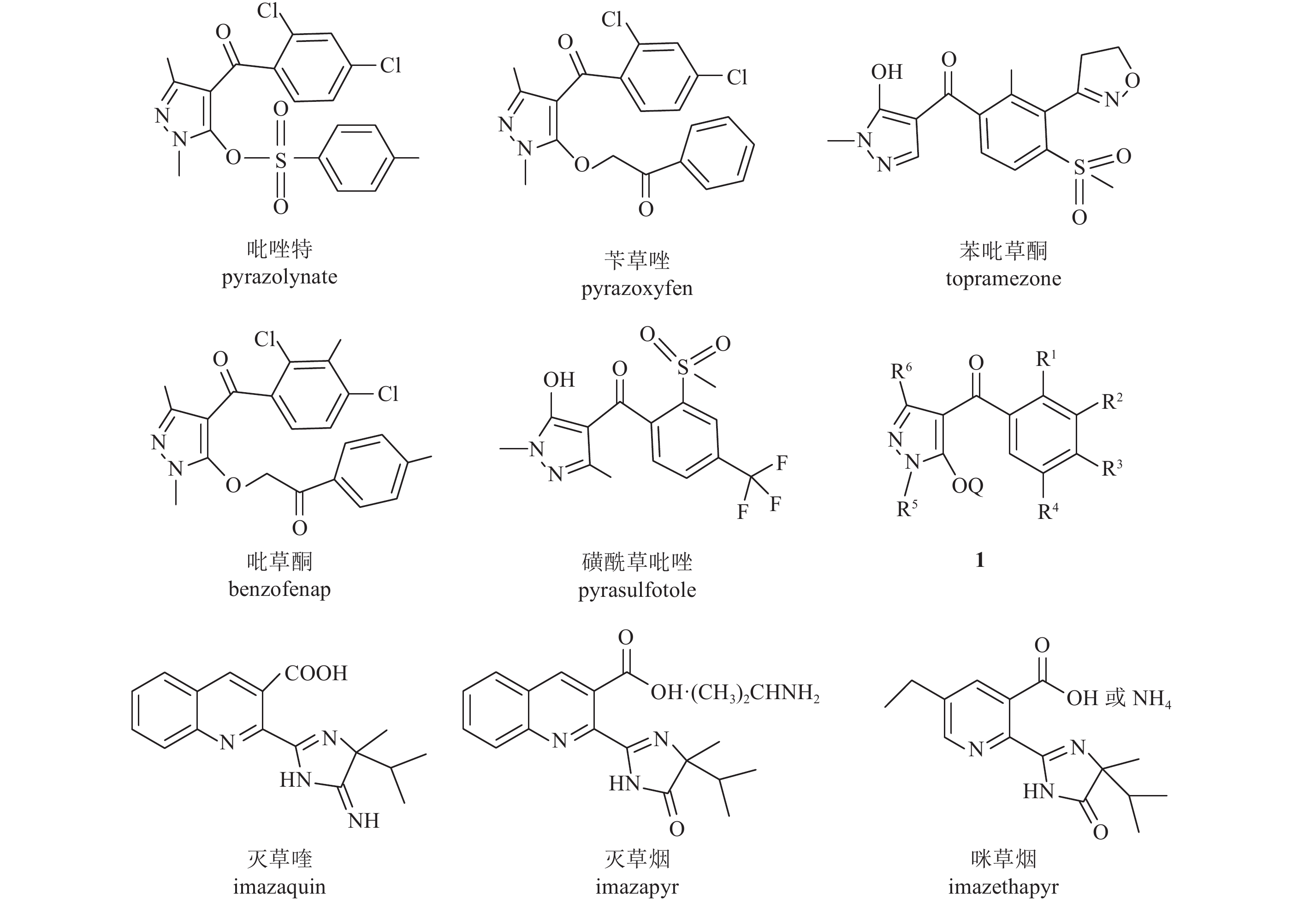
目前已商品化的HPPD抑制剂约15个,按其结构主要分为3种类型:吡唑类、三酮类及二酮腈类 (异鰁唑类)[8]。其中吡唑类是HPPD抑制剂中最重要的一类除草剂,已商品化的有吡唑特、苄草唑和苯吡草酮等5个品种[10, 13-15](结构见图式1)。吡唑类与三酮类一样,其化合物分子或其异构体或其代谢物中具有共同的结构单元2-苯甲酰基乙烯-l-醇基团,充当底物对羟苯基丙酮酸的α-酮酸部分的等排体,并具有与对羟基苯基丙酮酸 (HPPA) 竞争HPPD活性中心Fe2+并进行络合的能力;同时吡唑部分与HPPD的结合和它的酶活抑制性是导致白化症状的主要原因[16]。因此,吡唑类HPPD抑制型除草剂始终是近几年农药新品种研究的热点。吡唑类结构主要包括吡唑部分和苯环部分,吡唑环上取代基可多方位的变换,苯环部分可改变R1~R4等取代基 (见图式1)。近几年不断有新专利对吡唑结构进行优化,例如改变R5或R6基团[17]、优化Q取代基[18-20](见图式1中结构1) 以及苯并杂环等[21-22],尤其是苯并杂环类HPPD抑制剂近年来研究较多,并发现了很多优秀的、广谱的除草剂先导化合物[23-26]。
|
图式 1 吡唑类HPPD抑制剂结构及已开发的含咪唑啉 (酮) 除草剂 Scheme1 HPPD-inhibition based herbicides and compounds that containing-pyrazole and developed imidazole (ketone) |
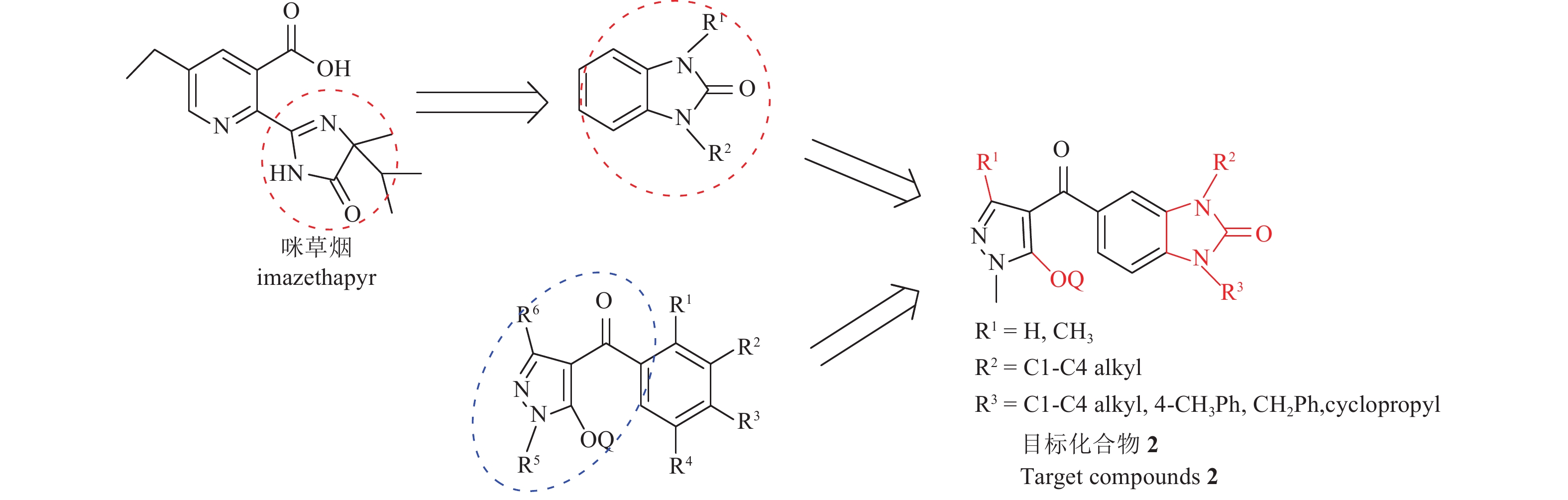
咪唑啉酮类化合物具良好的生物活性,从20世纪90年代以来,很多高活性的含咪唑啉酮衍生物相继被报道[27-29]。在除草剂方面目前已开发了灭草喹 (imazaquin) 用以防除阔叶杂草与禾本科杂草等;灭草烟 (imazapyr) 用以防除一年生或多年生阔叶杂草;咪草烟 (imazethapyr) 用以防除稗草、金色狗尾草 (Setaria glauca)、苘麻及反枝苋等[30]。这些代表性化合物的结构见图式1所示。
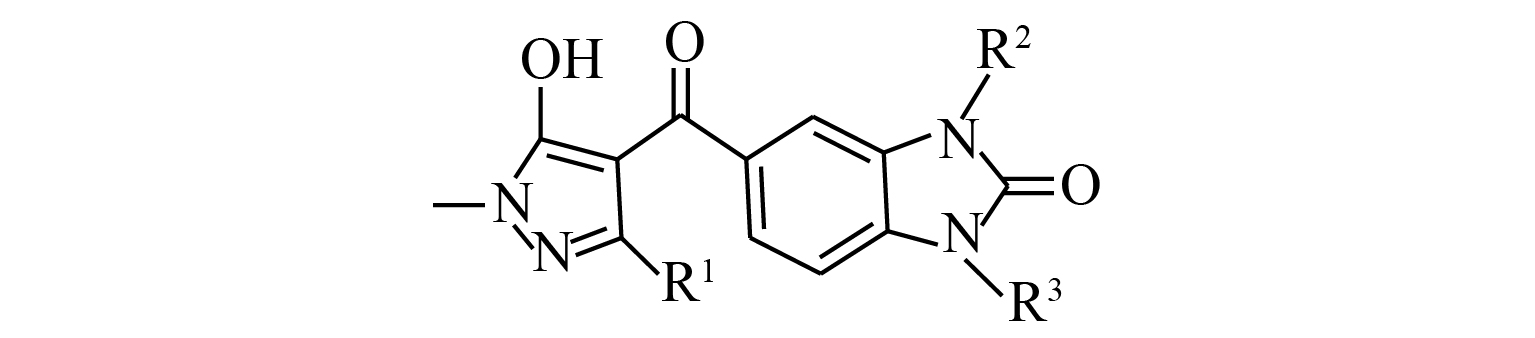
基于咪唑啉酮广泛的生物活性,本研究将咪唑啉酮部分与苯环组成一个含有咪唑啉酮基的苯并五元杂环结构,随后基于活性亚结构拼接的策略,将这个苯并咪唑啉酮杂环与商品化吡唑类除草剂结构中的羟基吡唑结构拼接,得到一类新型的含有苯并咪唑啉酮的吡唑类HPPD抑制剂 (见图式2)[31],结合活体水平的生物活性评价,对该结构进行初步的构效关系总结,并对除草活性突出的化合物进行作物安全性的评价,结合离体水平对人源HPPD(hHPPD) 的活性和对拟南芥Arabidopsis thaliana HPPD (AtHPPD) 活性的生物评价,计算出选择性倍数,以寻找对拟南芥活性高而对人体安全的高活性除草剂。
|
图式 2 目标化合物的设计思路 Scheme2 Design strategy of the target compounds |
1 材料与方法 1.1 仪器与试剂
1H NMR谱和13C NMR谱采用Mercury Plus 400 MHz核磁共振仪或者Varian VNMR600 MHz(TMS为内标,CDCl3或者DMSO-d6为溶剂);高分辨质谱是由安捷伦科技公司的6224 TOF LC/MS (USA) 质谱仪测定;熔点由BüCHI B-545数字熔点仪 (温度计未经校正) 测定。德国Heidolph公司生产的MR3001型恒温磁力搅拌器,BüCHI R-200型旋转蒸发仪,BüCHI Vacuum Pump V-700隔膜泵,DLSB低温冷却循环泵,ZF-200暗箱式紫外分析仪。石油醚沸程为60~90 ℃;其他试剂均为分析纯或化学纯。所用溶剂在实验前均经过重蒸或者干燥处理。
1.2 目标化合物的合成及结构表征目标化合物2A~2W的合成路线及合成方法见文献[31],其中化合物2A~2N、2S~2W及相关中间体的结构已在文献[31]中表征,化合物2O~2R为新化合物,其结构表征数据如下。
2O: 白色固体. 熔点159~160 ℃. 收率 52%. 1H NMR (600 MHz, DMSO-d6), δ: 7.49 (s, 2H), 7.26 (d, J = 7.8 Hz, 1H), 3.79 (t, J = 6.6 Hz, 2H), 3.48 (s, 3H), 3.05~2.87 (m, 1H), 2.08 (s, 3H), 1.76~1.52 (m, 2H), 1.05 (q, J = 6.6 Hz, 2H), 0.93~0.79 (m 5H). 13C NMR (100 MHz, CDCl3), δ: 191.84, 160.10, 154.41, 146.39, 133.37, 131.28, 128.91, 122.32, 107.44, 107.09, 102.05, 42.60, 32.38, 22.53, 21.58, 15.77, 11.16, 5.90. 高分辨质谱:理论值 355.177 0, 测量值355.177 9.
2P: 白色固体. 熔点142~144 ℃. 收率 53%. 1H NMR (600 MHz, CDCl3), δ: 7.40 (d, J = 7.8 Hz, 1H), 7.31 (s, 1H), 7.20 (d, J = 7.8 Hz, 1H), 4.83 – 4.72 (m, 1H), 3.89 (t, J = 7.8 Hz, 2H), 3.72 (s, 3H), 2.21 (s, 3H), 1.81 – 1.67 (m, 2H), 1.57 (d, J = 7.2 Hz, 6H), 1.41 (dd, J = 15.6, 7.8 Hz, 2H), 0.96 (t, J = 7.2 Hz, 3H). 13C NMR (100 MHz, CDCl3), δ: 191.76, 160.20, 153.62, 146.38, 131.42, 130.64, 129.37, 122.13, 107.76, 107.31, 102.08, 45.17, 40.92, 32.40, 30.40, 20.15, 19.98, 15.83, 13.60.高分辨质谱: 理论值371.208 3, 测量值371.209 9.
2Q: 白色固体. 熔点188~189 ℃. 收率 51%. 1H NMR (600 MHz, CDCl3), δ: 7.42 (dd, J = 7.8, 1.2 Hz, 1H), 7.33 (s, 1H), 7.06 (d, J = 7.8 Hz, 1H), 3.99 (q, J = 7.2 Hz, 2H), 3.73 (d, J = 7.8 Hz, 2H), 3.70 (s, 3H), 2.31 – 2.20 (m, 1H), 2.18 (s, 3H), 1.37 (t, J = 7.2 Hz, 3H), 0.99 (d, J = 6.6 Hz, 6H). 13C NMR (100 MHz, CDCl3), δ: 191.86, 160.26, 154.18, 146.42, 133.07, 131.04, 128.82, 122.43, 107.21, 106.91, 102.10, 48.68, 35.98, 32.45, 27.89, 20.05, 15.85, 13.66. 高分辨质谱: 理论值 357.192 7,测量值357.193 9.
2R: 白色固体. 熔点163~164 ℃. 收率 55%. 1H NMR (600 MHz, CDCl3), δ: 7.42 (d, J = 8.4 Hz, 1H), 7.27 (s, 2H), 3.87 (t, J = 7.2 Hz, 2H), 3.68 (s, 3H), 3.00 – 2.83 (m, 1H), 2.15 (s, 3H), 1.82 – 1.63 (m, 2H), 1.40 (dd, J = 15.0, 7.2 Hz, 2H), 1.15 (q, J = 7.8 Hz, 2H), 1.10 – 1.01 (m, 2H), 0.96 (t, J = 7.2 Hz, 3H). 13C NMR (100 MHz, CDCl3), δ: 191.90, 160.17, 154.40, 146.40, 133.40, 131.30, 128.89, 122.32, 107.46, 107.08, 102.06, 40.84, 32.41, 30.34, 22.55, 19.93, 15.81, 13.57, 5.91. 高分辨质谱: 理论值369.192 7, 测量值369.193 1.
1.3 目标化合物的体外HPPD酶抑制活性测试采用偶联法测定目标化合物2A~2W对体外拟南芥HPPD(AtHPPD) 和人源HPPD(hHPPD) 酶的抑制活性。AtHPPD和hHPPD的表达、纯化及测定方法参考文献[25, 35-38]进行。其主要原理为:对羟苯基丙酮酸 (HPPA) 在HPPD的作用下转化生成尿黑酸 (HGA),但由于尿黑酸与底物HPPA的紫外吸收重叠,且没有特征吸收,故向体系中加入了另外一种酶—尿黑酸双加氧酶 (HGD) 来辅助测试。HGD可以将HGA催化转化成马来酰乙酰乙酸 (MAA),而MAA在318 nm紫外处吸光度随着时间的变化而变化。酶促反应动力学测试在96孔板中进行,反应体系在pH = 7.0的HEPES buffer中进行。总体系包含: pH = 7.0 的4-羟乙基哌嗪乙磺酸缓冲液,2 mmol/L的抗坏血酸钠,100 μmol/L的硫酸亚铁,1 μmol/L的抑制剂,适量的HPPD和HGD。抑制剂常数用Ki表示,所测得化合物的Ki值通过Dixon作图法求得[38]。
1.4 目标化合物的选择性倍数以化合物对人源HPPD酶的Ki值除以化合物对拟南芥HPPD酶的Ki值即得到化合物的选择性倍数。选择性倍数高表示化合物对人源HPPD酶的抑制常数高于对拟南芥HPPD酶的抑制常数,进而表示化合物可能对人具有较好的安全性[39]。
1.5 化合物2E、2U和2W的分子对接采用种属来源为拟南芥的HPPD晶体结构 (PDB ID:1TFZ) 作为受体[38, 40-41],剔除结晶中的水分子和其他有机小分子,保留参与络合的三价铁离子。使用Gold 3.2 进行分子对接,将1TFZ中以金属铁原子为中心1.5 nm (15 Å) 半径内的区域设置为活性腔格点扫描区,设定亚铁离子为八面体的六配位鳌合中心。采用GoldScore进行打分, 其他位置保持默认设置,每个分子产生100个对接构象,并分别取各自的最优打分构象作为其代表的结合模式。3个化合物与AtHPPD的结合模式均采用Pymol 1.3作图。红色虚线代表金属铁原子与周围氨基酸残基His205、His287、Glu373和小分子之间的络合作用, 蓝色虚线代表抑制剂小分子与周围氨基酸残基之间的立体冲撞效应。
1.6 目标化合物的除草活性测试委托国家南方农药创制中心浙江省化工研究院生物安全评价中心测定目标化合物的生物活性。采用温室盆栽法[32-33]。
普筛试验:用分析天平 (0.000 1 g) 称取一定质量的原药,用含1%吐温-80乳化剂的DMF溶解,配制成质量分数为1.0%~5.0%母液,用蒸馏水稀释备用。供试靶标为芥菜 Brassica juncea (L.) Czern. Et Coss.、菵草 Beckmannia syzigachne (Stend.) Fernd、繁缕 Stellariamedia (L.) Cyr、早熟禾 Poa annua L.、小藜 Chenopodium serotinum L.、棒头草 Polypogon fugax Nees ex Steud。取内径7.5 cm花盆,装复合土[V(菜园土):V(育苗基质)=1:2]至3/4处,直接播种上述6种杂草靶标 (发芽率 ≥ 85%),覆土0.2 cm,待杂草长至3叶期备用。采用自动喷雾塔喷施目标化合物2A~2W及对照硝磺草酮,施药有效剂量均为150 g/hm2,待杂草叶面药液晾干后移入温室培养 (培养条件:温度5~30 ℃,空气相对湿度50%~90%)。于药后 35 d 目测调查杂草的综合生长抑制率 (%)。
初筛试验:选择普筛活性较好的化合物降低施药剂量 (150、37.5和75 g/hm2) 后进行初筛。试验方法同上。以硝磺草酮为对照药剂。于药后 30 d 目测调查试验结果。
生长抑制率设为0~100%,其中80%~100%为除草活性优秀,60%~75%为除草活性良好,低于55%为除草活性较差,0为无效。
1.7 化合物对作物安全性试验采用温室盆栽法[34]对初筛活性较好的化合物进行作物安全性评价。供试靶标为小麦 (鲁源)、玉米 (农大108)、水稻 (内5优8015)、大豆 (铁丰30)、棉花 (烟台2号) 和油菜 (浙油50)。取内径12 cm花盆,装复合土[V(菜园土):V(育苗基质)=1:2]至3/4处,直接播种作物种子 (发芽率 ≥ 85%),覆土1~2 cm,待植株长至4~5叶备用。采用自动喷雾塔施药,施药剂量为150 g/hm2,以硝磺草酮为对照。待作物叶面药液晾干后移入温室培养。于药后30 d目测调查综合生长抑制率 (%),并测定棉花、玉米、小麦、水稻、大豆和油菜地上部分鲜重,计算鲜重抑制率,以喷施蒸馏水为空白对照。鲜重抑制率计算公式:E/% = (C – T)/C × 100,其中,E:鲜重抑制率;C:对照植株地上部分鲜重;T:处理植株地上部分鲜重。依据农药室内生物测定试验准则[34]判定:药剂对作物药害小于10%表示安全 (记作0),药害在11%~30%表示有轻微药害,药害在31%~50%为中度药害,药害大于51%为严重药害。
2 结果与分析 2.1 AtHPPD 酶抑制活性与构效关系表1列出了化合物2A~2W对AtHPPD和hHPPD的抑制常数 (Ki) 值。从中可以看出, 绝大部分化合物对AtHPPD都表现出了较好的抑制活性。例如, 化合物2F的Ki值为0.001 2 μmol/L, 比对照药剂硝磺草酮 (Ki=0.010 6 μmol/L) 提高了近9倍。
|
|
表 1 目标化合物对重组HPPD的抑制活性及其选择性倍数 Table 1 The chemical structures of target compounds and their inhibitory activity against recombinant HPPD and the selectivity profile |
从构效关系上看,当R1为氢原子时酶活性普遍高于R1为甲基;当R2为甲基时,R3为简单的乙基、丙基或者异丙基时有利于活性的提高;当R3为较大的取代基如丁基、苄基或者苯基时,化合物的活性急剧下降甚至失活。同时发现酶抑制活性高的化合物如2E,除草活性也较高,而酶抑制活性较差的化合物2U和2W,除草活性也已丧失 (表2),表明酶抑制活性与除草活性存在一定相关性。当R2为甲基时,大部分化合物选择性倍数较低,当R2为甲基以外的其他基团时,选择性倍数均提高;当R2与R3为不同基团时比为相同基团时,选择性倍数高,如化合物2I和2J比化合物2G和2M选择性倍数高;尤其可喜的是化合物2P选择性倍数达到最高时,对拟南芥来源酶的抑制活性仍然高于对照硝磺草酮。值得一提的是,化合物2F (Ki = 0.001 2 μmol/L) 对AtHPPD的抑制活性是硝磺草酮 (Ki = 0.010 6 μmol/L) 的9倍,化合物2P在人源和拟南芥HPPD之间的选择性倍数为93倍。进一步开展温室盆栽除草活性筛选和作物安全性试验, 除草活性研究发现,取代基对化合物除草活性有一定的影响,尤其是取代基R2和R3影响显著。具体的构效关系如下。(a) 当R2为甲基时,R3若为较大体积的苄基或者取代苯基时,化合物除草活性大大下降甚至丧失,如化合物2T、2U、2V和2W。(b) R3 若为体积较小的烷基或环烷基取代时,则有利于活性增加。(c) 当R2为乙基或者丙基时,化合物整体活性增加,这时R3的影响并不明显。(d) 当R2与R3取代基相同且为乙基时,除草活性显著增强而杀草谱也变宽,如化合物2E和2G;若同为丙基,则杀草谱变窄,活性略有下降,如化合物2F和2M。在初筛中发现,当化合物2E在处理剂量为37.5 g/hm2下对繁缕和小藜的防效仍可达到98%以上;化合物2G在处理剂量降至37.5 g/hm2时,对繁缕、小藜和棒头草的防效仍保持在90%以上。
为了深入了解取代基对化合物活性的影响,以化合物2E、2U和2W为例,采用AtHPPD的晶体结构作为受体 (PDB ID为1TFZ),通过计算机模拟获得了上述化合物的结合模式。通过比较,发现3个分子的结合模式比较相似 (图1):首先烯醇的结构都能与亚铁离子形成较好的配位作用,中间的并环都可以与Phe360、Phe403形成π-π三明治堆积的疏水相互作用。由于2W和2U末端都有较大的取代基,右边并环部分发生翻转,即R3基团朝上,发生反转后都会与Met314氨基酸残基侧链产生一定的立体冲撞效应 (具体距离见图1中蓝线),导致并环部分较末端位阻较小的2E的并环部分发生了一定的偏转,使得并环部分与Phe360和Phe403的π-π堆积作用减弱,故它们的活性比2E要低。而由于2W末端与苯环相连的亚甲基具有柔性,其冲撞效应比2U有所减弱,故2W的活性要高于2U。化合物2E的取代基体积比较小,因而不存在翻转和立体冲撞效应,活性较其他两个化合物高。
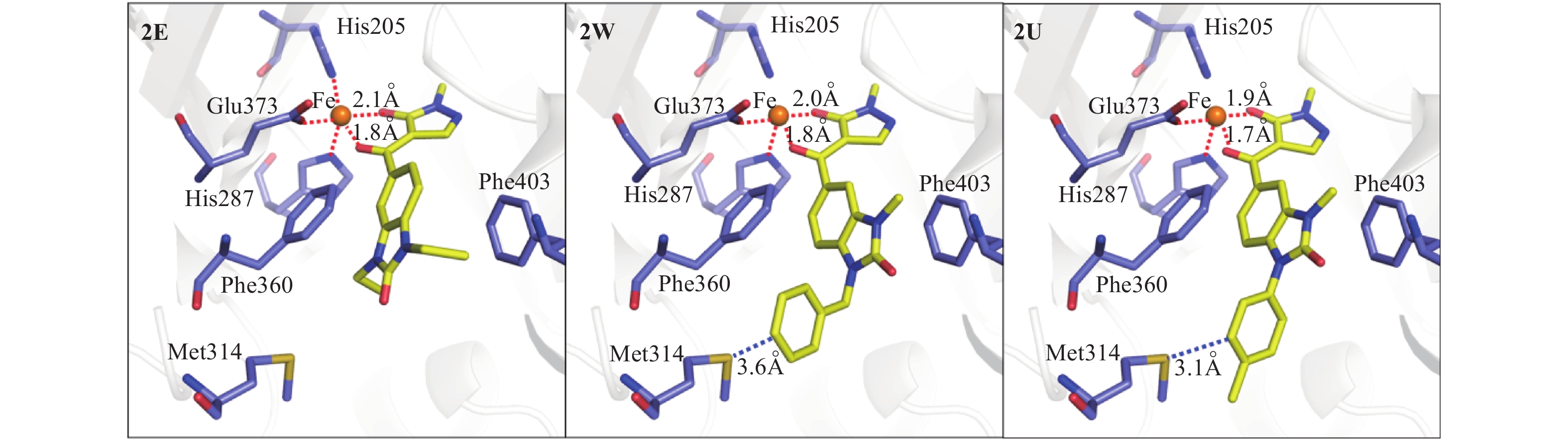
|
图 1 模拟得到的化合物2E、2W和2U在AtHPPD活性空腔中的结合模式 Fig. 1 Simulated binding modes of the compounds 2E, 2W and 2U in the AtHPPD active site |
2.2 目标化合物的酶抑制活性和种属选择性
在前期工作中,测试了化合物对人源HPPD的IC50值,并总结了其结构活性关系[31]。本研究中,为了研究化合物对哺乳动物的安全性,测试了化合物对人源HPPD的Ki值,由两个种属的Ki值计算的选择性倍数见表1。由表1可以看出,大部分化合物的选择性倍数均较硝磺草酮高,部分化合物的选择性倍数10以上,尤其是化合物2P达到了93倍,比硝磺草酮的选择性高出23倍;化合物2O、2R的选择性倍数也分别达到了59和57,均是硝磺草酮选择性的10倍以上。基于酶水平的选择性研究表明,目标化合物2O、2R的对哺乳动物的安全性可能比硝磺草酮高。
2.3 除草活性目标化合物温室盆栽除草活性普筛结果见表2。可以看出, 在有效剂量150 g/hm2下,目标化合物对阔叶杂草繁缕和小藜均表现出了较高的除草活性,大部分化合物对繁缕、小藜和棒头草的抑制活性达到80%以上,其中化合物2E、2G和2N杀草谱较广,对4种及以上杂草表现出了较高的除草活性。但对于早熟禾,仅有2G、2H、2I和2N表现出70%以上的防效。所有化合物对菵草均未表现出活性。
|
|
表 2 化合物2A~2W苗后除草活性普筛试验结果 (150 g/hm2) Table 2 Post-emergent herbicidal activity of compounds 2A-2W(150 g/hm2) |
对普筛除草活性较好的化合物2E和2G又进行了初筛试验,结果 (表3) 表明:化合物2E和2G对阔叶杂草芥菜、繁缕和小藜具有较高的除草活性,与硝磺草酮活性相当;化合物2E在有效成分75 g/hm2下对繁缕和小藜的抑制率仍保持100%,即使在37.5 g/hm2条件下对繁缕和小藜的抑制率仍可达到98%以上。化合物2G在150 和75 g/hm2条件下对芥菜、繁缕和小藜3种阔叶杂草和禾本科杂草棒头草的抑制率高达100%,在37.5 g/hm2条件下对繁缕、小藜和棒头草的抑制率仍保持在90%以上,但在该剂量下比硝磺草酮活性略差。
|
|
表 3 化合物2E和2G苗后温室除草活性初筛试验结果 Table 3 The results of further herbicidal testing of compounds 2E and 2G (post-emergence) |
2.4 作物安全性测试
除草活性较高的化合物2E和2G在150 g/hm2剂量下对作物的安全性测试结果 (表4) 表明:这两个化合物对阔叶作物大豆、油菜和棉花均有显著抑制 (抑制率 ≥ 10%);二者对玉米、水稻、小麦等作物生长的抑制率均 < 10%,对作物的安全性较高;而对照药剂硝磺草酮仅对玉米无明显抑制,对水稻、小麦、大豆、油菜和棉花均显示出较强的抑制作用。可见,化合物2E和2G对作物安全性优于硝磺草酮。结合前述酶抑制活性、温室内除草活性试验结果,发现化合物2E和2G具备开发成为玉米田、水稻田和小麦田除草剂的潜力,值得进一步研究。
|
|
表 4 化合物2E和2G的苗后作物安全性测试 (150 g/hm2) Table 4 Crop safety of compounds 2E and 2G (post-emergence) (150 g/hm2) |
3 结论
本研究结果表明,23个含咪唑啉酮结构单元的化合物对来源于拟南芥的HPPD具有较好的抑制活性,且不同取代基对化合物的选择性倍数有显著影响,其中化合物2P的选择性与硝磺草酮相比提高了近23倍。进一步的除草活性测试表明,化合物2E和2G对阔叶杂草的防效与硝磺草酮相当,且在 150 g/hm2剂量下对玉米、水稻和小麦等作物的安全性优于硝磺草酮,具有深入研究的价值。
| [1] | MORAN G R. 4-Hydroxyphenylpyruvate dioxygenase[J]. Arch Biochem Biophys, 2005, 433(1): 117–128. doi:10.1016/j.abb.2004.08.015 |
| [2] | BROWNLEE J M, JOHNSON-WINTERS K, HARRISON D H T, et al. Structure of the ferrous form of (4-hydroxyphenyl) pyruvate dioxygenase from Streptomyces avermitilis in complex with the therapeutic herbi-cide, NTBC [J]. Biochemistry, 2004, 43(21): 6370–6377. doi:10.1021/bi049317s |
| [3] | KOVALEVA E G, LIPSCOMB J D. Versatility of biological non-heme Fe(II) centers in oxygen activation reac-tions[J]. Nat Chem Biol, 2008, 4(3): 186–193. doi:10.1038/nchembio.71 |
| [4] | RASPAIL C, GRAINDORGE M, MOREAU Y, et al. 4-Hydroxyphenylpyruvate dioxygenase catalysis: identifi-cation of catalytic residues and production of a hydroxylated intermediate shared with a structurally unrelated enzyme[J]. J Biol Chem, 2011, 286(29): 26061–26070. doi:10.1074/jbc.M111.227595 |
| [5] | GARCIA I, RODGERS M, PEPIN R, et al. Characterization and subcellular compartmentation of recombinant 4-hydroxyphenylpyruvate dioxygenase from Arabidopsis in transgenic tobacco [J]. Plant Physiol, 1999, 119(4): 1507–1516. doi:10.1104/pp.119.4.1507 |
| [6] | AHRENS H, LANGE G, MÜLLER T, et al. 4-Hydroxyphenylpyruvate dioxygenase inhibitors in combination with safeners: solutions for modern and sustainable agriculture[J]. Angew Chem Int Ed, 2013, 52(36): 9388–9398. doi:10.1002/anie.v52.36 |
| [7] |
朱有全, 司学凯, 邹小毛, 等. 新型3-羟亚甲基吡咯烷-2,4-二酮衍生物的合成与除草活性研究[J]. 有机化学, 2007, 27(3): 385–390.
ZHU Y Q, SI X K, ZOU X M, et al. Synthesis and herbicidal evaluation of novel 3-(hydroxymethylene)pyrrolidine-2,4-dione[J]. Chin J Org Chem, 2007, 27(3): 385–390. |
| [8] | BEAUDEGNIES R, EDMUNDS A J F, FRASER T E M, et al. Herbicidal 4-hydroxyphenylpyruvate dioxygenase inhibitors—a review of the triketone chemistry story from a syngenta perspective[J]. Bioorg Med Chem, 2009, 17(12): 4134–4152. doi:10.1016/j.bmc.2009.03.015 |
| [9] |
程永浩, 邹小毛, 高颖, 等. 1-(取代吡唑-4-甲酰基)吡唑类化合物的合成及生物活性研究[J]. 高等学校化学学报, 2004, 11(25): 2024–2027.
CHENG Y H, ZOU X M, GAO Y, et al. Synthesis and biological activity of novel 1-(substituted-pyrazole-4-carbonyl) pyrazoles[J]. Chem J Chin Univ, 2004, 11(25): 2024–2027. |
| [10] | SCHMITT M H, VAN ALMSICK A, WILLMS L. Discovery and chemistry of pyrasulfotole, a new dicot herbicide for cereal production[J]. Pflanzenschutz-Nachr Bayer, 2008, 61: 7–14. |
| [11] |
张一宾. HPPD抑制剂类除草剂及其市场开发进展[J]. 现代农药, 2013, 12(5): 5–8.
ZHANG Y B. Herbicides as HPPD inhibitors and their market development[J]. Mod Agrochem, 2013, 12(5): 5–8. |
| [12] |
周蕴赟, 李正名. HPPD抑制剂类除草剂作用机制和研究进展[J]. 世界农药, 2013, 35(1): 1–7.
ZHOU Y Y, LI Z M. Recent advances in 4-hydroxyphenylpyruvate dioxygenase (HPPD) inhibitors[J]. World Pestic, 2013, 35(1): 1–7. |
| [13] | EDMUNDS A J F, MORRIS J A, VAN ALMSICK A. Modern crop protection compounds[M]. 2nd ed. Weinheim: Wiley-VCH, 2012: 235-258, 262-275. |
| [14] | KONOTSUNE T, KAWAKUBO K. Herbicidal compositions and pyrazole derivatives: DE2513750 A1[P/OL]. 1975-10-09. [2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?CC=DE&NR=2513750A1&KC=A1&FT=D&ND=3&date=19751009&DB=EPODOC&locale=en_EP#. |
| [15] | RYUZO N, FUMIO K, TAKAHIRO H, et al. Pyrazole derivatives useful as a herbicidal component: US4230481 A[P/OL]. 1980-10-28. [2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?FT=D&date=19801028&DB=EPODOC&locale=en_EP&CC=US&NR=4230481A&KC=A&ND=4#. |
| [16] | GROSSMANN K, EHRHARDT T. On the mechanism of action and selectivity of the corn herbicide toprame-zone: a new inhibitor of 4-hydroxyphenylpyruvate dioxygenase[J]. Pest Manage Sci, 2007, 63(5): 429–439. doi:10.1002/(ISSN)1526-4998 |
| [17] | AHRENS H, VAN ALMSICK A, LEHR S, et al. 3-Cyclopropyl-4-(3-thiobenzoyl) pyrazoles and their use as herbicides: US2008305956 A1[P/OL]. 2008-12-11. [2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?DB=EPODOC&II=1&ND=3&adjacent=true&locale=en_EP&FT=D&date=20081211&CC=US&NR=2008305956A1&KC=A1#. |
| [18] | MASAMITSU T, HIROSHI K, SOUICHIRO N, et al. Pyrazole compounds, process for their production and herbicides containing them: WO2009142318 A1[P/OL]. 2009-11-26. [2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?CC=WO&NR=2009142318A1&KC=A1&FT=D&ND=3&date=20091126&DB=EPODOC&locale=en_EP#. |
| [19] | MASAMITSU T, HIROSHI K, SOUICHIRO N. Benzoylpyrazole compound, process for production of the same, and herbicide comprising the same: WO2009145202 A1[P/OL]. 2009-12-03. [2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?DB=EPODOC&II=0&ND=3&adjacent=true&locale=en_EP&FT=D&date=20091203&CC=WO&NR=2009145202A1&KC=A1#. |
| [20] | YAMAGUCHI M, KOBAYASHI M, MITSUNARI T, et al. 5-Asylpyrimidine-2,4-dion derivative and herbicide: JP2013040141 A[P/OL]. 2013-02-28.[2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?DB=EPODOC&II=0&ND=3&adjacent=true&locale=en_EP&FT=D&date=20130228&CC=JP&NR=2013040141A&KC=A#. |
| [21] | TAKABE F, FUKUMOTO S, KAJIKI R, et al. Pyridone derivative and herbicide: WO2007088876 A1[P/OL]. 2007-08-09. [2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?DB=EPODOC&II=0&ND=3&adjacent=true&locale=en_EP&FT=D&date=20070809&CC=WO&NR=2007088876A1&KC=A1#. |
| [22] | PATEL K M, SELBY T P, SMITH B T, et al. Herbicidal bis-nitrogen-containing oxo and sulfono heterocycles: WO2012033548 A2[P/OL]. 2012-03-15. [2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?DB=EPODOC&II=0&ND=3&adjacent=true&locale=en_EP&FT=D&date=20120315&CC=WO&NR=2012033548A2&KC=A2#. |
| [23] | WANG D W, LIN H Y, CAO R J, et al. Synthesis and herbicidal evaluation of triketone-containing quinazo-line-2,4-diones[J]. J Agric Food Chem, 2014, 62(49): 11786–11796. doi:10.1021/jf5048089 |
| [24] | JEANMART S, EDMUNDS A J F, LAMBERTH C, et al. Synthetic approaches to the 2010-2014 new agro-chemicals[J]. Bioorg Med Chem, 2016, 24(3): 317–341. doi:10.1016/j.bmc.2015.12.014 |
| [25] | WANG D W, LIN H Y, CAO R J, et al. Synthesis and herbicidal activity of triketone?quinoline hybrids as novel 4-hydroxyphenylpyruvate dioxygenase inhibitors[J]. J Agric Food Chem, 2015, 63(23): 5587–5596. doi:10.1021/acs.jafc.5b01530 |
| [26] | LEI K, HUA X W, TAO Y Y, et al. Discovery of (2-benzoylethen-1-ol)-containing 1,2-benzothiazine derivatives as novel 4-hydroxyphenylpyruvate dioxygenase (HPPD) inhibiting-based herbicide lead compounds[J]. Bioorg Med Chem, 2016, 24(2): 92–103. doi:10.1016/j.bmc.2015.11.032 |
| [27] | MAIENFISCH P. Heterocyclic compounds as pesticides: WO9912906 A1[P/OL]. 1999-03-18.[2017-04-09] https://worldwide.espacenet.com/publicationDetails/biblio?DB=EPODOC&II=0&ND=3&adjacent=true&locale=en_EP&FT=D&date=19990318&CC=WO&NR=9912906A1&KC=A1#. |
| [28] | KAWATO H, MIYAZAKI M, SUGIMOTO Y, et al. Imidazothiazole derivatives: WO2008072655 A1[P/OL]. 2008-06-19. [2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?DB=EPODOC&II=0&ND=3&adjacent=true&locale=en_EP&FT=D&date=20080619&CC=WO&NR=2008072655A1&KC=A1#. |
| [29] | CHAMOIN S, ROTH H J, ZIMMERMANN J, et al. Substituted dihydroimidazoles and their use in the treatment of tumors: WO2008065068 A2[P/OL]. 2008-06-05. [2017-04-09]. https://worldwide.espacenet.com/publicationDetails/biblio?DB=EPODOC&II=0&ND=3&adjacent=true&locale=en_EP&FT=D&date=20080605&CC=WO&NR=2008065068A2&KC=A2#. |
| [30] |
宋宝安, 吴剑. 新杂环农药: 除草剂[M]. 北京: 化学工业出版社, 2011.
SONG B A, WU J. New heterocyclic pesticide: herbicide[M]. Beijing: Chemical Industry Press, 2011. |
| [31] | XU Y L, LIN H Y, RUAN X, et al. Synthesis and bioevaluation of pyrazole-benzimidazolone hybrids as novel human 4-hydroxyphenylpyruvate dioxygenase inhibitors[J]. Eur J Med Chem, 2015, 92: 427–438. doi:10.1016/j.ejmech.2015.01.018 |
| [32] | STREIBIG J C. Herbicide bioassay[M]. London: CRC Press Inc., 1993: 7-28. |
| [33] |
农药室内生物测定试验准则 除草剂 第4部分: 活性测定试验 茎叶喷雾法: NY/T 1155.4—2006[S]. 北京: 中国农业出版社, 2006.
Pesticides guidelines for laboratory bioactivity tests Part 4: foliar spray application test for herbicide activity: NY/T 1155.4—2006[S]. Beijing: China Agriculture Press, 2006. |
| [34] |
农药室内生物测定试验准则 除草剂 第8部分: 作物的安全性试验 茎叶喷雾法: NY/T 1155.8—2007[S]. 北京: 中国标准出版社, 2007.
Guideline for laboratory bioassay of pesticides Part 8: foliar application test for herbicide crop safety evaluation: NY/T 1155.8—2007[S]. Beijing: China Standard Press, 2007. |
| [35] | WANG D W, LIN H Y, CAO R J, et al. Design, synthesis and herbicidal activity of novel quinazoline-2,4-diones as 4-hydroxyphenylpyruvate dioxygenase inhibitors[J]. Pest Manage Sci, 2015, 71(8): 1122–1132. doi:10.1002/ps.2015.71.issue-8 |
| [36] | SCHMIDT S R, MÜLLER C R, KRESS W. Murine liver homogentisate 1,2-dioxygenase: purification to homogeneity and novel biochemical properties[J]. Eur J Biochem, 1995, 228(2): 425–430. doi:10.1111/ejb.1995.228.issue-2 |
| [37] |
王大伟, 林红艳, 曹润洁, 等. 含喹唑啉二酮片段的新型三酮类化合物的合成及生物活性[J]. 化学学报, 2015, 73(1): 29–35.
WANG D W, LIN H Y, CAO R J, et al. Synthesis and bioactivity studies of triketone-containing quinazoline-2,4-dione derivatives[J]. Acta Chim Sinica, 2015, 73(1): 29–35. |
| [38] | XU Y L, LIN H Y, CAO R J, et al. Pyrazolone-quinazolone hybrids: a novel class of human 4-hydroxyphenylpyruvate dioxygenase inhibitors[J]. Bioorg Med Chem, 2014, 22(19): 5194–5211. doi:10.1016/j.bmc.2014.08.011 |
| [39] |
左炀. 新型苯并噻咪类PPO抑制剂的设计、合成及除草活性研究[D]. 武汉: 华中师范大学, 2013.
ZUO Y. Design, synthesis and herbicidal activity of novel PPO inhibitors containing benzothiazole moeity[D]. Wuhan: Central China Normal University, 2013. |
| [40] | FRITZE I M, LINDEN L, FREIGANG J, et al. The crystal structures of Zea mays and Arabidopsis 4-hydroxyphenylpyruvate dioxygenase [J]. Plant Physiol, 2004, 134(4): 1388–1400. doi:10.1104/pp.103.034082 |
| [41] | YANG C, PFLUGRATH J W, CAMPER D L, et al. Structural basis for herbicidal inhibitor selectivity revealed by comparison of crystal structures of plant and mammalian 4-hydroxyphenylpyruvate dioxygenases[J]. Bio-chemistry, 2004, 43(32): 10414–10423. |
 2017, Vol. 19
2017, Vol. 19