2. 贵州大学 精细化工研究开发中心/教育部绿色农药与生物工程重点实验室,贵阳 550025
2. Key Laboratory of Green Pesticide and Agricultural Bioengineering, Ministry of Education/Center for Research and Development for Fine Chemicals, Guizhou University, Guiyang 550025, China
茶叶质量安全是保障茶产业可持续发展的重要基础,而茶青是生产茶叶的原材料,其安全与否决定了茶叶的质量安全,以及茶产业的可持续发展性[1]。目前中国茶叶中农药残留的检测方法主要有气相色谱-火焰光度法[2-3]和气相色谱-电子捕获法等[4-6],而关于茶青中农药残留的检测方法较少[9-10],造成茶青中多农药残留的检测空白,增加了成品茶中的农药残留风险。QuEChERS 方法[7]具有快速、简便、成本低的优点,已成为欧洲标准委员会认可的快速检测方法,被广泛运用于蔬菜、水果、茶叶中农药残留的检测分析。褚能明等[8]利用 QuEChERS-GC-MS 法快速分析了茶叶中 86 种农药残留;刘腾飞等[9]及侯如燕等[10]利用 QuEChERS-GC-ECD 法建立了茶青中菊酯类农药的检测方法,样品经分散固相萃取净化后利用 ECD 检测器检测,但其仅涉及了拟除虫菊酯类农药且样品中含有大量的杂质成分会在 ECD 检测器上产生响应,对检测造成干扰。在此基础上,本研究根据 2015—2016 年两年国家茶叶农药残留风险评估项目研究中农药检出率较高的农药种类情况 (联苯菊酯、氯氟氰菊酯、甲氰菊酯、氟氯氰菊酯、毒死蜱、哒螨灵、苯醚甲环唑),结合国家相关标准[11-14],共选择 28 种农药 (25 种杀虫剂、1 种杀菌剂和 2 种杀螨剂) 为研究对象,通过正交试验筛选,对前处理方法进行了改良,结合 GC-MS/MS 检测仪,建立了同时分析茶青中 28 种农药残留的方法。
1 材料与方法 1.1 仪器与药剂GC-MS/MS 仪 (Trace GC Ultra-TSQ MS/MS,美国赛黙飞世尔公司);乙腈、甲苯 (色谱纯,美国天地公司),氯化钠、正己烷 (分析纯,国药集团);PSA 吸附剂、C18 吸附剂和 GCB 粉末 (美国安捷伦公司);28 种农药标准品质量浓度均为 1 000 mg/L,均购于农业部环境质量安全监督检验测试中心 (天津),包括 25 种杀虫剂 [敌敌畏 (dichlorvos)、乙酰甲胺磷 (acephate)、α-六六六 (α-HCH)、β-六六六 (β-HCH)、乐果 (dimethoate)、γ-六六六 (γ-HCH)、δ-六六六 (δ-HCH)、毒死蜱 (chlorpyrifos)、杀螟硫磷 (fenitrothion)、喹硫磷 (quinalphos)、硫丹 (endosulfan)、p,p′-滴滴伊 (p,p′-DDE)、p,p′-滴滴滴 (p,p′-DDD)、o,p′-滴滴涕 (o,p′-DDT)、p,p′-滴滴涕 (p,p′-DDT)、联苯菊酯 (bifenthrin)、三唑磷 (triazophos)、甲氰菊酯 (fenpropathrin)、氯氟氰菊酯 (cyhalothrin)、氯菊酯 (permethrin)、氟氯氰菊酯 (cyfluthrin)、氟氰戊菊酯 (flucythrinate)、氯氰菊酯 (cypermethrin)、氰戊菊酯 (fenvalerate)、溴氰菊酯 (decamethrin)],1 种杀菌剂 [苯醚甲环唑 (difenoconazole)] 和 2 种杀螨剂 [三氯杀螨醇 (dicofol)、哒螨灵 (pyridaben)]。
1.2 QuEChERS 样品前处理方法样品采自遵义市湄潭县贵州省茶叶科学研究所实验茶园,采集一芽二叶和一芽三叶茶青,于 4 ℃ 条件下运回实验室,粉碎后于 –18 ℃ 下保存,备用。
准确称取 10.0 g 茶青样品 (精确至 0.01 g) 于 100 mL 离心管中,先加入 10.0 mL 纯水,再加入 20.0 mL 乙腈,于 15 000 r/min 下匀浆提取 4 min (在 3 min 左右时加入约 3 g NaCl),于 4 000 r/min 下离心 5 min;取 2.0 mL 上清液至预装有 75 mg PSA、25 mg C18 及 4 mg GCB 粉末的 5 mL 离心管中,涡旋 60 s,于 5 000 r/min 下离心 5 min;取上清液过 0.22 μm 微孔滤膜,待 GC-MS/MS 分析。
1.3 气相色谱-串联质谱检测条件色谱条件:VF-5MS 石英毛细管柱 (30 m × 0.25 mm,0.25 μm);升温程序:80 ℃ 保持 1.0 min,以 20 ℃/min 升温至 130 ℃ 保持 1.0 min,以 6 ℃/min 升温至 250 ℃ 保持 5.0 min,再以 8 ℃/min 升温至 300 ℃ 保持 5.0 min;载气为 He,流速 1.0 mL/min;进样口温度 (230.0 ℃);进样量 1.0 μL;不分流进样。
质谱条件:电子轰击 (EI) 离子源;电子能量 70 eV;气相色谱-串联质谱传输线温度 280 ℃;离子源温度 250 ℃;多反应检测 (MRM) 模式扫描;碰撞反应气压力 0.2 Pa。
1.4 标准溶液的配制及标准曲线的绘制1.4.1 标准储备液的配制 将 28 种农药标准品分别用甲醇稀释,配成质量浓度为 100 mg/L 的标准储备液,再用甲醇稀释配成 2 mg/L 的混合标准储备液,于 –18 ℃ 避光保存,有效期 3 个月。
1.4.2 基质匹配混合标准工作溶液配制 取不含待测物的茶青样品,按 1.2 节的前处理方法制得空白基质溶液,并用其稀释混合标准储备液,配成 0.02、0.04、0.10、0.20 和 0.40 mg/L 系列质量浓度的基质匹配混合标准工作溶液,现配现用。
1.5 基质效应采用提取后加入法[15]和绝对基质效应法[16]评价基质效应。通过测定各农药在基质匹配标准溶液中的响应值 (A) 及其在纯溶剂中的响应值 (B),根据公式 (1) 计算基质效应 (ME)。当 ME < 15% 时,样品基质效应对检测结果的影响可忽略;当 ME ≥ 15 时,样品基质效应对检测结果的影响不可忽略。
| $M_E/\text{\%} = \left[ {\left( {A - B} \right)/B} \right] \times 100$ | (1) |
比较了高速匀浆提取和超声浸泡萃取两种方式对样品提取效果的影响。结果表明:在 0.1 mg/kg 添加水平下,两种方式萃取后的农药回收率均在 80%~120% 之间,均可选作样品的提取方法。但由于茶青的含水量较低 (70% 左右),样品比较蓬松,高速匀浆提取效果更好,故最终选择高速匀浆提取。
2.2 QuEChERS 净化条件的优化将不含待测物的空白茶青样品,经乙腈高速匀浆提取后量取 15 mL,加入 1.5 mL 混合标准储备液,制成农药质量浓度为 0.2 μg/mL 的基质匹配标准工作溶液;分别按不同配比的 PSA、C18、GCB 对其进行净化处理。设计 PSA、C18 和 GCB 用量三因素三水平的正交试验,通过添加回收验证 QuEChERS 的净化效果 (表 1)。结果表明:GCB 是影响回收率的主要因子,PSA 和 C18 为次要因子。方差 (Kmax) 越大,回收率越好;级差 (R) 越大对回收率影响越大。本研究中最佳组合是 PSA 25 mg、C18 50 mg 和 GCB 2 mg,其中 GCB 可以除去茶青中的色素,减少样品基质干扰,但在除去色素的同时也会吸附部分农药,造成样品检测值偏低;PSA 和 C18 吸附剂用量对农药的添加回收率影响不大,但由于茶青中含有大量儿茶素、咖啡碱、氨基酸等强极性的有机酸和酚类以及糖和脂类干扰物,以 PSA 为填料对这类物质有很好的吸附作用,故最终确定用 75 mg PSA、25 mg C18 和 4 mg GCB 作为茶青中 28 种农药的 QuEChERS 净化处理条件。
|
|
表 1 正交试验及结果 Table 1 The results of orthogonal experiment |
2.3 质谱离子对的确定
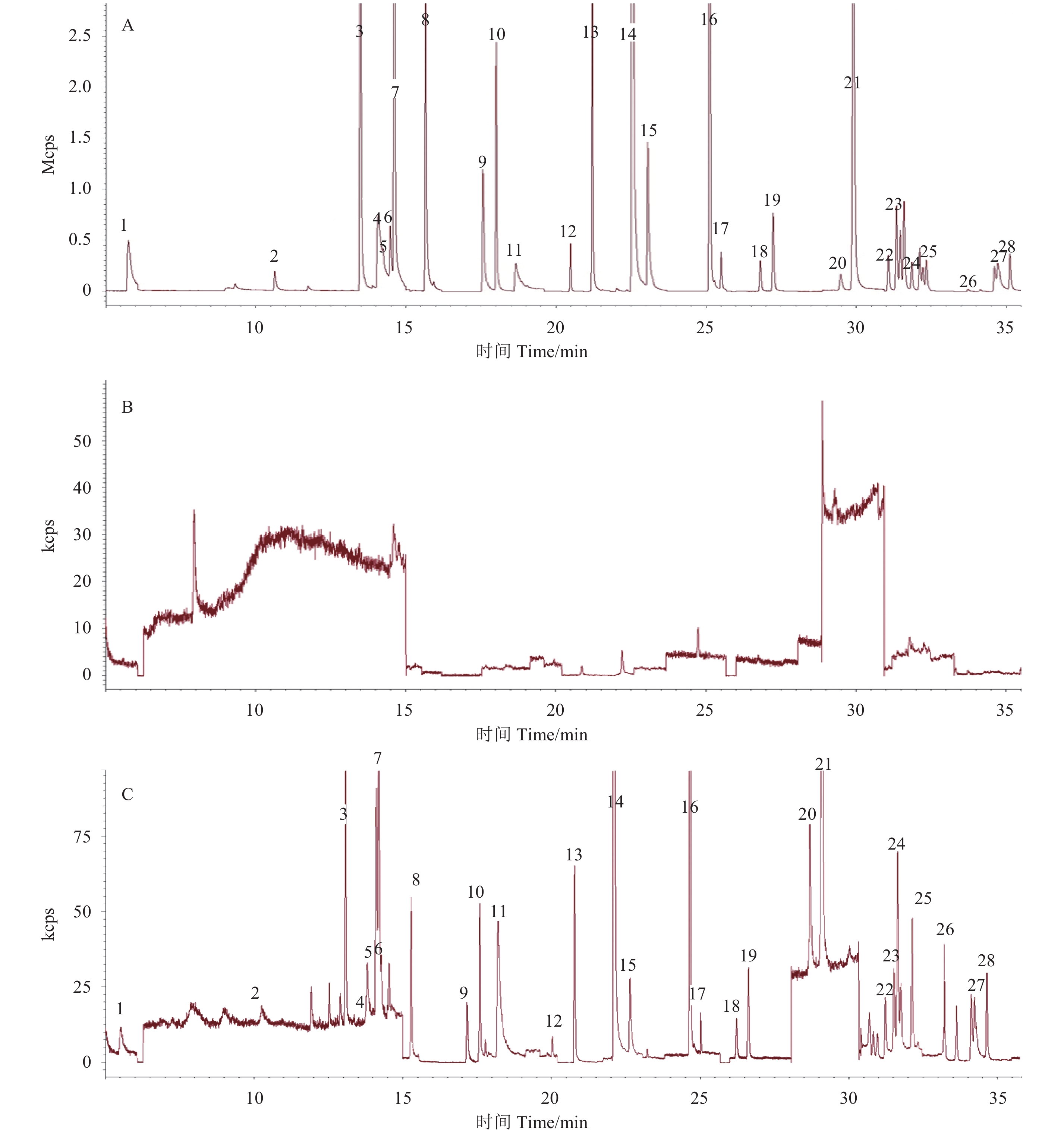
取 10 mg/L 的农药混合标准溶液在 50~500 质量数范围内进行全扫描,通过 NIST 2011 标准库检索,确定每种农药成分的保留时间和特征离子碎片。母离子选择标准为特征性、丰度相对较高、质量数和对称性均高,同时重现性好且不与柱流失碎片离子相同的一级碎片离子,再采用子离子扫描模式确定子离子,在 MRM 多反应监测模式下逐步改变碰撞能量,选择当子离子强度最大且母离子强度占子离子强度 25% 左右时的碰撞能量定为最佳能量,优化后的质谱条件见表 2。图 1 为 28 种农药在 0.10 mg/L 和表 2 条件下得到的多反应监测总离子流图。
|
|
表 2 28 种农药的保留时间及 GC-MS/MS 参数 Table 2 Retention time and GC-MS/MS parameters of 28 pesticides |
|
|
2.4 质谱定性及定量
在相同的条件下进行样品测定,如果农药色谱峰的保留时间与标准品一致,并且在扣除背景值后的样品质谱图中,所选择的离子均出现,离子丰度比与标准品的离子丰度比一致(相对丰度 > 50%,允许 ± 20% 偏差;相对丰度 > 20%~50%,允许 ± 25% 偏差;相对丰度 > 10%~20%,允许 ± 30% 偏差;相对丰度 ≤ 10%,允许 ± 50% 偏差),则可判断样品中存在该农药[8]。采用峰面积质量浓度标准曲线法定量分析。
2.5 方法的线性范围取 1.4.2 节中配制的基质匹配混合标准工作溶液按 1.3 节的条件测定,以各农药的定量离子峰面积 (y) 为纵坐标,以其质量浓度 (x) 为横坐标绘制标准曲线,得到 28 种农药的线性方程及决定系数 R2。结果 (表 3) 表明,在 0.020~0.40 mg/L 范围内,28 种农药的质量浓度与对应的峰面积间均呈良好的线性关系。
2.6 方法检出限、精密度和准确度准确称取 10 g 空白茶青样品进行添加回收试验。农药混合标准品添加水平为 0.1 和 0.5 mg/kg,每个水平重复 6 次。结果 (表 4) 表明,各农药的平均回收率为 77%~106%,RSD 为 1.4~8.0%,检出限为 5~20 μg/kg,定量限为 10~60 μg/kg。
|
|
表 3 茶青中 28 种农药残留标准工作曲线 Table 3 Work standard curves from 28 kinds of pesticide residues in fresh tea leaves |
|
|
表 4 茶青中 28 种农药的检出限、定量限、添加回收率和相对标准偏差 Table 4 LOD, LOQ, recoveries and RSD from 28 kinds of pesticide residues in fresh tea leaves |
2.7 基质效应
结果 (表 5) 表明:六六六和滴滴涕等 11 种农药在茶青基质中均存在一定程度的基质效应 (2.6%~12.2% 之间),但对结果的影响较小;乙酰甲胺磷、乐果、苯醚甲环唑等 17 种农药在茶青基质中均存在较强的基质效应 (7.5%~31.0% 之间),对结果的影响较大。为降低基质效应对结果带来的误差,样品均采用基质匹配标准曲线定量。
|
|
表 5 28 种农药在茶青中的基质效应 Table 5 Matrix effect of 28 pesticides in fresh tea leaves |
2.8 实际样品分析
利用所建立的方法对采集的 6 个茶青样本进行农药残留检测,每份茶青样品平行重复检测 3 次,计算相对标准偏差 (RSD,n = 3)。结果 (表 6) 表明,实际样品检测的 RSD 为 3.91%~5.63%,说明所建立的方法适用于茶青样品中 28 种农药残留的分析检测。
|
|
表 6 实际茶青样品的测定结果 (n = 3) Table 6 The detections of tea leaves samples (n = 3) |
3 结论
本研究优化了 QuEChERS 方法,采用优化后的 QuEChERS 净化技术,结合气相色谱-质谱法,可快速测定茶青中多种农药残留。样品采用高速匀浆乙腈提取,QuEChERS 净化,气相色谱-质谱联用仪测定。在 0.020~0.40 mg/L 范围内,28 种农药的质量浓度与对应的峰面积间呈良好的线性关系;在 0.10 和 0.50 mg/kg 添加水平下,28 种农药的平均回收率在 77%~106% 之间,RSD 在 1.4%~8.0% 之间 (n = 6);方法的检出限为 5.0~20 μg/kg,定量限为 10~60 μg/kg。方法学考察及实际样品检测证明该方法具有简单、快速、准确、灵敏度高等优点,可用于茶青中 28 种农药残留的同时测定。
| [1] |
谢争珍. 中国输日茶叶贸易及影响因素研究[J]. 茶叶, 2008, 34(4): 225–229, 236.
XIE Z Z. The research on exportation of Chinese tea to Japan and its impact factors[J]. J Tea, 2008, 34(4): 225–229, 236. |
| [2] |
植物性食品中甲胺磷和乙酰甲胺磷农药残留量的测定: GB/T 5009.103—2003[S]. 北京: 中国标准出版社, 2004.
Determination of methamidophos and acephate pesticide residues in vegetable foods: GB/T 5009.103—2003[S]. Beijing: Standards Press of China, 2004. |
| [3] |
食品中有机磷农药残留量的测定: GB/T 5009.20—2003[S]. 北京: 中国标准出版社, 2004.
Determination of organophosphorous pesticide residues in foods: GB/T 5009.20—2003[S]. Beijing: Standards Press of China, 2004. |
| [4] |
食品中六六六、滴滴涕残留量的测定: GB/T 5009.19—2003[S]. 北京: 中国标准出版社, 2004.
Determination of HCH and DDT residues in foods: GB/T 5009.19—2003[S]. Beijing: Standards Press of China, 2004. |
| [5] |
植物性食品中氯氰菊酯、氰戊菊酯和溴氰菊酯残留量的测定: GB/T 5009.110—2003[S]. 北京: 中国标准出版社, 2004.
Determination of cypermethrin, fenvalerate and deltamethrin residues in vegetable foods: GB/T 5009.110—2003[S]. Beijing: Standards Press of China, 2004. |
| [6] |
植物性食品中有机氯和拟除虫菊酯类农药多种残留量的测定: GB/T 5009.146—2008[S]. 北京: 中国标准出版社, 2009.
Determination of organochlorines and pyrethroid pesticide multiresidues in vegetable foods: GB/T 5009.146—2008[S]. Beijing: Standards Press of China, 2009. |
| [7] | ANASTASSIADES M, LEHOTAY S J, ŠTAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/ partitioning and " dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412–431. |
| [8] |
褚能明, 孟霞康, 康月琼, 等. 分散固相萃取-气相色谱-串联质谱法测定茉莉花茶中86种农药残留[J]. 食品科学, 2016, 37(24): 239–246.
CHU N M, MENG X K, KANG Y Q, et al. Determination of 86 pesticide residues in jasmine tea by dispersive solid-phase extraction combined with gas chromatography-tandem mass spectrometry[J]. Food Sci, 2016, 37(24): 239–246. doi:10.7506/spkx1002-6630-201624038 |
| [9] |
刘腾飞, 杨代凤, 董明辉, 等. 分散固相萃取-气相色谱法测定茶鲜叶中7种拟除虫菊酯类农药残留[J]. 农药学学报, 2015, 17(5): 571–578.
LIU T F, YANG D F, DONG M H, et al. Determination of pyrethroid residues in fresh tea leaves by dispersive solid phase extraction and gas chromatography[J]. Chin J Pestic Sci, 2015, 17(5): 571–578. |
| [10] |
侯如燕, 宛晓春, 朱旭君. 茶鲜叶中拟除虫菊酯类农药残留的检测方法[J]. 食品与发酵工业, 2008, 34(8): 137–140.
HOU R Y, WAN X C, ZHU X J. A Novel method for determination pyrethroid pesticides in fresh tea leaves with GC-μECD[J]. Food Ferment Ind, 2008, 34(8): 137–140. |
| [11] |
食品中农药最大残留限量: GB 2763—2014[S]. 北京: 中国标准出版社, 2014.
National food safety standard-Maximum residue limits for pesticides in food: GB 2763––2014[S]. Beijing: Standards Press of China, 2014. |
| [12] |
绿色食品 茶叶: NY/T 288—2012[S]. 北京: 中国农业出版社, 2012.
Green food-tea: NY/T 288—2012[S]. Beijing: China Agriculture Press, 2012. |
| [13] |
有机茶: NY 5196—2002[S]. 北京: 中国标准出版社, 2004.
Organic tea: NY 5196—2002[S]. Beijing: Standards Press of China, 2004. |
| [14] |
绿色食品 代用茶: NY/T 2140—2015[S]. 北京: 中国农业出版社, 2016.
Green food-Herbal tea: NY/T 2140—2015[S]. Beijing: China Agriculture Press, 2016. |
| [15] |
王鹏, 蒋学华, 王凌. LC-MSn应用于生物样品检测中基质效应的评价
[J]. 中国新药杂志, 2011, 20(20): 1953–1956.
WANG P, JIANG X F, WANG L. Assessment of matrix effect in quantitative bioanalytical methods based on LC-MSn[J]. Chin J New Drugs, 2011, 20(20): 1953–1956. |
| [16] | MATUSZEWSKI B K, CONSTANZER M L, CHAVEZ-ENG C M. Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Anal Chem, 2003, 75(13): 3019–3030. doi:10.1021/ac020361s |
 2017, Vol. 19
2017, Vol. 19


